Беременность при низком АМГ — Семейный медицинский центр «Лейб Медик»
АМГ или антимюллеров гормон – важный фактор в планировании беременности, так как он является маркером овариального резерва женщин. Вероятность забеременеть при низком АМГ незначительна – в яичниках нет яйцеклеток, готовых к зачатию. Главная причина снижения показателя – возраст после 35, но у молодых истощение резерва тоже бывает. Искусственно повысить АМГ нельзя, однако шанс зачать и выносить ребенка все же есть. На помощь приходит вспомогательный метод оплодотворения – ЭКО.
О чем говорит низкий АМГ?
АМГ (антимюллеров гормон) – это показатель, точно отражающий состояние овариального резерва женщины. Этот резерв показывает количество яйцеклеток в яичниках, которые необходимы для зачатия и наступления беременности. АМГ определяется также у мужчин и тоже может быть маркером нарушений сперматогенеза.
Антимюллеров гормон выявляется у мужчин и женщин на протяжении всей жизни. Максимальные показатели у мужчин отмечаются в пубертатном периоде, у женщин пик гормона – этап полового созревания, во время формирования фолликулов.
Определение показателя назначается в следующих ситуациях:
- Возраст старше 35 лет
- Не была выявлена причина бесплодия в ходе предварительных обследований
- Повышен ФСГ (или верхняя граница нормы)
- Неудачные попытки ЭКО в анамнезе
- Отсутствие ответа яичников на гормональную стимуляцию
Особенности и нормы АМГ у мужчин и женщин
| Где вырабатывается? | За что отвечает? | Показатели нормы (нг/мл) | |
| Вырабатывается гранулезными клетками яичников до наступления менопаузы. | Регулирует формирование доминантного фолликула. | • До 9 лет – 1,7-5,3 • Средняя норма – 4-6,8 • Нижний порог нормы – 2,2-4 • Возраст 35-40 лет – 2,1-1,0 • После 40 – меньше 1,0 |
|
| Мужчины | Вырабатывается клетками Сертоли в семенных канальцах. |
• Сперматогенез • Синтез андрогенов |
• До 9 лет – 46,4-53,6 • Начало полового созревания – 31,2-38,6 • По окончании полового созревания –4,8-9,6 |
Снижение АМГ свидетельствует об истощении овариального резерва у женщин. Данная проблема очень актуальна в современной репродуктологии, так как встречается не только у женщин старше 35 лет, но и у молодых девушек. Сдача АМВ – один из признаков истощения, дополнительно проверяется число антральных фолликулов в естественном цикле на 4-5 день.
Причины низкого АМГ
- Возраст (ключевой фактор естественного снижения показателя, но даже при патологическом истощении резерва процент успешных беременностей и протоколов ЭКО выше в молодом возрасте)
- Хирургические вмешательства на яичниках и органах малого таза в анамнезе
- Генетические аномалии (в том числе дефекты развития репродуктивной системы)
- Гипергонадотропная аменорея
- Ожирение или чрезмерное истощение
- Преждевременная менопауза
- Синдром поликистозных яичников
- Криптогенное истощение резерва
Можно ли забеременеть при низком АМГ?
Недостаток АМГ – ниже 1 нг/мл – все равно оставляет женщине шанс забеременеть. Критически низкий показатель гормона отмечается при результатах менее 0,2 нг/мл. Шанс успешной самостоятельной беременности крайне мал. Однако даже в таких ситуациях остается возможность забеременеть самостоятельно.
При сниженном показателе АМГ от 0,9 до 0,2 нг/мл проверяется фолликулостимулирующий гормон. Если ФСГ низкий, то остается шанс естественной беременности с низким АМГ. Однако планирование нужно начинать сразу же, ведь с течением времени показатель антимюллерова гормона будет только падать.
Женщинам с низким АМГ и планами на самостоятельную беременность в клинике «Лейб Медик» предоставляется комплексная поддержка. В случае необходимости проводится поддерживающая гормональная терапия для стимуляции созревания фолликулов. Индивидуальный подход позволяет добиться положительного результата даже при незначительных уровнях АМГ.
В случае необходимости проводится поддерживающая гормональная терапия для стимуляции созревания фолликулов. Индивидуальный подход позволяет добиться положительного результата даже при незначительных уровнях АМГ.
Каковы шансы успешного ЭКО?
При отсутствии результатов консервативного лечения остается возможность проведения ЭКО при низком АМГ. Стоит учитывать, что неудачи в искусственном оплодотворении с истощенным резервом случаются достаточно часто.
Особенности проведения ЭКО с низким АМГ:
- Обязательное проведение предимплантационного генетического исследования
- Применение донорских яйцеклеток, если АМГ стремится к 0, а антральных фолликулов нет вообще
- Заморозка эмбрионов во всех циклах и последующая селекция самого сильного (японский протокол)
- Предварительная гормональная стимуляция для созревания фолликула с повышенной кратностью программы ЭКО
При сниженном АМГ, но с числом антральных фолликулов более 3 проводится классический протокол ЭКО. Но при этих показателях также можно попробовать добиться естественной беременности.
Как повысить АМГ?
Повысить амнтимюллеров гормон искусственным образом не представляется возможным. Он всего лишь маркер истощения овариального резерва. Даже лучший репродуктолог не сможет увеличить концентрацию гормона, а небольшие колебания при повторных сдачах анализа обусловлены погрешностями лаборатории. Для планирования беременности важно определить число антральных фолликулов.
Считается, что прием КОК (контрацептивов) повышает уровень АМГ. Однако это всего лишь заблуждение. Всегда нужно помнить, что в женском организме изменение показателя гормона АМГ происходит только в сторону уменьшения. Поэтому лучше заранее определить этот маркер, чтобы проанализировать состояние репродуктивной системы.
Отзывы врачей и пациентов
Отзывы об ЭКО при низком АМГ достаточно разнообразные, но неудачные попытки – очень распространенное явление. Мнения врачей о низком АМГ и реальные истории пациентов показывают, что шансы на самостоятельную беременность есть всегда.
Мнения врачей о низком АМГ и реальные истории пациентов показывают, что шансы на самостоятельную беременность есть всегда.
Врач
«Низкий АМГ – распространенное явление среди женщин старше 35 лет. Сейчас идет тенденция к позднему планированию беременности, поэтому подобные ситуации встречаются часто. Несмотря на то, что повлиять на показатель невозможно, многое зависит от ЧАФ. Если при исследовании их хотя бы 3-4, то можно попробовать добиться беременности даже без применения ЭКО.»
Врач
«Многие стремятся сразу идти на протокол ЭКО с низким АМГ. Такая поспешность ни к чему, тем более при показателе АМГ меньше 1 в бесплатном проведении процедуры чаще всего отказывают. Да, современные протоколы учитывают овариальную истощенность, однако риск напрасно потраченных денег все равно остается. При этом, если у женщины не нулевое ЧАФ, то вполне можно пробовать забеременеть естественным путем. Единственное, что хочется добавить, не затягивайте, так как АМГ будет только снижаться.»
Пациент
«Когда мне было 26 лет, то начали планировать с мужем ребенка. Пытались даже не год, как положено, а два. Соблюдали все возможные предписания, но никакого эффекта. Потом начали оба обследоваться, но основные показатели были в норме. Пока мне не провели тест на АМГ. Точный результат не помню, но близко к 1. В общем, мы были в отчаянии, так как прочитали, что низкий показатель – предвестник климакса. Спасибо лечащему врачу, который грамотно подошел к нашей проблеме и буквально спустя полгода желанная беременность все же наступила.»
Пациент
«Мне всегда говорили, что низкий АМГ – это приговор. Повысить его нельзя, лечения нет. Делала несколько попыток ЭКО, но все неудачные. Но все же не сдалась и продолжила ходить по врачам, спрашивать мнения разные. Как хорошо, что в итоге натолкнулась на клинику «Лейб Медик». Меня комплексно обследовали, назначили курс лечения, наконец-то правильно проинформировали.
Видео
АМГ – маркер работы репродуктивной системы женщины. Беременность при низком АМГ может наступить, однако при определенных условиях. Рекомендуется заранее планировать ребенка, так как у молодых девушек больше шансов на зачатие при недостатке АМГ. Для тех, у кого уровень гормона на критическом уровне, существуют специальные программы ЭКО. Даже если подходящие яйцеклетки для ЭКО обнаружить не получается, всегда можно воспользоваться донорскими. Поэтому отчаиваться не стоит. Клиника «Лейб Медик» помогает планировать беременность и борется за естественное зачатие в клинических случаях любой сложности.
За что отвечает гормон АМГ и что делать, если его уровень понижен
Гормон, называемый АМГ (ингибирующее вещество Мюллера или антимюллеров гормон) синтезируется женскими и мужскими половыми железами. Это вещество играет важную роль в регуляции репродуктивной функции. В случаях, когда пониженный уровень АМГ у женщины выявлен на этапе подготовки к проведению ЭКО для достижения успешных результатов процедуры потребуется пройти лечения для восстановления нормальных значений этого показателя.
О чем свидетельствует понижение уровня АМГ и причины этого явления
Если синтез антимюллерова гормона ухудшается, у женщины нарушается функция яичников и падает выработка антральных фолликулов, отвечающих за производство здоровых яйцеклеток, готовых к оплодотворению. У мужчин падение уровня АМГ в долгосрочной перспективе ведет к развитию функционального бесплодия.
Для восстановления нормальной продукции ингибирующего вещества Мюллера необходимо установить и устранить причину развившегося нарушения. В репродуктивном возрасте такое явление может быть вызвано ранним угасанием репродуктивной функции, сильным стрессом, приемом некоторых лекарственных препаратов (например, входящих в состав химиотерапии), снижение овариального резерва яичников (у женщин), избыточный вес.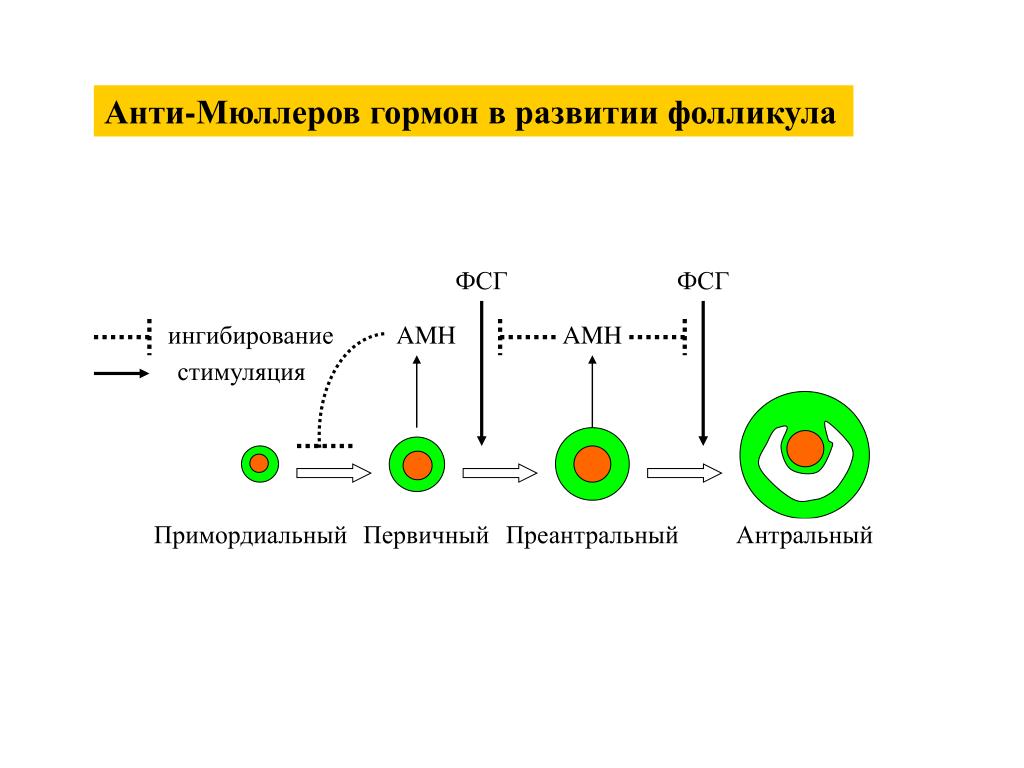
Что делать при низком АМГ
Если пара планирует беременность, низкий АМГ у одного или обоих партнеров может стать причиной невозможности естественного зачатия. Проведение ЭКО в естественном цикле (то есть без стимуляции яичников) в этом случае проводят только с донорскими ооцитами. Сегодня производятся препараты, прием которых помогает увеличить число антральных фолликулов, но назначить их может только лечащий врач, при наличии строгих показаний (так как это сильные гормональные средства). Схема терапии разрабатывается в соответствии с индивидуальными особенностями организма пациентки. В ряде случаев показано проведение искусственной стимуляции яичников. На уровень АМГ оказывает влияние витамин D, поэтому при дефиците антимюллерова гармона показано принятие солнечных ванн и прием комплексных поливитаминов.
Как можно провести успешное ЭКО у женщин с АМГ
Показатели овариального резерва используются для прогнозирования ответа яичников на стимуляцию овуляции гонадотропинами. Так, низкие показатели овариального резерва могут явиться причиной плохого или “бедного” ответа на стимуляцию. Для оценки овариального резерва врач учитывает возраст пациентки, определение уровня АМГ (антимюллерова гормона), уровня ФСГ (фолликулостимулирующего гормона) на 2–3 день менструального цикла, числа антральных фолликулов в яичниках при УЗИ (от 2 до 10 мм в диаметре) как вместе, так и по‐отдельности.
Что такое АМГ?
АМГ является точным маркером овариального резерва. Этот гормон вырабатывается преантральными и малыми антральными фолликулами яичника размером до 8 мм, в силу чего может отражать величину пула фолликулов, то есть репродуктивный потенциал женщины. Уровень АМГ незначительно изменяется от цикла к циклу и в течение одного менструального цикла женщины, не зависит от уровня ФСГ.
Причина низкого АМГ
Кроме возрастного снижения АМГ, следует отметить, что использование препаратов, подавляющих функцию яичников (агонисты гонадотропин‐рилизинг гормона, комбинированные оральные контрацептивы), может также в значительной мере снижать показатели АМГ. Благодаря простоте исследования и интерпретации результатов этот показатель широко используется с современной практике. Однако следует отметить, что показатели между лабораториями могут значительно различаться.
Благодаря простоте исследования и интерпретации результатов этот показатель широко используется с современной практике. Однако следует отметить, что показатели между лабораториями могут значительно различаться.
Что такое антральные фолликулы?
Антральные фолликулы — это фолликулы небольшого размера (2–8 мм в диаметре), которые мы можем увидеть, измерить и подсчитать при ультразвуковом исследовании. Количество антральных фолликулов имеет прямое соотношение с количеством примордиальных фолликуловвидимых только при микроскопическом исследовании, находящихся яичниках. Каждый примордиальный фолликул — предшественник яйцеклетки. Т.е.. число антральных фолликулов (ЧАФ), измеренное при УЗИ на 2–3 день менструального цикла, точно отражает состояние овариального резерва в данный момент. Следует отметить, что ЧАФ может изменяться от цикла к циклу и в значительной степени зависит от оценки специалиста, выполняющего исследование.
«Бедный» овариальный резерв
Оценка овариального резерва позволяет определить группу риска по получению малого количества фолликулов. На рисунке — возрастное снижение АМГ.
Получение 3 и менее ооцитов при стандартной стимуляции является «бедным» ответом. Частота родов на цикл ЭКО у женщин с «бедным» ответом на стимуляцию по данным Американского общества репродуктивной медицины, опубликованным в сентябре 2015 года составила 4% (от 5 до 7% по данным Европейских исследований). Причем частота наступления беременности и родов не зависит от возраста пациентки. Однако, если удавалось получить при стимуляции 4 и более ооцитов, частота родов на цикл ЭКО возрастала в 2 и более раза. Таким образом, основной задачей врачей «ЭмбриЛайф» является получение у таких пациентов как можно большего количества ооцитов.
Как «повысить» ответ на стимуляцию?
В настоящее время в Клинике «ЭмбриЛайф» используется огромное количество методов увеличения ответа на стимуляцию. Вот некоторые варианты протоколов, используемые для повышения ответа яичников:
— Протокол с использованием антагонистов ГнРГ
— Использование микродоз аГнРГ в протоколе
— Длинный протокол
— Добавление лютеинизирующего гормона при стимуляции
— Летрозол + ФСГ + антагонисты ГнРГ
— Применение дигидроэпиандростерона
— Использование гормона роста
Протокол ЭКО при низком овариальном резерве — это совместное творчество врача «ЭмбриЛайф» и пациента, основанное на фундаментальных знаниях, опыте и современных технологиях.
Антимюллеровский гормон
Антимюллеровский гормон обеспечивает дифференцировку пола у эмбриона, а также участвует в сперматогенезе и созревании фолликула. Он служит индикатором функции половых желез, и его используют, чтобы выяснить причину нарушения дифференцировки пола, мужского и женского бесплодия, а также при диагностике некоторых опухолей.
Синонимы русские
АМГ, ингибирующее вещество Мюллера.
Синонимы английские
Anti-Müllerian hormone, AMH, Müllerian inhibiting factor, MIF, Müllerian-inhibiting hormone, MIH, Müllerian-inhibiting substance, MIS.
Метод исследования
Иммунохемилюминесцентный анализ.
Единицы измерения
Нг/мл (нанограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования.
- Исключить прием эстрогенов и андрогенов в течение 48 часов до исследования.
- Не курить в течение 30 минут перед анализом.
Общая информация об исследовании
Антимюллеровский гормон (АМГ) в норме синтезируется только клетками Сертоли яичек (как в период эмбрионального развития, так и после рождения) и зернистыми клетками яичников (только после рождения). Он получил свое название благодаря уникальному свойству препятствовать развитию женских половых структур из зачатка, называемого Мюллеровым протоком. Хотя пол ребенка определяется в момент зачатия, до 6-й недели беременности плод имеет недифференцированные половые гонады и зачатки внутренних половых структур обоих полов: мезонефритический проток (Вольфов) и парамезонефритический проток (Мюллеров). Изначально плод развивается по женскому типу. При этом Мюллеров проток стимулирует развитие матки, маточных труб и верхней части влагалища, а клетки Вольфова протока разрушаются. И наоборот, при наличии подавляющих факторов разрушению подвергается Мюллеров проток, а Вольфов дает начало придатку яичка, семявыносящему каналу и семенным пузырькам – таким образом, развитие половой системы происходит по мужскому типу. Одним из таких факторов, в итоге анатомически формирующих мужской пол ребенка, является антимюллеровский гормон. Он вырабатывается клетками Сертоли яичка примерно с 7-й недели эмбрионального развития. Его основная функция – подавить формирование женских половых структур из мюллерова протока. Если у плода генетически мужского пола происходят мутации в гене антимюллеровского гормона или мутации в гене его рецептора, то развитие мюллерова протока продолжается и, наряду с внутренними мужскими половыми структурами, формируются и женские половые структуры (матка, маточные трубы или шейка матки). При этом ребенок имеет нормально развитые яички, внутренние мужские половые структуры (придаток яичка, семявыносящий канал и семенные пузырьки) и наружные мужские половые органы, пол при рождении определяется как мужской и заподозрить аномалию развития не представляется возможным.
И наоборот, при наличии подавляющих факторов разрушению подвергается Мюллеров проток, а Вольфов дает начало придатку яичка, семявыносящему каналу и семенным пузырькам – таким образом, развитие половой системы происходит по мужскому типу. Одним из таких факторов, в итоге анатомически формирующих мужской пол ребенка, является антимюллеровский гормон. Он вырабатывается клетками Сертоли яичка примерно с 7-й недели эмбрионального развития. Его основная функция – подавить формирование женских половых структур из мюллерова протока. Если у плода генетически мужского пола происходят мутации в гене антимюллеровского гормона или мутации в гене его рецептора, то развитие мюллерова протока продолжается и, наряду с внутренними мужскими половыми структурами, формируются и женские половые структуры (матка, маточные трубы или шейка матки). При этом ребенок имеет нормально развитые яички, внутренние мужские половые структуры (придаток яичка, семявыносящий канал и семенные пузырьки) и наружные мужские половые органы, пол при рождении определяется как мужской и заподозрить аномалию развития не представляется возможным.
Другой важной функцией АМГ является опускание яичек из полости живота в мошонку. При отклонении АМГ опускание яичек нарушено. Задержка опускания яичек (крипторхизм) – самая частая патология мочеполовой системы у мальчиков, она встречается у 30 % недоношенных и у 5 % доношенных детей. Как правило, опускание яичек все же происходит спонтанно к 3-му месяцу жизни. Если этого не случается к 6 месяцам, выполняется операция по перемещению яичек из полости живота или пахового канала в мошонку (орхидопексия). У большинства пациентов с недостатком или нечувствительностью к АМГ наблюдается крипторхизм, так что им назначают такую операцию. Часто именно во время орхидопексии обнаруживают дополнительные внутренние женские половые структуры и предполагают синдром персистирующего Мюллерова протока. Кроме анатомических дефектов, увеличивающих вероятность паховой грыжи у детей, данный синдром ассоциирован с бесплодием.
Врачи, наблюдающие мальчика с крипторхизмом, сталкиваются с определенными трудностями. Такая патология может встречаться как при нарушении опускания яичек, так и при их отсутствии. У этих отклонений совершенно разный прогноз и лечение, поэтому необходима их правильная дифференциальная диагностика. Ультразвуковое исследование позволяет выявить тестикулярную ткань в полости живота или пахового канала лишь в 70-80 % случаев, в то время как АМГ является специфическим (98 %) и чувствительным (91 %) индикатором наличия тестикулярной ткани. Положительный тест на АМГ у мальчика свидетельствует о нарушении опускания яичек, что может быть скорректировано с помощью операции. Отсутствие АМГ позволяет диагностировать анорхию (врождённое двустороннее отсутствие яичек), при которой операция не показана. В связи с этим измерение АМГ может быть использовано для дифференциальной диагностики крипторхизма.
Концентрация АМГ значительно изменяется в течение жизни. Уровень АМГ у мальчика низкий при рождении, но значительно повышается к 6 месяцам. В детском и подростковом возрасте АМГ постепенно снижается и достигает самых низких значений во взрослой жизни. В отличие от новорождённых мальчиков, уровень АМГ у младенцев женского пола в норме очень низкий (не определяется) и остается таким в детском и подростковым периоде. Во время полового созревания у девочек он незначительно повышается и в течение взрослой жизни соответствует таковому у взрослых мужчин. Уровень АМГ после менопаузы в норме не определяется. Таким образом, концентрации АМГ у мальчиков и девочек в период новорождённости и раннего детства значительно отличаются, поэтому АМГ может быть использован для диагностики синдромов нарушения дифференцировки пола. При наличии у младенца наружных половых структур, обладающих как женскими, так и мужскими признаками, АМГ в сочетании с некоторыми другими показателями позволяет не только определить истинный пол, но и выявить причину нарушения дифференцировки пола. Так, например, изолированная дисфункция тестостеронпродуцирующих клеток Лейдига сопровождается недоразвитием наружных мужских половых органов, при этом концентрация АМГ, синтезируемого клетками Сертоли, остается нормальной. Наоборот, недоразвитие наружных мужских половых органов, возникшее в результате недоразвития яичек, сопровождающейся потерей как клеток Сертоли, так и клеток Лейдига, характеризуется низким значением АМГ. У новорождённых девочек уровень АМГ очень низкий (не определяется). В связи с этим анализ на АМГ может быть использован при диагностике нарушения дифференцировки пола и выявлении его причины.
Наоборот, недоразвитие наружных мужских половых органов, возникшее в результате недоразвития яичек, сопровождающейся потерей как клеток Сертоли, так и клеток Лейдига, характеризуется низким значением АМГ. У новорождённых девочек уровень АМГ очень низкий (не определяется). В связи с этим анализ на АМГ может быть использован при диагностике нарушения дифференцировки пола и выявлении его причины.
Несмотря на то что главная функция АМГ реализуется при развитии зародыша, этот гормон осуществляет ряд задач и после рождения. В организме взрослого мужчины он участвует в регуляции синтеза андрогенов. Уровень сывороточного АМГ у мужчин с необструктивной азооспермией (отсутствие сперматозоидов в эякуляте из-за их нарушенного образования) на 50 % ниже, чем у пациентов с обструктивной азооспермией (отсутствие сперматозоидов в эякуляте из-за препятствия в семявыводящих протоках). Данный лабораторный показатель является даже более точным методом дифференциальной диагностики двух вариантов азооспермии, чем традиционно применяемый анализ на фолликулостимулирующий гормон (ФСГ), поэтому АМГ может быть использован для выявления причины мужского бесплодия.
В организме женщины АМГ участвует в созревании фолликулов, а также их отборе для овуляции. Он синтезируется зернистыми клетками растущих фолликулов, подавляет рост соседних примордиальных фолликулов, а также уменьшает чувствительность растущих фолликулов к действию ФСГ. Все это способствует окончательному созреванию и овуляции одного фолликула каждый месяц. Так как синтез АМГ осуществляется растущими фолликулами, по его концентрации оценивают их количество. В свою очередь, количество растущих фолликулов отражает количество покоящихся примордиальных фолликулов, которые называют функциональным резервом яичников. Этот резерв снижается с возрастом, а также при состояниях, сопровождающихся преждевременной менопаузой (например, при химиотерапии). Оценка функционального резерва с помощью АМГ позволяет ответить на многие вопросы. Достаточно часто современная женщина сознательно откладывает рождение ребенка. При этом доказано, что вероятность зачатия первого ребенка в течение 1 года женщиной старше 31 года уменьшается в 6 раз по сравнению с более молодыми женщинами. К 41 году количественные и качественные изменения фолликулов в подавляющем большинстве случаев приводят к так называемой естественной инфертильности, причем она наступает гораздо раньше, чем менопауза. Поэтому оценка функционального резерва яичников позволяет определить примерный возраст наступления менопаузы и инфертильности (бесплодия), что может быть учтено молодыми женщинами при планировании беременности. Низкий уровень АМГ указывает на наступление менопаузы в ближайшие 5 лет. Преимущества теста на АМГ в том, что концентрация этого гормона не изменяется значительно в течение менструального цикла, а также остается постоянной от одного цикла к другому.
Достаточно часто современная женщина сознательно откладывает рождение ребенка. При этом доказано, что вероятность зачатия первого ребенка в течение 1 года женщиной старше 31 года уменьшается в 6 раз по сравнению с более молодыми женщинами. К 41 году количественные и качественные изменения фолликулов в подавляющем большинстве случаев приводят к так называемой естественной инфертильности, причем она наступает гораздо раньше, чем менопауза. Поэтому оценка функционального резерва яичников позволяет определить примерный возраст наступления менопаузы и инфертильности (бесплодия), что может быть учтено молодыми женщинами при планировании беременности. Низкий уровень АМГ указывает на наступление менопаузы в ближайшие 5 лет. Преимущества теста на АМГ в том, что концентрация этого гормона не изменяется значительно в течение менструального цикла, а также остается постоянной от одного цикла к другому.
Оценка функционального резерва яичников с помощью АМГ также производится при отборе и подготовке пациенток к программам экстракорпорального оплодотворения для лечения женского бесплодия. Пациентки с недостаточным функциональным резервом яичников и сниженным АМГ хуже отвечают на стимуляцию овуляции, и беременность у них наступает реже. С другой стороны, АМГ используют, чтобы оценить риск избыточной стимуляции овуляции. Она не только сопровождается дискомфортом в животе и продукцией большего количества неполноценных яйцеклеток, но и может привести к опасному для жизни состоянию – синдрому гиперстимуляции яичников. АМГ позволяет выявить пациенток с высоким риском избыточной стимуляции овуляции, что необходимо для дальнейшего выбора оптимальной схемы лечения бесплодия.
АМГ является маркером опухолей яичников, происходящих из зернистых клеток (гранулезоклеточных опухолей). На их долю приходится около 3 % новообразований яичников. Чаще встречается так называемый взрослый вариант опухоли, наблюдающийся у женщин в пре- и постменопаузе (средний возраст, в котором диагностируется опухоль, – 51 год). При этом наряду с повышенной продукцией АМГ значительно увеличивается количество эстрогенов, что приводит к гиперплазии эндометрия, которая проявляется нарушениями менструального цикла в пременопаузальном периоде. В постменопаузе гиперэстрогенизм чаще всего проявляется маточным кровотечением или аденокарциномой эндометрия. У мужчин избыток эстрогенов сопровождается гинекомастией. К другим редким гормонально-активным опухолям яичников относятся опухоли из клеток Сертоли. В обоих случаях уровень АМГ будет значительно повышен.
При этом наряду с повышенной продукцией АМГ значительно увеличивается количество эстрогенов, что приводит к гиперплазии эндометрия, которая проявляется нарушениями менструального цикла в пременопаузальном периоде. В постменопаузе гиперэстрогенизм чаще всего проявляется маточным кровотечением или аденокарциномой эндометрия. У мужчин избыток эстрогенов сопровождается гинекомастией. К другим редким гормонально-активным опухолям яичников относятся опухоли из клеток Сертоли. В обоих случаях уровень АМГ будет значительно повышен.
Повторные анализы на АМГ могут быть использованы на этапе контроля за лечением опухолей.
Для чего используется исследование?
- Для дифференциальной диагностики причин крипторхизма: задержки опускания яичек или анорхии (а также синдрома персистирующего Мюллерова протока).
- Для диагностики нарушения дифференцировки пола и выявления его причины.
- Для диагностики необструктивной азооспермии как причины мужского бесплодия.
- Чтобы оценить функциональный резерв яичников в целях планирования беременности и прогнозирования срока наступления менопаузы.
- Чтобы выделить группы пациенток с недостаточным или избыточным ответом на стимуляцию овуляции при проведении программ экстракорпорального оплодотворения и коррекции лечения женского бесплодия.
- Для диагностики гранулезоклеточных опухолей яичников и яичек и контроля за их лечением, а также для диагностики новообразований из клеток Сертоли.
Когда назначается исследование?
- При крипторхизме – отсутствии яичек в мошонке у новорождённого мальчика.
- При наличии у новорождённого наружных половых структур, обладающих как женскими, так и мужскими признаками.
- При дифференциальной диагностике обструктивной и необструктивной азооспермии.
- Когда прогнозируют возраст наступления инфертильности и менопаузы.
- При выделении групп пациенток: а) с недостаточным ответом на стимуляцию овуляции и неблагоприятным прогнозом наступления беременности; б) с избыточным ответом на стимуляцию овуляции и неблагоприятным прогнозом развития синдрома гиперстимуляции яичников.

- При симптомах гиперэстрогенизма у женщин (маточное кровотечение) и у мужчин (гинекомастия).
Что означают результаты?
Референсные значения
|
Пол |
Возраст (лет) / стадия по Таннеру |
Референсные значения, нг/мл |
|
Мужской |
1 стадия |
4,95 — 144,48 |
|
2 стадия |
5,02 — 140,06 |
|
|
3 стадия |
2,61 — 75,9 |
|
|
4 стадия |
0,43 — 20,14 |
|
|
5 стадия |
1,95 — 21,2 |
|
|
> 18 |
0,73 — 16,05 |
|
|
Женский |
18-26 |
0,96 — 13,34 |
|
26-31 |
0,17 — 7,37 |
|
|
31-36 |
0,07 — 7,35 |
|
|
36-41 |
0,03 — 7,15 |
|
|
41-46 |
0 — 3,27 |
|
|
> 46 |
0 — 1,15 |
Для лиц женского пола: Значения АМГ
Причины повышения уровня антимюллеровского гормона:
- синдром поликистозных яичников;
- гормонально-активные опухоли яичек и яичников.
Причины понижения уровня антимюллеровского гормона:
- менопауза;
- низкий функциональный резерв яичников;
- анорхия и дисгенезия яичек;
- синдром персистирующего Мюллерова протока.

Что может влиять на результат?
Возраст и пол пациента.
Скачать пример результатаТакже рекомендуется
Кто назначает исследование?
Педиатр, эндокринолог, уролог, гинеколог, генетик.
Литература
- Ahmed SF, Rodie M. Investigation and initial management of ambiguous genitalia. Best Pract Res Clin Endocrinol Metab. 2010 Apr;24(2):197-218.
- Visser JA, Themmen AP. Anti-Müllerian hormone and folliculogenesis. Mol Cell Endocrinol. 2005 Apr 29;234(1-2):81-6.
- Lambalk CB, van Disseldorp J, de Koning CH, Broekmans FJ. Testing ovarian reserve to predict age at menopause. Maturitas. 2009 Aug 20;63(4):280-91.
- La Marca A, Volpe A. The Anti-Mullerian hormone and ovarian cancer. Hum Reprod Update. 2007 May-Jun;13(3):265-73.
- Rey R, Sabourin JC, Venara M, Long WQ, Jaubert F, Zeller WP, Duvillard P, Chemes H, Bidart JM. Anti-Müllerian hormone is a specific marker of sertoli- and granulosa-cell origin in gonadal tumors. Hum Pathol. 2000 Oct;31(10):1202-8.
Оценка овариального резерва — Запас на будущее
Определение овариального резерва – ключевой фактор в схеме проведения ЭКО. Или может вы планируете беременность в будущем, но желаете удостовериться, что с зачатием не будет проблем? Тогда самое время провести оценку запаса своих яйцеклеток в сети клиник «Центр ЭКО».
Овариальный запас закладывается у каждой девочки внутриутробно еще на стадии эмбриона. К моменту рождения около 1 млн. яйцеклеток, а к наступлению половой зрелости остается всего 300 тысяч. Каждый месячный цикл в яичниках начинают созревать сразу несколько яйцеклеток, но овулирует лишь один доминантный фолликул. Остальные погибают, и это естественный процесс.
К сожалению, яйцеклеток в яичниках определенное количество, увеличить которое невозможно. Как максимум, можно попробовать повысить их качество во время протокола ЭКО: грамотной стимуляцией суперовуляции, приемом назначенных препаратов, витаминов и микроэлементов. Овариальный резерв снижается с возрастом, а также после операции на яичниках и под воздействием химиотерапии, облучений. Выделяют и СИЯ – синдром истощения яичников, т.е. ранний климакс – до 35 лет. Низкий овариальный резерв дает о себе знать во время стимуляции овуляции: вызревает небольшое количество фолликулов, менее 10. Зрелость ооцитов также может страдать, поэтому за желанную беременность придется побороться. Каким бы ни был результат, отчаиваться не стоит. В сети клиник «Центр ЭКО» работают опытные репродуктологи и эмбриологи, именно поэтому к нам часто идут женщины со сниженным овариальным резервом. Беременность, полученную в позднем репродуктивном возрасте, мы называем «золотой».
Овариальный резерв снижается с возрастом, а также после операции на яичниках и под воздействием химиотерапии, облучений. Выделяют и СИЯ – синдром истощения яичников, т.е. ранний климакс – до 35 лет. Низкий овариальный резерв дает о себе знать во время стимуляции овуляции: вызревает небольшое количество фолликулов, менее 10. Зрелость ооцитов также может страдать, поэтому за желанную беременность придется побороться. Каким бы ни был результат, отчаиваться не стоит. В сети клиник «Центр ЭКО» работают опытные репродуктологи и эмбриологи, именно поэтому к нам часто идут женщины со сниженным овариальным резервом. Беременность, полученную в позднем репродуктивном возрасте, мы называем «золотой».
Оценивая овариальный резерв, можно предположить возможную реакцию яичников на стимуляцию и рассчитать дозу препаратов. Например, при поликистозе приходится действовать особенно осторожно, чтобы не спровоцировать гиперстимуляцию. При слабом ответе, напротив, увеличивают дозировки. Если по результатам анализов и итогам протокола яичники выдают всего несколько фолликулов, пустых или незрелых, а полученные яйцеклетки неспособны к оплодотворению или дальнейшему делению, то стоит рассмотреть использование донорских ооцитов. Если есть своя овуляция, выходом может стать ЭКО в естественном цикле, где больше шансов вырастить хорошую яйцеклетку.
Посчитать шансы
Для оценки овариального резерва нужно пройти небольшое обследование в начале менструального цикла. Сдать гормоны ФСГ, ЛГ и АМГ необходимо на 2-5 день цикла, на 2-3 день пройти УЗИ-диагностику. Как интерпретировать результаты?
Содержание фолликулостимулирующего гормона: норма не более 10 МЕд/л. Высокий ФСГ в сочетании с низким АМГ говорит о пониженном овариальном запасе. Отсутствие сильного роста ФСГ (даже завышенного) на протяжении нескольких циклов – хороший признак.
Содержание лютеинизирующего гормона: норма от 2 до 14 мЕд/л. Повышение может говорить об истощении или поликистозе яичников.
Содержание антимюллерова гормона: норма в зависимости от возраста 1-6.8 нг/мл. Повышенный уровень гормона обычно сигнализирует о СПКЯ. Показатель АМГ является одним из ключевых в получении направления на ЭКО по ОМС. Если он менее 1 нг/мл, то это говорит о малом количестве антральных фолликулов в яичниках и, соответственно, слабом ответе на будущую стимуляцию. Тогда программа ЭКО может быть неэффективна, поэтому комиссия, если вы идете по ОМС, может отказать в выдаче заключения. Впрочем, пациентки уже научились обходить этот пункт, увеличивая цифру до минимальной проходимой при помощи фотошопа. Стоит знать, что один АМГ не способен дать объективную оценку овариального резерва. Показатель 0,86 нг/мл отнюдь не означает, что стимуляция будет безуспешной, и поэтому квоту на ЭКО можно не давать. Репродуктолог должен провести анализ других результатов плюс подсчет количества фолликулов на УЗИ и уже на основании всех данных сделать вывод о возможной успешности протокола.
Содержание ингибина В. Ингибин В синтезируется в антральных фолликулах в яичниках и помогает высвобождению ФСГ. В норме их соотношение должно быть обратно пропорционально: низкий ФСГ сопровождает высокий ингибин В. И тогда стоит ожидать адекватную реакцию яичников на стимуляцию. Пониженный уровень в первую фазу менструального цикла может говорить о скором наступлении менопаузы.
УЗИ-диагностика. На 2-3 день менструального цикла проводится подсчет антральных фолликулов в каждом яичнике. Только один из них стал бы доминантным в естественном цикле, но благодаря гормональной стимуляции должны «подтянуться» и созреть большинство. Обычно репродуктологи опираются именно на количество антральных фолликулов, поскольку показатель АМГ может варьироваться при сдаче крови в разных лабораториях. И мы всегда стремимся к тому, чтобы количество фолликулов и полученных яйцеклеток, причем зрелых, примерно совпадало. Это зависит от овариального резерва, схем стимуляции и адекватного ответа яичников.
Роль антимюллерова гормона (амг) в норме и при различных гинекологических заболеваниях Текст научной статьи по специальности «Фундаментальная медицина»
ОБЗОРЫ
© К. Ю. Боярский, С. Н. Гайдуков, Е. А. Машкова
Кафедра акушерства и гинекологии Санкт-Петербургской государственной педиатрической медицинской академии, Клиника лечения бесплодия «ИнАлМед»
РОЛЬ АНТИМЮЛЛЕРОВА ГОРМОНА (АМГ) В НОРМЕ И ПРИ РАЗЛИЧНЫХ ГИНЕКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ
УДК: 618.11-07
■ В представленном обзоре рассмотрены различные аспекты использования измерения АМГ в гинекологической практике. АМГ является гормоном, вырабатываемым клетками гранулезы растущих фолликулов вплоть до стадии больших антральных. Измерение АМГ может быть использовано для измерения овариального резерва, в диагностике СПКЯ, ПИЯ, нервной анорексии, гипоталами-ческой аменореи, определения времени наступления менопаузы, диагностики гранулезоклеточных опухолей яичников.
■ Ключевые слова: АМГ; фолликулогенез; гинекологические заболевания; СПКЯ; овариальный резерв.
Введение
Антимюллеров гормон (АМГ), другие названия — анти-мюллеровская субстанция или антимюллеровый фактор, является одним из наиболее интересных маркеров репродуктивной системы женщины, появившихся за последние годы. Измерение этого нового яичникового нестероидного гормона позволило изучить более глубокие процессы роста и созревания фолликулов и выяснить отдельные вопросы патогенеза ряда гинекологических заболеваний. В отечественной литературе роли АМГ в норме и патологии яичников посвящены пионерские работы профессора Орлова В.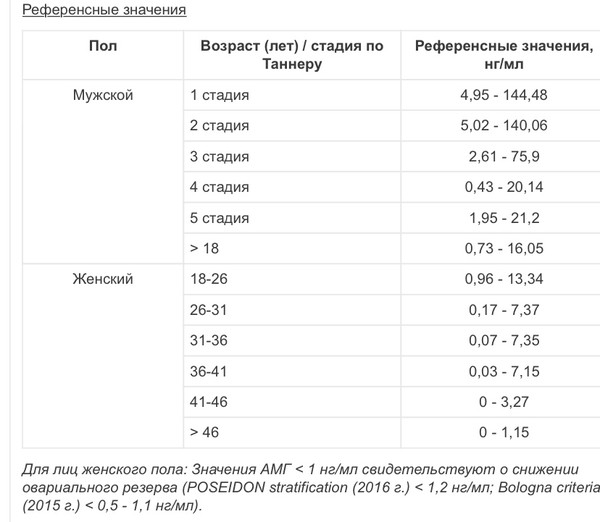 М. (Санкт-Петербург) [1, 2] и профессора Назаренко Т. А. (Москва) [5].
М. (Санкт-Петербург) [1, 2] и профессора Назаренко Т. А. (Москва) [5].
Роль АМГ в мужском и женском организмах
Немецкий анатом Йохан Мюллер (1801-1858) описал эмбриональный проток, предшественник матки, маточных труб и верхней трети влагалища. Этот проток получил название мюллерова. Другой анатом — Каспар Вольф (1733-1794) описал проток, предшественник семявыводящих путей, эпидиди-миса и семенных пузырьков. Этот проток получил название вольфова.
Во время эмбрионального развития в мужском организме на сроке 8-10 недель мюллеров проток рассасывается. В середине ХХ века были произведены эксперименты, которые показали, что эмбриональное яичко выделяет субстанцию, которая способна вызывать рассасывание мюллерова протока. Это вещество получило название антимюллеров гормон [70]. Физиологическая функция данного гормона различается в мужском и женском организме. В мужском организме в фетальный период формирующиеся клетки Лейдега продуцируют тестостерон, под воздействием которого развивается вольфов проток. Клетки Сертоли продуцируют АМГ, что вызывает регрессию мюллерового протока. В мужском организме АМГ выделяется клетками Сертоли с высокой интенсивностью в течение фетального периода и в детстве, однако уровень экспрессии снижается, когда половые клетки в яичках начинают процесс мейоза, в пубертатный период и во взрослом возрасте.
Долгое время функция АМГ в женском организме была неизвестна. Это связано с тем, что этот гормон могут вырабатывать только клетки гранулезы фолликулов от преантральной стадии до стадии больших антральных. В яичниках девочки первые признаки продукции АМГ появляются в пренатальный период (32-36 недель беременности) и уровень этого гормона в крови медленно повышается с возрастом. Максимума уровень АМГ достигает у женщины в возрасте 20-30 лет, после чего посте-
пенно снижается и к менопаузе равняется нулю. В мужском организме АМГ в фетальный период достигает максимума после 8-й недели беременности — 105 нг/мл, после чего постепенно уменьшается, достигая низких величин после 40 лет [26].
В мужском организме АМГ в фетальный период достигает максимума после 8-й недели беременности — 105 нг/мл, после чего постепенно уменьшается, достигая низких величин после 40 лет [26].
Молекулярно-биологические характеристики АМГ
АМГ человека представляет собой димерный гликопротеин с молекулярным весом 140 кДа, при активации от него отделяется биологически активный фрагмент весом 25 кДа [34]. Ген этого гормона у человека находится на хромосоме 19 p13.3—p13.2 [45]. АМГ относится к гликопротеинам, относящимся к суперсемейству трансформирующего фактора роста бета (ТФР-ß). Кроме АМГ, к регуляторам функции яичников относятся также члены этого суперсемейства BMP-4, BMP-8, BMP-15, CDF-9, ингибины А и B [23].
Коммерческие определители уровня АМГ
Ряд фирм производит коммерческие определители уровня АМГ в крови, основанные на энзим-связанном иммуносорбентном методе (ELISA). Обычно используют определители фирм Medgenix, Serotec, Bayer, Immunotech-Coulter. Современные методы позволяют определить уровень АМГ от 0,01 нг/ мл. При указании уровня в пмолях на литр коэффициент пересчета составляет 7,14 пмоль/л = 1 нг/мл.
В связи с клиническим использованием определения уровней АМГ встал вопрос о нормальных значениях этого гормона. Для определения нижнего порогового значения АМГ в диагностике овариального резерва обычно используют уровень от 0,2 до 0,5 и даже 1,0 нг/мл. Для определения верхнего значения обычно используют уровень 11 нг/мл и более высокие значения могут говорить о возможном наличии гранулезоклеточной опухоли яичников (см. ниже).
Роль АМГ в фолликулогенезе
Роль АМГ в фолликулогенезе разнообразна и до конца не изучена. Эксперименты на мышах, с выключенной функцией АМГ, показали, что у таких животных скорость входа примордиальных фолликулов в число растущих увеличена. Авторы этого исследования считают, что АМГ может защищать примордиальные фолликулы от выхода из покоящегося состояния [24]. Недавно было найдено подтверждение подобного механизма у человека. Были описаны женщины с уменьшенной активностью АМГ, которая объяснялась полиморфизмом в гене рецептора к АМГ второго типа (AMH-RII). У таких женщин менопауза наступала раньше, чем в популяции [6].
Эксперименты на мышах, с выключенной функцией АМГ, показали, что у таких животных скорость входа примордиальных фолликулов в число растущих увеличена. Авторы этого исследования считают, что АМГ может защищать примордиальные фолликулы от выхода из покоящегося состояния [24]. Недавно было найдено подтверждение подобного механизма у человека. Были описаны женщины с уменьшенной активностью АМГ, которая объяснялась полиморфизмом в гене рецептора к АМГ второго типа (AMH-RII). У таких женщин менопауза наступала раньше, чем в популяции [6].
В яичниках человека АМГ вырабатывается от пренатального периода до менопаузы. Этот гор-
мон выделяется клетками гранулезы растущих фолликулов от преантральной стадии вплоть до размера антральных фолликулов 6-8 мм в диаметре. После достижения фолликулов размера 8 мм и более уровень АМГ резко падает и возрастает активность ароматазы и, соответственно, продукция эстрадиола. Имеется четкое обратное взаимодействие между продукцией гранулезой предоми-нантного фолликула эстрадиола и АМГ [8]. Также было отмечено, что доминантные и атретические фолликулы содержат крайне низкие уровни АМГ [10]. У пациенток с полиморфизмом в гене рецептора к АМГ (AMH-RII) и уменьшенной функцией этого гормона наблюдается более быстрый рост доминантного фолликула [7].
Эти исследования говорят о том, что АМГ характеризует фолликулы на стадии, предшествующей гормонзависимому периоду роста фолликулов, и сам АМГ защищает гранулезу растущих фолликулов от избыточного митогенного влияния ФСГ. Это позволяет получить информацию о более глубоких процессах фолликулогенеза и оценить число растущих фолликулов на гормон-чувствительной стадии роста [4].
Уровень АМГ в течение менструального цикла женщины остается относительно постоянным и не сильно зависит от колебаний гипофизарных гонадотропинов, половых стероидов и ингибинов [12, 66]. Одиночное измерение АМГ на любой день менструального цикла дает полную клиническую информацию о состоянии овариального резерва [13]. Wunder et al. тщательно изучили колебания АМГ в течение менструального цикла женщины с помощью особо чувствительного набора, способного определять уровни АМГ порядка 0,01 нг/мл. Было обнаружено, что АМГ подвержен небольшим, но статистически значимым колебаниям. Наибольшего значения АМГ достигает за четыре дня до овуляторного пика ЛГ, после чего снижается до минимума на четвертый день после его пика. После этого уровень АМГ повышается в течение первой половины лютеиновой фазы цикла и остается относительно стабильным в течение поздней лютеиновой фазы вплоть до середины фолликулярной фазы следующего цикла [68].
Одиночное измерение АМГ на любой день менструального цикла дает полную клиническую информацию о состоянии овариального резерва [13]. Wunder et al. тщательно изучили колебания АМГ в течение менструального цикла женщины с помощью особо чувствительного набора, способного определять уровни АМГ порядка 0,01 нг/мл. Было обнаружено, что АМГ подвержен небольшим, но статистически значимым колебаниям. Наибольшего значения АМГ достигает за четыре дня до овуляторного пика ЛГ, после чего снижается до минимума на четвертый день после его пика. После этого уровень АМГ повышается в течение первой половины лютеиновой фазы цикла и остается относительно стабильным в течение поздней лютеиновой фазы вплоть до середины фолликулярной фазы следующего цикла [68].
Изменение уровня АМГ с возрастом женщины
АМГ является важнейшим показателем старения женской репродуктивной системы. Van Rooij et al. исследовали 81 здоровую женщину в возрасте 25-46 лет с целью изучить изменение таких показателей старения яичников, как число антральных фолликулов (ЧАФ), уровень АМГ, базальные уровни ФСГ, ингибина В и эстрадиола. Все женщины были обследованы дважды, с промежутком в 4
года. Выяснилось, что у женщин любого возраста уровень АМГ и ЧАФ имели корреляцию с возрастом, тогда как базальные уровни ФСГ и ингибина В имели такую корреляцию только у пациенток после 40 лет, а уровень эстрадиола вообще не имел такой корреляции. По мнению этих авторов, уменьшение уровня АМГ является наилучшим показателем старения яичников, вторым после него — уменьшение ЧАФ; базальные уровни ФСГ и ингибина В — показатели старения яичников средней степени достоверности, а уровень эстрадиола рассматривают как не имеющий значения [65].
Группа ВОЗ по изучению менопаузы в 1980 году ввела ряд определений. Под «естественной менопаузой» понимается прекращение месячных из-за потери фолликулярной активности яичниками. Естественная менопауза возникает после 12 месяцев аменореи, когда нет другой причины для ее возникновения. Под «переходом к менопаузе» понимают период между началом нарушения менструального цикла и последними месячными [55, 75]. Более подробно стадии репродуктивного старения (STRAW) рассмотрела группа исследователей Американского общества репродуктивной медицины под руководством профессора Майкла Саулеса [37]. Уровень ФСГ растет, начиная с позднего репродуктивного периода, достигая максимума в раннюю постменопаузу. Продолжительность менструального цикла начинает быть подвержена колебаниям во время ранней стадии перехода к менопаузе, затем нарушения становятся более выраженными и, наконец, после отсутствия месячных более 12 месяцев можно поставить диагноз «менопауза» [37].
Естественная менопауза возникает после 12 месяцев аменореи, когда нет другой причины для ее возникновения. Под «переходом к менопаузе» понимают период между началом нарушения менструального цикла и последними месячными [55, 75]. Более подробно стадии репродуктивного старения (STRAW) рассмотрела группа исследователей Американского общества репродуктивной медицины под руководством профессора Майкла Саулеса [37]. Уровень ФСГ растет, начиная с позднего репродуктивного периода, достигая максимума в раннюю постменопаузу. Продолжительность менструального цикла начинает быть подвержена колебаниям во время ранней стадии перехода к менопаузе, затем нарушения становятся более выраженными и, наконец, после отсутствия месячных более 12 месяцев можно поставить диагноз «менопауза» [37].
Hale G. et al. подробно изучили уровни гормонов в крови пациенток согласно классификации STRAW. Выяснилось, что самым ранним маркером, показывающим переход от пика репродуктивной функции к позднему репродуктивному периоду, является падение уровня АМГ в десять раз, с 3,9 + 2,3 нг/мл до 0,32 + 0,24 нг/мл. В то же время такие показатели, как увеличение базального уровня ФСГ, падение базального уровня ингибина В гораздо менее выражены, а уровень прогестерона в середине лютеиновой фазы цикла остается неизмененным. Все это говорит о роли АМГ как перспективном маркере уменьшения репродуктивной функции женщины с возрастом.
С приближением менопаузы отмечается дальнейшее падение уровня АМГ. В ранний и поздний период перехода к менопаузе уровень этого гормона составляет 0,15 + 0,2 и 0,06 + 0,08 нг/мл, соответственно. В постменопаузу уровень этого гормона равен нулю. Авторы делают выводы об АМГ, как наиболее чувствительном маркере старения яичников у человека [33]
Группа голландских исследователей на основе популяционного исследования создала модель, которая может предсказывать возможное время наступления менопаузы по одиночному измерению АМГ. В этой работе представлена таблица, согласно которой можно предсказать возможное время наступления менопаузы. Так, если у женщины в 37 лет наблюдается низкий уровень АМГ — 0,3 нг/мл, то возможное время наступления менопаузы у такой женщины составляет 4144 года, что на 7-10 лет раньше, чем в популяции (51 год). И наоборот, если у женщины в 42 года наблюдается высокий уровень АМГ — 2 нг/мл, то время наступления менопаузы у этой женщины должно составлять 51-53 года, что на 2 года позже, чем в среднем по популяции [54].
В этой работе представлена таблица, согласно которой можно предсказать возможное время наступления менопаузы. Так, если у женщины в 37 лет наблюдается низкий уровень АМГ — 0,3 нг/мл, то возможное время наступления менопаузы у такой женщины составляет 4144 года, что на 7-10 лет раньше, чем в популяции (51 год). И наоборот, если у женщины в 42 года наблюдается высокий уровень АМГ — 2 нг/мл, то время наступления менопаузы у этой женщины должно составлять 51-53 года, что на 2 года позже, чем в среднем по популяции [54].
Американские исследователи изучили уровни базального ингибина В и АМГ у женщин в течение 5 лет до наступления менопаузы и выяснили, что крайне низкие уровни обоих гормонов являются достоверными маркерами, предсказывающими время наступления последних месячных, однако АМГ является более достоверным показателем [16].
Роль АМГ в определении овариального резерва
Под овариальным резервом понимают функциональный резерв яичника, который определяет способность последнего к развитию здорового фолликула с полноценной яйцеклеткой и адекватному ответу на овариальную стимуляцию. Овариальный резерв отражает количество находящихся в яичниках фолликулов (примордиальный пул и растущие фолликулы) и зависит от физиологических и патофизиологических факторов [3]. Впервые измерение АМГ как метод определения овариального резерва был предложен Seifer D. et al. в 2002 году. Авторы обнаружили, что у пациенток с числом полученных ооцитов 6 и менее, по сравнению с пациентками, у которых было получено 11 и более ооцитов, статистически различаются уровни АМГ, измеренного перед началом стимуляции, 1,0 + 0,4 нг/мл и 2,5 + 0,3 нг/мл соответственно [30].
Назаренко Т. А. с соавт. исследовали АМГ у 30 здоровых женщин и у 210 пациенток с бесплодием. Авторы выявили, что у пациенток с трубноперитонеальным фактором имелась тенденция к увеличению доли женщин с низкими показателями АМГ. Авторы делают вывод о применимости измерения АМГ как показателя овариального резерва [5].
Авторы делают вывод о применимости измерения АМГ как показателя овариального резерва [5].
Van Rooij et al. тщательно изучили клиническое значение определения АМГ в программе ЭКО. Выяснилось, что уровень АМГ имеет корреля-
цию с возрастом пациентки (R=-0,30, Р < 0,01), с базальным уровнем ФСГ (R=0,54, P < 0,01), с базальным уровнем ингибина В (R=0,32, P < 0,01), с числом антральных фолликулов (ЧАФ) (R = 0,77, P < 0,01) и с числом полученных ооцитов (R = 0,57, P < 0,01). При логистическом регрессионном анализе влияния АМГ на частоту плохого ответа на стимуляцию (наличие менее 4 полученных ооцитов) выяснилось, что уровень АМГ определял статистически достоверно вероятность этого состояния, независимо от уровня ФСГ и ингибина В [62]. Fanchin R. et al. установили, что уровень АМГ имеет более выраженную корреляцию с числом антральных фолликулов, чем остальные гормональные тесты, определяющие овариальный резерв (базальные уровни ФСГ, ЛГ, ингибина В и эстара-диола) [59]. Hazout A. et al. обнаружили статистически значимое различие в уровне АМГ в группе пациенток, у которых наступила беременность в результате ЭКО и тех, у которых беременность не наступила. В группе беременных уровень АМГ составил 2,4+0,9 нг/мл, в группе небеременных —
1,1 + 0,6 нг/мл, P < 0,002. В то же время возраст, базальные уровни ФСГ, ЛГ, ингибина В и эстрадиола не различались в обеих группах пациенток [63]. Muttukrishna S. et al. изучили влияния АМГ как маркера плохого ответа, который авторы определили как наличие менее чем 4 фолликулов 15 мм в диаметре, после проведения стимуляции яичников в программе ЭКО. Выяснилось, что АМГ является главным фактором, который может определять вероятность плохого ответа и включение в логистический регрессионный анализ базальных уровней ФСГ и ингибина В не дают дополнительную клиническую информацию [43]. Группа французских исследователей выявила, что уровень АМГ мало подвержен колебаниям при измерении в разных менструальных циклах одной женщины по сравнению с другими показателями овариального резерва, базальными уровнями ФСГ, ингибина В, эстра-диолом и числом антральных фолликулов [42].
Группа французских исследователей выявила, что уровень АМГ мало подвержен колебаниям при измерении в разных менструальных циклах одной женщины по сравнению с другими показателями овариального резерва, базальными уровнями ФСГ, ингибина В, эстра-диолом и числом антральных фолликулов [42].
Ebner T. et al. обнаружили, что уровень АМГ может быть фактором, определяющим не только число ооцитов, полученных в программе ЭКО, но и их качество, т. е. отсутствие центральной темной грануляции и агрегации гладкого эндо-плазматического ретикулума. Было показано, что пациентки с высоким уровнем АМГ имеют более высокую вероятность получить ооциты хорошего качества, чем пациентки с низким уровнем этого гормона. Уровни базального ФСГ не определяли качество ооцитов. В то же время частота оплодотворения и развитие эмбрионов до стадии бластоцисты не зависели от уровня АМГ [21].
Группа американских исследователей изучала влияние измерения уровня АМГ у пациенток
старшей возрастной группы, проходящих лечение методом ЭКО. Пациентки 37 лет и старше были разделены на 3 группы. В первую вошли женщины, у которых цикл стимуляции яичников был отменен из-за неудовлетворительного ответа. Во вторую вошли пациентки, у которых были получены ооциты в результате стимуляции. В третью группу вошли пациентки, которым было отказано в лечении из-за высокого уровня базального ФСГ (более 15 мЕд/Л). Выяснилось, что уровень АМГ был статистически выше у пациенток с полученными ооцитами (1,1 + 0,2 нг/мл) и фактически не различался у пациенток с плохим ответом на стимуляцию яичников (0,20 + 0,03 нг/мл) и теми у которых наблюдался высокий уровень ФСГ (0,15 + 0,07 нг/мл). Другие клинические показатели, такие как возраст, базальные уровни ФСГ, ЛГ и эстрадиола не различались в трех группах [47].
Согласно данным британских исследователей уровень АМГ является значимым прогностическим фактором не только для отсутствия ответа на овариальную стимуляцию, но и для чрезмерного ответа на препараты ФСГ. Более того, было показано, что АМГ может предсказывать вероятность рождения живого ребенка после лечения методом ЭКО. Авторы подчеркивают, что измерение уровня АМГ может помочь в подборе индивидуальной дозы ФСГ при стимуляции суперовуляции [50].
Более того, было показано, что АМГ может предсказывать вероятность рождения живого ребенка после лечения методом ЭКО. Авторы подчеркивают, что измерение уровня АМГ может помочь в подборе индивидуальной дозы ФСГ при стимуляции суперовуляции [50].
Австралийские исследователи показали, что у пациенток с низким уровнем АМГ (менее 2 нг/мл) наблюдалась более низкая частота оплодотворения ооцитов, чем у женщин с высоким уровнем этого гормона, причем вне зависимости от способа оплодотворения — стандартного ЭКО или ин-трацитоплазматической инъекции сперматозоида в яйцеклетку. У пациенток с низким уровнем АМГ наблюдалось меньшее число полученных ооцитов, меньшее число полученных эмбрионов и более высокая частота выкидышей в сроке до 12 недель, что в общем приводило к тому, что частота беременности на сроке более 12 недель была в два раза выше у пациенток с высоким уровнем АМГ (выше 2 нг/мл), чем у пациенток с низким уровнем гормона [9]. Kwee J. et al. сравнили однократное измерение уровня АМГ с определением овариального резерва с помощью гормональных тестов с нагрузкой (теста с нагрузкой кломифен-цитратом (ТНКЦ) и тест с нагрузкой экзогенным ФСГ (ТЭФСГ)). Несмотря на то, что ТНКЦ и ТЭФСГ были лучшими показателями для предсказания вероятности беременности после процедуры ЭКО, авторы считают одиночное определение АМГ наиболее применимым методом оценки овариального резерва в клинической практике [35].
Nardo L. et al. изучали клиническое значение измерения уровня АМГ по сравнению с базаль-
ным уровнем ФСГ и числом антральных фолликулов. Авторы делают вывод, что измерение уровня АМГ может помочь как в прогнозе плохого ответа на овариальную стимуляцию, так и чрезмерного ответа, что делает измерение данного гормона привлекательным в плане индивидуального планирования лечения в программе ЭКО. Число антральных фолликулов и базальный уровень ФСГ не обладают схожей с АМГ клинической значимостью.
Fraisse T. et al. описали 2 случая спонтанной беременности у женщин 29 лет и 41 года со вторичным бесплодием и уровнем АМГ, не определяемым стандартными методиками — менее 0,4 нг/мл [73]. Эти данные говорят о необходимости разработки более чувствительных методов определения АМГ и изучении более тонких механизмов фолликулогенеза. Однако строить клинические рекомендации для программ ЭКО на двух наблюдениях спонтанных беременностей не стоит, так как у пациенток с крайне низкими уровнями АМГ наблюдается крайне низкая частота наступления беременности как при применении стимуляции с высокими стартовыми дозами ФСГ, так и при использовании модифицированного естественного цикла [20].
Nelson S. et al. использовали уровень АМГ, как фактор, определяющий выбор схемы для стимуляции в ЭКО. У пациенток с низким уровнем АМГ (от 0,14 до 0,7 нг/мл) была применена схема овариальной стимуляции с применением антагонистов и высоких стартовых доз ФСГ (300 мЕд). У этой группы пациенток частота отмены цикла из-за отсутствия ответа на стимуляцию составила
8,2 % и частота наступления беременности на начатый цикл — 14,7 %. У пациенток с уровнем АМГ от 0,7 до 2,1 нг/мл был применен длинный протокол с применением препаратов агонистов люли-берина и ежедневной дозой ФСГ 225-300 мЕд. В этой группе пациенток не было отмечено случаев плохого ответа на овариальную стимуляцию и синдрома гиперстимуляции яичников (СГЯ) и частота наступления беременности на начатый цикл составила 32,9 %. В группе пациенток с уровнем АМГ более 2,1 нг/мл применялся протокол с антагонистами и дозой ФСГ 150 мЕ в день. В данной группе пациенток у двух (6 %) наблюдался плохой ответ на овариальную стимуляцию, однако не было отмечено случаев СГЯ. Частота наступления беременности на начатый цикл составила 61,7 %. Авторы делают вывод о большом клиническом значении определения уровня АМГ в плане индивидуального ведения пациенток и уменьшении вероятности таких осложнений, как плохой ответ на стимуляцию яичников и СГЯ./22/22_2.jpg) Для пациенток с высокими рисками уменьшенного и
Для пациенток с высокими рисками уменьшенного и
чрезмерного ответа на стимуляцию авторы предлагают использовать схемы с антагонистами лю-либерина и высокими или низкими начальными дозами ФСГ [20].
АМГ и синдром гиперстимуляции яичников
Уровень АМГ может быть важным прогностическим фактором, определяющим вероятность развития такого грозного осложнения овариальной стимуляции, как СГЯ. Было показано, что у пациенток с уровнем АМГ выше 7 нг/мл отмечается крайне высокая частота СГЯ и именно у этой группы пациенток возникает необходимость прекращать стимуляцию или замораживать все эмбрионы ввиду развития СГЯ тяжелой степени [13]. Lee Т. et а1. определили, что пороговым значением для риска развития СГЯ является уровень АМГ выше 3,36 нг/мл. При включении в логистический регрессионный анализ выяснилось, что уровень АМГ может предсказывать возможность развития СГЯ более достоверно, чем возраст пациентки и росто-весовой индекс. Уровень эстрадиола на день назначения овуляторной дозы ХГЧ тоже имеет клиническое назначение, но имеет ограниченное значение в плане профилактики данного осложнения [56]. Измерение АМГ может служить важным фактором в подборе дозы ФСГ у пациенток с риском СГЯ.
АМГ и синдром поликистозных яичников (СПКЯ)
Современные международные диагностические критерии включают в себя следующие признаки: во-первых, наличие ановуляции, которая выражается в олигоменорее или аменорее, во-вторых, в признакахгиперандрогении яичникового генеза, которая выражается клинически (наличие гирсутизма) или по изменению биохимических показателей (повышение уровней андрогенов), и, в-третьих, в морфологических признаках муль-тифолликулярных яичников (определяется при ультразвуковом исследовании). Наличие двух из этих трех признаков является современным диагностическим критерием СПКЯ [71]. Согласно современным представлениям о патогенезе этого синдрома, причиной его является нарушение резистентности к инсулину, что сопровождается повышенным выделением клетками теки и грануле-зы растущих фолликулов андрогенов, что в свою очередь вызывает остановку роста фолликулов на стадии, предшествующей селекции доминантного, 4-10 мм в диаметре. Недавно была предложена теория, объясняющая сочетание инсулин-резистентности и гиперандрогении. Активация в серин киназной системе приводит к фосфо-риляции рецептора к инсулину и инактивации
Согласно современным представлениям о патогенезе этого синдрома, причиной его является нарушение резистентности к инсулину, что сопровождается повышенным выделением клетками теки и грануле-зы растущих фолликулов андрогенов, что в свою очередь вызывает остановку роста фолликулов на стадии, предшествующей селекции доминантного, 4-10 мм в диаметре. Недавно была предложена теория, объясняющая сочетание инсулин-резистентности и гиперандрогении. Активация в серин киназной системе приводит к фосфо-риляции рецептора к инсулину и инактивации
субстрата инсулинового рецептора — 1 (Ш5-1), которая, в свою очередь, ведет к резистентности к действию этого гормона. Одновременно активация этой же киназной системы приводит к фос-форилированию цитохрома Р450с17, что в свою очередь ведет к гиперандрогении [22].
Многие исследования показывают, что при СПКЯ уровень АМГ в крови повышен в 2-3 раза [32, 53]. Также показано, что уровень АМГ в крови имеет положительную корреляцию с такими гормональными маркерами наличия СПКЯ, как уровни тестостерона, андростендиона и число антральных фолликулов [32]. Более того, было показано, что у пациенток с СПКЯ измерение уровня АМГ может заменить ультразвуковой подсчет числа фолликулов. Это важно у тех пациенток, у которых сложно произвести ультразвуковое обследование яичников, например при ожирении [64]. Стоит отметить, что увеличение продукции АМГ яичниками при СПКЯ вызвано не только увеличением числа фолликулов, вырабатывающих АМГ, но и увеличением выработки АМГ гранулезой этих фолликулов [41]. Более того, увеличение в уровне АМГ наблюдается у пациенток с СПКЯ до наступления менархе, а также у дочерей пациенток с этим синдромом [18, 67]. Также измерение уровня АМГ у пациенток старшей возрастной группы помогло разобраться с таким феноменом, как наступление поздней менопаузы у пациенток с СПКЯ. Действительно, у таких женщин менопауза наступает позже на 1-2 года, чем в среднем по популяции и уровни АМГ выше, чем в контрольной группе здоровых женщин. Все это говорит о большой роли АМГ в патогенезе этого синдрома [61].
Все это говорит о большой роли АМГ в патогенезе этого синдрома [61].
Причина, по которой при СПКЯ фолликулы остаются на стадии, предшествующей селекции доминантного, остается неизвестной, и по этой причине трудно судить, является ли повышенный уровень АМГ продуктом остановки роста фолликулов или это повышение играет самостоятельную патогенетическую роль. В любом случае повышенный уровень АМГ блокирует ароматазу и препятствует дальнейшему росту продукции гранулезой эстрадиола [53]. Исследования показали, что на клетках гранулезы фолликулов, полученных у пациенток с СПКЯ, наблюдается повышенное число рецепторов к ФСГ и андрогенам, а также повышенная экспрессия уровня мРНК АМГ и соответственно повышенная продукция этого гормона. Более того, наблюдается феномен уменьшения продукции АМГ в ответ на добавление ФСГ и увеличение продукции этого гормона в ответ на добавление ЛГ. Уровень выделения АМГ клетками гранулезы, полученной от здоровых пациенток, не менялся в ответ на добавление в культуру ФСГ или ЛГ [19, 41]. Все это
говорит о повреждении в секреции АМГ у пациенток с СПКЯ. Вероятно, высокий уровень АМГ в фолликулах пациенток с СПКЯ определяет резистентность к ФСГ. Дальнейшее подтверждение этого предположения нашло подтверждение в работе Бебия З. Н. с соавт., которые обнаружили, что при иммуногистохимической оценке содержания АМГ в гранулезных клетках больших антральных фолликулов, полученных у пациенток с СПКЯ, отмечается интенсивное окрашивание. В то же время у пациенток контрольной группы не наблюдалось окрашивания клеток гранулезы больших антральных фолликулов [1]. Stubbs S. et al. исследовали ранние стадии роста фолликулов у пациенток с СПКЯ с помощью иммуногистохи-мического анализа. Было обнаружено парадоксально меньшее число АМГ-позитивных клеток гранулезы в примордиальных и первичных фолликулах у пациенток с СПКЯ по сравнению с яичниками здоровых женщин. Авторы делают вывод о вовлеченности в процесс формирования СПКЯ самых ранних этапов роста фолликулов [14].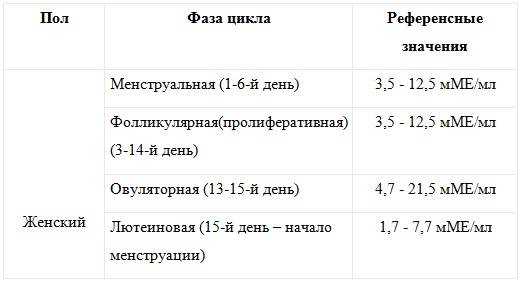
При анализе клеток гранулезы, полученной из фолликулярной жидкости, программе ЭКО, у пациенток с СПКЯ и у пациенток с трубноперитонеальным фактором, выяснилось, что у пациенток с СПКЯ наблюдается более высокий уровень экспрессии АМГ и рецептора к ФСГ как в фолликулах большого размера (17-22 мм в диаметре), так и малого (8-13 мм в диаметре). Также в гранулезе, полученной из фолликулов малого размера, у пациенток с СПКЯ наблюдалась повышенная экспрессия рецепторов к АМГ второго типа (AMHR-II) и к андрогенам по сравнению с пациентками со здоровыми яичниками. Все это говорит о том, что высокий уровень АМГ может играть одну из ключевых ролей в патогенезе СПКЯ [19]. Также имеется сообщение о повышенном содержании АМГ в фолликулярной жидкости и сыворотке крови у пациенток с этим синдромом по сравнению с пациентками со здоровыми яичниками, 7,01 ± 1,52 и 1,65 ± 0,23 нг/ мл и 2,7 ± 0,52 и 0,92 ± 0,19 нг/мл, соответственно [48]. Высокий уровень АМГ в фолликулярной жидкости и часто наблюдаемое плохое качество ооцитов у пациенток с СПКЯ ставит вопрос о возможном действии АМГ как ингибитора мейо-за в ооците [2, 69]. Однако дальнейшие исследования на животной модели показали, что АМГ не ингибирует процесс мейоза в ооцитах [72]. Необходимы дальнейшие исследования этого механизма у человека.
Интересно отметить, что к фенотипу, характерному для СПКЯ могут приводить различные мутации в генах рецепторов к андрогенам, инсулину, к ЛГ и ФСГ [38-40, 52]. Недавно был обнаружен
полиморфизм в гене рецептора АМГ первого типа (AMHR-I), который был ассоциирован с уровнем АМГ у пациенток с СПКЯ. Дальнейшие исследования должны показать, как эти изменения в рецепторе к АМГ могут влиять на резистентность к ФСГ, наблюдаемую у пациенток с СПКЯ [74].
Гипоталамическая аменорея и АМГ
Группа итальянских и израильских исследователей изучала уровни АМГ у пациенток с вторичной аменореей и у здоровых женщин. Пациентки с аменореей были отобраны по трем диагнозам: ПИЯ, функциональная гипоталамическая аменорея и СПКЯ. Было обнаружено, что у пациенток с ПИЯ уровень АМГ не определялся или был крайне низким, у пациенток с функциональной гипо-таламической аменореей средний уровень АМГ составлял 3,9 + 1,5 нг/мл, у пациенток с СПКЯ 7,4 + 1,7 нг/мл и у здоровых женщин из контрольной группы 3,5 + 1,5 нг/мл. Эти данные показывают, что у пациенток с функциональной гипо-таламической аменореей измерение АМГ дает представление о состоянии яичников, что может позволить произвести более точный дифференциальный диагноз при аменорее [60].
Пациентки с аменореей были отобраны по трем диагнозам: ПИЯ, функциональная гипоталамическая аменорея и СПКЯ. Было обнаружено, что у пациенток с ПИЯ уровень АМГ не определялся или был крайне низким, у пациенток с функциональной гипо-таламической аменореей средний уровень АМГ составлял 3,9 + 1,5 нг/мл, у пациенток с СПКЯ 7,4 + 1,7 нг/мл и у здоровых женщин из контрольной группы 3,5 + 1,5 нг/мл. Эти данные показывают, что у пациенток с функциональной гипо-таламической аменореей измерение АМГ дает представление о состоянии яичников, что может позволить произвести более точный дифференциальный диагноз при аменорее [60].
Роль АМГ в диагностике преждевременного истощения яичников (ПИЯ)
Преждевременное истощение яичников (ПИЯ) или по новой классификации, первичная яичниковая недостаточность (ПЯН), это гетерогенное состояние, которое характеризуется аменореей и менопаузальным уровнем ФСГ у женщин до 40 лет [49]. В последние годы АМГ был предложен как показатель наличия фолликулов у пациенток с ПИЯ. Massin N. et al. измерили уровень АМГ и сравнили его с данными биопсии яичников у 48 пациенток с ПИЯ и нормальным кариотипом. Выяснилось, что уровень АМГ был значительно выше у женщин, у которых при биопсии было обнаружено более 5 фолликулов. При иммуногисто-химическом исследовании экспрессии АМГ клетками гранулезы фолликулов было обнаружено, что у пациенток с ПИЯ уровень выделения АМГ преантральными фолликулами находится в пределах нормы, однако в антральных фолликулах он снижен [36]. Авторы делают вывод о важности измерения АМГ как маркера наличия персисти-рующих фолликулов у пациенток с ПИЯ [58].
Также АМГ был предложен как перспективный показатель сохранности овариального резерва у пациенток, перенесших лечение онкозаболеваний в молодом возрасте. Bath L. et al. выяснили, что уровень АМГ значительно снижен, а базальный уровень ФСГ повышен у молодых пациенток,
перенесших лучевую и химиотерапию в детстве [27]. Преимуществом измерения АМГ является то, что его можно измерять у пациенток с нерегулярным циклом во время приема КОК. Также уровень АМГ был измерен у молодых пациенток перенесших несколько циклов химиотерапии по поводу лимфогранулематоза. Выяснилось, что АМГ является лучшим показателем сохранности овариального резерва, чем базальные уровни ФСГ и ингибина В. Более того, он является наиболее значимым маркером возникновения ПИЯ после лечения лимфогранулематоза [17].
Преимуществом измерения АМГ является то, что его можно измерять у пациенток с нерегулярным циклом во время приема КОК. Также уровень АМГ был измерен у молодых пациенток перенесших несколько циклов химиотерапии по поводу лимфогранулематоза. Выяснилось, что АМГ является лучшим показателем сохранности овариального резерва, чем базальные уровни ФСГ и ингибина В. Более того, он является наиболее значимым маркером возникновения ПИЯ после лечения лимфогранулематоза [17].
АМГ и нервная анорексия
Нервная анорексия — это серьезное заболевание, которое заключается в частичном или полном отказе от пищи, что приводит к резкому уменьшению веса тела, нарушениям в эндокринной системе и к аменорее. Несмотря на то, что большую часть пациенток удается с помощью психотропных препаратов и психологического воздействия вернуть к полноценному питанию, аменорея и нарушения менструального цикла могут наблюдаться в течение многих лет после того, как вес пришел в норму. Van Elburg A. et al. изучили значение измерения уровней АМГ, лептина, эстрадиола, ингибина В, ФСГ на вероятность восстановления функции яичников у пациенток с перенесенной нервной анорексией. Было обнаружено, что уровни АМГ, ингибина В и ФСГ независимо друг от друга могут определять вероятность восстановления функции яичников [51].
АМГ и эндометриоз
Недавно была опубликована работа, в которой были сравнены уровни АМГ у пациенток с малыми формами эндометриоза (первой и второй стадией по классификации американского общества репродуктивной медицины) и пациенток с трубным фактором бесплодия. Было обнаружено, что пациентки с эндометриозом имеют меньший уровень АМГ: 1,26 + 0,7 нг/мл по сравнению с
2,02 + 0,72 нг/мл у пациенток с трубным фактором, P=0,004. При анализе размеров фолликулов, которые могут продуцировать АМГ было обнаружено, что у пациенток с эндометриозом имеется большая, чем в контрольной группе, гетерогенность в этой группе фолликулов и они в среднем имеют больший размер [24]. Дальнейшие исследования должны показать не имеется ли дефект в секреции АМГ у пациенток с эндометриозом.
Дальнейшие исследования должны показать не имеется ли дефект в секреции АМГ у пациенток с эндометриозом.
АМГ и гранулезоклеточные опухоли
АМГ может быть маркером гранулезо-клеточных опухолей (ГКО) яичников. АМГ повышен от 76 до 93 % пациенток с ГКО. Уровень
этого гормона у этих пациенток в среднем составляет 190,3 нг/мл (от 2 до 1124 нг/мл) [28]. АМГ может служить маркером эффективности хирургического лечения и химиотерапии у пациенток с ГКО [44].
Влияние лекарственных препаратов на уровень АМГ
Somunkiran A. et al. изучили влияние комбинированных оральных контрацептивов (КОК) на уровень АМГ у пациенток с СПКЯ и здоровых женщин. Было определено, что после 6 месяцев применения КОК уровень АМГ не менялся, тогда как объем яичников, общее число фолликулов, уровни ФСГ, ЛГ, эстрадиола и тестостерона уменьшались статистически достоверно [11]. Динамика изменений гормональных и ультразвуковых показателей была идентична у пациенток с СПКЯ и здоровых женщин.
Назначение метформина (в среднем 1500 мг в день) в течение 6 месяцев пациенткам с СПКЯ приводило к статистически значимому снижению АМГ, с 12,2+2,1 нг/мл до 11,4+2,2 нг/мл соответственно, P < 0,01). Также снижались объем яичников и число фолликулов [61].
Jayaprakasan K. et al. изучали влияние десенси-тизации гипофиза препаратами агониста люлибе-рина в программе ЭКО на такие показатели овариального резерва, как уровень АМГ, ингибина В, ФСГ, ЛГ, эстрадиола и числа антральных фолликулов, подсчитанных с помощью трехмерного ультразвукового исследования. Указанные показатели были измерены на 2-3 дни менструального цикла и были сравнены с теми параметрами, что были получены после двух недель назначения агонистов люлиберина. Было показано, что уровень АМГ повысился на 32 % (P < 0,01), тогда как уровни ингибина В, эстрадиола, ФСГ и ЛГ понизились на 40-50 % (P < 0,01). Объем яичников уменьшился, тогда как число антральных фолликулов осталось неизменным. Авторы делают вывод, что десенситизация гипофиза позволяет получать большое число фолликулов, способных отвечать на овариальную стимуляцию, показателем чего служит увеличение уровня АМГ [31].
Было показано, что уровень АМГ повысился на 32 % (P < 0,01), тогда как уровни ингибина В, эстрадиола, ФСГ и ЛГ понизились на 40-50 % (P < 0,01). Объем яичников уменьшился, тогда как число антральных фолликулов осталось неизменным. Авторы делают вывод, что десенситизация гипофиза позволяет получать большое число фолликулов, способных отвечать на овариальную стимуляцию, показателем чего служит увеличение уровня АМГ [31].
Mohamed K. et al. исследовали влияние длительного воздействия агонистов люлиберина (4 и 8 недель применения депонированного агониста гозерелина) на уровень АМГ, ФСГ и ЛГ у пациенток с эндометриозом. Выяснилось, что уровни ФСГ и ЛГ снизились в среднем на 50 % и 200-290 % (Р < 0,01) соответственно, тогда как уровень АМГ не изменился. Авторы делают вывод, что длительное применение препаратов агонистов люлиберина не меняет числа антральных фолликулов [46].
После достижения десенситизации назначение препаратов мочевого или рекомбинантного ФСГ вызывает значительное снижение уровня АМГ. Было показано, что снижение уровня АМГ происходило постоянно во время стимуляции, и на день назначения овуляторной дозы ХГЧ составило 44 % от дня начала стимуляции (1,21 + 0,11 и 0,53 + 0,06 соответственно, Р < 0,001). Падение уровня АМГ происходило параллельно уменьшению числа антральных фолликулов менее 12 мм в диаметре и увеличению числа большего размера и концентраций в крови эстрадиола, ингибина В, прогестерона и тестостерона. Все это говорит о резком снижении во время овариальной стимуляции фолликулов, которые способны вырабатывать АМГ в связи с их переходом в число быстрорастущих предовуляторных фолликулов [57].
Динамика уровня АМГ в лютеиновую фазу цикла в протоколе стимуляции ЭКО была изучена группой французских исследователей. Выяснилось, что по сравнению с днем назначения ХГЧ на четвертый день уровень АМГ падает в среднем на 64 %, после чего повышается на 82 % на восьмой день после назначения овуляторной дозы ХГЧ. Динамика падения и подъема АМГ совпадала по динамике с эстра-диолом, тогда как уровень прогестерона постепенно повышался с дня назначения ХГЧ до восьмого дня [29]. Падение уровня АМГ от дня назначения ХГЧ до четвертого дня можно объяснить процессами лютеинизации фолликулов и резким снижением продукции этого гормона клетками желтых тел. Дальнейший подъем АМГ в середине лютеиновой фазы, вероятно, связан с процессом дальнейшего роста фолликулов, и формированием пула антральных фолликулов, из которого в следующем цикле будет выбираться доминантный [4, 15].
Динамика падения и подъема АМГ совпадала по динамике с эстра-диолом, тогда как уровень прогестерона постепенно повышался с дня назначения ХГЧ до восьмого дня [29]. Падение уровня АМГ от дня назначения ХГЧ до четвертого дня можно объяснить процессами лютеинизации фолликулов и резким снижением продукции этого гормона клетками желтых тел. Дальнейший подъем АМГ в середине лютеиновой фазы, вероятно, связан с процессом дальнейшего роста фолликулов, и формированием пула антральных фолликулов, из которого в следующем цикле будет выбираться доминантный [4, 15].
Заключение
АМГ является одним из наиболее значимых регуляторов репродуктивной функции женщины, который отражает рост фолликулов от примордиального пула до стадии больших антральных. Появившаяся в последние годы возможность измерять уровень этого гормона в крови позволила по-новому взглянуть на диагностику овариального резерва, СПКЯ, ПИЯ, гипоталамической аменореи, нервной анорексии, гранулезоклеточных опухолей яичников. Кроме высокой точности в определении овариального резерва, АМГ может быть привлекательным, так как уровень этого гормона может быть измерен в любой день менструального цикла, а также при приеме КОК или применении агонистов люлиберина.
Литература
1. Бебия З. Н. Новый взгляд на патогенез синдрома поликистозных яичников // Бебия З. Н., Гаджиева Т. С. Новые
подходы к решению проблем женского здоровья. — СПб.: СПБМАПО, 2000. — С. 11-18.
2. Бебия З.Н., Орлов В. М. Антимюллеровый фактор // Ж. акуш. и жен. болезн. — 1999. — № 2. — C. 66-70.
3. Боярский К. Ю. Роль показателей овариального резерва при лечении бесплодия методом ЭКО-ПЭ // Лечение женского и мужского бесплодия (вспомогательные репродуктивные технологии) / ред. Кулаков В. И., Леонов Б. В., Кузьмичев Л. Н. — Москва.: МИА, 2005. — С. 53-60.
Кулаков В. И., Леонов Б. В., Кузьмичев Л. Н. — Москва.: МИА, 2005. — С. 53-60.
4. Боярский К. Ю. Фолликулогенез и современная овариальная стимуляция // Проблемы репродукции. — 2002. — Т. 8, № 3. — С. 36-43.
5. Назаренко Т. А., МишиеваН. Г., ФанченкоН. Д. Роль антимюл-лерова гормона в оценке овариального резерва // Проблемы репродукции. — 2005. — № 6. — С. 26-30.
6. A polymorphism in the AMH type II receptor gene is associated with age at menopause in interaction with parity / Kavenaar M. E. [et al.] // Hum. Reprod. — 2007. — Vol. 22. — P. 2382-2388.
7. Anti-Mullerian hormone and anti-Mullerian hormone type II receptor polymorphisms are associated with follicular phase estradiol levels in normo-ovulatory women / Kevenaar M. E. [et al.] // Hum. Reprod. — 2007. — Vol. 22. — P. 1547-1554.
8. Anti-Mullerian hormone and ovarian dysfunction / Broekmans F. J. [et al.] // Trends. Endocrinol. Metab. — 2008. — Vol. 19, №9. — P. 340-347.
9. Anti-Mullerian hormone as a predictor of IVF outcome / Lekamge D. N. [et al.] // Reprod. Biomed. Online. — 2007. — Vol. 14, № 5. — P. 602-610.
10. Anti-Mullerian hormone expression pattern in the human ovary: potential implications for initial and cyclic follicle recruitment / Weenen C. [et al.] // Mol. Hum. Reprod. — 2004. — Vol. 10. — P. 77-83.
11. Anti-Mullerian hormone levels during hormonal contraception in women with polycystic ovary syndrome / Somunkiran A. [et al.] // Eur. J. Obstet. Gynecol. Reprod. Biol. — 2007. — Vol. 134. — P. 196-201.
12. Anti-Mullerian hormone levels in the spontaneous menstrual cycle do not show substantial fluctuation / Hehenkamp W. J. [et al.] // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91. — P. 4057-4063.
J. [et al.] // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91. — P. 4057-4063.
13. Anti-Mullerian hormone measurement on any day of the menstrual cycle strongly predicts ovarian response in assisted reproductive technology / La Marca A. [et al.] // Hum. Reprod. — 2007. — Vol. 22, № 3. — P. 766-771.
14. Anti-mullerian hormone protein expression is reduced during the initial stages of follicle development in human polycystic ovaries / Stubbs S. A. [et al.] // J. Clin. Endocrinol. Metab. —
2005. — Vol. 90. — P. 5536-5543.
15. Anti-Mullerian hormone: clinical insights into a promising biomarker of ovarian follicular status / Feyeresen E. [et al.] // Reprod. Biomed. Online. — 2006. — Vol. 12, № 6. — P. 695-703.
16. Anti-mullerian hormone and inhibin B in the definition of ovarian aging and the menopause transition / Sowers M. R. [et al.] // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93. — P. 3478-3483.
17. Anti-Mullerian hormone is a sensitive serum marker for gonadal function in women treated for Hodgkin’s lymphoma during childhood / van Beek R. D. [et al.] // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — P. 3869-3874.
18. Anti-Mullerian hormone levels in peripubertal dauthers of women with polycystic ovary syndrome / Crisosto N. [et al.] // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92, № 7. — P. 2739-2743.
19. Anti-Mullerian hormone, its receptor, FSH receptor, and androgen receptor genes are overexpressed by granulosa cells from stimulated follicles in women with polycystic ovary syndrome / Catteau-Jonard S. [et al.] // J. Clin. Endocrinol. Metab. — 2008. — Vol.93, № 11. — P. 4456-4461.
Clin. Endocrinol. Metab. — 2008. — Vol.93, № 11. — P. 4456-4461.
20. Anti-Mullerian hormone-based approach to controlled ovarian stimulation for assisted conception / Nelson S. M. [et al.] // Hum. Reprod. — 2009. — Vol. 24. — P. 867-875.
21. Basal level of anti-Müllerian hormone is associated with oocyte quality in stimulated cycles / Ebner T. [et al.] // Hum. Reprod. — 2006. — Vol. 21. — P. 2022-2026.
22. Bremer A. A, Miller W. L.The serine phosphorylation hypothesis of polycystic ovary syndrome: a unifying mechanism for hyperandrogenemia and insulin resistance // Fertil. Steril. — 2008. — Vol. 89, № 5. — P. 1039-1048.
23. Chang H., Brown C., Matzuk M. Genetic analysis of the mammalian transforming growth factor-beta superfamily // Endocrine reviews. — 2002. — Vol. 23. — P. 787-823.
24. Control of primordial follicle recruitment by anti-Müllerian hormone in the mouse ovary / Durlinger A. L. [et al.] // Endocrinology. — 1999. — Vol. 140, N 12. — P. 5789-5796.
25. Decreased AMH and altered ovarian follicular cohort in infertile patients with mild / minimal endometriosis / Lemos N. [et al.] // Fertility and Sterility. — 2008. — Vol. 89. — P. 1064-1068.
26. Deffieux X., Antoine J. M. Inhibins, activins and anti-Müllerian hormone: structure, signalling pathways, roles and predictive value in reproductive medicine // Gynecol. Obstet. Fertil. — 2003. — Vol. 31, № 11. — P. 900-911.
27. Depletion of ovarian reserve in young women after treatment for cancer in childhood: detection by anti-Müllerian hormone, inhibin B and ovarian ultrasound / Bath L. E. [et al.] // Hum. Reprod. — 2003. — Vol. 18, № 11. — P. 2368-2374.
[et al.] // Hum. Reprod. — 2003. — Vol. 18, № 11. — P. 2368-2374.
28. Diagnostic utility of Müllerian inhibiting substance determination in patients with primary and recurrent granulosa cell tumors / Lane A. H. [et al.] // Gynecol. Oncol. —1999. — Vol. 73, № 1. — P. 51-55.
29. Dynamics of serum anti-Müllerian hormone levels during the luteal phase of controlled ovarian hyperstimulation / Fanchin R. [et al.] // Hum. Reprod. — 2005. — Vol. 20, № 3. — P. 747-751.
30. Early follicular serum müllerian-inhibiting substance levels are associated with ovarian response during assisted reproductive technology cycles / Seifer D. B. [et al.] // Fertil. Steril. — 2002. — Vol. 77. — P. 468-471.
31. Effect of pituitary desensitization on the early growing follicular cohort estimated using anti-Mullerian hormone / Jayaprakasan K. [et al.] // Hum. Reprod. — 2008. — Vol. 23. — P. 2577-2583.
32. Elevated serum level of anti-mullerian hormone in patients with polycystic ovary syndrome: relationship to the ovarian follicle excess and to the follicular arrest / Pigny P. [et al.] // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88. — P. 5957-5962.
33. Endocrine features of menstrual cycles in middle and late reproductive age and the menopausal transition classified according to the Staging of Reproductive Aging Workshop (STRAW) staging system / Hale G. E. [et al.] // J. Clin. Endocrinol. Metab. — 2007. — Vol.92, № 8. — P. 3060-3067.
34. Enhanced purification of Mullerian inhibiting substance for therapeutic applications / Danahoe P. [et al.] // Mol. Cell. Endocr. — 2003. — Vol. 211. — P. 37-41.
35. Evaluation of anti-Müllerian hormone as a test for the prediction of ovarian reserve / Kwee J. [et al.] // Fertil. Steril. — 2008. — Vol. 90, № 3. — P. 737-743.
36. Evaluation of different markers of the ovarian reserve in patients presenting with premature ovarian failure / Massin N. [et al.] // Mol. Cell Endocrinol. —• 2008. — Vol. 30. — P. 95-100.
37. Executive summary: Stages of Reproductive Aging Workshop (STRAW) / Soules M. R. [et al.] // Fertil. Steril. — 2001. — Vol. 76. — P. 874-878.
38. Ferk P., Perme M. P., Gersak K. Insulin gene polymorphism in women with polycystic ovary syndrome // J. Int. Med. Res. — 2008. — Vol. 36, № 6. — P. 1180-1187.
39. Functional genetic polymorphisms and female reproductive disorders: Part I: Polycystic ovary syndrome and ovarian response / Simoni M. [et al.] // Hum. Reprod. Update. — 2008. — Vol. 14. — P. 459-484.
40. Genetics of polycystic ovary syndrome / Franks S. [et al.] // Mol. Cell. Endocrinol. — 1998. — Vol. 145. — P. 123-128.
41. Granulosa cell production of anti-Müllerian hormone is increased in polycystic ovaries / Pellatt L. [et al.] // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — P. 240-245.
42. High reproducibility of serum anti-Müllerian hormone measurements suggests a multi-staged follicular secretion and strengthens its role in the assessment of ovarian follicular status / Fanchin R. [et al.] // Hum. Reprod. — 2005. — Vol. 20. — P. 923-927.
43. Inhibin B and anti-Mullerian hormone: markers of ovarian response in IVF/ICSI patients? / Muttukrishna S. [et al.] // BJOG. — 2004. — Vol. 111. — P. 1248-1253.
44. LaMarcaA., Volpe A. The Anti-Mullerian hormone and ovarian cancer // Hum. Reprod. Update. — 2007. — Vol. 13. — P. 265-2673.
45. Mapping of the gene for anti- mullerian hormone to the short arm of human chromosome 19 / Cohen-Haguenauer O. [et al.] // Cytogenet. Cell Genet. — 1987. — Vol. 44. — P. 2-6.
46. MohamedK. A., Davies W. A., Lashen H. Antimüllerian hormone and pituitary gland activity after prolonged down-regulation with goserelin acetate // Fertil. Steril. — 2006. — Vol. 86. — P. 1515-1517.
47. Müllerian inhibiting substance is an accurate marker of ovarian response in women of advanced reproductive age undergoing IVF / Nakhuda G. S. [et al.] // Reprod. Biomed. Online. — 2007. — Vol. 14, № 4. — P. 450-454.
48. Müllerian-inhibiting substance in follicular fluid and serum: a comparison of patients with tubal factor infertility, polycystic ovary syndrome, and endometriosis / Fallat M. E. [et al.] // Fertil. Steril. — 1997. — Vol. 67. — P. 962-965.
49. Nelson L. M. Clinical practice. Primary ovarian insufficiency // N. Engl. J. Med. — 2009. — Vol. 360. — P. 606-614.
50. Nelson S.M., Yates R. W., Fleming R. Serum anti-Müllerian hormone and FSH: prediction of live birth and extremes of response in stimulated cycles—implications for individualization of therapy // Hum. Reprod. — 2007. — Vol. 22. — P. 2414-2421.
51. Predictors of recovery of ovarian function during weight gain in anorexia nervosa / van Elburg A. A. [et al.] // Fertil. Steril. — 2007. — Vol. 87. — P. 902-908.
52. Prevalence of an immunological LH beta-subunit variant in a UK population of healthy women and women with polycystic ovary syndrome / Rajkhova M. [et al.] // Clin. Endocrinol. — 1995. — Vol. 43. — P. 297-303.
53. Relationship between serum müllerian-inhibiting substance and other reproductive hormones in untreated women with polycystic ovary syndrome and normal women / Cook C. L. [et al.] // Fertil. Steril. — 2002. — Vol. 77, № 1. — P. 141-146.
54. Relationship of serum antimüllerian hormone concentration to age at menopause / van Disseldorp J. [et al.] // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93. — P. 2129-2134.
55. Research on menopause: Report WHO Scientific group: WHO Technical report series. № 670. — Geneva, 1981.
56. Serum anti-Müllerian hormone and estradiol levels as predictors of ovarian hyperstimulation syndrome in assisted reproduction technology cycles / Lee T. H. [et al.] // Hum. Reprod. — 2008. — Vol. 23, № 1. — P. 160-167.
57. Serum anti-Müllerian hormone dynamics during controlled ovarian hyperstimulation / Fanchin R. [et al.] // Hum. Reprod. — 2003. — Vol. 18, № 2. — P. 328-332.
58. Serum anti-Müllerian hormone expression in women with premature ovarian failure / Meduri G. [et al.] // Hum. Reprod. — 2007. — Vol. 22. — P. 117-123.
59. Serum anti-Müllerian hormone is more strongly related to ovarian follicular status than serum inhibin B, estradiol, FSH and LH on day 3 / Fanchin R. [et al.] // Hum. Reprod. — 2003. — Vol. 18, № 2. — P. 323-327.
60. Serum anti-müllerian hormone levels in women with secondary amenorrhea / La Marca A. [et al.] // Fertil. Steril. — 2006. — Vol. 85, № 5. — P. 1547-1549.
61. Serum anti-Müllerian hormone levels remain high until late reproductive age and decrease during metformin therapy in women with polycystic ovary syndrome / Piltonen T. [et al] // Hum. Reprod. — 2005. — Vol. 20, 7. — P. 1820-1826.
62. Serum anti-Müllerian hormone levels: a novel measure of ovarian reserve / van Rooij I. A. [et al.] // Hum. Reprod. — 2002. — Vol. 17. — P. 3065-3071.
63. Serum antimüllerian hormone/müllerian-inhibiting substance appears to be a more discriminatory marker of assisted
reproductive technology outcome than follicle-stimulating hormone, inhibin B, or estradiol / Hazout A. [et al.] // Fertil. Steril. — 2004. —Vol. 82. — P. 1323-1329.
64. Serum anti-Mullerian hormone as a surrogate for antral follicle count for definition of the polycystic ovary syndrome / PignyP. [et al.] // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91. — P. 941-945.
65. Serum antimullerian hormone levels best reflect the reproductive decline with age in normal women with proven fertility: a longitudinal study / van Rooij I. A. [et al.] // Fertil.
Steril. — 2005. — Vol. 83. — P. 979-987.
66. Serum anti-Mullerian hormone throughout the human menstrual cycle / La Marca A. [et al.] // Hum. Reprod. —
2006. — Vol. 21. — P. 3103-3107.
67. Serum Müllerian-inhibiting substance levels in adolescent girls with normal menstrual cycles or with polycystic ovary syndrome / Siow Y. [et al.] // Fertil. Steril. — 2005. — Vol. 84. — P.938-944.
68. Statistically significant changes of antimüllerian hormone and inhibin levels during the physiologic menstrual cycle in reproductive age women / Wunder D. M. [et al.] // Fertil. Steril. — 2008. — Vol. 89. — P. 927-933.
69. Takahashi M., Koide S. S., Donahoe P. K. Müllerian inhibiting substance as oocyte meiosis inhibitor // Mol. Cell Endocrinol. — 198. — Vol. 47. — P. 225-234.
70. Teixeira J., Maheswaran S., Donahoe P. K. Müllerian inhibiting substance: an instructive developmental hormone with diagnostic and possible therapeutic applications // Endocr. Rev. — 2001. — Vol. 22. — P. 657-674.
71. The Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS) // Hum. Reprod. — 2004. — Vol. 19. — P. 41-47.
72. Tsafriri A., Picard J. Y., Josso N. Immunopurified anti-müllerian hormone does not inhibit spontaneous resumption of meiosis in vitro of rat oocytes // Biol. Reprod. — 1988. — Vol. 38. — P. 481-485.
73. Undetectable serum anti-Müllerian hormone levels and occurrence of ongoing pregnancy / Fraisse T. [et al.] // Fertil. Steril. — 2008. — Vol. 89, № 3. — P. 723.
74. Variants in the ACVR1 gene are associated with AMH levels in women with polycystic ovary syndrome / Kavenaar M. E. [et al.] // Hum. Reprod. — 2009. — Vol. 24, № 1. — P. 241-249.
75. WHO Scientific group: Research on the menopause in the 1990’s: a report of the WHO Scientific group. № 866. — Geneva,1996. — 79 p.
Статья представлена И. Ю. Коганом, ГУ НИИ акушерства и гинекологии им. Д. О. Отта,
Санкт-Петербург
THE ROLE OF AMH MEASUREMENT IN NORMAL OVARIAN FUNCTION AND DIFFERENT GYNECOLOGICAL DISEASES
Boyarsky C. Y., Gaidukov S. N., Mahkova E. A.
■ Summary: In this review different aspects of AMH measuring in gynecologic practice are presented. AMH is a hormone, that produced by granulosa cells of growing follicles from primordial to antral stages. AMH measurement can be used for diagnostics of ovarian reserve, polycystic ovarian syndrome, premature ovarian failure, anorexia nervosa, hypothalamic amenorrhea, granulosa-cell ovarian tumors and the time of menopause.
■ Key words: AMH; folliculogenesis; gynecological diseases; PCOS; ovarian reserve.
■ Адреса авторов для переписки————————————-
Боярский Константин Юрьевич — к. м. н., ассистент кафедры. Кафедра акушерства и гинекологии Санкт-Петербургской Государственной Педиатрической Медицинской Академии, клиника ИнАлМед. 198255, Россия, Санкт-Петербург, ул. Танкиста д. 3.
E-mail: [email protected]
Гайдуков Сергей Николаевич — зав. кафедрой, д. м. н., профессор. Кафедра акушерства и гинекологии Санкт-Петербургской Государственной Педиатрической Медицинской Академии.
194100, Россия, Санкт-Петербург, ул. Литовская д. 2.
E-mail: [email protected]
Машкова Елена Андреевна — врач акушер-гинеколог.
Клиника лечения бесплодия ИнАлМед.
198255, Россия, Санкт-Петербург, ул. Танкиста д. 3.
Boyarsky Constantin Yurievich — assistant professor. Department of Obstetrics and Gynecology, State Pediatric Medical Academy, St-Petersburg, InAlMed clinics 198259 Russia, St. Petersburg, Ul. Tankista Chrustitskogo d.3 E-mail: [email protected]
Gaidukov Sergey Nikolaevich — head of department, professor. Department of Obstetrics and Gynecology, State Pediatric Medical Academy, St-Petersburg.
194100 Russia, St. Petersburg, ul. Litovskaya d. 2.
E-mail: [email protected]
Mahkova Elena Andreevna — obstetrician-gynecologist . InAlMed infertility clinics.
198259 Russia, St. Petersburg, Ul. Tankista Chrustitskogo d.3
Антимюллеров гормон – статьи о здоровье
Оглавление
Антимюллеров гормон (АМГ), названный так по имени ученого, выделившего у женского и мужских эмбрионов общую канал‑трубку, является биологически активным веществом, определяющим способность к зачатию. Его отклонения от норм могут свидетельствовать о серьезных проблемах со здоровьем. Выделяется антимюллеров гормон и у женщин, и мужчин. У представителей сильного пола его концентрация в организме существенно ниже.
Особенно важной оценка показателей содержания гормона в организме является на этапе планирования беременности. Также анализы сдаются для определения задержек и преждевременного полового созревания, решения иных задач.
Роль в организме женщины
Антимюллеров гормон производится клетками яичников. Он вырабатывается организмом уже на 32 недели зародышевого состояния. Особенно важную роль гормон играет на этапе полового созревания. В это время его концентрация постепенно увеличивается. В 20‑30 лет содержание гормона максимально. Спад показателя отмечается после 30 лет. Свое существование он прекращает после наступления менопаузы. Это обусловлено тем, что в данный период процесс образования яйцеклеток останавливается.
АМГ указывает на фолликулярный запас яичников. При этом уровень гормона может варьироваться от цикла к циклу (как снижаться, так и повышаться). С качеством яйцеклеток АМГ не связан. Поэтому нельзя точно утверждать, что его низкий показатель свидетельствует о бесплодии.
Когда нужно пройти исследование?
Сдать анализ на антимюллеров гормон следует:
- при необходимости в установлении стадии полового созревания пациентки
- при проведении оценки фертильности
- при выявлении резерва яйцеклеток в организме женщины
- при фиксации наступления ранней менопаузы
Также исследование проводится при неуспешных попытках ЭКО, выявлении причин бесплодия и в ряде других случаев.
Важно! Особенно важно исследовать показатели антимюллерова гормона при проблемах с зачатием. Если обнаруживается риск бесплодия, рекомендуют провести извлечение здоровых яйцеклеток и выполнить их заморозку – программа витрификации ооцитов (отложенное материнство).
Как подготовиться к сдаче анализа?
Для получения достоверных результатов исследования следует пройти небольшую подготовку:
- Анализ на антимюллеров гормон сдают натощак. Поэтому за 6‑8 часов следует отказаться от употребления пищи и воды
- За 4 дня до диагностики исключают стрессовые и физические нагрузки
- За час перед сдачей анализа отказываются от курения
- За день до исследования прекращают употребление жирной и жареной пищи и алкоголя
Кровь на анализ не сдают после перенесенных острых заболеваний.
Важно! Об остальных особенностях подготовки к диагностике расскажет лечащий врач. Он же проведет и расшифровку результатов анализа.
На какой день цикла сдают анализ на антимюллеров гормон? Срок прохождения исследования не играет существенной роли. Это связано с тем, что концентрация гормона на протяжении всего менструального цикла практически не меняется. Тем не менее, лучше всего проходить диагностику с 3 по 5 день цикла. Это обусловлено тем, что АМГ обычно сдают вместе с ФСГ (фолликулостимулирующий гормон). Показатели нормы антимюллерова гормона в лаборатории подбираются с учетом фазы менструального цикла. Его пациентка указывает при сдаче крови. Благодаря этому повышается точность получаемых результатов. Чтобы отследить необходимые показатели в динамике, диагностику повторяют несколько раз.
Нормы антимюллерова гормона (по возрасту): пониженные и повышенные показатели
Показатели содержания вещества зависят от ряда факторов. Одним из них является возраст пациентки.
В период с 18 до 25 лет нормальными считаются показатели от 1,2 до 13,4 нг/мл, например. Отклонения могут свидетельствовать о различных патологических процессах.
Важно!
Следует учитывать, что на показатель влияют и такие факторы, как:
- метод проведения исследования
- соблюдение всех установленных норм, связанных с транспортировкой и хранением биологического материала
- наличие лишнего веса у пациентки
- склонность к сахарному диабету
- содержание витамина D
- расовая принадлежность и др.
Антимюллеров гормон может быть повышен при:
- поликистозе яичников (блокировке фолликулов в их полости)
- наличии опухолевых процессов
- бесплодии
- позднем половом созревании
- туберкулезе
Понижен антимюллеров гормон при уменьшении количества плодотворных фолликулов. Низкий уровень также может указывать на сокращение функции яичников в связи с их истощением.
Пониженный показатель может свидетельствовать о:
- начале менопаузы
- генетических отклонениях в развитии яичников
- ожирении
- сбоях в работе гипофиза
- травмах яичников и др.
Влияние на беременность
Антимюллеров гормон важен для зачатия. При этом вопрос естественного оплодотворения при низком уровне АМГ остается спорным. В этом случае сниженным считается уровень менее 1,2 нг/мл. При этом шансы на зачатие уменьшаются. Но они сохраняются в случае, если в пределах нормы будет находиться уровень фолликулостимулирующего гормона (ФСГ).
Успешное зачатие даже при низком показателе АМГ возможно с применением методик ЭКО (экстракорпорального оплодотворения). Обычно в таких случаях рекомендуют японский протокол. Обеспечивается минимальная стимуляция, которая разделяется перерывами и позволяет получить в каждом цикле 1‑2 жизнеспособные яйцеклетки. Их замораживают и переносят в матку в наиболее благоприятный период. Также возможно применение ЭКО в естественном цикле и другие модифицированные протоколы стимуляции овуляции.
Высокие показатели АМГ также могут негативно сказаться на возможностях зачатия. Это обусловлено тем, что они указывают на нарушения репродуктивной функции. Обычно рост АМГ отмечается при опухолях, поликистозе и генетических проблемах. Зачатие рекомендуют отложить до выяснения причины повышения уровня антимюллерова гормона и ее устранения. Лечение не стоит откладывать.
Преимущества обращения в МЕДСИ
- Квалифицированные специалисты в области репродуктологии. Врачи МЕДСИ своевременно осваивают все новые методики и техники оказания медицинской помощи, при этом они располагают необходимыми базовыми знаниями и навыками
- Экспертная диагностика и собственная лаборатория. Для проведения анализа в клиниках применяется передовое оборудование, обеспечивающее высокую точность результатов. В лаборатории созданы все условия для качественного хранения и обработки биологического материала
- Оперативная расшифровка анализа на антимюллеров гормон и выдача профессиональных рекомендаций. Врач объяснит все особенности состояния в зависимости от выявленных показателей и расскажет о том, как спланировать беременность или решить иные задачи
- Возможности для лечения, а также подготовки и проведение программ ЭКО. Мы располагаем всеми возможностями для решения задач, связанных с экстракорпоральным оплодотворением, и обеспечиваем комплексный подход к ним
- Предоставление полного комплекса услуг. Наши специалисты обеспечивают не только процессы зачатия, но и ведение беременности, а также восстановление после родов
- Индивидуальный подход. Мы предлагаем комплексный подход и учитываем все факторы, которые могут стать барьерами на пути к рождению малыша
- Соблюдение международных стандартов. Мы обеспечили многоступенчатую очистку воздуха в помещениях, автоматизированное поддержание давления, температуры и уровня влажности
- Автоматизированная система идентификации биологического материала. Система FertiProof является первой в России и гарантирует исключение человеческого фактора «подмены» биоматериала на протяжении всех этапов программы ЭКО
- Комфорт посещения клиники. Наш Центр располагается недалеко от метро, что позволяет посещать его жителям любых районов Москвы. Кроме того, мы позаботились об отсутствии очередей и длительного ожидания приема. Не напрасно наш Центр рекомендуют знакомым и близким
Чтобы сдать анализ на антимюллеров гормон, уточнить его цену, достаточно позвонить по телефону +7 (495) 7-800-500 Записаться в клинику можно не только по указанному номеру, но и с помощью приложения SmartMed.
Что делать, если у меня нормальный уровень ФСГ, но низкий уровень АМГ?
Уровень фолликулостимулирующего гормона (ФСГ) и уровень антимюллерова гормона (АМГ) в день 3 цикла обычно используются для оценки резерва яичников. Уровень ФСГ обычно позволяет прогнозировать частоту наступления беременности при экстракорпоральном оплодотворении (ЭКО), а уровень <10 мМЕ / мл считается «обнадеживающим».
С другой стороны, уровни АМГ позволяют прогнозировать количество фолликулов (яйцеклеток), которые образуются у пациента во время ЭКО, а уровень> 0,8 нг / мл считается «обнадеживающим».(Важно отметить, что эти пороговые уровни могут варьироваться в зависимости от используемого анализа и могут варьироваться от лаборатории к лаборатории.)
Комбинация обнадеживающих уровней ФСГ и АМГ обычно считается «хорошей», а комбинация относительного уровня ФСГ (> 10 мМЕ / мл) и уровня АМГ (<0,8 нг / мл) обычно считается «плохой».
Но что, если есть несоответствие между уровнями ФСГ и АМГ?
Иногда ваши тесты могут показать относительный уровень ФСГ с уровнем АМГ, который обнадеживает, или наоборот: обнадеживающий уровень ФСГ с относительным уровнем АМГ.Насколько распространено это несоответствие?
Обычные уровни дискордантных гормонов
В недавней статье Leader et al. (Fertil Steril 2012; 98: 1037-42) именно эта проблема была решена. Они обнаружили, что из 5354 протестированных женщин каждая пятая имела несогласованные значения АМГ и ФСГ. Среди женщин с обнадеживающими значениями ФСГ (n = 4469) соответствующие значения АМГ были обнаружены у каждой пятой женщины, сильно зависящей от возраста, от 1 из 11 женщин в возрасте до 35 лет до 1 из 3 женщин старше 40 лет. возраст.С другой стороны, из женщин с обнадеживающими значениями АМГ (n = 3 742), у 1 из 18 были примерно одинаковые значения ФСГ, частота которых не изменялась статистически значимо по возрасту.
Таким образом, клиническое несоответствие значений АМГ и ФСГ в сыворотке было частым и зависело от возраста. В этой статье, однако, не рассматривались клинические исходы у этих пациентов.
Что означают сообщения о смешанных гормонах для успеха ЭКО
Итак, что это несоответствие означает для шансов пациента на успех? В настоящее время считается, что количество извлеченных яиц уменьшается в следующем порядке: обнадеживающие ФСГ и АМГ, касающиеся ФСГ, но успокаивающие АМГ, касающиеся АМГ, но успокаивающие ФСГ, и то и другое в отношении ФСГ и АМГ.
В другой публикации Buyuk et al. (Fertil Steril 2011; 95: 2369-72) изучали 73 женщины с повышенным уровнем ФСГ на третий день цикла (> 10 мМЕ / мл). У женщин с повышенным уровнем ФСГ, у которых уровень АМГ> 0,6 нг / мл, было извлечено вдвое больше яйцеклеток, большее количество эмбрионов третьего дня, треть случаев отмены и тенденция к более высоким показателям клинической беременности по сравнению с женщины с уровнем АМГ <0,6 нг / мл.
Таким образом, в настоящее время в литературе предполагается, что комбинация двух гормонов вместе дает больше информации, хотя для подтверждения этой концепции необходимы дополнительные исследования с клиническими результатами.
Таким образом, пациенту с нормальным уровнем ФСГ, но низким уровнем АМГ, вероятно, будет лучше, чем у пациента с высоким уровнем ФСГ. Возраст, количество антральных фолликулов, индекс массы тела и предыдущая реакция яичников на препараты для лечения бесплодия — это другие факторы, которые необходимо принимать во внимание для полной оценки овариального резерва.
Чтобы обратиться к специалисту по лечению бесплодия, который является сертифицированным врачом с отличными показателями успешности, запишитесь на прием в одну из четырех клиник репродуктивного здоровья InVia в Чикаго.
Как уровни ФСГ и АМГ влияют на беременность?
Блог
Как уровни ФСГ и АМГ влияют на беременность?
При бесплодии женщинам говорят, что необходимо провести анализ на ФСГ и АМГ, чтобы выявить состояние их запаса яйцеклеток.
Достаточно просто, но что такое ФСГ и АМГ и как они влияют на фертильность?
Доктор Марси Магуайр, ведущий врач офиса RMANJ в West Orange, недавно объяснила их значение в эпизоде This is Infertility , нового подкаста, посвященного тому, каково быть бесплодным в США.S.
Вот что поделился доктор Магуайр.
Что такое преждевременное старение яичников, преждевременная недостаточность яичников или снижение резерва яичников?
Д-р Магуайр: Все вышесказанное означает, по сути, одно и то же: в яичниках меньше яиц, чем следовало бы, учитывая возраст женщины. Уменьшение резерва яичников не является синонимом старения всего тела — это не означает, что сама женщина каким-то образом преждевременно стареет, это просто означает, что у нее общее количество яйцеклеток ниже, чем следует с учетом ее возраста.
Каковы симптомы преждевременного старения яичников?
Д-р Магуайр: Двумя наиболее частыми симптомами являются бесплодие и нерегулярные или пропущенные менструальные циклы.
Как диагностировать преждевременное старение яичников?
Д-р Магуайр: Лучший диагноз будет поставлен на основе уровней ФСГ и АМГ, а затем ультразвукового исследования — все три могут быть маркерами более низкого количества яйцеклеток.
Что такое ФСГ?
Др.Магуайр: ФСГ или фолликулостимулирующий гормон — это гормон, вырабатываемый гипофизом, органом мозга, который стимулирует рост и созревание фолликулов и яйцеклеток каждый месяц. Если уровень ФСГ начинает повышаться, обычно выше десяти, это означает, что мозг изо всех сил пытается стимулировать яичники для производства яиц, но ему трудно заставить яичники слушать. Таким образом, ФСГ поднимается и повышается, становясь все громче, громче и громче, пытаясь заставить яичники прислушиваться — но яиц просто не так много, поэтому яичникам труднее производить.
Что такое AMH?
Доктор Магуайр: AMH, или антимюллеров гормон, это гормон, который вырабатывается клетками гранулезы, которые заботятся о яйцеклетках, поэтому чем больше у женщины яйцеклеток, тем больше у нее гранулезных клеток и выше ее AMH. Нам нравится использовать АМГ в качестве маркера общего количества яйцеклеток у женщины. Если AMH выше 1,2, мы чувствуем себя относительно уверенно, а если ниже 1,2, это вызывает большее беспокойство. Конечно, это также будет коррелировать с возрастом женщины, поэтому женщина в возрасте от 30 лет с низким АМГ менее 1.2 очень беспокоит, в то время как женщины в возрасте от 40 лет чаще имеют низкий АМГ.
Как вы тестируете на ФСГ и АМГ?
Д-р Магуайр: Анализ крови определит у женщины уровни ФСГ и АМГ.
Какие существуют варианты фертильности для женщин с высоким уровнем ФСГ и низким уровнем АМГ?
Д-р Магуайр: Если у женщины снижен яичниковый резерв, то есть общее более низкое количество яйцеклеток, у нее все еще может быть возможность иметь детей, используя ее собственные яйца — это просто зависит от ее относительного уровня яйцеклеток.Если есть некоторые из них, к которым мы можем получить доступ, обычно мы проводим экстракорпоральное оплодотворение (ЭКО), чтобы добраться до них, и, возможно, даже копить некоторые из них, чтобы женщина могла использовать их в будущем, когда ожидается, что количество ее яйцеклеток будет еще ниже. .
Что делать, если женщина вообще не может использовать собственные яйца?
Д-р Магуайр: Когда запас яйцеклеток у женщины настолько низок, что она находится на ранних стадиях менопаузы, лечение бесплодия обычно не может помочь женщине использовать ее собственные яйцеклетки, но донорские яйцеклетки доступны, и женщина может вынашивать беременность сама.Это можно сделать с помощью известного или анонимного донора яйцеклеток.
Для женщин, рассматривающих возможность использования донора яйцеклеток, важно смириться с этим решением — уделить время его рассмотрению, поговорить с консультантами, чтобы рассмотреть все последствия, а затем действовать дальше. Что касается всех моих пациентов, когда они преодолевают этот горб и говорят: «Да, это вариант для меня», они очень довольны своим решением.
Может ли ФСГ или АМГ подтвердить и спрогнозировать вашу фертильность?
Тестирование овариального резерва становится все более популярным среди женщин, пытающихся определить, сколько еще лет у них фертильности.Однако недавнее исследование, опубликованное в Журнале Американской медицинской ассоциации, ослабило ажиотаж среди энтузиастов овариального резерва и вызвало более чем небольшое беспокойство среди женщин в целом.
«Это исследование вызвало у женщин много беспокойства и замешательства», — говорит Марк П. Тролис, доктор медицины, сертифицированный специалист по репродуктивной эндокринологии, специалист по бесплодию и основатель Fertility CARE: The IVF Center. «В нем было рассмотрено определение возраста яичников и роль фолликулостимулирующего гормона (ФСГ) или антимюллерова гормона (АМГ) в определении их фертильности.”
Ниже д-р Тролис дает общие сведения о двух тестах на гормоны и разбивает исследование, его результаты и то, действительно ли ФСГ или АМГ могут подтвердить или предсказать вашу фертильность.
Что такое ФСГ?
Фолликулостимулирующий гормон секретируется гипофизом в кровоток. ФСГ играет важную роль в половом развитии и функционировании женских яичников и мужских семенников. У женщин гормон стимулирует рост фолликулов в яичниках до выхода яйцеклетки во время овуляции.У мужчин ФСГ помогает стимулировать выработку спермы в яичках (процесс, известный как сперматогенез).
«ФСГ был золотым стандартом на протяжении многих лет тестирования возраста яичников», — говорит д-р Тролис. «ФСГ — это гормон гипофиза, используемый для стимуляции фолликула, который в этом месяце будет производить яйцеклетку и овуляцию. Чем выше уровень ФСГ в начале менструального цикла (обычно измеряется на 2, 3 или 4 день), тем меньше количество яиц. Он косвенно получает питание от яичника и дает представление о количестве яиц.”
Но доктор Тролис отмечает, что многие специалисты по бесплодию пришли к выводу, что анализ ФСГ не является надежным способом прогнозирования фертильности женщины. «ФСГ — не очень надежный тест», — говорит д-р Тролис. «(Уровень ФСГ) может колебаться от месяца к месяцу, и тест очень ограничен, потому что его нужно делать в определенный день менструального цикла. Кроме того, тест имеет ряд ложноотрицательных результатов: даже если уровень ФСГ в норме, у вас все равно может быть старение яичников, которое не было обнаружено в этом месяце.”
Что такое AMH?
Антимюллеров гормон — это белок, вырабатываемый клетками растущих фолликулов женщины, окружающих каждую яйцеклетку. Уровень АМГ снижается по мере того, как женщина становится старше, и количество видимых и микроскопических фолликулов неуклонно уменьшается. К менопаузе уровни АМГ и количество фолликулов практически отсутствуют.
«АМГ — это тест, который мы используем исключительно в Fertility CARE, и большинство репродуктивных центров перестали использовать ФСГ и теперь тестируют только АМГ», — говорит д-р.Тролис. «АМГ — это гормон, вырабатываемый клетками, окружающими яйцеклетку. Следовательно, чем меньше количество яиц, тем ниже АМГ и тем выше старение яичников ».
ТестAMH до недавнего времени в основном использовался у пациенток с бесплодием до начала лечения экстракорпоральным оплодотворением (ЭКО). Уровни АМГ могут помочь предсказать, как яичники будут реагировать на лекарства для стимуляции ЭКО, и указать шансы на успех ЭКО.
Многие врачи, занимающиеся лечением бесплодия, пошли еще дальше, заявив, что уровень АМГ в крови здоровой женщины может предсказать, будут ли у нее проблемы с бесплодием в будущем.
«Антимюллеров гормон вырабатывается крошечными жидкими капсулоподобными фолликулами в яичниках, которые содержат и питают человеческие яйца», — говорит д-р Тролис. «Считается, что подсчитав количество АМГ, производимого фолликулами, специалисты по фертильности могут измерить оставшееся количество яйцеклеток, оставшихся у женщины».
Что точно отражают тесты на ФСГ и АМГ?
«Могут ли тесты на ФСГ и АМГ предсказать фертильность?» — спрашивает доктор Тролис.
«В исследовании Университета Северной Каролины, опубликованном в Журнале Американской медицинской ассоциации, изучались женщины в возрасте от 30 до 44 лет, у которых были более низкие уровни АМГ и ФСГ.Они сравнили эту группу с женщинами того же возраста с нормальным уровнем ФСГ и АМГ », — говорит д-р Тролис. «В ходе исследования выяснялось, можно ли предсказать их фертильность с точки зрения частоты наступления беременности. И не было никакой разницы в частоте наступления беременности между ними ».
«Но есть определенные предостережения», — говорит д-р Тролис. «Во-первых, они не включали никаких проблем с фертильностью ни у мужчин, ни у женщин. Во-вторых, они не включали пациентов, которые впоследствии принимали лекарства от бесплодия, поэтому мы не знаем, было ли это включено (мы называем эту информацию цензурой).И в-третьих, тесты на беременность были просто положительными тестами на беременность. Они не говорили о продолжающейся беременности или живорождении. Мы не знаем, приведет ли низкий АМГ или высокий ФСГ к более высокому уровню выкидышей ».
Итог
Доктор Тролице не решается придавать слишком большое значение тестам на ФСГ и АМГ, особенно для женщин, которые еще не пытались зачать ребенка или только недавно начали попытки зачать ребенка.
«Если вы не пытались в течение достаточного времени, чтобы зачать ребенка, я считаю, что сдавать анализы на уровни AMH или FSH преждевременно», — говорит он.«Чем вы моложе, независимо от этих результатов тестов, вы все равно должны иметь успех, потому что у вас все еще есть яйца хорошего качества».
Уровни AMH— Уровни AMH по возрасту
Медицинский осмотр Норберта Глейхера, MD, FACOG, FACS — Автор CHR — Обновлено 3 сентября 2020 г.
Как AMH влияет на фертильность?
Уровни гормона AMH снижаются по мере того, как женщина становится старше, и это снижение связано с возрастным снижением фертильности и количества яйцеклеток.¹ Из-за этой связи анализ крови на АМГ является очень полезным показателем овариального резерва и фертильности женщины — даже в большей степени, чем количество антральных фолликулов (AFC) на УЗИ. АМГ отражает женскую фертильность, потому что он выражается клетками гранулезы фолликулов яичников, маленькими фолликулами в яичниках женщины, которые находятся на пути к овуляции.
Как измеряется уровень антимюллерова гормона?
Уровень гормона AMH можно измерить в любой момент менструального цикла женщины с помощью анализа крови на AMH.Этот тест является рутинной и важной частью обследования на бесплодие, а также частью прогностического тестирования фертильности для молодых женщин, которое может помочь врачам определить женщин с риском преждевременного старения яичников.
Но АМГ — не единственный гормон, измеряемый при тестировании резерва яичников. Фолликулостимулирующий гормон — еще один важный гормон при тестировании на фертильность. Когда мы ищем потенциальную причину женского бесплодия и проблем с качеством яйцеклеток, мы смотрим на оба гормона вместе с другими.Два результата теста используются в сочетании, чтобы получить лучшее представление о фертильности женщины с точки зрения ее общего овариального резерва или функции яичников. Это потому, что каждый гормон отражает фолликулы в яичниках на разных стадиях развития.
Как правило, с возрастом женщины значения фолликулостимулирующего гормона и антимюллерова гормона меняются в противоположных направлениях: значения АМГ снижаются, а значения ФСГ повышаются. Эта закономерность является результатом естественного возрастного снижения овариального резерва.
Важно отметить несколько важных различий в измерениях этих гормонов:
- Уровни АМГ можно измерить в любое время во время менструального цикла. Это отличается от фолликулостимулирующего гормона, который необходимо измерять в определенный день женского цикла (обычно на 3-й день).
- AMH, по-видимому, лучше предсказывает шансы на беременность , чем FSH, согласно недавнему исследованию. Однако сообщалось, что антимюллеров гормон теряет часть своих прогностических свойств у женщин старше 42 лет.Тем не менее, все же полезно принимать во внимание AMH, даже если женщина вышла из этого возраста. Это связано с тем, что два гормона вместе по-прежнему являются более надежным предиктором шансов на беременность, чем один фолликулостимулирующий гормон. Уровни могут сильно различаться в зависимости от тестируемой женщины и ее возраста.
- Уровни АМГ отражают, сколько очень незрелых яиц находится «на палубе», чтобы начать путь к созреванию , в то время как уровни ФСГ отражают яйца, которые в настоящее время проходят процесс созревания и будут доступны для овуляции (или извлечения яйцеклеток, если через цикл ЭКО).
Что такое нормальное значение теста AMH в зависимости от возраста?
Важно помнить, что нормальный диапазон этого гормона меняется в зависимости от возраста женщины .² Например, нормальные результаты AMH для женщины в 42 года могут указывать на преждевременное старение яичников (POA), если такой же уровень был обнаружен в 32 -летняя женщина. Очень важно оценивать результаты тестов с учетом возраста. В этом примере 32-летняя женщина, вероятно, будет бороться за естественное зачатие, поскольку она явно страдает от POA с яичниковым резервом на 10 лет раньше своего физиологического возраста.У нее также были бы проблемы, если бы ей дали универсальный протокол экстракорпорального оплодотворения, который не учитывал ее снижающийся запас яичников.
Аналогичным образом, уровни AMH также используются для диагностики того, имеет ли более молодая женщина в возрасте 20 лет повышенный риск POA, чтобы она могла рассмотреть возможность замораживания яйцеклеток, если она еще не готова создать семью.
Относительно высокий уровень АМГ является нормальным в молодом возрасте, но иногда он может сигнализировать о синдроме поликистозных яичников (СПКЯ). В то время как низкий уровень АМГ обычно сопровождается высоким уровнем ФСГ, когда уровень АМГ у женщины нормальный или высокий, а также высокий уровень ФСГ, это может сигнализировать о гипоандрогенном СПКЯ, относительно новом типе СПКЯ, который исследователи CHR первыми определили. .Исследование CHR показало, что пациенты с гипоандрогенным СПКЯ, даже когда им от 40 до 40 лет, как правило, производят большое количество высококачественных яйцеклеток в циклах ЭКО после того, как их низкий уровень андрогенов корректируется с помощью добавок ДГЭА. Следовательно, у этих пациенток также удивительно хорошие показатели беременности при ЭКО.
На основании обширных клинических исследований, проведенных в CHR, мы составили графики возрастных уровней гормонов. Это позволяет нам своевременно диагностировать POA и адаптировать наши методы лечения для пациентов со снижением DOR, что может быть не сразу очевидным.Сосредоточившись на этих возрастных уровнях, мы можем гораздо лучше оценить овариальный резерв и потенциал фертильности женщины, разработать соответствующий план лечения и оценить шансы на беременность при экстракорпоральном оплодотворении.
Таблица уровней антимюллерова гормона
| Возраст | AMH |
|---|---|
| <33 лет | = 2,1 нг / мл |
| 33-37 лет | мл мл мл 902|
| 38-40 лет | = 1.1 нг / мл |
| = 41+ лет | = 0,5 нг / мл |
Беременность все еще возможна при низком уровне АМГ.
Вопросы о вашем уровне AMH для ЭКО?
В CHR мы специализируемся на передовых методах лечения бесплодия и трудно поддающихся лечению случаях, в том числе на лечении женщин с низким, даже неопределяемым, уровнем АМГ3. Свяжитесь с нами, чтобы узнать, являетесь ли вы кандидатом. Поскольку лечение бесплодия зависит от времени, мы остаемся открытыми для срочного лечения во время закрытия COVID-19.Мы также предлагаем виртуальные консультации для женщин и семей, которые предпочитают этот вариант.
Как повысить низкий уровень АМГ для улучшения шансов на беременность
Лечение низкого уровня АМГ с помощью ДГЭА
ДГЭА можно использовать для значительного увеличения шансов на беременность у женщин с низким уровнем АМГ и высоким уровнем ФСГ.
Как мне повысить уровень АМГ, чтобы забеременеть? Это вопрос, который задают многие женщины. Однако это неправильная постановка вопроса. Важно помнить, что низкий уровень АМГ — это всего лишь индикатор реального состояния: уменьшение резерва яичников, или DOR.Так что увеличение AMH не является целью. Устранение причин и смягчение негативных последствий уменьшения резерва яичников — это то, что необходимо для достижения успешного результата: здоровая беременность и получение ребенка домой.
Многие пациенты обращаются в CHR после того, как в других клиниках репродуктивного здоровья им сообщили, что их шанс на беременность составляет менее 1% из-за низкого уровня АМГ и высокого уровня ФСГ. Эти клиники часто подталкивают женщин к использованию донорских яйцеклеток, что, по нашему мнению, часто является ненужным или преждевременным.Правильное лечение, направленное на решение проблем с уровнем этих гормонов, значительно увеличивает вероятность успеха. Во многих случаях врачи CHR обнаружили, что эти прогнозы «вероятность беременности менее 1%» в корне неверны. Многие из женщин, которые слышали этот прогноз, на самом деле имеют гораздо более высокие шансы на беременность, используя собственные яйцеклетки при экстракорпоральном оплодотворении.
Это особенно верно, если женщина может произвести большее количество яйцеклеток или несколько эмбрионов в цикле ЭКО со стимуляцией яичников.CHR недавно провела анализ результатов ЭКО для наших пациентов с очень низким уровнем АМГ. В ходе исследования мы обнаружили, что даже в возрасте старше 41 года, если яичники женщины все еще производят более двух переносимых эмбрионов, частота наступления беременности находится в диапазоне 6-7%. Это видео о роли раннего извлечения яйцеклеток для женщин старше 43 лет объясняет, как одно из инновационных методов лечения репродуктивной медицины CHR удвоило показатели успешной беременности у пожилых женщин. Поскольку инновационное индивидуальное лечение может иметь решающее значение, особенно важно обращаться за лечением бесплодия в центр ЭКО, специализирующийся на лечении женщин с низким уровнем AMH / DOR.
Источники
1. Сабахат Расул. Фертильность с ранним сокращением овариального резерва: последняя капля, которая сломает спину верблюдам. Fertil Res Pract. Связь. Опубликовано 11 октября 2017 г. По состоянию на 26 августа 2020 г.2. Gleicher, N. Антимюллеров гормон (AMH) определяет, независимо от возраста, низкие или хорошие шансы на рождение живого ребенка у женщин с сильно уменьшенным овариальным резервом. Связь. Опубликовано 10 июня 2010 г. По состоянию на 26 августа 2020 г. Том 94, ВЫПУСК 7, P2824-2827.
3. Википедия. Центр репродукции человека.Связь. Опубликовано 20 августа 2020 г. По состоянию на 26 августа 2020 г.
Подробнее об антимюллеровом гормоне
Норберт Глейхер, доктор медицины, FACOG, FACS
Норберт Глейхер, доктор медицины, возглавляет клинические и исследовательские усилия CHR в качестве медицинского директора и главного научного сотрудника. Всемирно известный специалист в области репродуктивной эндокринологии, доктор Глейхер опубликовал сотни рецензируемых статей и читал лекции по всему миру, продолжая при этом активную клиническую карьеру, сосредоточенную на старении яичников, иммунологических проблемах и других сложных случаях бесплодия.
Не позволяйте результатам анализа резерва яичников определять вас! — Доктор Лора Шахин
Тестирование яичникового резерва в настоящее время является лучшим способом узнать о качестве своих яйцеклеток и потенциале фертильности, но он не идеален. Тестирование включает анализ крови на уровень гормонов, который специалисты по фертильности использовали в течение многих лет, чтобы консультировать женщин по поводу фертильности, но недавнее исследование, опубликованное в Журнале Американской медицинской ассоциации из Университета Северной Каролины, показывает, что эти тесты не предсказывают фертильность так же хорошо, как мы. думал ранее.
Что такое анализ яичникового резерва?Анализы крови на фолликулостимулирующий гормон (ФСГ), эстрадиол и антимуллерианский гормон (АМГ). ФСГ (гормон гонадотропина из гипофиза) и эстрадиол (эстроген, вырабатываемый яичниками) вводятся в начале менструального цикла (обычно в 3-й день цикла), и исследования показали, что высокий уровень ФСГ (обычно> 10 мМЕ / мл) может прогнозировать низкое качество, снижение эффективности лечения ЭКО и более высокий риск выкидыша из-за хромосомных аномалий.
Быстрый факт: эстрадиол всегда необходимо проверять с помощью ФСГ, потому что высокий уровень эстрадиола может ложно снизить уровень ФСГ, и распространенной ошибкой является ложное подтверждение низкого уровня ФСГ, если в тот же день эстрадиол не проверяется. .
Уровни ФСГ и эстрадиола десятилетиями использовались специалистами по фертильности для диагностики пониженного резерва яичников, но уровни колеблются от цикла к циклу, и у большинства специалистов по фертильности есть истории о женщинах с очень высоким уровнем ФСГ, которые забеременели, несмотря на все шансы.
Быстрый факт: Распространенное заблуждение состоит в том, что ФСГ> 20 мМЕ / мл означает, что кто-то находится в менопаузе, что не обязательно верно. Менопауза — это клинический диагноз отсутствия менструаций (периодов) в течение более 6 месяцев, когда запасы яйцеклеток закончились. Если у кого-то очень высокий уровень ФСГ, но у него все еще есть менструальный цикл — у него уменьшился овариальный резерв, но он не в менопаузе.
Антимуллерианский гормон (АМГ) — это гормон, содержащийся в поддерживающих клетках вокруг яиц. Чем выше уровень АМГ, тем больше поддерживающих клеток и, вероятно, больше яйцеклеток или яичникового резерва.АМГ только недавно был принят в качестве стандартного теста на фертильность, и специалисты по фертильности все еще пытаются выяснить, как интерпретировать результаты, но в целом АМГ уменьшается с возрастом, и исследования показали, что низкий АМГ (обычно <1,0 нг / мл) может предсказывать низкое качество, снижение эффективности лечения ЭКО и более высокий риск выкидыша из-за хромосомных аномалий.
Что показало исследование?В недавно опубликованном исследовании приняли участие 750 женщин, которые пытались зачать ребенка в течение 3 месяцев или меньше (то есть не бесплодных, что определяется как попытки пройти 12+ циклов без зачатия).Женщин обследовали на наличие АМГ, ФСГ и эстрадиола, а также на другой менее распространенный тест на овариальный резерв, называемый ингибином B, и наблюдали в течение 12 месяцев. Женщины с уменьшенным овариальным резервом (определенным в исследовании как АМГ <0,7 нг / мл или ФСГ> 10 мМЕ / мл) имели аналогичные шансы на зачатие по сравнению с женщинами с нормальным тестированием яичникового резерва в течение наблюдаемого года. Исследователи учли факторы, влияющие на фертильность, такие как возраст, курение и ожирение, что сделало результаты более значимыми.Ни одно исследование не является идеальным, и есть такие проблемы, как 77% изучаемого населения — европеоиды, поэтому они могут не представлять всех женщин, и каждая лаборатория использует разные анализы для гормональных тестов, и значения могут не отражать все результаты. Однако это интересные результаты, и их следует отметить.
Это новая информация?Нет, есть предыдущие исследования, которые показывают ограниченную интерпретацию тестов яичникового резерва. Это исследование больше, чем большинство других, и проводится интересным образом, и его трудно провести с большим количеством пациентов (наблюдение за женщинами в течение 12-месячного периода и наблюдение за результатами без вмешательства).
Почему это важно?Это важно, потому что в обществе и в социальных сетях женщины призывают «проверить свой уровень». Женщины должны быть проинформированы об их яичниковом резерве и искать проблемы на раннем этапе (до того, как они будут готовы начать попытки их семья). Существует много шума вокруг компаний, продающих домашние гормональные тесты для женщин и многое другое.
Знания и образование — это мощное средство, и женщины должны иметь возможность проверять свой уровень гормонов, но в контексте.Женщины должны знать, что определение овариального резерва несовершенно, и если они проверят эти уровни, им нужно интерпретировать результаты с осторожностью. Женщины с «нормальным» уровнем могут иметь проблемы с фертильностью, а женщины с «плохим» уровнем могут зачать ребенка естественным путем.
Не позволяйте овариальному резерву определять вас. Они могут предсказать проблему с фертильностью, и нельзя игнорировать плохие результаты, но они не идеальны, и женщинам следует интерпретировать их с осторожностью!
Узнайте больше о бесплодии и выкидышах из других сообщений в блоге на drlorashahine.com.
Подключайтесь в Instagram, Twitter и Facebook.
Опубликовано HuffPost
ФСГ по сравнению с АМГ по сравнению с АФК
Резерв яичников — это качество и количество яйцеклеток женщины. Бесплодие может быть вызвано множеством факторов, но, к счастью, существуют различные обследования, которые могут помочь вашему врачу диагностировать проблемы. Резервирование яичников может помочь вам решить, стоит ли рассматривать беременность раньше или позже, следует ли заморозить яйцеклетки или лечение бесплодия может быть успешным.
Есть три теста, которые врачи используют для прогнозирования резерва яичников: ФСГ, АМГ и АФК.
Скрининг FSH
ФСГ (фолликулостимулирующий гормон) — гормон, который стимулирует яичник к выделению яйцеклетки (овуляции). У женщин, которые сталкиваются со снижением резерва яичников, от яичников к мозгу поступает сигнал о выработке большего количества ФСГ. Следовательно, высокий уровень ФСГ, вероятно, указывает на низкий резерв яичников.
УровеньФСГ может колебаться во время менструального цикла, поэтому его обычно проверяют на 3-й день с началом менструации.Уровень ФСГ на 3-й день, равный 10 или меньше, обычно считается нормальным.
AMH Скрининг
АМГ (антимюллеров гормон) считается более надежным предиктором резерва яичников, поскольку его уровни в основном остаются неизменными на протяжении всего менструального цикла и могут быть проверены в любой день. АМГ продуцируется клетками гранулезы, поддерживающими клетками, прикрепленными к каждой яйцеклетке. Просто, чем выше АМГ, тем больше яиц в теории. Чем ниже AMH, тем меньше яиц.
Существуют средние возрастные уровни АМГ, поэтому мы знаем, чего ожидать, исходя из возраста женщин. Важно знать, что АМГ не предсказывает успех беременности. Он действительно предсказывает реакцию во время цикла замораживания яйцеклеток или цикла экстракорпорального оплодотворения (ЭКО). Как правило, женщины с более высоким уровнем АМГ нуждаются в меньшем количестве лекарств для стимуляции и часто производят большее количество яйцеклеток. Уровни АМГ продолжают снижаться с возрастом женщины и имеют тенденцию к «0» во время менопаузы.
Скрининг AFC
AFC (количество антральных фолликулов) — это измерение антральных фолликулов (также известных как покоящиеся фолликулы) в яичниках. Фолликулы — это структуры, содержащие яйца. AFC измеряется во время трансвагинального ультразвукового исследования. Общее количество наблюдаемых антральных фолликулов может предсказать вашу реакцию во время цикла замораживания яйцеклеток или ЭКО. Лучше всего проводить АЧХ в начале менструального цикла.
Все три из этих тестов являются важными предикторами резерва яичников и выполняются во время первичной консультации с врачом по бесплодию.Если пациент подумывает о замораживании яйцеклеток или испытывает трудности с зачатием, лучше обратиться за помощью раньше, чем позже.
Доктор Бет МакЭви сертифицирована в области репродуктивной эндокринологии и бесплодия, а также акушерства и гинекологии. Доктор МакЭви получила медицинскую степень в Медицинском центре Нижнего штата Нью-Йорка, закончила резидентуру по акушерству и гинекологии в пресвитерианской больнице Нью-Йорка, Медицинском центре Вейл Корнелл, а также закончила стипендиальную программу Медицинского центра Монтефиоре по репродуктивной эндокринологии и бесплодию.Доктор МакЭви — ассистент клинического профессора акушерства, гинекологии и репродукции в Медицинской школе Икана на горе Синай. Доктор МакЭви лечит пациентов от бесплодия, предоставляет вспомогательные репродуктивные технологии и малоинвазивные гинекологические операции, а также выполняет замораживание яйцеклеток как по медицинским, так и по плановым показаниям.
Это только для информационных целей и не является медицинской консультацией, диагнозом или лечением. Всегда обращайтесь за советом к своему врачу или другому квалифицированному поставщику медицинских услуг по любым вопросам, которые могут у вас возникнуть относительно состояния здоровья.
Резерв яичников — обзор
Экран резерва яичников
Уменьшенный резерв яичников (DOR) определяется как «женщины репродуктивного возраста с регулярными менструациями, реакция которых на стимуляцию яичников или плодовитость снижена по сравнению с женщинами сопоставимого возраста». 3 Пониженный ответ на стимуляцию яичников определяется как <2–3 фолликулов или ≤ 4 извлеченных яйцеклеток. 16
Яичниковый резерв следует оценивать у женщин с повышенным риском DOR.Сюда входят женщины, которые: 3
- •
Возраст более 35 лет
- •
Имеют в семейном анамнезе раннюю менопаузу
- •
Имеют в анамнезе повреждения яичников после химиотерапии, лучевой терапии тазовых органов или операции на яичниках или имеют только один яичник
- •
Имеют необъяснимое бесплодие
- •
Имеют в анамнезе плохую реакцию на стимуляцию яичников гонадотропинами
- 9038 Планируете пройти курс лечения вспомогательными репродуктивными технологиями (ВРТ)
Идеальных показателей овариального резерва не существует.Даже если после исследований установлен пониженный резерв яичников, это имеет только прогностическое значение при определении вероятной реакции на стимуляцию яичников и не обязательно означает невозможность зачать ребенка. 3 Женщины могут зачать ребенка даже с чрезвычайно низкими показателями резерва яичников, а возраст является более точным предиктором будущего живорождения. 21
Тесты яичникового резерва включают гормональные тесты крови, такие как FSH, E2, анти-мюллеровский гормон (AMH), ультразвуковое сканирование на подсчет антральных фолликулов (AFC) и провокационные тесты, такие как тест Clomiphene Citrate Challenge (CCCT) .
ФСГ, Е2 (и ЛГ)
Как объяснялось в главе 2, ФСГ высвобождается передней долей гипофиза, чтобы стимулировать рост и развитие фолликулов яичников. У некоторых женщин гипофиз должен выделять гораздо более высокие уровни ФСГ, чтобы яичники отреагировали. Обычно это происходит у женщин, у которых сокращается яичниковый резерв.
Тест на ФСГ был и до некоторой степени остается наиболее часто используемым тестом для измерения резерва яичников. Однако он не так надежен, как AMH 22 и AFC 21 (информация об этих тестах представлена далее в этом разделе).
ФСГ следует проверять на 2–5 дни менструального цикла, обычно с помощью тестов на лютеинизирующий гормон (ЛГ), а в идеале — на Е2. Референсные значения для ФСГ различаются, но в большинстве лабораторий пороговая точка для ФСГ составляет <10 мМЕ / мл. 15, 18 Значения> 12 мМЕ / мл на третий день менструального цикла (особенно уровни> 20 мМЕ / мл) предполагают очень плохой прогноз беременности. 15
Следует проявлять осторожность и проверять концентрации E2 одновременно с концентрациями ФСГ, потому что высокие уровни E2 могут иметь отрицательную обратную связь по значениям ФСГ (путем искусственного подавления ФСГ, что приводит к ложным нормальным значениям ФСГ). 15, 16 Однако уровни E2 сами по себе не должны использоваться для измерения резерва яичников. 3, 5, 16
Уровни E2 также могут помочь различать: 3
- •
Аменорея из-за недостаточности яичников (высокий ФСГ, низкий E2), которая требует донорства яйцеклеток, и
- •
Гипоталамическая аменорея (нормальный ФСГ, низкий E2), которая требует стимуляции экзогенным гонадотропином для индукции овуляции.
Эталонные диапазоны FSH, LH и E2 показаны в таблице 4.2.
С точки зрения традиционной китайской медицины, аномалии ФСГ, Е2 и ЛГ связаны с поражением оси сердца и почек. Синдромы, на которые следует обратить внимание:
- •
Пустые синдромы
- ■
Дефицит цзин (сущности) почек
- ■
Дефицит инь почек
20,Пустое тепло от Инь 24–26 или Дефицит крови 23
- ■
Дефицит ци селезенки и крови 25
- ■
- Печень
Смешанные синдромы
- ■
Застой ци сердца и / или печени 26 с дефицитом крови и высокой температурой
- ■
Застой крови 24, 2503
AMH — гормон, вырабатываемый клетками гранулезы первичных, преантральных и антральных фолликулов. 16 Чем выше количество этих ранних фолликулов, тем выше уровень АМГ. АМГ относительно постоянен и поэтому может быть проверен в любой день менструального цикла. 3, 27 AMH является лучшим предиктором ответа на стимуляцию яичников, чем FSH, но не так хорош, как AFC. 21
Низкие значения (<1,5–5,0 пмоль / л или <0,2–0,7 нг / мл DSL-иммуноферментный иммуноферментный анализ (ELISA)) показали высокую предсказуемость плохого ответа яичников (<3 фолликулов или ≤ 2–4 извлеченных яйца). 16 Однако женщины с низкими или неопределяемыми значениями АМГ все же могут хорошо отреагировать на стимуляцию яичников и забеременеть. 16
Операция на яичниках, например, эндометриома 28–30 или киста 29 операция может привести к повреждению здоровой ткани яичников и фолликулов и, следовательно, к снижению АМГ и резерва яичников. Одно исследование показало, что через 3 месяца после операции уровень АМГ немного восстановился. 29 Другое недавнее исследование, однако, показало, что яичниковый резерв ниже у пациенток с эндометриомами еще до того, как они перенесут операцию на яичниках. 31
Высокие значения АМГ (> 48 пмоль / л или> 6,7 нг / мл) связаны с СПКЯ. 32
Как обсуждалось в главе 2, пул фолликулов естественным образом уменьшается с возрастом женщины. Следовательно, с возрастом уровень АМГ естественным образом снижается. Оценка значений АМГ относительно возраста женщины может быть более полезным инструментом при принятии решения о том, сокращается ли фолликулярный пул яичников женщины с возрастом или преждевременно.
В таблице 4.3 показано, как интерпретировать значения AMH.
С точки зрения традиционной китайской медицины, низкие уровни АМГ связаны с:
- •
Дефицитом цзин в почках
- •
Инь почек 23 Дефицитом с пустым теплом или без него
- •
Застой ци печени с дефицитом крови 26
- •
Дефицит ци сердца и / или селезенки
AFC
AFC — это трансвагинальное ультразвуковое исследование, во время которого проводится трансвагинальное ультразвуковое сканирование . 16 Обычно выполняется во время ранней фолликулярной фазы, 16 , но может выполняться в любой момент цикла. 27 В разных клиниках антральный отдел определяется по-разному. Например, одни считают фолликулы диаметром 2–10 мм, другие — 3–8 мм. 16
AFC является наиболее прямым показателем овариального резерва и соответствует тому, сколько яйцеклеток может быть извлечено во время ЭКО.