причины, симптомы, лечение в Москве – Консультация и обследование при энцефалопатии – Неврология в Клинике № 1
Обследование и лечение
Дисциркуляторная энцефалопатия – неврологическое заболевание с медленным прогрессированием. Оно характеризуется недостатком кровоснабжения сосудов головного мозга. В результате его функции нарушаются в области пораженных очагов. Болезнь встречается как у пожилых, так и у молодых пациентов. Чем раньше будет начато лечение, тем выше шансы на полное восстановление.
Пройдите диагностику дискуляторной энцефалопатии в Клинике №1:
- МРТ
- Консультация офтальмолога
- ЭЭГ, РЭГ
- УЗД сосудов
- Дуплексное сканирование
При единовременной оплате услуг – скидка 20%
ПозвонитьПричины развития заболевания
Ткани мозга в очень высокой степени зависят от поступления в них кислорода. Без постоянного кровоснабжения клетки погибают не позднее чем через шесть минут после прекращения питания. Основными причинами дисциркуляторной энцефалопатии являются:
Без постоянного кровоснабжения клетки погибают не позднее чем через шесть минут после прекращения питания. Основными причинами дисциркуляторной энцефалопатии являются:
- Атеросклероз.
- Скачки давления при гипертонической болезни, поликистозе почек, гламерулонефрите, болезни Кушинга.
- Шейный остеохондроз.
- Травмы шеи.
- Пороки развития артерий.
- Вегетососудистая дистония.
- Диабет.
- Аритмия.
- Воспалительные процессы в сосудах.
- Вредные привычки.
- Заболевания эндокринной системы.
- Тромбы в церебральных артериях.
- Частые стрессы.
Симптомы и стадии развития
Симптомы заболевания различаются в зависимости от степени поражения:
- При первой степени ДЭП появляется тревога, ранимость, раздражительность, частая смена настроения. Больной быстро утомляется, периодически жалуется на головную боль.
 Память ухудшается, наблюдается усталость после физических нагрузок. Может проявляться неустойчивость, неуверенная походка, тошнота.
Память ухудшается, наблюдается усталость после физических нагрузок. Может проявляться неустойчивость, неуверенная походка, тошнота. - Вторая стадия характеризуется более серьезными признаками, появляются явные когнитивные нарушения, двигательные расстройства. Головная боль становится частой, больной ощущает шум в голове, вялость, плохо спит. Могут быть трудности с глотанием, нарушается координация, речь, слух, появляется тремор головы и рук, судороги. Могут возникать вспышки света перед глазами.
- Третья степень сопровождается серьезным нарушением координации и по сути является сосудистой деменцией. Зрение, слух и речь нарушаются, поведение больного неадекватное. Наблюдается шаркающая походка, постоянный тремор головы и рук, недержание кала и мочи, судороги.
Виды заболевания
Виды дисциркуляторной энцефалопатии разделяются в зависимости от причин ее возникновения:
- Гипертоническая.
- Венозная.

- Смешанная.
К какому врачу обратиться?
Дисциркуляторная энцефалопатия относится к неврологическим нарушениям. При появлении тревожных симптомов необходимо как можно скорее обратиться к врачу неврологу. Специалист проведет обследование, поставит точный диагноз и назначит адекватное лечение. Чем раньше будет оказана помощь – тем более оптимистичный прогноз для пациента
Пройдите диагностику дискуляторной энцефалопатии в Клинике №1:
- МРТ
- Консультация офтальмолога
- ЭЭГ, РЭГ
- УЗД сосудов
- Дуплексное сканирование
При единовременной оплате услуг – скидка 20%
ПозвонитьДиагностика
Своевременная точная постановка диагноза крайне важна для проведения сосудистой терапии и восстановления нормального кровоснабжения мозга. Выявить заболевания на ранней стадии поможет посещение плановых осмотров у невролога.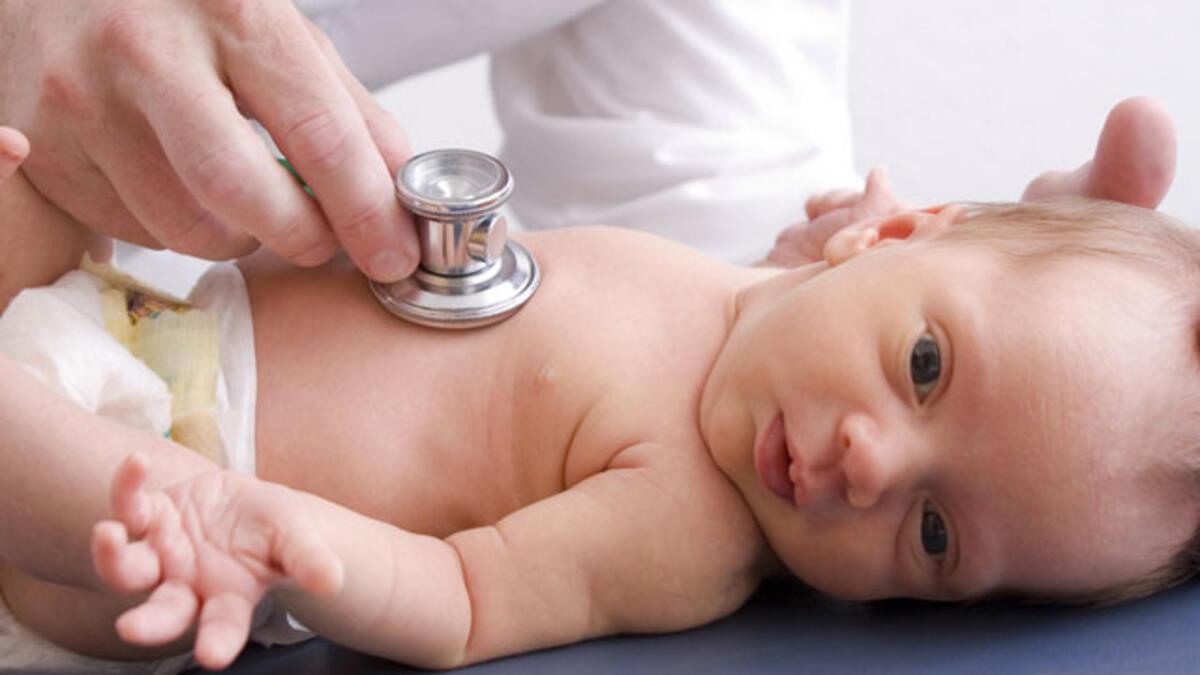 Особенно пациентам старшего возраста это необходимо делать регулярно. Также профилактические осмотры показаны пациентам из группы риска: гипертоникам, диабетикам, больным, страдающим атеросклерозом. Выявить когнитивные нарушения, которые поначалу незаметны для окружающих и самого пациента, позволяют специальные тесты. Невролог может попросить пациента нарисовать циферблат, повторить слова, произнесенные ранее.
Особенно пациентам старшего возраста это необходимо делать регулярно. Также профилактические осмотры показаны пациентам из группы риска: гипертоникам, диабетикам, больным, страдающим атеросклерозом. Выявить когнитивные нарушения, которые поначалу незаметны для окружающих и самого пациента, позволяют специальные тесты. Невролог может попросить пациента нарисовать циферблат, повторить слова, произнесенные ранее.
Также для постановки диагноза используются:
- МРТ (позволяет выявить очаги немых инфарктов – наиболее достоверный признак ДЭП).
- Консультация офтальмолога.
- ЭЭГ, РЭГ.
- Ультразвуковая диагностика сосудов.
- Дуплексное сканирование.
Лечение
При лечении патологии применяется комплексная этиопатогенетическая терапия. Она направлена на компенсацию заболевания, нормализацию циркуляции крови, защиту нервных клеток от кислородного голодания и ишемии. Применяются препараты для снижения уровня сахара в крови, нормализации давления, холестерина.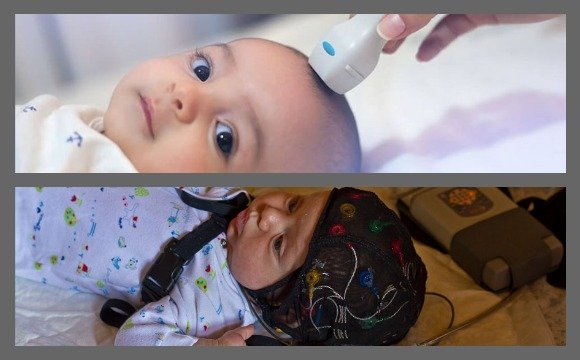
Операция может быть назначена в том случае, когда патология вызвана сужением просвета артерии, прогрессирует быстро и сопровождается серьезными осложнениями.
В качестве меры профилактики используется нормализация липидного обмена. Нарушение этого процесса влечет отложения на внутренней поверхности сосудов, которые сужают просвет и мешают нормальной циркуляции крови. Также важна борьба с атеросклерозом, поддержание нормального уровня сахара у пациентов с сахарным диабетом.
Записаться на консультацию к неврологу
Пройти грамотную консультацию невролога предлагает «Клиника №1» в Москве. Многопрофильный медицинский центр расположен в непосредственной близости от станции метро Люблино. Клиника располагает всеми современными техническими возможности для успешной диагностики и лечения множества заболеваний. Записаться на прием можно по телефону или через наш сайт.
г. Москва, ул. Краснодарская, дом. 52, корп. 2
+7 (495) 152-33-19
Цены на консультацию и прием врача невролога
| Название услуги | Стоимость |
| Бесплатная консультация врача после МРТ/КТ | 0,00 |
| Первичный прием невролога (консультация) | 1270,00 |
| Повторная консультация невролога | 810,00 |
| Вызов врача на дом |
Перинатальная гипоксическая энцефалопатия | Бондаренко Е.
 С., Зыков В.П.
С., Зыков В.П.Перинатальная гипоксическая энцефалопатия является частым осложнением патологии беременности и родов и диагносцируется у новорожденных до 5% случаев [1]. Перинатальные повреждения мозга составляют более 60% всей патологии нервной системы детского возраста, непосредственно участвуют в развитии таких заболеваний, как детский церебральный паралич, эпилепсия, минимальная мозговая дисфункция.
Факторы риска. Этиология и патогенез гипоксической энцефалопатии
Для распознавания клинических признаков перинатальной гипоксии необходимо учитывать факторы риска, предрасполагающие к ее развитию [8]:
• Пограничный возраст матери (моложе 20 и старше 35 лет)
• Предлежание плаценты
• Преэклампсия
• Преждевременные или поздние роды
• Окрашивание околоплодных вод меконием
• Брадикардия, тахикардия плода, приглушение тонов сердца плода
• Многоплодие
• Длительный безводный промежуток
• Диабет матери
• Любые заболевания матери во время беременности
• Прием матерью потенциально опасных для плода препаратов
Среди причин нарушений вентиляции легких и оксигенации крови выделяют периферическую и центральную гипоксию.
Этиология гипоксии
| Периферическая | Центральная |
| 1. Респираторный | 1. Пониженное давление |
| дистресс-синдром | у матери |
| 2. Аспирация околоплодных | 2. Анемия матери |
| вод | |
| 3. Пневмоторакс | 3. Артериальная гипертензия |
| (с родовой травмой) | |
4. Бронхолегочная Бронхолегочная |
4. Плацентарная |
| дисплазия | недостаточность |
| 5. Врожденные аномалии (синдром Пьера — Робена) |
5. Пороки развития мозга |
Гипоксия приводит к нарушению окислительных процессов, развитию ацидоза, снижению энергетического баланса клетки, избытку нейромедиаторов, нарушению метаболизма глии и нейронов. Ацидоз увеличивает проницаемость сосудистой стенки с развитием межклеточного отека и нарушением церебральной гемодинамики. В условиях гипоксии нарушается перекисное окисление липидов с накоплением агрессивных свободных радикалов, гидроперекисей, которые оказывают деструктивное действие на мембраны нейронов. Нарушения церебральной гемодинамики ишемическо-геморрагического характера являются следствием тяжелой гипоксии мозга.
В антенатальном периоде основным этиологическим фактором гипоксии является плацентарная недостаточность [2,9]. Трофическая недостаточность протекает с нарушением всасываемости и усвоением питательных веществ через плаценту, дефицитом транспорта кислорода и углекислоты, что проявляется синдромом задержки развития плода, внутриутробной гипотрофией, незрелостью легких и сурфактанта. Установлено, что снижение маточно-плацентарного кровотока служит объективным показателем гипоксического поражения мозга [4]. Дефицит сурфактанта и дыхательная аноксия служат основными патогенетическими факторами церебральной гипоксии недоношенных и новорожденных от больных диабетом матерей. В патогенезе дефицита сурфактанта новорожденных лежит вторичный гиперинсулинизм плода, который развивается в ответ на гликемию матери. Инсулин тормозит синтез лецитина — основного элемента сурфактанта, недостаток которого препятствует разлипанию альвеол, что и приводит к нарушению вентиляции легких.
Таким образом, компенсация диабета беременных является профилактикой дыхательного дисстресс-синдрома новорожденных и гипоксической энцефалопатии [15]. В неонатальном периоде причиной церебральной гипоксии и ишемии может быть выраженный интрапульмональный шунт. В патогенезе гипоксии мозга значительную роль играют гипоксическая кардиопатия новорожденных и надпочечниковая недостаточность. Гипогликемия и дефицит запаса гликогена рассматриваются как факторы, обусловливающие повышенную ранимость мозговой ткани к гипоксии новорожденных, особенно недоношенных с низкой массой тела.
В неонатальном периоде причиной церебральной гипоксии и ишемии может быть выраженный интрапульмональный шунт. В патогенезе гипоксии мозга значительную роль играют гипоксическая кардиопатия новорожденных и надпочечниковая недостаточность. Гипогликемия и дефицит запаса гликогена рассматриваются как факторы, обусловливающие повышенную ранимость мозговой ткани к гипоксии новорожденных, особенно недоношенных с низкой массой тела.
Морфология гипоксической энцефалопатии
Головной мозг в норме поглощает пятую часть кислорода, поступающего в организм. У детей раннего возраста доля мозга в использовании кислорода составляет почти половину, что обеспечивает высокий уровень метаболизма окислительных процессов. В зависимости от длительности гипоксии в мозге развиваются изменения от локального отека до некрозов с геморрагическим пропитыванием. В ряде исследований было показано, что имеется различная чувствительность мозговых структур к гипоксии, которая зависит от особенностей метаболизма и кровоснабжения. Наиболее чувствительными к гипоксии являются зона Зоммера аммонова рога и перивентрикулярная область смежного кровоснабжения между передней, средней и задней мозговыми артериями. При сочетании гипоксии и ишемии возникают очаги некрозов в коре, зрительном бугре, полосатом теле, мозжечке. Выделяют следующие стадии морфологических гипоксических изменений в головном мозге: I стадия — отечно-геморрагическая, II стадия — энцефальный глиоз, III стадия — лейкомаляция (некроз), IV стадия — лейкомаляция с кровоизлиянием. Первые две стадии острой гипоксии являются курабельными, имеется возможность восстановления метаболизма нейронов и глии, III и IV стадии ведут к необратимой гибели нейронов. При антенатальной гипоксии наблюдаются дистрофия нейронов, пролиферация глии, явления склерозирования, кистозные полости на местах мелких очагов некрозов.
Наиболее чувствительными к гипоксии являются зона Зоммера аммонова рога и перивентрикулярная область смежного кровоснабжения между передней, средней и задней мозговыми артериями. При сочетании гипоксии и ишемии возникают очаги некрозов в коре, зрительном бугре, полосатом теле, мозжечке. Выделяют следующие стадии морфологических гипоксических изменений в головном мозге: I стадия — отечно-геморрагическая, II стадия — энцефальный глиоз, III стадия — лейкомаляция (некроз), IV стадия — лейкомаляция с кровоизлиянием. Первые две стадии острой гипоксии являются курабельными, имеется возможность восстановления метаболизма нейронов и глии, III и IV стадии ведут к необратимой гибели нейронов. При антенатальной гипоксии наблюдаются дистрофия нейронов, пролиферация глии, явления склерозирования, кистозные полости на местах мелких очагов некрозов.
Клиника гипоксической энцефалопатии
В клинической картине гипоксической энцефалопатии выделяют три периода — острый (1-й месяц жизни ребенка), восстановительный (с 1-го месяца до 1 года, а у недоношенных незрелых детей до 2 лет) и исход [12].
В остром периоде по степени тяжести выделяются легкая форма поражений нервной системы, отражающая преходящие нарушения гемоликвородинамики; форма средней тяжести с отечно-геморрагическими изменениями, глиозом, единичными лейкомаляциями; тяжелая форма, характерная для генерализованного отека мозга, множественных лейкомаляций и кровоизлияний. Для определения степени тяжести и выраженности нарушений мозгового кровообращения применяется шкала Апгар.
В остром периоде выделяют 5 клинических синдромов: повышение нервно-рефлекторной возбудимости, судорожный, гипертензионно-гидроцефальный, синдром угнетения, коматозный. Обычно наблюдается сочетание нескольких синдромов. Особенностью острого периода является доминирование общемозговых нарушений без выраженных локальных симптомов. При легкой форме поражения мозга (оценка по шкале Апгар 6 — 7 баллов) характерным является синдром повышенной нервно-рефлекторной возбудимости. Основными проявлениями синдрома являются усиление спонтанной двигательной активности, беспокойный поверхностный сон, удлинение периода активного бодрствования, трудность засыпания, частый немотивированный плач, оживление безусловных врожденных рефлексов, мышечная дистония, повышение коленных рефлексов, тремор конечностей и подбородка. У недоношенных синдром нервно-рефлекторной возбудимости в 94% случаев является клиническим признаком понижения порога судорожной готовности, что подтверждается данными электроэнцефалографии (ЭЭГ) [12]. Больные, у которых, по данным ЭЭГ, имеется снижение порога судорожной готовности, должны рассматриваться в группе риска по судорожному синдрому.
У недоношенных синдром нервно-рефлекторной возбудимости в 94% случаев является клиническим признаком понижения порога судорожной готовности, что подтверждается данными электроэнцефалографии (ЭЭГ) [12]. Больные, у которых, по данным ЭЭГ, имеется снижение порога судорожной готовности, должны рассматриваться в группе риска по судорожному синдрому.
Среднетяжелая форма гипоксической энцефалопатии (оценивается по шкале Апгар 4 — 6 баллов) проявляется гипертензионно-гидроцефальным синдромом и синдромом угнетения.
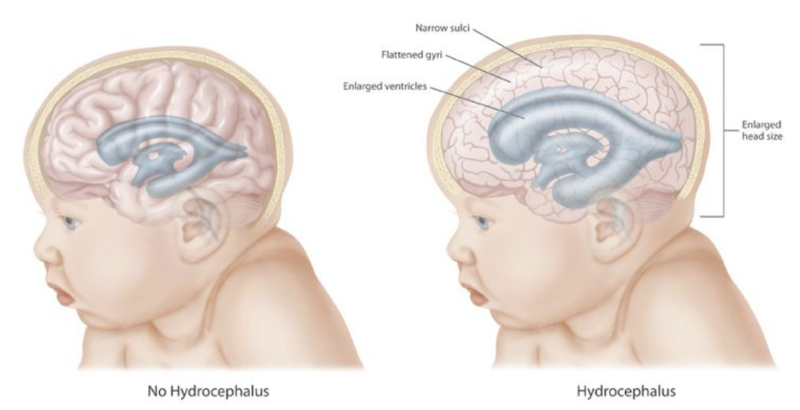
Для гипертензионно-гидроцефального синдрома характерным является увеличение размеров головы на 1 — 2 см по сравнению с нормой (или окружностью грудной клетки), раскрытие сагитального шва более 0,5 см, увеличение и выбухание большого родничка. Типичной является брахиоцефалическая форма головы с увеличенными лобными буграми или долихоцефалическая — с нависающим кзади затылком. Отмечается симптом Грефе, симптом «заходящего солнца», непостоянный горизонтальный нистагм, сходящее косоглазие. Выявляется мышечная дистония, больше в дистальных отделах конечностей в виде симптома «тюленьих лапок» и «пяточных стопок». У большинства детей, особенно в первые дни жизни, эти явления сочетаются с пароксизмами вздрагиваний, спонтанным рефлексом Моро, нарушением сна, симптомом Арлекино, общим и локальным цианозом. Развитие гипертензионно-гидроцефального синдрома на 3 — 5-й день жизни может являться признаком перивентрикулярного кровоизлияния. Гипертензионно-гидроцефальный синдром может быть изолированным, но чаще сочетается с синдромом угнетения или коматозным синдромом. Синдром угнетения проявляется вялостью, гиподинамией, снижением спонтанной активности, общей мышечной гипотонией, гипорефлексией, угнетением рефлексов новорожденных, снижением рефлексов сосания и глотания. Наблюдаются локальные симптомы в виде расходящегося и сходящегося косоглазия, нистагм, асимметрия и отвисание нижней челюсти, асимметрия мимической мускулатуры, бульбарные и псевдобульбарные симптомы. Синдром характеризует течение острого периода гипоксической энцефалопатии и в конце первого месяца жизни обычно исчезает.
Выявляется мышечная дистония, больше в дистальных отделах конечностей в виде симптома «тюленьих лапок» и «пяточных стопок». У большинства детей, особенно в первые дни жизни, эти явления сочетаются с пароксизмами вздрагиваний, спонтанным рефлексом Моро, нарушением сна, симптомом Арлекино, общим и локальным цианозом. Развитие гипертензионно-гидроцефального синдрома на 3 — 5-й день жизни может являться признаком перивентрикулярного кровоизлияния. Гипертензионно-гидроцефальный синдром может быть изолированным, но чаще сочетается с синдромом угнетения или коматозным синдромом. Синдром угнетения проявляется вялостью, гиподинамией, снижением спонтанной активности, общей мышечной гипотонией, гипорефлексией, угнетением рефлексов новорожденных, снижением рефлексов сосания и глотания. Наблюдаются локальные симптомы в виде расходящегося и сходящегося косоглазия, нистагм, асимметрия и отвисание нижней челюсти, асимметрия мимической мускулатуры, бульбарные и псевдобульбарные симптомы. Синдром характеризует течение острого периода гипоксической энцефалопатии и в конце первого месяца жизни обычно исчезает. В остром периоде синдром угнетения может являться предвестником отека мозга и развития коматозного синдрома.
В остром периоде синдром угнетения может являться предвестником отека мозга и развития коматозного синдрома.
Коматозный синдром является проявлением тяжелого состояния новорожденного, по шкале Апгар оценивается 1 — 4 балла. В клинической картине выявляются выраженная вялость, адинамия, мышечная гипотония до атонии, врожденные рефлексы не выявляются, зрачки сужены, реакция на свет незначительная или отсутствует. Нет реакции на болевые раздражители, «плавающие» движения глазных яблок, горизонтальный и вертикальный нистагм, сухожильные рефлексы угнетены. Дыхание аритмичное, с частыми апное, брадикардия, тоны сердца глухие, пульс аритмичный, артериальное давление низкое. Могут отмечаться приступы судорог с преобладанием тонического компонента. Тяжелое состояние сохраняется 10 — 15 дней, отсутствуют рефлексы сосания и глотания. Появление в остром периоде гидроцефалии с выбуханием и напряжением большого родничка, расхождением черепных швов, протрузией глазных яблок, быстрым ростом головы свидетельствует о внутричерепном кровоизлиянии.
Судорожный синдром в остром периоде, как правило, сочетается с синдромом угнетения или коматозным. Возникает в результате гипоксического отека мозга, гипогликемии, гипомагнемии или внутричерепных кровоизлияний. Проявляется в первые дни жизни тонико-клоническими или тоническими судорогами. Наряду с этим наблюдаются локальные клонические судороги или гемиконвульсии. Судорожные припадки у новорожденных отличаются кратковременностью, внезапным началом, отсутствием закономерности повторения и зависимости от состояния сна или бодрствования, режима кормления и других факторов. Судороги наблюдаются в виде мелкоамплитудного тремора, кратковременной остановки дыхания, тонического спазма глазных яблок по типу пареза взора вверх, имитации симптома «заходящего солнца», нистагма, автоматических жевательных движений, пароксизмов клонуса стоп, вазомоторных реакций. Эти судороги по своему характеру иногда напоминают спонтанные движения ребенка, что затрудняет диагностику.
Восстановительный период гипоксической энцефалоратии включает следующие синдромы: повышение нервно-рефлекторной возбудимости, гипертензионно-гидроцефальный, вегетовисцеральных дисфункций, двигательных нарушений, задержки психомоторного развития, эпилептический.
Синдром повышенной нервно-рефлекторной возбудимости в восстановительном периоде имеет два варианта течения. При благоприятном варианте течения отмечается исчезновение или уменьшение выраженности симптомов повышенной нервно-рефлекторной возбудимости в сроки от 4 — 6 месяцев до 1 года. При неблагоприятном варианте, особенно у недоношенных, может развиться эпилептический синдром.
Гипертензионно-гидроцефальный синдром имеет два варианта течения:
1) гипертензионно-гидроцефальный синдром с благоприятным течением, при котором наблюдается исчезновение гипертензионных симптомов при задержке гидроцефальных;
2) неблагоприятный вариант гипертензионно-гидроцефального синдрома, входящий в симптомокомплекс органического церебрального синдрома.
Исходы гипертензионно-гидроцефального синдрома:
1. Нормализация роста окружности головы к 6 месяцам.
2. Компенсированный гидроцефальный синдром в 8 — 12 месяцев.
3. Развитие гидроцефалии.
Развитие гидроцефалии.
Синдром вегето-висцеральных дисфункций начинает проявляться после 1 — 1,5 месяца жизни на фоне повышения нервно-рефлекторной возбудимости и гипертензионно-гидроцефального синдрома. В клинической картине отмечаются упорные срыгивания, стойкая гипотрофия, нарушение ритма дыхания и апное, изменение окраски кожных покровов, акроцианоз, пароксизмы тахи- и брадипное, расстройства терморегуляции, дисфункция желудочно-кишечного тракта, височное облысение.
Эпилептический синдром может проявляться в любом возрасте (как продолжение судорог после рождения или на фоне соматической инфекции). У новорожденных и грудных детей он имеет так называемое возрастное лицо, т. е. судорожные пароксизмы имитируют те двигательные возможности, которыми ребенок к моменту их появления обладает.
У новорожденных и грудных детей (особенно у недоношенных) судорожный синдром характеризуется многообразием клинических форм припадков. Наблюдаются генерализованные судорожные припадки (тонико-клонические, клонические, тонические), абортивные, фокальные, гемиконвульсивные, полиморфные припадки, простые и сложные абсансы. По частоте преобладают полиморфные формы припадков. У недоношенных детей с перинатальной энцефалопатией пропульсивные и импульсивные пароксизмы в изолированном виде не встречаются, а наблюдаются только в составе полиморфных припадков. Наибольшую трудность в диагностике представляют абортивные и бессудорожные формы пароксизмов.
По частоте преобладают полиморфные формы припадков. У недоношенных детей с перинатальной энцефалопатией пропульсивные и импульсивные пароксизмы в изолированном виде не встречаются, а наблюдаются только в составе полиморфных припадков. Наибольшую трудность в диагностике представляют абортивные и бессудорожные формы пароксизмов.
Наблюдается имитация безусловных двигательных рефлексов в виде пароксизмально возникающих проявлений шейно-тонического симметричного рефлекса с наклоном головы и тоническим напряжением рук и ног; шейно-тонического асимметричного рефлекса с поворотом головы в сторону и разгибанием одноименной руки и ноги; первой фазы рефлекса Моро с раскрытием ручек. Бывают пароксизмы в виде спазма взора и нистагмом, имитацией «симптома заходящего солнца». Нередко наблюдаются приступы покраснения и побледнения кожных покровов с усиленным потоотделением, иногда срыгиваниями. После 3 — 4 месяцев жизни, по мере появления способности удерживать голову, появляются «кивки», «кливки», а с 6 — 7 месяцев — «поклоны» (сгибание туловища вперед-назад).
Такие особенности судорожного синдрома у недоношенных детей, как нестабильность клинических проявлений с преобладанием полиморфных судорог, наличие абортивных форм припадков, а также сложных абсансов с имитацией безусловных рефлексов новорожденных (первой фазы рефлекса Моро, асимметричного шейно-тонического рефлекса) являются, вероятно, следствием незрелости структур головного мозга. Однако увеличение частоты припадков, нарастание полиморфизма их проявлений, резистентность к противосудорожной терапии должны настораживать в отношении формирования грубых органических форм поражения мозга.
Полиморфизм приступов, их резистентность к терапии является прогностически неблагоприятным признаком.
Синдром двигательных нарушений выявляется с первых недель жизни, может протекать с мышечной гипотонией или гипертонией. При появлении синдрома двигательных нарушений с мышечной гипотонией отмечается снижение спонтанной двигательной активности, угнетение сухожильных рефлексов и врожденных безусловных рефлексов новорожденных. Синдром двигательных нарушений с мышечной гипотонией встречается изолированно, а также в сочетании с гипертензионно-гидроцефальным синдромом, синдром повышенной нервно-рефлекторной возбудимости с понижением порога судорожной готовности. Неблагоприятно сочетание синдрома двигательных нарушений и судорожного синдрома.
Синдром двигательных нарушений с мышечной гипотонией встречается изолированно, а также в сочетании с гипертензионно-гидроцефальным синдромом, синдром повышенной нервно-рефлекторной возбудимости с понижением порога судорожной готовности. Неблагоприятно сочетание синдрома двигательных нарушений и судорожного синдрома.
Нарастание мышечной гипертонии у доношенных детей, появление сторонности очаговых симптомов должны настораживать в плане развития детского церебрального паралича.
Синдром задержки психомоторного развития начинает проявляться с 1 — 2 месяцев. В структуре синдрома отмечается нарушение редукции безусловных врожденных рефлексов. Большую диагностическую роль приобретает шейно-тонические симметричный и асимметричный рефлексы, задержка формирования выпрямительных лабиринтных цепных тонических рефлексов. При наличии в структуре данного синдрома задержки психического развития у детей к месячному возрасту наблюдается недостаточно устойчивая фиксация взгляда, кратковременное прослеживание с быстрым истощением. Нет реакции на голос матери, слухового сосредоточения. К 2 — 3-месячному возрасту наблюдается недостаточное оживление при общении, крик маловыразителен, гуление отсутствует, дети отыскивают источник звука глазами без поворота головы, появляется редкая, трудно вызываемая улыбка. К полугоду — недостаточно активно интересуются игрушками и окружающими предметами, недостаточно реагируют на присутствие матери, гуление малоактивное и непродолжительное, манипуляции с предметами задержаны, нет активного внимания. Если задержка развития является «темповой», она при правильном выхаживании начинает исчезать. Данная группа детей в 4 — 5 месяцев как бы «скачком» становится активнее, причем психическое развитие опережает моторное. Появляются эмоциональная реакция на окружающих, интерес к игрушкам.
Нет реакции на голос матери, слухового сосредоточения. К 2 — 3-месячному возрасту наблюдается недостаточное оживление при общении, крик маловыразителен, гуление отсутствует, дети отыскивают источник звука глазами без поворота головы, появляется редкая, трудно вызываемая улыбка. К полугоду — недостаточно активно интересуются игрушками и окружающими предметами, недостаточно реагируют на присутствие матери, гуление малоактивное и непродолжительное, манипуляции с предметами задержаны, нет активного внимания. Если задержка развития является «темповой», она при правильном выхаживании начинает исчезать. Данная группа детей в 4 — 5 месяцев как бы «скачком» становится активнее, причем психическое развитие опережает моторное. Появляются эмоциональная реакция на окружающих, интерес к игрушкам.
Возрастные двигательные функции начинают активно компенсироваться после 6 — 7 месяцев и, как правило, восстанавливаются к 1 — 1,5 годам. Прогностически неблагоприятна длительная задержка психического развития.
Диагностика
Исследование глазного дна в остром периоде легкой гипоксической энцефалопатии отклонений не выявляет, реже наблюдают умеренное полнокровие вен. При среднетяжелой степени отмечают расширение вен, отек, отдельные геморрагии. При тяжелой степени повреждения на фоне выраженного отека расширения сосудов отмечается стушеванность границ диска зрительного нерва, кровоизлияния. В дальнейшем у таких детей может обнаружиться атрофия сосков зрительных нервов.
В спинномозговой жидкости изменения выявляются при наличии внутричерепного кровоизлияния. В этих случаях в ликворе имеются свежие и выщелочные эритроциты. После 7 — 10-го дня жизни подтверждением перенесенного кровоизлияния является наличие в ликворе макрофагов.
Нейросонография — двухмерное ультразвуковое исследование анатомических структур мозга через большой родничок — позволяет установить перивентрикулярное кровоизлияние, очаги лейкомаляции, расширение желудочковой системы — вентрикуломегалию [5, 10]. Нейросонография позволяет провести дифференциальную диагностику с пороками головного мозга. Признаки гипоплазии мозга: увеличение субарахноидальных пространств, расширение межполушарной щели, вентрикуломегалия, повышение плотности в области паренхимы мозга без четкой дифференциации извилин, порэнцефалия. Галопрозэнцефалия — увеличение одного желудочка, тени, повышение эхоплотности от стволовых структур мозга, снижение плотности от паренхимы мозга [7]. При клинико-нейросонографических сопоставлениях выявляется корреляция числа лейкомаляций и неврологических исходов. Множественные лейкомаляции в обоих полушариях, обнаруживаемые у больных по данным нейросонографии в остром периоде заболевания, сочетаются с синдромом двигательных нарушений и грубой задержкой психомоторного развития в восстановительном периоде. Компьютерная томография головного мозга помогает объективизировать гипоксические изменения мозговой ткани в структурах мозжечка и ствола мозга, которые недостаточно четко выявляются при нейросонографии.
Нейросонография позволяет провести дифференциальную диагностику с пороками головного мозга. Признаки гипоплазии мозга: увеличение субарахноидальных пространств, расширение межполушарной щели, вентрикуломегалия, повышение плотности в области паренхимы мозга без четкой дифференциации извилин, порэнцефалия. Галопрозэнцефалия — увеличение одного желудочка, тени, повышение эхоплотности от стволовых структур мозга, снижение плотности от паренхимы мозга [7]. При клинико-нейросонографических сопоставлениях выявляется корреляция числа лейкомаляций и неврологических исходов. Множественные лейкомаляции в обоих полушариях, обнаруживаемые у больных по данным нейросонографии в остром периоде заболевания, сочетаются с синдромом двигательных нарушений и грубой задержкой психомоторного развития в восстановительном периоде. Компьютерная томография головного мозга помогает объективизировать гипоксические изменения мозговой ткани в структурах мозжечка и ствола мозга, которые недостаточно четко выявляются при нейросонографии.
Электроэнцефалографическое (ЭЭГ) исследование выявляет очаги медленноволновой активности, очаги редукции корковой ритмики, очаги эпилептической активности. Большое значение ЭЭГ-исследование имеет для выделения группы риска по судорожному синдрому и диагностики клинически «немых» приступов. Косвенным подтверждением судорожного синдрома, а также признаком понижения порога судорожной готовности у больных является наличие пароксизмальных изменений ЭЭГ. Повторные припадки могут приводить к усилению выраженности пароксизмальной активности на ЭЭГ.
Из биохимических исследований в остром периоде показателем глубины гипоксических нарушений является оценка ацидоза от смешанного до выраженного декомпенсированного метаболического. При тяжелой гипоксии нарастает осмотическое давление плазмы крови, увеличивается уровень лактатдегидрогеназы. Лактатдегидрогеназа и другие ферменты гликолиза коррелируют с тяжестью состояния детей и отражают выраженность гипоксии в остром периоде перинатальной энцефалопатии.
Рентгенография легких используется для диагностики врожденных ателектазов, пневмопатии и воспалительных изменений легких.
Лечение острого периода
В остром периоде необходима своевременная коррекция респираторного дыхательного дисстресс-синдрома и адекватная вентиляция легких. У недоношенных проводится эндотрахеальное введение колфосцерила пальмитата 5 мл/кг. Использование аналогов сурфактанта приводит к значительному регрессу неврологических синдромов гипоксической энцефалопатии.
1. Коррекция гомеостаза и гиповолемии: свежезамороженная плазма 5 — 10 мл/кг, 10% альбумин 5 — 10 мл/кг, реополиглюкин 7 — 10 мл/кг, гемодез 10 мл/кг.
2. Снижение проницаемости сосудов: 12,5% раствор этамзилата внутримышечно или внутривенно, 1% викасол 0,1 мл/кг.
3. Метаболическая и антиоксидантная терапия: пирацетам 50 мг/кг, 10% глюкоза 10 мл/кг, актовегин внутривенно, 5% витамин Е 0,1 мл в день. В качестве антиоксиданта используется соевое масло 2 — 3 мл 4 — 6 дней на кожу живота [11]./hands-applying-electrodes-to-baby-for-electroencephalography-183041287-58aca8df5f9b58a3c95cfcfe.jpg)
4. Сосудистая терапия: винпоцетин 1мг/кг внутривенно.
5. Дегидратационная терапия: гидрокортизон 3 — 10 мг/кг, преднизолон 1 — 2 мг/кг, 25% магния сульфат 0,2 мл/кг.
6. Улучшение тканевого метаболизма сердечной мышцы: кокарбоксилаза 8 мг/кг, АТФ 10 мг/кг.
7. Антиконвульсантная терапия: диазепам 1мг/кг внутримышечно или внутривенно, ГОМК 50 мг/кг, барбитураты, когда бензодиазепины не эффективны, 5 мг/кг [14].
Лечение восстановительного периода
Лечение восстановительного периода проводится по синдромологическому принципу.
1. При синдроме повышенной нервно-рефлекторной возбудимости с проявлениями вегетовисцеральных дисфункций показаны седативные препараты: диазепам 0,001 г 2 раза в день, тазепам 0,001 г 2 раза в день, микстура с цитралью — раствор цитраля 2,0, магния сульфат 3,0, 10% раствор глюкозы 200,0 — по чайной ложке 3 раза в день; с 2-месячного возраста назначаются успокоительный коктейль из трав (корень валерианы, пустырник, шалфей) по 1 чайной ложке 3 раза в день.
2. При гипертензионно-гидроцефальном синдроме целесообразно назначать фуросемид 0, 002 г/кг в сутки с панангином, глицерол по 1 чайной ложке 3 раза в день. При выраженных проявлениях гипертензионно-гидроцефального синдрома используют ацетазоламид по 0,02 г/кг в сутки однократно по схеме: 3 дня — прием, 1 день перерыв, курс от 3 нед до 1 — 1,5 мес с панангином.
3. При синдроме двигательных нарушений: витамин В6 5 мг, витамин В1 2 мг, АТФ 0,5 мл 10 — 12 инъекций, пиритинол 10 — 20 капель на 1 кг массы тела 2 раза в день в первой половине дня 1 — 3 мес. Массаж. Лечебная гимнастика, проводится обучение матери навыкам реабилитации.
4. При синдроме задержки психомоторного развития: пирацетам 30 — 50 мг/кг в 3 приема, пиритинол. С 6 месяцев церебролизин 0,5 мл № 20 (противопоказан при судорожном синдроме), витамины В6, В1. Гамма-аминобутировая кислота по 0,06 г 2 — 3 раза в день.
5. При судорожном синдроме: вальпроат натрия 20 — 50 мг/кг, клоназепам до 1 — 2 мг в сутки, фенобарбитал 1 — 2 мг/кг. При резистентных судорогах ламотригин 1 — 2 мг/кг.
При резистентных судорогах ламотригин 1 — 2 мг/кг.
6. Хирургическое лечение применяется при сочетанных перивентрикулярных кровоизлияниях и развитии постгеморрагической гидроцефалии, проводится вентрикулярное шунтирование.
Терапевтические мероприятия в дальнейшем индивидуализируются в зависимости от исхода процесса. К годовалому возрасту у большинства зрелых детей с появлением вертикализации и речевых функций можно выявить исходы перинатальной гипоксической энцефалопатии. Выздоровление наступает у 15 — 20% детей. Частыми последствиями перенесенной энцефалопатии являются минимальная мозговая дисфункция, гидроцефальный синдром. Наиболее тяжелыми исходами являются детский церебральный паралич и эпилепсия.
Безусловно, успехи перинатальной медицины, адекватное ведение родов и острого периода гипоксической энцефалопатии позволят снизить психоневрологические исходы заболевания.
Литература:
1.Балан П.В., Маклакова А. С., Крушинская Я.В., Соколова Н.Л., Кудаков Н.И. Сравнительный анализ устойчивости к острой гипобарической гипоксии новорожденных и взрослых экспериментальных животных. Акуш. и гин. 1998;3:20-3.
С., Крушинская Я.В., Соколова Н.Л., Кудаков Н.И. Сравнительный анализ устойчивости к острой гипобарической гипоксии новорожденных и взрослых экспериментальных животных. Акуш. и гин. 1998;3:20-3.
2. Громыко Ю.Л. Оценка эффективности нового антиоксидантного препарата -актовегина для лечения плацентарной недостаточности и отставания в размерах плода. Материалы 1 съезда Российской ассоциации специалистов перинатальной медицины, 32.
3. Ивановская Т.Е., Покровская Л.Я. Основная патология перинатального периода по современным патологическим данным. Педиатрия 1987;4:11-7.
4. Кулаков В.И. Пренатальная медицина и репродуктивное здоровье женщины. Акуш. и гин. 1997;5:19-22.
5. Кузнецова Л.М, Дворяковский И.В., Мордова Н.А. Корреляция клинических и ультразвуковых признаков при ликвородинамических нарушениях у детей раннего возраста. Материалы научно-практической конференции. Калуга, 1980;34.
6. Миленин О.Б., Ефимов М.С. Применение синтетического сурфактанта экзосорфа в лечении и профилактике респираторного дисстресс-синдрома у новорожденных детей. Акуш. и гин. 1998;3:5-9.
Акуш. и гин. 1998;3:5-9.
7. Орлова Н.С., Мачинская Е.А., Фишкина Е.В. Нейросонография в диагностике некоторых пороков развития головного мозга. Материалы научно-практической конференции. Калуга. 1982;35.
8. Педиатрия (пер. англ.) / Под ред. Н.Н.Володина. М.,1996;125-70.
9. Федорова М.В. Плацентарная недостаточность. Акуш. и гин. 1997;5:40-3.
10. Фишкина Е.В., Симушин Г.П., Рубцова И.И. и др. Возможности нейросонографии в диагностике поражений центральной нервной системы
у новорожденных детей. Материалы научно-практической конференции. Калуга. 1980;43.
11. Шарипов Р.Х. Применение препаратов мембраннотропного действия в комплексном лечении недоношенных детей с перинатальной энцефалопатией. Тезисы докладов научно-практической конференции. Самара. 1993;1:63.
12. Эдельштейн Э.А., Бондаренко Е.С., Быкова Л.И. Перинатальные гипоксические синдромы. Учебное пособие. М., 1988;38.
13. De Volder AG, Joffinet AM, Bol A, et al. Brain glucose metabolism in postanoxic syndrome. Arch Neurol 1990;47(2):197-204.
Brain glucose metabolism in postanoxic syndrome. Arch Neurol 1990;47(2):197-204.
14. Carlier G, Guidi О, Dubru JM. Le traitement des convulsions d’enfant. Rev/med/ Liege. 1989;257-62.
15. J. VoIpe Neurology of the Newborn, coundres company. 1987;715.
.
Энцефалопатия | Медицинский центр АКАДЕМИЯ VIP
Перинатальная энцефалопатия
Сложное словосочетание перинатальная энцефалопатия встречается в лексиконе детских врачей, а следовательно, и родителей удивительно часто. По крайней мере, у половины читателей, заглянувших в амбулаторную карточку своего ребенка, есть реальные шансы обнаружить там знаменитую аббревиатуру ПЭП — что, собственно, и расшифровывается как перинатальная энцефалопатия.
Перевод на русский язык этого медицинского термина не очень прост. Но мы попробуем. «Пери-» — (греч. peri-) приставка, означающая «расположение вокруг, снаружи, при чем-либо». «Натальный» — от лат. natus — рождение. Несложно сделать вывод, что суть понятия «перинатальный» — связанный с родами, имеющий место до, во время, после родов, есть даже такое словосочетание — «перинатальный период» и наука «перинатология». Имеет, по-видимому, смысл сразу же уточнить, что перинатология называет перинатальным периодом интервал, начиная с 28-й недели внутриутробной жизни плода и заканчивая седьмым днем после рождения1.
Имеет, по-видимому, смысл сразу же уточнить, что перинатология называет перинатальным периодом интервал, начиная с 28-й недели внутриутробной жизни плода и заканчивая седьмым днем после рождения1.
Слово «патия-», происходящее от греческого pathos-, переводится как «болезнь», «страдание». Также греческое enkefalos — головной мозг. Ну а вместе получается «энцефалопатия» — болезнь мозга.
Болезнь мозга — понятие неконкретное, неудивительно, что и энцефалопатия — не конкретная болезнь, а термин, объединяющий целый ряд самых разнообразных болезней головного мозга. Становится очевидным, что диагностировать, лечить и вылечить энцефалопатию нельзя в принципе, ибо как можно лечить неконкретное понятие.
Нервная система ребенка вообще и головной мозг в частности развиваются очень быстро. В процессе развития эпизодически возникают всякие непонятности, появляются, исчезают и угасают рефлексы, стремительно меняются реакции на окружающую среду, совершенствуются органы чувств, значительные изменения претерпевает объем движений и т. д. и т. п. Медицинская наука изрядно потрудилась и постаралась все эти изменения систематизировать. Отсюда многочисленные труды с информацией о нормах, о том, что положено, а что нет, о том, что может быть, что допустимо, чего не может быть никогда. А поскольку анализируемых и подвергнутых учету факторов сотни, что-нибудь обязательно выйдет за рамки отведенных сроков и норм. И тогда на повестку дня встанет вопрос о диагнозе…
д. и т. п. Медицинская наука изрядно потрудилась и постаралась все эти изменения систематизировать. Отсюда многочисленные труды с информацией о нормах, о том, что положено, а что нет, о том, что может быть, что допустимо, чего не может быть никогда. А поскольку анализируемых и подвергнутых учету факторов сотни, что-нибудь обязательно выйдет за рамки отведенных сроков и норм. И тогда на повестку дня встанет вопрос о диагнозе…
А поставить диагноз, руководствуясь международной классификацией болезней, не удастся. Но ведь есть конкретные жалобы и проблемы: у нас подбородочек дрожит, мы плакали 30 минут без остановки, а вчера срыгнули целых четыре раза, а на прошлой неделе очень сильно дрыгали ногами и т. д.
Алгоритм взаимоотношений детского врача и родителей в рамках отечественной ментальности совершенно не предусматривает фразы типа «все нормально, оставьте дитя в покое» или «успокойтесь, перерастет». Стандартная процедура любого врачебно-родительского контакта начинается с вопроса «на что жалуетесь?» и заканчивается конкретным диагнозом. Ситуация, при которой родители всем довольны, — удивительная редкость. Врачебный осмотр, в ходе которого не будут обнаружены никакие отклонения от норм, сроков и стандартов, — явление уникальное. Сочетание редкого и уникального — это уже вне комментариев.
Ситуация, при которой родители всем довольны, — удивительная редкость. Врачебный осмотр, в ходе которого не будут обнаружены никакие отклонения от норм, сроков и стандартов, — явление уникальное. Сочетание редкого и уникального — это уже вне комментариев.
В то же время и жалобы, и выявленные в ходе осмотра ненормальности сплошь и рядом на диагноз, собственно говоря, не тянут. Ну не все замечательно, ну не так кое-что, ну не совсем так кое-где, но это ж не повод лечиться-спасаться-обследоваться… Но произнести, а тем более написать фразу «что-то не так» или «с мозгами что-то не так» — это ж окончательно и бесповоротно подорвать доверие к медицинской науке вообще и к конкретному врачу в частности.
И тут приходит на помощь замечательный диагноз — «перинатальная энцефалопатия». Диагноз чрезвычайно удобный в силу своей внешней учености и неопределенности.
Лечение перинатальных поражений нервной системы лекарствами — это вообще отдельная тема. Дело в том, что после воздействия на мозг ребенка повреждающего фактора (травма, кислородное голодание и т. д.) начинается острый период энцефалопатии, который длится 3—4 недели. Именно в остром периоде необходима активная лекарственная терапия, которая способна серьезным образом повлиять на исход болезни. Далее следует т. н. восстановительный период, когда эффективность фармакологических средств очень невелика и акцент делается на принципиально другие методы помощи — массаж, физиопроцедуры и т. п.
д.) начинается острый период энцефалопатии, который длится 3—4 недели. Именно в остром периоде необходима активная лекарственная терапия, которая способна серьезным образом повлиять на исход болезни. Далее следует т. н. восстановительный период, когда эффективность фармакологических средств очень невелика и акцент делается на принципиально другие методы помощи — массаж, физиопроцедуры и т. п.
И в этом аспекте неопределенное, умно-ученое, но ничего не требующее и ни к чему не обязывающее понятие «перинатальная энцефалопатия» представляет собой конкретное зло. Именно зло, поскольку сплошь и рядом инициирует действия и явления совершенно ненужные, иногда опасные — эксперименты с лекарствами, ограничения нормального образа жизни, хождения по медицинским учреждениям, материальные потери, эмоциональные стрессы.
Искоренить это зло практически невозможно. Можно лишь изменить к нему отношение. Изменить отношение и понять самое-самое главное: перинатальная энцефалопатия — это не повод спасаться и грустить. Ведь если у вашего малыша обнаружили перинатальную энцефалопатию, так это значит, что нет у него серьезных, конкретных и опасных болезней. Это временно, это мелочи, это само пройдет, образуется, перерастется.
Ведь если у вашего малыша обнаружили перинатальную энцефалопатию, так это значит, что нет у него серьезных, конкретных и опасных болезней. Это временно, это мелочи, это само пройдет, образуется, перерастется.
И это повод улыбнуться и потерпеть.
В «Академии VIP» Вашему малышу смогут оказать помощь детские специалисты: педиатр, ЛОР, невролог, хирург, эндокринолог. В случае острого заболевания ребенка врача можно пригласить на дом. В нашем распоряжении самые современные лабораторные и функциональные методы диагностики детской патологии. Доброго здоровья Вам и Вашему малышу!
Эпилептическая энцефалопатия, индуцированная лихорадкой, у детей школьного возраста (FIRES): обзор литературы и собственные наблюдения | Куликова
1. Мухин К.Ю., Петрухин А.С., Холин А.А. Эпилептические энцефалопатии и схожие синдромы у детей. М.: АртСервис Лтд, 2011. 680 с. [Mukhin K.Yu., Petrukhin A.S., Kholin A.A. Epileptic encephalopaties and similar syndromes in children. Moscow: ArtService Ltd, 2011. 680 p. (In Russ.)].
680 с. [Mukhin K.Yu., Petrukhin A.S., Kholin A.A. Epileptic encephalopaties and similar syndromes in children. Moscow: ArtService Ltd, 2011. 680 p. (In Russ.)].
2. Awaya Y., Fukuyama Y. Epilepsy sequelae of acute encephalitis or encephalopathy (3rd report). Jpn J Psychiatr Neurol 1986;40:385–7.
3. Baxter P., Clarke A., Cross H. et al. Idiopathic catastrophic epileptic encephalopathy presenting with acute onset intractable status. Seizure 2003;12(6):379–87. DOI: 10.1016/S1059-1311(02)00340-0. PMID: 12915084.
4. Berg A.T., Berkovic S.F., Brodie M.J. et al. Revised terminology and concepts for organisation of seizures and epilepsies: report of the ILAE Commission on Classification and Terminology, 2005–2009. Epilepsia 2010;51(4).
5. Caraballo R.H., Reyes G., Avaria M.F. et al. Febrile infection-related epilepsy syndrome: a study of 12 patients. Seizure 2013;22(7):553–9. DOI: 10.1016/j.seizure.2013.04.005. PMID: 23643626.
6. Kramer U., Chi C.S., Lin K.L. et al. Febrile infection-related epilepsy syndrome (FIRES): pathogenesis, treatment, and outcome: a multicenter study on 77 children. Epilepsia 2011;52(11):1956–65. DOI: 10.1111/j.1528-1167.2011.03250.x. PMID: 21883180.
7. Kramer U., Shorer Z., Ben-Zeev B. et al. Severe refractory status epilepticus owing to presumed encephalitis. J Child Neurol 2005; 20(3):184–7. DOI: 10.1177/08830738050200030301. PMID: 15832606.
8. Lin J.J., Lin K.L., Wang H.S. et al. Analysis of status epilepticus related presumed encephalitis in children. Eur J Paediatr Neurol 2008;12(1): 32–7. DOI: 10.1016/j.ejpn.2007.05.007. PMID: 17584506.
9. Lin J.J., Lin K.L., Wang H.S. et al. Effect of topiramate, in combination with lidocaine, and phenobarbital, in acute encephalitis with refractory repetitive partial seizures. Brain Dev 2009;31(8):605–11. DOI: 10.1016/j.braindev.2008.09.010. PMID: 18993000.
10. Lyon G., Dodge P.R., Adams R.D. The acute encephalopathies of obscure origin in infants and children. Brain 1961;84(4):680–708. DOI: 10.1093/brain/84.4.680. PMID: 14467623.
11. Mikaeloff Y., Jambaque I., Hertz-Pannier L. et al. Devastating epileptic encephalopathy in school-aged children (DESC): a pseudo encephalitis. Epilepsy Res 2006;69(1):67–79. DOI: 10.1016/j.eplepsyres.2006.01.002. PMID: 16469483.
12. Nabbout R., Mazzuca M., Hubert P. et al. Efficacy of ketogenic diet in severe refractory status epilepticus initiating fever induced refractory epileptic encephalopathy in school age children (FIRES). Epilepsia 2010;51(10):2033–7. DOI: 10.1111/j.1528-1167.2010.02703.x. PMID: 20813015.
13. Nabbout R., Vezzani A., Dulac O., Chiron C. Acute encephalopathy with inflammation-mediated status epilepticus. Lanc Neurol 2011;10(1):99–108. DOI: 10.1016/S1474- 4422(10)70214-3. PMID: 21163447.
14. Rani K. Singh et al. Cognitive outcomes in febrile infection-related epilepsy syndrome treated with the ketogenic diet. Pediatrcs 2014;134(5):1431–5. DOI: 10.1542/peds.2013-3106. PMID: 25332495.
15. Rantala H., Saukkonen A.L., Remes M., Uhari M. Efficacy of five days barbiturate anesthesia in the treatment of intractable epilepsies in children. Epilepsia 1999;40(12):1775–9. DOI: 10.1111/j.1528-1157.1999.tb01597.x. PMID: 10612343.
16. Rossetti A.O., Logroscino G., Bromfield E.B. Refractory status epilepticus: effects of treatment aggressiveness on prognosis. Arch Neurol 2005;62(11):1698–702. DOI: 10.1001/archneur.62.11.1698. PMID: 16286542.
17. Sahin M., Menache C.C., Holmes G.L., Riviello J.J. Outcome of severe refractory status epilepticus in children. Epilepsia 2001;42(11):1461–7. DOI: 10.1046/j.1528-1157.2001.21301.x. PMID: 11879350.
18. Sakuma H., Awaya Y., Shiomi M. et al. Acute encephalitis with refractory, repetitive partial seizures (AERRPS): a peculiar form of childhood encephalitis. Acta Neurol Scand 2010;121(4):251–6. DOI: 10.1111/j.1600-0404.2009.01198.x. PMID: 20028339.
19. Specchio N., Fusco L., Claps D., Vigevano F. Epileptic encephalopathy in children possibly related to immune-mediated pathogenesis. Brain Dev 2010;32(1):51–6. DOI: 10.1016/j.braindev.2009.09.017. PMID: 19850427.
20. Ueda R., Saito Y., Ohno K. et al. Effect of levetiracetam in acute encephalitis with refractory, repetitive partial seizures during acute and chronic phase. Brain Dev 2015;37(5):471–7. DOI: 10.1016/j.braindev.2014.08.003. PMID: 25174548.
21. Van Baalen A., Häusler M., Boor R. et al. Febrile infection-related epilepsy syndrome (FIRES): a non-encephalitic encephalopathy in childhood. Epilepsia 2010;51(7):1323–8. DOI: 10.1111/j.1528-1167.2010.02535.x. PMID: 20345937.
22. Walker M.C., White H.S., Sander J.W. Disease modification in partial epilepsy. Brain 2002;125(9):1937–50. DOI: 10.1093/brain/awf203. PMID: 12183340.
23. Watanabe S., Okumura Y., Aiba H. A case of acute encephalitis with refractory repetitive partial seizures successfully controlled by veryhigh-dose phenobarbital therapy found in a boy. No To Hattatsu 2014;46(6):443–6. PMID: 25558588.
24. Wilder-Smith E.P., Lim E.C., Teoh H.L. et al. The NORSE (new-onset refractory status epilepticus) syndrome: defining a disease entity. Ann Acad Med Singapore 2005;34(7):417–20. PMID: 16123813.
Перинатальная энцефалопатия: причины, симптомы и лечение
Перинатальная энцефалопатия — целый ряд заболеваний (отклонений в работе) центральной нервной системы у новорожденных. Заболевание может проявляться по-разному, а потому его весьма непросто диагностировать, особенно у младенцев. С этим и связан тот факт, что симптомы энцефалопатии зачастую расцениваются педиатрами как признаки совсем других заболеваний. В итоге лечению заболевания не уделяется необходимого внимания в раннем возрасте, когда наиболее велика вероятность полного выздоровления. Прогрессирующее заболевание при взрослении ребенка зачастую также диагностируется симптоматически, и лечение назначается соответствующее.
Избавление от ПЭП без остеопатического воздействия на первопричины возникновения заболевания, если не полностью невозможно (все-таки организм является саморегулирующей системой, которая вполне способна справиться с рядом серьезных заболеваний), то существенно затруднено. Конечно, не следует пренебрегать и другими методами лечения — как показывает практика, наиболее эффективны как раз комплексные процедуры.
Симптомы и последствия перинатальной энцефалопатии
Симптомы заболевания проявляются по-разному в различные периоды жизни ребенка. Для простоты классификации и улучшения диагностики принято выделять три основных периода ПЭП: острый (в течение первого месяца жизни), восстановительный (до 1 года, реже до 2 лет — в основном у недоношенных детей) и исход заболевания. Существует вероятность, что организм ребенка — как саморегулирующая система, с точки зрения остеопатии, — может полностью восстановиться и нейтрализовать симптомы болезни, адаптировавшись к ним. Это не означает полного выздоровления, так как последствия ПЭП могут проявиться в более позднем возрасте. Поэтому при возникновении подозрений на заболевание необходимо сразу же показать ребенка врачу-остеопату, который сможет поставить правильный диагноз и назначить грамотное адекватное лечение, направленное на избавление организма не от последствий, а от причин болезни.
Основные симптомы перинатальной энцефалопатии
В острый период развития заболевания наблюдаются:
- синдром угнетения ЦНС. Характеризуется общей вялостью новорожденных, сниженной реакцией на внешние раздражители, наличием спонтанных двигательных рефлексов;
- коматозный синдром. Обычно развивается быстро и внезапно, вызывая бессознательное состояние у ребенка. Может проявляться в остром нарушении жизненно важных функций организма;
- повышенная нервно-рефлекторная возбудимость. Проявляется в виде тремора конечностей и ненормально-возбужденной реакцией на внешние раздражители;
- повышенное черепное давление с последующим гипертензионно-гидроцефальным синдромом и непропорциональным увеличением размера черепа;
- судороги.
В восстановительный период к этим симптомам могут добавляться:
- двигательные нарушения. Проявляются по-разному, но общим является то, что ребенок полностью или частично не контролирует свои движения;
- задержка психомоторного развития (ЗПР). Проявляется в замедленном развитии, проблемах с речью, нарушении памяти, проблемах с вниманием и т.д.;
- эпилептические припадки.
Признаки заболевания могут проявляться как комбинированно, так и поодиночке. Причем в разном возрасте. При обнаружении хотя бы одного симптома рекомендуется обратиться к специалисту-остеопату для проведения более детального обследования.
Исходом заболевания могут быть:
- выздоровление;
- минимальная мозговая дисфункция;
- умственное недоразвитие;
- ДЦП;
- невротические заболевания;
- эпилепсия;
- гидроцефалия.
Как показывает практика, при легких формах перинатальной энцефалопатии вероятность полного выздоровления достаточно велика. Особенно при правильном остеопатическом лечении, которое может сочетаться с другими методами воздействия на детский организм.
При более тяжелой форме понадобится более длительное лечение, которое в силу различных факторов может не иметь стопроцентной результативности. Некоторые проблемы с памятью, вниманием, координацией движений у ребенка могут сохраняться как в течение длительного периода, так и на протяжении всей жизни. Но остеопатия способствует если и не полному излечению, то существенной минимизации симптомов перинатальной энцефалопатии.
Факторы риска
К факторам риска, повышающим опасность возникновения заболевания, относятся:
- хронические болезни матери. Зачастую они не передаются ребенку напрямую, так как не являются наследственными, но на генетическом уровне обуславливают проявления различных патологий и отклонений в развитии плода и уже родившегося ребенка;
- инфекционные заболевания, перенесенные во время беременности. Очень опасны недолеченные патологии, которые могут проявиться на фоне общего ослабления иммунитета организма из-за беременности;
- неправильное питание. В период вынашивания плода организм матери должен получать весь необходимый набор белков, витаминов и минеральных веществ. Питание должно быть сбалансированным и согласовываться с врачом — во избежание возникновения пищевой аллергии и расстройств органов пищеварения;
- слишком молодой возраст матери. Организм девушки может быть просто неготовым к вынашиванию полноценного и здорового ребенка. В случае слишком юного возраста или недостаточного физического развития будущей матери она должна находиться под постоянным контролем специалиста в течение всего периода беременности и после родов;
- нарушение обмена веществ в организме матери. Так как ее организм тесно взаимосвязан с организмом будущего ребенка, любые нарушения отражаются на питании и здоровье плода. Поэтому столь важно правильное питание, о котором говорилось ранее, а также безотказная работа органов, отвечающих за обмен веществ в организме;
- патологии во время беременности. Очень опасны ранние и поздние токсикозы, стрессы, физические нагрузки и другие факторы, которые могут привести к прерыванию и ненормальному течению беременности;
- неблагоприятная экологическая обстановка. К сожалению, сегодня этот фактор опаснее многих других, ведь избежать воздействия вредных внешних проявления зачастую невозможно. Рекомендуется обратиться к специалистам (в том числе и остеопату), которые помогут в значительной мере нейтрализовать неблагоприятное воздействие окружающей среды;
- недоношенность или переношенность плода.
- Таким образом, большинство факторов риска связаны
именно со здоровьем матери. Поэтому в период беременности она должна тщательно следить за своим самочувствием, прислушиваясь к совету хорошего врача. Параллельно с другими специалистами рекомендуется регулярно посещать остеопата, который также будет следить за ходом протекания беременности и сможет скорректировать вероятные отклонения остеопатическими методами, без применения лекарств, способных навредить будущему ребенку.
Опасность перинатальной энцефалопатии
Как и многие другие младенческие заболевания, не будучи вылеченной на ранних стадиях, перинатальная энцефалопатия прогрессирует с возрастом и может проявляться в виде самых различных нарушений, которые на первый взгляд покажутся не связанными:
- синдром частой заболеваемости. Это могут быть как частые простуды, так и периодические недомогания, связанные с плохим самочувствием, повышенной утомляемостью, головными болями и т.д.;
- хронические заболевания дыхательной системы. Могут проявляться на фоне частых ОРЗ, постепенно переходя в хроническую форму. При отсутствии грамотного остеопатического лечения с возрастом могут перерасти в астму и другие не менее опасные заболевания;
- отставание в развитии. Могут проявляться в не очень явной форме, как затруднения в учебе, особенно в точных науках и творческих дисциплинах;
- нарушения осанки. Незаметные родовые травмы и нарушения в работе ЦНС, возникшие еще на этапе беременности, в дальнейшем нередко приводят к искривлению позвоночника и появлению таких серьезных заболеваний, как сколиоз, со всеми вытекающими из него последствиями, влекущими опускание внутренних органов и их частичную или полную дисфункцию;
- нарушения в работе внутренних органов, системы обмена веществ и системы кровообращения. Обычно эти нарушения неизменно влекут за собой другие заболевания, так как из-за нарушенного кровотока различные участки организма начинают недополучать кислород, что приводит к гибели клеток и дисфункции.
Как расценивают перинатальную энцефалопатию специалисты-остеопаты
С точки зрения остеопатии весь комплекс заболеваний ЦНС, объединяемых под этим термином, является последствием механических нарушений в теле плода новорожденного ребенка. Причем возникнуть они могут еще на этапе беременности или позже — при сложных родах и/или кесаревом сечении. Причинами, приводящими к появлению заболевания, являются:
- дисфункция позвоночного столба или отдельных его участков;
- нарушения в работе внутренних органов;
- продолжительное кислородное голодание;
- нарушение кровообращения.
Но даже в том случае, если во время беременности плод развивался нормально, существует большая вероятность получения повреждения во время родов, так как, проходя между костями таза, плод поворачивается на 360 градусов, что может вызвать нарушения в структуре скелета, мышечных тканях. Наиболее часто наблюдается нарушения в положении шейных позвонков. В большинстве случаев в первые недели роста ребенка последствия повреждений полностью нейтрализуются организмом самостоятельно. Но так бывает далеко не всегда, любые изменения или отклонения в развитии могут привести к осложнениям, которые впоследствии спровоцируют нарушения кровоснабжения мозга и проявление перинатального расстройства.
Как диагностируется перинатальная энцефалопатия у новорожденных и младенцев
Существует ряд безопасных методов исследования головного мозга, которым могут подвергаться новорожденные. Они позволяют составить полную клиническую картину, определить наличие заболевания, его степень, характер течения. Наиболее информативной и эффективной является нейросонография, которая точно выявляет наличие поврежденных участков в мозгу младенца. Дополнительно к ней можно провести доплерографию — для оценки кровотока в сосудах головного мозга.
В случае выявления отклонений в развитии рекомендуется пройти электроэнцефалографическое обследование, направленное на определение степени задержки в развитии. Эта процедура также позволяет выявить очаги эпилептического поражения и оценить степень их активности и опасности для организма.
В некоторых случаях также рекомендуется осмотр окулиста, который поможет выяснить степень поражения путем оценки состояния зрительных нервов и анализа глазного дна.
Лечение энцефалопатии остеопатическими методами
Хороший врач-остеопат способен диагностировать ранние симптомы заболевания и составить полную картину его течения. Это дает возможность назначить грамотное лечение, способствующее адаптации организма к новым условиям, запуску и стимуляции его функций саморегулирования.
Воздействия остеопата — в зависимости от течения и сложности заболевания — направляются, в первую очередь, на пораженные участки тела, чтобы снять болевые ощущения и спазмы, образующиеся в результате неправильного развития и нарушений в системе кровообращения. Параллельно с этим специалист осуществляет комплекс процедур с целью нормализации работы мозга. Обычно для этого применяются различные техники мышечно-энергетического воздействия, которые позволяют мануальным путем восстановить равновесие натяжения внутричерепных оболочек. Это способствует восстановлению микропульсаций костей черепа и самого мозга, нормализации кровообращения.
После нормализации мозговой деятельности организм получает мощный стимул к саморегуляции и избавлению от энцефалопатии. Дальнейшие действия остеопата заключаются в том, чтобы помочь телу малыша справиться с болезнью. Для этого применяется мануальная терапия, массаж, лечебная физкультура и другие методики, которые, по мнению специалиста, смогут помочь скорейшему выздоровлению.
Как показывает практика, перинатальная энцефалопатия у новорожденных излечивается полностью в 30% случаев — при раннем обнаружении и грамотном лечении. Еще примерно в 20–30% — обычно при тяжелых и среднетяжелых случаях течения — новорожденные излечиваются не полностью. Какие-то симптомы при этом остаются, но зачастую часть из них удается скорректировать комплексной терапией, включающей как ЛФК, остеопатию, массажные техники, так и особое воспитание, обучение и т.д.
К сожалению, во многих случаях, когда перинатальная энцефалопатия проявляется в форме серьезного поражения клеток коры головного мозга, избавиться от заболевания невозможно. Причина в гибели клеток мозга и нарушении нейронных связей, которые не могут быть восстановлены из-за недостатка или отсутствия физических носителей в мозге ребенка. Даже в этих случаях остеопатия может помочь снять некоторые неврологические симптомы, но полное восстановление мозговой деятельности оказывается невозможным.
Важно, чтобы возможная энцефалопатия новорожденных диагностировалась на самых ранних стадиях развития — в первые месяцы жизни ребенка. Чтобы поспособствовать этому, рекомендуется посетить остеопата на 3 месяце жизни, для проведения полного обследования. Специалист назначит необходимые анализы и проведет самостоятельные осмотр, что в комплексе позволит обнаружить симптомы и выявить возможное наличие заболевания.
Нередко при обнаружении ПЭП врачи-педиатры советуют начинать медикаментозное лечение. Причем делать это необходимо с раннего младенческого возраста. Каждый родитель должен осознавать, что такой подход далеко не всегда действенен и способен скорее навредить ребенку. Дело в том, что организм новорожденного достаточно слаб, но при этом сбалансирован и способен к адаптации и саморегуляции. Воздействие на него сильнодействующих лекарств приводит к необратимым изменениям, которые даже остеопат не сможет нейтрализовать. Поэтому, если у ребенка диагностирована перинатальная энцефалопатия или имеются серьезные подозрения на ее наличие, рекомендуется пройти обследование также и у остеопата. Остеопатические техники более тонкие и деликатные, а потому — эффективные. Они точечно воздействуют на участки тела и мозга, нервную систему ребенка, приводя ее в нормальное состояние.
Профилактика заболевания
Наиболее действенным методом профилактики является соблюдение матерью режима в период беременности. В большинстве случаев новорожденные отличаются хорошим здоровьем, если мама заботится о своем организме (а значит, и о малыше). Также рекомендуется регулярное посещение врача-остеопата, который поможет следить за здоровьем в предродовой период.
Очень важно и внимание к здоровью и состоянию ребенка в первые недели и месяцы его жизни. Любые отклонения в развитии, аномалии и патологии должны выявляться и фиксироваться специалистом для точной диагностики и лечения.
Энцефалопатия новорожденного — хотя и очень серьезный диагноз, но еще не приговор. Это заболевание вполне эффективно лечится.
процедуры связанные с заболеванием
Перинатальная энцефалопатия (ПЭП)
Перинатальная энцефалопатия – различные поражения центральной нервной системы, возникшие в период внутриутробного развития, во время родов или в раннем неонатальном периоде. Перинатальная энцефалопатия может заявлять о себе синдромом угнетения или гипервозбудимости ЦНС, двигательными нарушениями, гипертензионно-гидроцефальным, судорожным, вегето-висцеральным синдромом, задержкой темпов моторного, психического и речевого развития. Диагностика перинатальной энцефалопатии включает нейросонографию, допплерографию, МРТ и КТ головного мозга, ЭЭГ. Лечение перинатальной энцефалопатии предполагает проведение посиндромной медикаментозной терапии, повторных курсов массажа, ЛФК, логопедической коррекции.
Перинатальная энцефалопатия (ПЭП) – мозговая дисфункция, вызванная гипоксическим, травматическим, инфекционным, токсико-метаболическим воздействием на ЦНС плода и новорожденного. Использование собирательного термина «перинатальная энцефалопатия» в детской неврологии и педиатрии обусловлено схожестью клинической картины, развивающейся при различных механизмах повреждения головного мозга. Поэтому, строго говоря, формулировка «перинатальная энцефалопатия» не является диагнозом и требует дальнейшего синдромологического анализа. В структуре патологии нервной системы детского возраста перинатальная энцефалопатия составляет более 60%. Последствия перинатальной энцефалопатии у детей могут варьировать от минимальной мозговой дисфункции и вегето-сосудистой дистонии до гидроцефалии, ДЦП и эпилепсии.
Причины перинатальной энцефалопатии
Ведущей причиной повреждения головного мозга плода и новорожденного в перинатальном периоде выступает внутриутробная гипоксия. Т. о., перинатальная энцефалопатия может являться следствием отягощенного соматического анамнеза беременной (пороки сердца, сахарный диабет, пиелонефрит, бронхиальная астма, гипертоническая болезнь и др.), неблагополучного протекания беременности (угроза выкидыша, внутриутробные инфекции, гемолитическая болезнь плода, гестоз, фетоплацентарная недостаточность) и родов (узкий таз, преждевременные роды, затяжные или стремительные роды, слабость родовой деятельности и пр.). Повреждающее действие на плод могут оказывать вредные привычки беременной (курение, употребление алкоголя и наркотических веществ), прием потенциально опасных для плода лекарственных препаратов, профессиональные вредности, экологическое неблагополучие.
Кроме этого, перинатальная гипоксическая энцефалопатия может развиваться и в первые дни после рождения, например, при синдроме дыхательных расстройств, врожденных пороках сердца, сепсисе новорожденных и т. д.
Независимо от непосредственной причины, во всех случаях гипоксического поражения ЦНС пусковым механизмом служит недостаток кислорода. Другие дисметаболические нарушения (ацидоз, гипогликемия, гипо-/гипернатриемия, гипо-/гипермагниемия, гипокальциемия) обычно возникают вслед за гипоксическим поражением ЦНС.
Внутричерепные родовые травмы, как причина перинатальной энцефалопатии, главным образом связаны с механическим воздействием — использованием травмирующих плод акушерских пособий, родами в тазовом предлежании, неправильным вставлением головки, тракцией за головку и т. д.
Классификация перинатальной энцефалопатии
В течении перинатальной энцефалопатии выделяют острый период (первый месяц жизни), ранний восстановительный (до 4-6 месяцев) и поздний восстановительный периоды (до 1-2-х лет) и период остаточных явлений.
К основным клиническим синдромам перинатальной энцефалопатии относятся синдром двигательных расстройств, синдром повышенной нервно-рефлекторной возбудимости (синдром гипервозбудимости), синдром угнетения ЦНС, гипертензионно-гидроцефальный синдром, судорожный синдром, вегето-висцеральный синдром.
При определении степени тяжести перинатальной энцефалопатии учитывается оценка состояния новорожденного по шкале АПГАР:
легкая степень — 6 — 7 баллов. Проявлением легкой формы перинатальной энцефалопатии служит синдром повышенной нервно-рефлекторной возбудимости. Недоношенные дети с легкой формой перинатальной энцефалопатии составляют группу повышенного риска по развитию судорожного синдрома.
среднетяжелая степень — 4 — 6 баллов. Перинатальная энцефалопатия обычно протекает с синдромом угнетения ЦНС и гипертензионно-гидроцефальным синдромом.
тяжелая степень – 1-4 балла. Тяжелая форма перинатальной энцефалопатии характеризуется прекоматозным или коматозным состоянием.
Симптомы перинатальной энцефалопатии
Ранние признаки перинатальной энцефалопатии могут быть выявлены неонатологом сразу после рождения ребенка. К ним относятся слабый или поздний крик новорожденного, длительный цианоз, отсутствие сосательного рефлекса, изменения двигательной активности и др.
Клиника легкой формы перинатальной энцефалопатии включает повышенную спонтанную двигательную активность новорожденного, трудности засыпания, поверхностный беспокойный сон, частый плач, мышечную дистонию, тремор подбородка и конечностей. Перечисленные нарушения обычно обратимы и регрессируют в течение первого месяца жизни.
Синдром угнетения ЦНС при среднетяжелой форме перинатальной энцефалопатии протекает с вялостью, гипорефлексией, гиподинамией, диффузной мышечной гипотонией. Типично наличие очаговых неврологических расстройств: анизокории, птоза, сходящегося косоглазия, нистагма, нарушения сосания и глотания, асимметрии носогубных складок, асимметрии сухожильно-надкостничных рефлексов. Гипертензионно-гидроцефальный синдром характеризуется напряжением и выбуханием большого родничка, расхождением швов, увеличением окружности головы, нарушением сна, пронзительными вскрикиваниями. Неврологические расстройства при среднетяжелой перинатальной энцефалопатии частично регрессируют к позднему восстановительному периоду.
Тяжелая степень перинатальной энцефалопатии сопровождается адинамией, мышечной гипотонией вплоть до атонии, отсутствием врожденных рефлексов, реакции на болевые раздражители, горизонтальным и вертикальным нистагмом, аритмичным дыханием и пульсом, брадикардией, артериальной гипотонией, приступами судорог. Тяжелое состояние ребенка может сохраняться от нескольких недель до 2-х месяцев. Исходом тяжелой перинатальной энцефалопатии, как правило, является та или иная форма неврологической патологии.
В раннем и позднем восстановительном периодах перинатальной энцефалопатии встречаются синдромы: церебрастенический (астеноневротический), двигательных нарушений, судорожный, вегегативно-висцеральный, гипертензионно-гидроцефальный.
Синдром двигательных нарушений может проявляться мышечным гипо-, гипертонусом или дистонией, гиперкинезами, парезами и параличами. Астеноневротическому синдрому соответствуют нарушения сна, эмоциональная лабильность, двигательное беспокойство ребенка.
Судорожный синдром в восстановительном периоде перинатальной энцефалопатии может выражаться не только непосредственно судорогами, но и мелкоамплитудным дрожанием, автоматическими жевательными движениями, кратковременной остановкой дыхания, спазмом глазных яблок и т. д.
Вегето-висцеральная дисфункция при перинатальной энцефалопатии проявляется микроциркуляторными нарушениями (бледностью и мраморностью кожных покровов, преходящим акроцианозом, холодными конечностями), желудочно-кишечными дискинезиями (срыгиванием, диспепсией, кишечными коликами и др.), лабильностью сердечно-сосудистой системы (тахикардией, брадикардией, аритмией) и т. д.
Исходом перинатальной энцефалопатии у детей может являться выздоровление, темповая задержка развития (ЗПР, ЗРР), минимальная мозговая дисфункция, синдром дефицита внимания и гиперактивности (СДВГ), грубые органические поражения ЦНС (ДЦП, эпилепсия, олигофрения, прогрессирующая гидроцефалия).
Диагностика перинатальной энцефалопатии
Признаки перинатальной энцефалопатии обычно выявляются при осмотре и объективном обследовании ребенка педиатром или детским неврологом. При этом важно учитывать данные о течении беременности, родов, состоянии ребенка сразу после рождения. Однако для определения характера поражения головного мозга и оценки степени тяжести перинатальной энцефалопатии требуется проведение дополнительных лабораторных и инструментальных исследований.
В целях изучения показателей метаболизма проводится определение КОС и газового состава крови, уровня глюкозы, электролитов, анализ состава спинномозговой жидкости.
Самую первую диагностическую информацию, позволяющую косвенным образом судить о наличии перинатальной энцефалопатии, получают с помощью ультразвукового исследования анатомических структур мозга — нейросонографии через большой родничок.
Для уточнения гипоксически-ишемических изменений мозговой ткани, обнаруженных при НСГ, проводится КТ или МРТ головного мозга ребенку. С целью оценки кровоснабжения головного мозга выполняется допплерография сосудов шеи ребенку и дуплексное сканирование артерий головы. ЭЭГ ребенку представляет наибольшую ценность в диагностике перинатальной энцефалопатии, протекающей с судорожным синдромом. При необходимости обследование ребенка может дополняться ЭхоЭГ, РЭГ, электронейромиографией, рентгенографией шейного отдела позвоночника.
Ребенку с перинатальной энцефалопатией необходима консультация окулиста с исследованием глазного дна. При задержке психического и речевого развития показана консультация детского психолога и логопеда.
Лечение перинатальной энцефалопатии
В остром периоде лечение ребенка с перинатальной энцефалопатией осуществляется в отделении патологии новорожденных. Ребенку показан щадящий режим, оксигенотерапия, при необходимости – зондовое питание.
Медикаментозная терапия назначается с учетом преобладающих синдромов перинатальной энцефалопатии. Для уменьшения внутричерепной гипертензии проводится дегидратационная терапия (маннитол), вводятся кортикостероиды (преднизолон, дексаметазон и др.), выполняются лечебные спинномозговые пункции.
С целью нормализации метаболизма нервной ткани и повышения ее устойчивости к гипоксии осуществляется инфузионная терапия – введение растворов глюкозы, калия, кальция, аскорбиновой кислоты, препаратов магния и т. д. Для борьбы с судорогами используется фенобарбитал, диазепам и др. В рамках терапии перинатальной энцефалопатии показано назначение препаратов, улучшающих кровообращение и метаболизм головного мозга (винпоцетина, пирацетама, кортексина, депротеинизированного гемодеривата крови телят и др.).
В восстановительном периоде лечение ребенка с перинатальной энцефалопатией, как правило, осуществляется амбулаторно или в условиях дневного стационара. Проводятся повторные курсы лекарственной терапии ноотропными препаратами и ангиопротекторами, лечебная физкультура, плавание, массаж, физиопроцедуры (амплипульстерапия, электрофорез), гомеопатическая терапии, фитотерапия, остеопатия.
При нарушениях речи — ЗРР, синдромах алалии и дизартрии показаны коррекционные логопедические занятия.
Профилактика перинатальной энцефалопатии
Полное выздоровление, как исход легкой степени перинатальной энцефалопатии наступает у 20-30 % детей. В остальных случаях в резидуальном периоде развиваются те или иные неврологические синдромы. Серьезность последствий зависит от характера и тяжести повреждения, своевременности и полноты оказания лечебной помощи. Высокая пластичность ЦНС у детей обусловливает большой резерв для восстановления нарушенных функций в первые месяцы жизни, поэтому крайне важно начать лечение как можно раньше даже при минимальных проявлениях перинатальной энцефалопатии.
Профилактика перинатальной энцефалопатии включает минимизацию факторов риска при беременности и родоразрешении. Основной задачей будущей мамы и акушеров-гинекологов на этапе ведения беременности служит предупреждение внутриутробной гипоксии, что может быть достигнуто терапией хронических заболеваний, коррекцией патологического течения беременности. Во время родов необходимо проводить профилактику интранатального травматизма плода.
Источник: http://www.krasotaimedicina.ru/diseases/children/perinatal-encephalopathy
Детские эпилептические энцефалопатии — Альфа-Ритм
Перунова Н.Ю., невролог-эпилептолог, д.м.н.
Детские эпилептические энцефалопатии с паттерном продолженной спайк-волновой активности во сне (CSWS, «continuous spike waves during slow wave sleep») принято рассматривать как модель воздействия эпилептиформной активности на высшие психические функции. Такие энцефалопатии, как эпилептический электрический статус медленноволнового сна (ESES, «electrical status epilepticus during slow wave sleep») и эпилептическая афазия Ландау-Клеффнера, считаются отдельными формами единого континуума.
Выраженность резидуального дефицита, формирующегося в исходе этих заболеваний, пропорциональна продолжительности активного периода. Критической длительностью активного периода эпилептических энцефалопатий с CSWS (ЭЭ с CSWS) предложено считать срок от 2 до 3 лет, после чего полноценное восстановление интеллектуальных функций невозможно.
В качестве отрицательных факторов прогноза ЭЭ с CSWS выделяют ранний возраст дебюта (до 3 лет), большую продолжительность активной фазы течения заболевания (более 3 лет), низкий уровень и длительное время диагностики, отсутствие ответа на терапию. Прогноз нарушений речи при эпилептических энцефалопатиях с CSWS считается неблагоприятным при дебюте заболевания в возрасте до 3 лет, сохранении речевых нарушений более 1 года.
В течении ЭЭ с CSWS предложено выделять активный период, характеризующийся персистированием паттерна CSWS, и резидуальный период. Проспективные исследования, содержащие информацию о динамике течения ЭЭ с CSWS, немногочисленны. Анализируются данные по группам из 11-18 пациентов (детей, подростков, молодых взрослых), длительность наблюдения от 5 до 9 лет, максимально – 16 лет.
Основными синдромами ЭЭ с CSWS являются наличие эпилептических припадков, расстройства поведения, когнитивные нарушения, нарушения речи, изменения на ЭЭГ.
Эпилептические припадки возникают у 80-90% пациентов, страдающих ЭЭ с CSWS. Назначение антиконвульсантов оказывается эффективным в отношении контроля припадков в 60% случаев, однако воздействие на эпилептиформную активность является недостаточным В отдаленном периоде эпилептические припадки могут сохраняться у 14% пациентов.
Рис.1. Сравнительная частота различных видов эпилептических припадков у пациентов с ЭЭ с CSWS (Перунова Н.Ю., Томенко Т.Р., 2004). ПП – простые парциальные; ВГСП – вторично-генерализованные судорожные припадки; АА – атипичные абсансы; ПАД. – эпилептические падения; СП – сложные парциальные припадки.
Рис.2. Фрагмент иктального паттерна парциального моторного (брахиофациального) припадка, развившегося во сне у пациента с ЭЭ с CSWS. Архив МКДЦ «Альфа-ритм».
Рис.3. Фрагмент иктального паттерна атипичного абсанса у пациента с ЭЭ с CSWS. Архив МКДЦ «Альфа-ритм».
Расстройства поведения в острой фазе ЭЭ с CSWS наблюдаются у 90% детей, однако при проспективном наблюдении у 75% из них отмечается постепенное снижение выраженности поведенческих нарушений.
Когнитивные нарушения в активном периоде ЭЭ с CSWS встречаются у 90% пациентов. Хорошее восстановление когнитивных функций возможно только у 10%, обучение в массовой школе – у 12%. Выраженный интеллектуальный дефицит в отдаленном периоде сохраняется у 18% подростков и молодых взрослых.
Полный регресс нарушений речи в исходе ЭЭ с CSWS возможен в 17-18% случаев, частичное восстановление нарушений речи — в 37-40%. У 50-60% пациентов речевые нарушения сохраняются в течение всей жизни.
Продолженная эпилептиформная активность с индексом более 50% — облигатный симптом ЭЭ с CSWS. В активном периоде эпилептиформная активность оценивается как диффузная в 40%, случаев, как диффузная с региональными преобладанием — в 60%. Клинические проявления ЭЭ с CSWS и характеристики эпилептиформной активности не всегда совпадают Персистирование изменений на ЭЭГ при LKS регистрируется до 5 лет, при ESES до 9 лет.
Рис.4. Фрагмент ЭЭГ сна пациента с ЭЭ с CSWS. Эпилептический электрический статус медленноволнового сна. Архив МКДЦ «Альфа-ритм».
Рис.5. Динамика основных синдромов ЭЭ с CSWS (собственная реконструкция по данным метаанализа).
К сожалению, доступные в настоящее время терапевтические воздействия на ЭЭ с CSWS недостаточно эффективны, что заставляет считать проблему ЭЭ с CSWS одной из наиболее актуальных и нерешенных в детской эпилептологии.
(Обзор составлен по данным публикаций: Smith MC. et al., 2003; Rossi PG. et al., 2004; Nickels K, Wirrell E., 2006; Tassinari CA, Rubboli G., 2006; Van Hirtum-Das M. et al., 2006; Wang S. et al., 2006; Praline J, et al., 2006; Scholtes FB. et al., 2010; García-Peñas JJ., 2010; Liukkonen E. et al., 2010; Loddenkemper T. et al., 2011.)
Энцефалопатия — Фонд детской неврологии
Описание
Энцефалопатия — это термин, обозначающий любое диффузное заболевание головного мозга, которое изменяет функцию или структуру мозга. Энцефалопатия может быть вызвана инфекционным агентом (бактериями, вирусом или прионом), метаболической или митохондриальной дисфункцией, опухолью головного мозга или повышенным давлением в черепе, длительным воздействием токсичных элементов (включая растворители, лекарства, радиацию, краски, промышленные химикаты и некоторые другие вещества). металлы), хроническая прогрессирующая травма, плохое питание или недостаток кислорода или кровотока в головном мозге.Отличительным признаком энцефалопатии является измененное психическое состояние. В зависимости от типа и тяжести энцефалопатии общими неврологическими симптомами являются прогрессирующая потеря памяти и когнитивных способностей, тонкие изменения личности, неспособность концентрироваться, летаргия и прогрессирующая потеря сознания. Другие неврологические симптомы могут включать миоклонус (непроизвольное подергивание мышцы или группы мышц), нистагм (быстрое непроизвольное движение глаз), тремор, атрофию и слабость мышц, слабоумие, судороги и потерю способности глотать или говорить.Анализы крови, исследование спинномозговой жидкости, визуализационные исследования, электроэнцефалограммы и аналогичные диагностические исследования могут использоваться для дифференциации различных причин энцефалопатии.
Лечение
Лечение симптоматическое и варьируется в зависимости от типа и тяжести энцефалопатии. Ваш врач может дать конкретные инструкции по правильному уходу и лечению. Могут быть назначены противосудорожные препараты для уменьшения или прекращения судорог.Некоторым пациентам могут помочь изменения в диете и пищевых добавках. В тяжелых случаях может потребоваться диализ или операция по замене органа.
Прогноз
Лечение основной причины расстройства может улучшить симптомы. Однако энцефалопатия может вызвать необратимые структурные изменения и необратимые повреждения головного мозга. Некоторые энцефалопатии могут быть фатальными.
Исследования
NINDS поддерживает и проводит исследования болезней мозга.Большая часть этого исследования направлена на характеристику агентов, вызывающих эти расстройства, выяснение механизмов, лежащих в их основе, и, в конечном итоге, поиск способов их предотвращения, лечения и лечения.
границ | Острая некротическая энцефалопатия детства: многоцентровый опыт в Саудовской Аравии
Введение
Острая некротическая энцефалопатия у детей (ANEC) — это молниеносный тип энцефалопатии. Большинство зарегистрированных случаев встречается у азиатских детей с самой высокой распространенностью среди пациентов в возрасте от 6 до 18 месяцев (1).Наиболее частыми клиническими проявлениями являются лихорадка, быстрое изменение уровня сознания и судороги, в дополнение к характерным находкам при визуализации головного мозга, которые включают, помимо прочего, двусторонние таламические поражения с над- и инфра-тенториальными поражениями различных размеров ( 2). Диагноз ANEC был определен с помощью определенных диагностических критериев, описанных Mizuguchi (1), которые включают (1) энцефалопатию, которой предшествует вирусная лихорадка с быстрым ухудшением уровня сознания и судорогами.(2) Отсутствие плеоцитоза спинномозговой жидкости (ЦСЖ). (3) Симметричные мультифокальные поражения головного мозга. (4) Повышение уровня аминотрансферазы в сыворотке. (5) Исключение подобных заболеваний. Наиболее частая этиология связана с вирусами, но сообщалось о спорадических случаях невирусного ANEC (3). Вирус гриппа играет важную роль в возникновении ANEC. В 1994 году было замечено, что количество случаев ANEC в Японии увеличилось после прекращения вакцинации против гриппа в том же году (4). Ранее было замечено, что ANEC, ассоциированный с гриппом, характеризуется увеличением концентрации цитокинов в сыворотке (интерлейкин-6 и интерлейкин-10) по сравнению с контролем (5).Связь между патогенными вариантами гена RANBP2 и восприимчивостью к ANEC рассматривалась в предыдущих исследованиях (6-8). В этом исследовании мы стремились представить клинические и радиологические особенности, а также методы лечения и результаты у 12 детей с ANEC после вирусной инфекции в пяти центрах третичной медицинской помощи в Саудовской Аравии.
Методы
Это был ретроспективный обзор пациентов, которым был поставлен диагноз ANEC в пяти специализированных центрах Королевства Саудовская Аравия с января 2015 года по октябрь 2018 года.Диагноз ANEC был установлен на основании специфических данных, предложенных Mizuguchi (1) и Mizuguchi et al. (2). Мы включили пациентов в возрасте до 18 лет с клиническими признаками, соответствующими ANEC в виде измененного уровня сознания и судорог, которым предшествовало вирусное заболевание, с типичными результатами магнитно-резонансной томографии головного мозга (МРТ) ANEC, которые включают симметричный, мультифокальный мозг. поражения, затрагивающие в основном оба таламуса. Были собраны клинические характеристики и рентгенологические характеристики, а также лабораторные исследования.Другие дифференциальные диагнозы были исключены на основании клинических и рентгенологических особенностей, а также метаболического скрининга. У всех пациентов был нормальный уровень аммиака в сыворотке, нормальный базовый метаболизм, включая лактат сыворотки, аминокислоты и мочу на содержание органических кислот. Мы описали результат на основании контрольных посещений в неврологических клиниках. Необходимость получения информированного согласия была отменена для ретроспективного обзора историй болезни.
Статистический анализ
Среднее стандартное отклонение использовалось для описания непрерывных переменных, категориально измеряемые переменные описывались с использованием частоты и процента.Тест корреляции Пирсона (r) использовался для оценки корреляции между непрерывными переменными и точным критерием Фишера, а тесты хи-квадрат использовались для оценки корреляции между категориально измеряемыми переменными. Анализ дихотомии множественного ответа использовался для оценки совокупной частоты различных признаков и симптомов и представления жалоб пациентов с диагнозом ANEC во время госпитализации из-за возможности появления различных комбинаций симптомов и признаков.
Исследование было одобрено институциональным наблюдательным советом и этическим комитетом Медицинского колледжа Университета короля Сауда, Эр-Рияд, Королевство Саудовская Аравия (номер KSU-IRB 18/0683).
Результаты
Клиническая картина и радиологические особенности
Всего было идентифицировано 14 пациентов с ANEC; два пациента были исключены из-за невозможности соответствовать радиологическим критериям ANEC. Возраст пациентов варьировал от 10 месяцев до 6 лет (средний 30,92 месяца, медиана 22 месяца, стандартное отклонение 20.63). Девять пациентов (75%) были женщинами. Все пациенты имели предшествующее лихорадочное заболевание в виде симптомов инфекции верхних дыхательных путей (ИВДП) или желудочно-кишечные симптомы в виде рвоты или диареи, а также изменение уровня сознания. Судороги были первичным проявлением в восьми случаях (66,7%). Визуализация головного мозга выполнялась с использованием аксиальных, сагиттальных и коронарных T1, T2, FLAIR, диффузионных изображений и изображений, взвешенных по восприимчивости, которые показали характерную высокую интенсивность сигнала на аксиальном T2 и FLAIR с различной степенью поражения обоих таламусов во всех случаях.Также было замечено ограничение диффузии, в то время как последовательность восприимчивости показывала интенсивность темного сигнала с цветением, что указывало на геморрагические изменения. Из 12 пациентов пять (41,7%) имели поражение ствола мозга. Последующие МРТ головного мозга были выполнены через 2–3 месяца после первичного обращения, которые показали признаки улучшения у 33,3%, а 66,7% ( n = 8) не показали никаких признаков улучшения. Клинические и рентгенологические данные приведены в таблицах 1, 2. На рисунках 1–4 показаны МРТ головного мозга отобранных пациентов.
Таблица 1 . Клиническая характеристика и рентгенологические особенности пациентов ( n = 12).
Таблица 2 . Клиническая характеристика и рентгенологические особенности пациентов.
Рисунок 1 . МРТ головного мозга. Осевые T2 (A) , FLAIR (B) , диффузионные (C, D) и восприимчивые (E) взвешенные изображения. Набухание и аномально высокая интенсивность сигнала таламуса (A, B) с ограничением диффузии (C, D) и интенсивность темнового сигнала с цветением (E) .
Рисунок 2 . МРТ головного мозга. Осевое T2 (A, B) , диффузное (C, D) и восприимчивость (E) взвешенных изображений. Наблюдаются припухлость и аномально высокая интенсивность сигнала моста, двустороннего белого вещества мозжечка (A) , обоих таламусов и двусторонней скорлупы (B) с ограничением диффузии (C, D) и интенсивностью темного сигнала с наведением в области мост (E) .
Рисунок 3 .МРТ головного мозга. Осевой T2 (A – C) и диффузный (D – F) , демонстрирующие набухание и аномально высокую интенсивность сигнала моста, двусторонней внешней капсулы и субостровной коры, а также обоих таламусов с ограничением диффузии.
Рисунок 4 . Осевой T2 (A – C) и FLAIR (D – F) демонстрирует отек и аномально высокую интенсивность сигнала как таламуса, так и базальных ганглиев и мозжечка.
Лабораторные исследования
Все пациенты имели предшествующее вирусное заболевание.Носоглоточный аспират (NPA) был положительным на грипп A у 6 (50% пациентов), тогда как у одного пациента был аденовирус, а у остальных (5 пациентов) не было выделенных вирусных агентов. Тест полимеразной цепной реакции спинномозговой жидкости на грипп A, энтеровирусы и вирус простого герпеса дал отрицательный результат у 10 обследованных пациентов.
Пациенты показали различные результаты общего анализа крови (ОАК). У пяти пациентов (41,7%) была легкая обратимая тромбоцитопения и у трех развился лейкоцитоз. Высокий уровень ферментов печени при первичном обращении был обнаружен у 66 пациентов.7% пациентов. У всех пациентов уровень аммиака в сыворотке был нормальным. Основные метаболические исследования, включая сывороточные аминокислоты, органическую кислоту в моче и лактат сыворотки, были нормальными. Тестирование спинномозговой жидкости проводилось у всех пациентов, кроме двух из них из-за гемодинамической нестабильности. Пациенты, прошедшие тестирование спинномозговой жидкости, имели нормальное количество клеток. Бактериологические исследования культур были отрицательными, вирус гриппа и другие вирусы, такие как вирус простого герпеса и вирус герпеса-6 человека, не были выделены в спинномозговой жидкости, включая пациентов с положительным результатом теста носоглоточной аспирации (NPA) на грипп А.Уровни глюкозы и белка в спинномозговой жидкости варьировали от 3,2 до 5,6 ммоль / л и от 0,19 до 1,65 г / дл соответственно. Результаты лабораторных исследований представлены в таблице 3.
Таблица 3 . Лабораторные исследования.
Генетическое тестирование
Генетическое тестирование было проведено у пяти пациентов [полное секвенирование экзома (WES) у трех и прямое секвенирование гена у двух пациентов]. Другим пациентам генетическое тестирование не проводилось либо из-за ограниченного доступа к генетическому тестированию, либо из-за раннего ухудшения состояния и смерти у других.Для пациентов с WES результат был отрицательным, в то время как секвенирование одного гена для гена RANBP2 выявило миссенс-гетерозиготный вариант у двух пациентов [c.3363G> T, p. (Lys1121Asn) и c.128A> T, стр. (Asp43Val)]. Оба варианта были классифицированы как вариант с неопределенной значимостью в соответствии с рекомендациями Американского колледжа медицинской генетики (ACMG).
Лечение и результаты
Все пациенты изначально получали антибиотики (в основном ванкомицин и цефтриаксон) и противовирусную терапию (ацикловир).Внутривенный метилпреднизолон в дозе 30 мг / кг в день в течение 3 дней и внутривенный иммуноглобулин (ВВИГ) в дозе 1 г / кг в день в течение 2 дней вводили на ранних стадиях заболевания (в течение 72 часов от начала заболевания) в 10 случаях (83,3%). ). Остальные два пациента не получали эту схему из-за быстрого ухудшения состояния и ранней смерти в течение первых 48 часов. Снижение дозы пероральных стероидов применялось у шести пациентов (50%). Плазмаферез (PLEX) был опробован у двух пациентов, у которых не было значительного улучшения.Все пациенты прошли физиотерапию и логопед с вариативным ответом.
Таблица 4 обобщает полученное лечение. В наших случаях результаты были разными. У пяти пациентов улучшились двигательные и когнитивные функции; у двух пациентов была дистония, у двух пациентов была задержка речи, а у трех пациентов (25%) была ранняя смерть. Девять из 12 пациентов выжили; все выжившие получали комбинацию IVIG и метилпреднизолона внутривенно. Два пациента, которые не получали эту комбинацию терапии, умерли.Однако статистическая значимость не может быть установлена из-за необычности измеряемых переменных из-за небольшого размера выборки. В таблице 5 представлены прогнозы и окончательные результаты. Выживаемость была значительно связана с использованием комбинации ВВИГ и метилпреднизолона внутривенно ( P = 0,043, точный критерий хи-квадрат Фишера), что показано в таблице 6.
Таблица 4 . Полученное лечение.
Таблица 5 . Прогноз и окончательные исходы: n = 12.
Таблица 6 . Двумерная связь между приемом IVIG и метилпреднизолона внутривенно с выживаемостью: ( n = 10).
Обсуждение
ANEC представляет собой молниеносный тип энцефалопатии, который первоначально был описан среди пациентов из Японии и Тайваня (2, 9). Считается, что ANEC имеет поведение, аналогичное поведению метаболических и иммуноопосредованных нарушений (10), но точная патофизиология все еще неизвестна. Он имеет несколько предполагаемых причин, включая предыдущую инфекцию, преимущественно грипп, вирус простого герпеса и вирус герпеса-6 человека (10–14).Чаще всего страдают дети младше 2 лет. Однако, как показано в этой серии, он также может повлиять на детей старшего возраста. В настоящем исследовании все пациенты имели предшествующее вирусное заболевание, что подтверждается клиническими проявлениями и вирусологическим скринингом.
Mizuguchi предложил конкретные критерии для постановки диагноза ANEC (1). Предложенные диагностические критерии соответствовали всем пациентам. Ягишита и др. (9) отметили, что пациенты с ANEC нередко имеют нормальное количество клеток в спинномозговой жидкости.Точно так же все пациенты в нашей ретроспективной серии имели нормальные показатели спинномозговой жидкости. В соответствии с предыдущими исследованиями, у всех пациентов наблюдались двусторонние таламические поражения с различным поражением других областей мозга, включая базальные ганглии, ствол мозга, белое вещество мозга и мозжечок. У всех наших пациентов уровень аммиака в сыворотке был нормальным, что является одним из критериев, предложенных в литературе и отмеченных в ранее описанных случаях (1, 9). Необходимо исключить дифференциальные диагнозы, такие как острый диссеминированный энцефаломиелит (ОДЭМ) и другие метаболические нарушения, такие как болезнь Ли, органическая ацидемия и синдром Рея (15).Пораженные пациенты с ANEC в этом исследовании были ранее здоровыми, и основные метаболические исследования были проведены с отрицательными результатами, включая отсутствие гипогликемии, гипераммонии и лактоацидоза, а также отрицательные результаты теста WES у трех протестированных пациентов. Помимо того, что ранее зарегистрированные случаи не имели повторных эпизодов (16). Синдром Рейе можно отличить от ANEC, поскольку первый сопровождается гипогликемией и гипераммонией и преимущественно развивается у пациентов, принимающих аспирин (17).
Множественные исследования показали связь между патогенными вариантами гена RANBP2 и повышенной чувствительностью к ANEC (6–8, 18–20). Ген RANBP2 расположен на хромосоме 2q12.1-q13 и является частью комплекса ядерных пор. Этот комплекс облегчает импорт и экспорт белка и играет важную роль в поддержании энергии нейронов (20, 21). В литературе описаны гетерозиготные патогенные варианты в гене RANBP2 и семейные или рецидивирующие ANEC, причем наиболее распространенным патогенным вариантом является миссенс, c.1754C> T, стр. (Thr585Met). Эти варианты наследуются по аутосомно-доминантному типу, и большинство из них имеют неполную пенетрантность. С другой стороны, были случаи, когда не было обнаружено вариантов RANBP2 и , что свидетельствует о существовании других предрасполагающих факторов (22, 23). В этом исследовании у обоих пациентов было вариантов гена RANBP2 и неопределенной значимости в соответствии с рекомендациями Американского колледжа медицинской генетики (ACMG).
Лечение ANEC недостаточно хорошо изучено и остается спорным.Предыдущее исследование показало, что раннее вмешательство в течение 24 часов после появления в / в введением метилпреднизолона 30 мг / кг / день в течение 5 дней или дексаметазона 0,6 мг / кг / день, разделенных на две-четыре дозы в течение 2-4 дней, было связано с хорошим прогнозом. , в то время как пациенты, получавшие лечение через 24 часа, имели худшие результаты. В том же исследовании у пациентов с поражением ствола мозга не наблюдалось значительного выздоровления. С другой стороны, введение ВВИГ не имеет значительной прогностической ценности (24). Несмотря на прогностическую ценность внутривенного введения метилпреднизолона в течение 24 часов с момента обращения, лечение ANEC остается проблематичным, поскольку врачи не решаются начинать лечение своих пациентов внутривенным введением метилпреднизолона на ранней стадии, поскольку состояние может имитировать герпетический энцефалит.Наличие характерных нейрорадиологических особенностей и первоначального отрицательного исследования спинномозговой жидкости может побудить лечащих врачей рассмотреть возможность назначения стероидов на ранней стадии заболевания. У девяти пациентов в нашем исследовании, получавших метилпреднизолон и внутривенный иммуноглобулин, были приемлемые результаты в отношении двигательных и психических функций во время последующего наблюдения. Однако для пациентов не проводилось стандартизированных измерений результатов. Выживаемость была значительно связана с использованием комбинации ВВИГ и метилпреднизолона внутривенно.Трудно судить об эффективности PLEX по двум пациентам. Прогноз ANEC обычно изменчив; однако многочисленные исследования показали улучшение со временем (15). Предполагается, что пациенты в возрасте до 2 лет с повышенным уровнем ферментов печени и поражением ствола мозга имеют худший прогноз (9, 25–28). Функциональные пробы печени не помогли определить жизненный прогноз. Уровни ферментов печени были от умеренного до умеренного повышены у умерших пациентов, в то время как в одном случае прогноз был лучше, несмотря на значительно более высокие уровни аминотрансферазы.Отек мозга и поражение ствола мозга, зарегистрированные у пяти наших пациентов, привели к различным результатам, в то время как степень тяжести поражения ствола мозга может играть важную роль в определении прогноза.
Ограничения исследования
Это исследование имеет некоторые ограничения. Во-первых, это было ретроспективное исследование, которое не позволило нам определить причинно-следственную связь между тестируемыми параметрами и прогнозом ANEC или иметь стандартизованные критерии оценки результатов. Во-вторых, размер выборки был небольшим, что ограничивало статистический анализ и обобщение результатов.В-третьих, мы не смогли провести функциональные исследования найденного варианта RANBP2 , и не было других данных, подтверждающих патогенность.
Заключение
АНЕК — редкое молниеносное заболевание. Оптимизация лечения, как правило, является сложной задачей, но раннее распознавание и вмешательство, а также раннее использование ВВИГ и метилпреднизолона могут помочь улучшить результаты. Необходимы дальнейшие исследования для выработки единого руководства по ведению таких случаев.
Заявление о доступности данных
Данные, проанализированные в этом исследовании, подлежат следующим лицензиям / ограничениям: они доступны по запросу.Запросы на доступ к этим наборам данных следует направлять Фахаду А. Башири, [email protected].
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены Медицинским колледжем Университета короля Сауда, Эр-Рияд, Королевство Саудовская Аравия (номер KSU-IRB 18/0683). Письменное информированное согласие законного опекуна / ближайшего родственника участников не требовалось для участия в этом исследовании в соответствии с национальным законодательством и институциональными требованиями.
Авторские взносы
Все перечисленные авторы внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее к публикации.
Финансирование
MS был поддержан номером проекта поддержки исследователей (RSP-2019/38), Университет короля Сауда, Эр-Рияд, Саудовская Аравия.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Мидзугути М. Острая некротическая энцефалопатия у детей: новая форма острой энцефалопатии, распространенная в Японии и на Тайване. Мозг Дев . (1997) 19: 81–92. DOI: 10.1016 / S0387-7604 (96) 00063-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Мидзугути М., Абэ Дж., Миккаичи К., Нома С., Йошида К., Яманака Т. и др. Острая некротизирующая энцефалопатия у детей: новый синдром, проявляющийся мультифокальными симметричными поражениями головного мозга. J Neurol Neurosurg Psychiatry . (1995) 58: 555–61. DOI: 10.1136 / jnnp.58.5.555
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Синджох М., Бамба М., Джозаки К., Такахаши Э., Коинума Г., Сугая Н. Энцефалопатия, связанная с гриппом А, с двусторонним таламическим некрозом в Японии. Клин Инфекция Дис . (2000) 31: 611–3. DOI: 10.1086 / 313978
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Сугая Н. Энцефалопатия, связанная с гриппом, в Японии. Семинар Педиатр Инфекция Дис . (2002) 13: 79–84. DOI: 10.1053 / spid.2002.122993
CrossRef Полный текст | Google Scholar
5. Ичияма Т., Эндо С., Канеко М., Исуми Х., Мацубара Т., Фурукава С. Концентрации цитокинов в сыворотке крови при острой некротической энцефалопатии, связанной с гриппом. Педиатр Интерн. . (2003) 45: 734–6. DOI: 10.1111 / j.1442-200X.2003.01822.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Денье С., Балу Л., Хассон Б., Нассер Г., Бурглен Л., Родригес Д. и др.Семейная острая некротическая энцефалопатия из-за мутации в гене RANBP2. J Neurol Sci . (2014) 345: 236–8. DOI: 10.1016 / j.jns.2014.07.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Сингх Р.Р., Седани С., Лим М., Вассмер Э., Абсуд М. Мутация RANBP2 и острая некротическая энцефалопатия: 2 случая и обзор литературы о расширяющемся клинико-радиологическом фенотипе. евро J Педиатр Neurol . (2015) 19: 106–13. DOI: 10.1016 / j.ejpn.2014.11.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Ди Мелио С., Кано А., Милх М., Жирар Н., Бурглен Л., Шаброл Б. Постинфекционный семейный случай острой некротической энцефалопатии, вызванной мутацией гена RANBP2. Арх Педиатр . (2014) 21: 73–7. DOI: 10.1016 / j.arcped.2013.10.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Ягишита А., Накано И., Ушиода Т., Оцуки Н., Хасегава А. Острая энцефалопатия с двусторонним таламотегментальным поражением у младенцев и детей: результаты визуализации и патологии. Ам Дж. Нейрорадиол . (1995) 16: 439–47.
PubMed Аннотация | Google Scholar
10. Скелтон Б.В., Холлингсхед М.К., Следд А.Т., Филлипс С.Д., Кастильо М. Острая некротическая энцефалопатия у детей: типичные признаки атипичного заболевания. Педиатр Радиол . (2008) 38: 810–3. DOI: 10.1007 / s00247-008-0823-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Ито Й, Ичияма Т., Кимура Х., Шибата М., Ишивада Н., Куроки Х. и др.Обнаружение РНК вируса гриппа с помощью ПЦР с обратной транскрипцией и провоспалительных цитокинов при энцефалопатии, связанной с вирусом гриппа. J Med Virol . (1999) 58: 420–5. DOI: 10.1002 / (SICI) 1096-9071 (199908) 58: 4 <420 :: AID-JMV16> 3.0.CO
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Ананд Г., Висаган Р., Чандратре С., Сегал С., Немет А. Х., Сквайер В. и др. h2N1 вызвал рецидив острой некротической энцефалопатии в семье с мутацией T653I в гене RANBP2. Педиатр Инфекция Дис. J . (2015) 34: 318–20. DOI: 10.1097 / INF.0000000000000533
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Хуанг С.М., Чен С.К., Чиу П.С., Ченг М.Ф., Лай П.Х., Се К.С. Острая некротическая энцефалопатия в детском возрасте, связанная с инфекцией вируса гриппа B у 3-летней девочки. J Детский нейрол . (2004) 19: 64–7. DOI: 10.1177 / 088307380401
709
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14.Орловска Э., Тарновска-Дзидушко Э., Гайковски К. Случай острого некротического энцефалита, вызванного вирусом простого герпеса — клинико-морфологический анализ. Neurol Neurochir Pol . (1985) 19: 349–53.
PubMed Аннотация | Google Scholar
15. Ким Дж.Х., Ким И.О., Лим М.К., Парк М.С., Чой К.Г., Ким Х.В. и др. Острая некротическая энцефалопатия у корейских младенцев и детей: результаты визуализации и различные клинические результаты. Корейский J Радиол . (2004) 5: 171–7. DOI: 10.3348 / кдж.2004.5.3.171
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Киртон А., Буше К., Росс С., Уиррелл Э. Острая некротическая энцефалопатия у детей европеоидной расы: два случая и обзор литературы. J Детский нейрол . (2005) 20: 527–32. DOI: 10.1177 / 08830738050200061201
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Кампистол Дж., Гассио Р., Пинеда М., Фернандес-Альварес Э. Острая некротическая энцефалопатия у детей (детский двусторонний таламический некроз): два случая не японцев. Дев Мед Детский Нейрол . (1998) 40: 771–4. DOI: 10.1111 / j.1469-8749.1998.tb12346.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Loh NR, Appleton DB. Нелеченная рецидивирующая острая некротизирующая энцефалопатия, связанная с мутацией RANBP2, и нормальный исход у белого мальчика. Eur J Педиатр . (2010) 169: 1299–302. DOI: 10.1007 / s00431-010-1213-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Гика А.Д., Рич П., Гупта С., Нилсон Д.Е., Кларк А.Рецидивирующая острая некротическая энцефалопатия после гриппа А в семье с генетической предрасположенностью. Дев Мед Детский Нейрол . (2010) 52: 99–102. DOI: 10.1111 / j.1469-8749.2009.03405.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Neilson DE, Adams MD, Orr CM, Schelling DK, Eiben RM, Kerr DS, et al. Спровоцированные инфекцией семейные или повторяющиеся случаи острой некротической энцефалопатии, вызванные мутациями в компоненте ядерной поры, RANBP2. Ам Джам Генет . (2009) 84: 44–51. DOI: 10.1016 / j.ajhg.2008.12.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Cho KI, Yi H, Desai R, Hand AR, Haas AL, Ferreira PA. RANBP2 представляет собой аллостерический активатор обычного моторного белка кинезина-1, KIF5B, в минимальной бесклеточной системе. EMBO Rep . (2009) 10: 480–6. DOI: 10.1038 / embor.2009.29
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Окумура А., Мидзугути М., Кидокоро Х., Танака М., Абэ С., Хосоя М. и др.Исход острой некротической энцефалопатии в связи с лечением кортикостероидами и гаммаглобулином. Мозг Дев . (2009) 31: 221–7. DOI: 10.1016 / j.braindev.2008.03.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Сан-Миллан Б., Тейджейра С., Пенин С., Гарсиа Дж. Л., Наварро С. Острая некротическая энцефалопатия детства: отчет о случае в Испании. Педиатр Нейрол . (2007) 37: 438–41. DOI: 10.1016 / j.pediatrneurol.2007.07.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Мастроянни С.Д., Гионнис Д., Вудрис К., Скардуцу А., Мизугучи М. Острая некротическая энцефалопатия у детей неазиатского происхождения: отчет о трех случаях и обзор литературы. J Детский нейрол . (2006) 21: 872–9. DOI: 10.1177 / 08830738060210101401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эпилептическая энцефалопатия у детей с факторами риска повреждения головного мозга
В исследовании 887 новорожденных с пренатальными и перинатальными факторами риска повреждения головного мозга, 11 детей с синдромом Веста, который прогрессировал в синдром Леннокса-Гасто, и еще 4 ребенка с синдромом Леннокса-Гасто. Обнаружен синдром Гасто, которому не предшествовал синдром Веста.В этом исследовании мы представляем основные результаты этих 15 субъектов. У всех младенцев выявлены многофакторные антецеденты. Наиболее частыми факторами риска были недоношенность и тяжелая асфиксия; однако часто наблюдались нарушения плаценты, сепсис и гипербилирубинемия. У всех младенцев МРТ наблюдались прямые или вторичные признаки перивентрикулярной лейкомаляции. Последующее наблюдение за всеми младенцами показало задержку нервного развития от умеренной до тяжелой, а также церебральный паралич. Сделан вывод о том, что пренатальные и перинатальные факторы риска повреждения головного мозга являются очень важными предпосылками, которые следует принимать во внимание при наблюдении за такими младенцами с раннего возраста, чтобы как можно раньше выявлять и лечить эпилептическую энцефалопатию.
1. Введение
Концепция эпилептической энцефалопатии включает в себя представление о том, что эпилептическая активность сама по себе может способствовать серьезным когнитивным и поведенческим нарушениям сверх того, что можно было бы ожидать только от основной патологии, и что они могут ухудшаться со временем [1] . Хотя энцефалопатические эффекты судорог и эпилепсии могут потенциально возникать в связи с любой формой эпилепсии, синдром Веста и синдром Леннокса-Гасто (LG) являются яркими примерами этой концепции.Синдром Веста — это трудноизлечимый эпилептический синдром, характеризующийся эпилептическими спазмами и гипсаритмией, которые часто связаны с задержкой развития. Этот синдром может развиться в синдром LG. Синдром LG характеризуется тяжелыми, трудноизлечимыми, смешанными типами приступов, умственной отсталостью и медленными всплесками и волнами (1,5–2,5 Гц) на ЭЭГ [2].
В этом исследовании нам было интересно представить частоту возникновения синдрома LG в нашей когорте детей, которые были конкретно вовлечены, потому что они представляют пренатальные и перинатальные предшественники факторов риска повреждения головного мозга и сообщают о клинических, электроэнцефалографических и магнитно-резонансных изображениях ( МРТ).
2. Материалы и методы
Протокол был одобрен Комитетом по этике исследований Института нейробиологии Национального автономного университета Мексики и соответствует этическим принципам медицинских исследований с участием людей, установленным Хельсинкской декларацией.
2.1. Пациенты
За период с 2003 по 2011 гг. Нами обследовано 887 новорожденных. По нашим данным, мы обнаружили 11 детей с синдромом Веста, у которых прогрессировал синдром LG.Также были обнаружены еще 4 ребенка с синдромом LG, которому не предшествовал синдром Веста. Всего было выбрано 15 детей, из них 8 мальчиков. Средний гестационный возраст составлял 35,46 + 4,17 недели в диапазоне от 28 до 40 недель. Все дети, поступившие из разных больниц города Керетаро, обращались в наше отделение, поскольку у них были факторы риска перинатального повреждения головного мозга.
2.2. Клиническое обследование детским неврологом-экспертом
Неврологическая оценка первого исследования проводилась в соответствии с неврологическими критериями Amiel-Tison [3, 4].За детьми наблюдали ежемесячно в течение первого года, каждые 4 месяца в течение второго года, а затем каждые 6 месяцев.
2.3. Психологическая оценка
2.3.1. Оценка развития Bayley II
Этот тест предназначен для оценки развития детей в возрасте от 1 до 42 месяцев. У него 3 балла: ментальная, психомоторная и поведенческая. Эти баллы используются для определения успеваемости ребенка по сравнению с нормами, взятыми у типично развивающихся детей их возраста (в месяцах) [5, 6].
Через 42 месяца использовались другие тесты: дошкольное учреждение Векслера и начальная шкала интеллекта (WPPSI), подходящая до 7 лет [7].
2.3.2. Записи ЭЭГ
Исследование проводилось в плохо освещенной звукоизолированной комнате. Во время записи каждый ребенок оставался на коленях у матери и носил шапочку из полиэстера с поверхностными электродами, распределенными в соответствии с Международной системой 10–20 (Fp1, Fp2, F3, F4, C3, C4, P3, P4, O1, O2, F7, F8. , T3, T4, T5, T6, Fz, Cz, Pz). Сопротивление было не более 5000 Ом.ЭКГ и ЭМГ записывались одновременно. Референтные записи ЭЭГ были сделаны во время спонтанного сна в течение 20-минутного интервала с использованием связанных мочек ушей в качестве эталона. Цифровой электроэнцефалограф (Medicid 4) использовался с усилением 20000, полоса пропускания усилителя была установлена от 0,5 до 100 Гц, а частота дискретизации составляла 200 Гц. Четыре записи ЭЭГ были получены на первом году жизни, две — на втором году жизни и одна — в трех, четырех и пятилетнем возрасте.
2.3.3. Исследования МРТ
Сканы были получены с использованием 1.0-T Philips Intera в осевых плоскостях для получения последовательностей T1W, T2W, PDW, T2 FLAIR и T2-EPI. Данные T1W, T2W и PDW также были получены в аксиальных, коронарных и сагиттальных срезах. Лицензированный детский радиолог проверил все снимки МРТ и поставил радиологический диагноз. Были произведены измерения объемов мозолистого тела и боковых желудочков. Эти значения сравнивались с нормативными значениями нашей базы данных. Эта нормативная база данных была получена из МРТ 313 здоровых младенцев в возрасте от 0 до 38 месяцев (неопубликованные результаты).
3. Результаты
Из 887 младенцев с предшествующими факторами риска повреждения головного мозга 15 соответствовали критериям синдрома Веста, а позже 11 из этих 15 имели синдром LG, поэтому 15/887 (1,69%) были распространены синдром Веста. Другая группа состояла из 4 детей, дебютировавших с синдромом LG, которому не предшествовал синдром Веста. Таким образом, у 15 детей был диагностирован синдром ЛГ.
3.1. Факторы риска
Все дети имели пренатальный и перинатальный анамнез факторов риска повреждения головного мозга.У всех детей было более одного фактора риска. В таблице 1 показано количество детей, представляющих каждый фактор. Недоношенность и тяжелая асфиксия (у 3 новорожденных с остановкой сердечно-сосудистой системы) были наиболее частыми факторами.
| ||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Клинические особенности
Гипоксическая ишемическая энцефалопатия наблюдалась у 3 детей (20%), микроцефалия — у 4 (27%) и гидроцефалия — у 4 (27%). У двух детей была билирубиновая энцефалопатия (13%), а у одного — легочная гипертензия (7%). В дальнейшем церебральный паралич наблюдался у всех детей.
Типы эпилептических припадков
В таблице 2 показано количество субъектов, у которых были разные типы припадков. У детей с синдромом Веста наблюдалось много различных типов, из которых наиболее частыми были эпилептические спазмы, в то время как в группе LG наблюдались миоклонические припадки.
3.3. Психологические исследованияДесять детей показали серьезную задержку психомоторного развития и 5 детей — умеренную задержку психомоторного развития. 3.4. Результаты ЭЭГСреднее количество записей ЭЭГ было 9 в обеих группах. У каждого ребенка с синдромом Веста была гипсарритмия, а у двоих из них также были аномальные очаговые медленные волны. Средний возраст начала гипсаритмии составлял 8,18 месяцев (SD = 2,7, диапазон возраста = 4–12 месяцев), в то время как признаки синдрома LG на ЭЭГ начинались примерно в 3 года (среднее значение = 2,95 года, SD = 0,87, интервал возраста 2–5 лет). Рассматривая все ЭЭГ, полученные у каждого ребенка в обеих группах, было замечено, что все показали одиночные спайки, множественные спайковые комплексы, комплексы спайк-волна, комплексы медленных спайк-волн и комплексы полиспайк-волна.Частота комплексов спайк-волны и острой волны составляла от 1,0 до 2,5 Гц. Резкие волны наблюдались у 11 детей. Трое из 15 детей продемонстрировали ритм набора, и разряды с подавлением вспышек, а также начальные очаговые разряды со вторичной генерализацией были относительно частыми в обеих группах. Организация сна в медленной фазе прогрессивно ухудшалась с возрастом. На рисунке 1 показаны ЭЭГ, записанные у одного младенца с синдромом Веста, который развился в синдром LG, на котором можно наблюдать гипсаритмию через 6 месяцев, а затем, через 4 года, генерализованные разряды медленных спайк-и остро-волновых комплексов ( около 1.0 Гц) и ритм набора. 3.5. МРТУ всех детей МРТ не соответствовала норме. Наиболее частым отклонением от нормы было наличие перивентрикулярной лейкомаляции (ПВЛ). Первичные признаки ПВЛ (наличие диффузных обширных интенсивностей на территории белого вещества и / или наличие макроскопических кист [8, 9]) наблюдались у 6 детей (3 кистозных). Кроме того, вторичные рентгенологические последствия ПВЛ, нерегулярно расширенные желудочки и атрофия мозолистого тела [8, 9] были обнаружены у 9 младенцев, таким образом, у всех детей были обнаружены признаки МРТ, совместимые с ПВЛ. Другие наблюдения МРТ: 3 ребенка с внутрижелудочковыми кровоизлияниями и 2 с перивентрикулярными кровоизлияниями, 3 с перекрестным диашизисом мозжечка, один с кровоизлияниями в мозжечок и один с инфарктом левой теменной кости. Церебральная атрофия наблюдалась у 6 детей, гидроцефалия — у 2 пациентов. Объемы мозолистого тела и боковых желудочков были измерены и сравнены с нормативными значениями, полученными у 313 здоровых младенцев в возрасте от 0 до 38 месяцев.Эти нормы были рассчитаны в нашем учреждении, что позволяет сравнивать с ними ценности конкретного предмета. Отклонения более или менее одного стандартного отклонения (SD) от среднего значения в зависимости от возраста имеют вероятность принадлежности к нормальной группе, равную или ниже 0,10, а отклонения более или менее 2 SD от среднего имеют вероятность принадлежности к нормальная группа равна или ниже 0,05. Значения, превышающие 1 или 2 стандартных отклонения (SD) от среднего значения в зависимости от возраста боковых желудочков, считаются умеренными или серьезными отклонениями от нормы.В случае мозолистого тела значения ниже 1 или 2 SD считаются умеренными или серьезными отклонениями от нормы. В таблице 3 представлены результаты этого анализа для всех детей в возрасте одного года и двух лет. Прежде всего, можно заметить, что объем мозолистого тела был тонким у 14 детей в возрасте одного года и всего в возрасте 2 лет (только у одного ребенка было отклонение от нормы). Правый боковой желудочек был сильно увеличен у 12 детей и у одного умеренно увеличен в возрасте одного года.Однако в 2 года у 14 детей был обнаружен сильно увеличенный правый желудочек. Левый желудочек в возрасте одного года имел серьезные отклонения от нормы у 12 детей в возрасте одного года и у 13 детей в возрасте 2 лет. Был только один ребенок с нормальными показателями обоих боковых желудочков в 1 и 2 года.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Память ухудшается, наблюдается усталость после физических нагрузок. Может проявляться неустойчивость, неуверенная походка, тошнота.
Память ухудшается, наблюдается усталость после физических нагрузок. Может проявляться неустойчивость, неуверенная походка, тошнота.