Что такое токсоплазмоз и чем он опасен
Понедельник, 13 Февраля 2017
Мало кто из нас задумывается о том, что обычный котёнок может стать причиной серьёзного заболевания, такого как токсоплазмоз. Как показывает медицинская практика, болезнь протекает практически бессимптомно, но приводит к тяжелейшим последствиям. Так, у беременных женщин, подвергшихся заражению, токсоплазмоз приводит к уродствам и нарушениям развития разных органов и систем плода, после чего, в большинстве случаев, ребёнок погибает внутри утробы матери.
Что такое токсоплазмоз?
Токсоплазмоз — паразитарное заболевание человека и животных, вызываемое микроорганизмом Toxoplasma gondii. Недуг поражает нервную систему, глаза, мышцы человека, приводит к увеличению лимфатических узлов, селезёнки, печени.
Впервые болезнь была выявлена в 1908 году.
Пути заражения
Можно выделить несколько способов передачи инфекции.
- От животных. Известно, что токсоплазмы и следы их активности обнаружены у 200 видов млекопитающих и 100 видов птиц. Инфицирование человека происходит вследствие контакта с больным животным.
- Вследствие употребления в пищу немытых овощей и фруктов, термически необработанного (недостаточно обработанного) мяса и яиц.
- Токсоплазмы могут попадать в кровь человека через открытые раны на коже (особенно в регионах с тёплым климатом).
- Внутриутробное заражение – от беременной женщины будущему ребёнку.
- Вследствие переливания крови или пересадки органов.

Наиболее распространённый путь заражения человека – контакт с домашними животными, преимущественно с кошками. В их организме происходит половое созревание и размножение паразита. Животные выделяют возбудителя с мочой, слюной, молоком, в виде цист во внешнюю среду с фекалиями. При этом цисты токсоплазм, которые находятся в мясных продуктах, недолго сохраняют свою жизнеспособность, быстро погибают при термической обработке или замораживании. А вот паразиты, попадающие во внешнюю среду с фекалиями, сохраняют свою жизнеспособность до 2 лет.
Клиническая картина
Выделяют врождённую и приобретённую форму болезни. О врождённом токсоплазмозе говорят в случаях, когда мать заразилась инфекцией в период беременности. Проявления заболевания зависят от срока беременности на момент инфицирования. В сроке от 2 до 24 недель, как правило, беременность самопроизвольно прерывается, или же возможно рождение ребёнка с грубейшими пороками развития.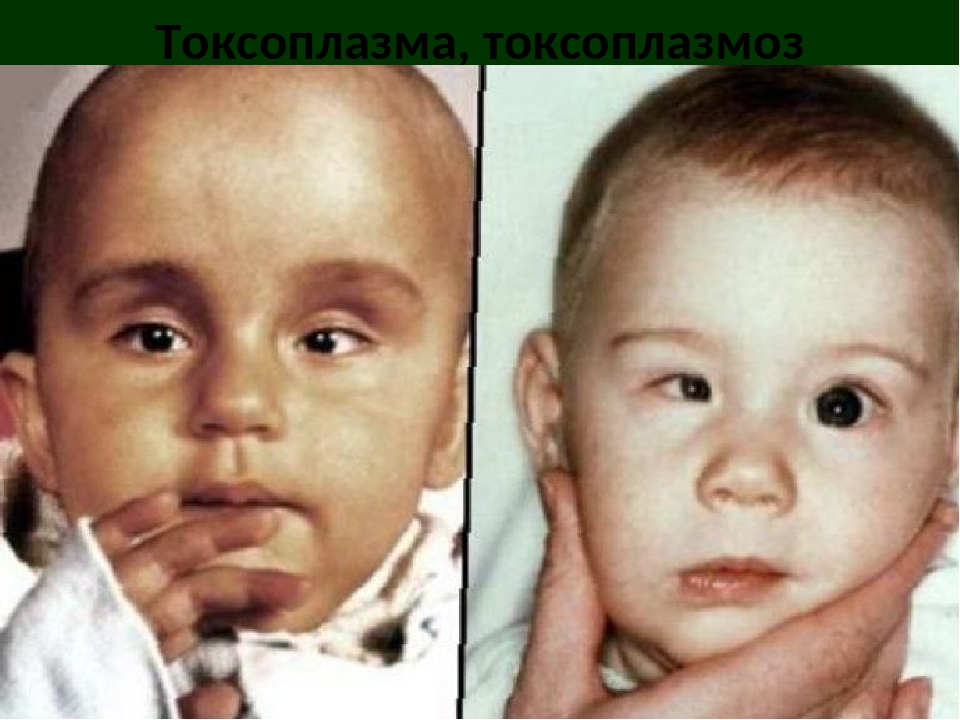
Приобретённый недуг имеет острую, хроническую и латентную форму. У большинства больных развивается хронический токсоплазмоз, который протекает без выраженных клинических проявлений. Острое течение заболевания встречается редко, в основном, у людей с низким иммунитетом. Латентные формы характеризуются тем, что даже при тщательном клиническом обследовании, признаков токсоплазмоза выявить не удаётся. Их диагностируют лишь с помощью серологических реакций или внутрикожной пробы с токсоплазмином.
Симптомы
Инкубационный период инфекции составляет от 3 до 21 дня, но может длиться и до нескольких месяцев.
Острое течение болезни характеризуется внезапным началом с выраженной симптоматикой интоксикации организма и лихорадкой, возможным увеличением печени и селезёнки. Иногда отмечаются кожные высыпания, признаки энцефалита и менингоэнцефалита.
Хроническому течению свойственно длительная вялотекущая картина. Общие симптомы включают субфебрилитет (повышение температуры тела на протяжении длительного времени в пределах 37,1 – 38°C), недомогание, мышечные и суставные боли, сбои в работе желудочно-кишечного тракта, центральной нервной и сердечно-сосудистой систем, нарушение зрительных и эндокринных функций организма.
Как отмечалось ранее, латентная форма плохо поддаётся диагностике и не проявляет себя. Подтвердить диагноз может лишь ПРЦ-исследования, либо внутрикожный тест на антитела к токсоплазмозу.
Врождённый токсоплазмоз в остром течении проявляется у малышей лихорадочным состоянием, интоксикацией, возможным присоединением механической желтухи, кожными высыпаниями и глазными патологиями, поражением мозга. В хронической стадии заболевание грозит тяжёлыми проявлениями воспалительных процессов в головном мозге – развитием у ребёнка умственной отсталости, водянки мозга, проявления приступов эпилепсии.
Осложнения
В основном, осложнения проявляются у пациентов с ослабленным иммунитетом и при врождённой форме болезни. Особенно тяжело её пациенты с ВИЧ-инфекцией и СПИДом. Им приходится лечиться на протяжении всей жизни. Чаще всего осложнения проявляются неврологическими нарушениями, полной, либо частичной слепотой, частичными парезами и параличом, эндокардитом, миокардитом и арахноидитом, пневмонией и инфекционно-токсическим шоком.
Лечение
Необходимо заметить, что применение методов народной медицины для лечения токсоплазмоза неприемлемо. Данное заболевание очень серьёзное и требует специализированного комплексного подхода.
Лечение приобретённого токсоплазмоза проводится только в том случае, если болезнь протекает в острой форме и имеет ярко выраженные признаки. В случаях с врождённой формой болезни терапия применяется в обязательном порядке. Носителям инфекции, находящейся в хронической форме, лечение не требуется.
Профилактика
Избежать заражения токсоплазмозом очень просто, если соблюдать правила личной гигиены и культуру питания. А именно:
- тщательно мыть фруктов, овощи и зелень,
- употреблять в пищу достаточно термически обработанные мясные блюда и яйца,
- мыть руки после земельных работ и ухода за животными,
- уничтожать мух, тараканов и грызунов, которые могут переносить цисты паразитов.
Особенно эти правила актуальны при беременности. Также с целью предупреждения врождённого токсоплазмоза, женщинам, планирующим завести ребёнка, необходимо пройти обследование на токсоплазмоз трижды.
Ю.С. Корепанова, врач-эпидемиолог
Токсоплазмоз. Чем опасен?
Токсоплазмоз. Чем опасен?
Токсоплазмоз относится к паразитарным заболеваниям, который имеет повсеместное распространение среди людей и животных.
В группе риска находятся беременные женщины, так как плацента пропускает через себя токсоплазму и таким образом, может наступить инфицирование плода, которое приведет к врожденному токсоплазмозу у будущего ребенка.
Опасность развития инфекционного процесса возникает в случае первичного инфицирования женщины во время беременности, в результате чего становится возможным поражение плода и ребенка. Риск инфицирования женщины в период беременности очень большой, так как более 70% девушек к началу детородного периода еще не имеют антител к токсоплазме. В среднем за время беременности инфицируется от 1 до 7-8 из 1000 беременных. Врожденный токсоплазмоз чаще проявляется поражением мозга (менингоэнцефалит), глаз (хореоретинит), лимфатических узлов и реже поражением паренхиматозных органов.
В последние десятилетия актуальность проблемы токсоплазмоза возросла в связи с ростом заболеваемости населения ВИЧ-инфекцией на 73,4% (с 16,02 в 2006 году до 60,26 в 2015 году на 100 тысяч населения) в Российской Федерации.
Активизация врожденного токсоплазмоза возможна в любом возрасте, нарастающая гидроцефалия может обнаружиться к концу первого года жизни, в 3-7 лет у инфицированных детей развиваются неврологические отклонения, отставания в психическом развитии, глухота, эндокринные нарушения.
Как предотвратить заболевание?
- Гигиена!!!! Мойте руки перед едой.
- Разделывайте сырое мясо в перчатках. Не пробуйте «на соль» сырой фарш. Хорошо прожаривайте и проваривайте мясо. Откажитесь от бифштексов с кровью, хотя бы на время беременности.
- Тщательно мойте овощи и фрукты.
- Если у вас никогда не было кошек, а вы планируете беременность, не стоит заводить животных в это время.
- Если кошка в доме есть: поручите уборку лотка домочадцам, либо проводите в перчатках сразу после испражнения животного. Помните, что токсоплазмы живут и размножаются в старых фекалиях. Также возбудители могут присутствовать в слюне и выделениях из носа кошки и собаки.

- Планируете беременность: сдайте анализ крови на определение токсоплазмоза (наличие иммуноглобулинов класса М и G). Опасно первичное заражение токсоплазмозом (Ig М+ при Ig G-).
Токсоплазмоз — БУ «Нижневартовская городская поликлиника»
Токсоплазмоз — это паразитарное заболевание, характеризующееся поражением нервной системы, глаз, скелетной мускулатуры и мышцы сердца, а также увеличением лимфоузлов, печени и селезенки. Склонно к хроническому течению.
Токсоплазмой инфицированы от 50 до 80% взрослого населения.
Факторы, которые могут способствовать появлению в организме паразита и повышают риск возникновения токсоплазмоза:
- контакт с заражёнными животными;
- использование в быту немытых после уборки кошачьего туалета или любого другого контакта с кошачьими экскрементами рук;
- употребление в пищу сырого или не до конца приготовленного мяса, особенно свинины, говядины, мяса ягнёнка или оленины;
- контакт с сырым или непрожаренным (непроваренным) мясом;
- заражение токсоплазмозом матери в период вынашивания беременности (передача инфекции плоду)
У большинства зараженных нет клинических проявлений заболевания. У части больных наблюдается вялотекущие хронические формы и крайне редко — острые, с тяжелым течением заболевания. При внутриутробном заражении в первые месяцы беременности часто происходит выкидыш и гибель плода. Не исключается возможность внутриутробных уродств плода и рождения детей с дефектами развития. Если заражение произошло в поздние сроки беременности, рождается ребенок с генерализованным токсоплазмозом.
У части больных наблюдается вялотекущие хронические формы и крайне редко — острые, с тяжелым течением заболевания. При внутриутробном заражении в первые месяцы беременности часто происходит выкидыш и гибель плода. Не исключается возможность внутриутробных уродств плода и рождения детей с дефектами развития. Если заражение произошло в поздние сроки беременности, рождается ребенок с генерализованным токсоплазмозом.
Приобретенный токсоплазмоз.
Продромальный период с общим недомоганием, мышечными и суставными болями — обычно несколько недель, иногда месяцев. Острая стадия заболевания проявляется повышением температуры, ознобом, лимфоаденопатией. Появляется генерализованнаямакулопапулезная сыпь, отсутствующая только на подошвах, ладонях, волосистой части головы. Наряду с общими признаками инфекционного заболевания имеется клиническая картина поражения различных органов: миокардит, пневмония, очаговый некротический нефрит, гепатит. Поражение нервной системы проявляется менингитом, энцефалитом, менингоэнцефалитом, энцефаломиелитом. Редко наблюдаются радикулоневритическая и малосимптомная формы (последняя может быть обнаружена лишь с помощью серологических реакций).
Редко наблюдаются радикулоневритическая и малосимптомная формы (последняя может быть обнаружена лишь с помощью серологических реакций).
Острый токсоплазмоз характеризуется внезапным началом, лихорадкой, явлениями общей интоксикации. У больных отмечаются лимфаденопатия, макулопапулезная сыпь, увеличиваются печень, селезенка. Могут развиться признаки энцефалита, менингоэнцефалита и миокардита.
Хронический токсоплазмоз длительным течением, при котором наблюдаются периоды обострения и ремиссии. Основные клинические симптомы — интоксикация, субфебрилитет, миалгии, артралгии. У больных отмечаются раздражительность, снижение памяти, невротические реакции. Частым симптомом является генерализованнаялимфаденопатия (увеличение лимфатических узлов всех групп). Вследствие мезаденита возникают ноющие боли и вздутие живота, запор, тошнота. К числу важных симптомов заболевания относятся специфический миозит (в толще мышц иногда можно прощупать уплотнения и даже кальцификаты) и миокардит. У многих больных обнаруживают признаки вегето-сосудистой дистонии, эндокринные нарушения (расстройства менструального цикла, импотенция, вторичная надпочечниковая недостаточность и др.). Нередко встречается поражение глаз в форме хориоретинита, ретинита, увеита.
У многих больных обнаруживают признаки вегето-сосудистой дистонии, эндокринные нарушения (расстройства менструального цикла, импотенция, вторичная надпочечниковая недостаточность и др.). Нередко встречается поражение глаз в форме хориоретинита, ретинита, увеита.
Врожденный токсоплазмоз.
Инфекция, перенесенная до беременности, женщинам в положении уже не страшна – к ней сформирована иммунная защита.
При заболевании матери токсоплазмозом в первой половине беременности плод, как правило, погибает вследствие несовместимых с жизнью пороков развития. При инфицировании матери во второй половине беременности ребенок рождается с тяжелым поражением мозга. Для врожденного токсоплазмоза характерна триада признаков: гидроцефалия, хориоретинит и интрацеребральныекальцификаты.
Дети с врожденным токсоплазмозом отстают в умственном развитии вплоть до олигофрении. У них наблюдаются также разнообразные психотические состояния (депрессия, психомоторное возбуждение, галлюцинации, кататония).
Диагностика Токсоплазмоза:
Диагноз токсоплазмоза устанавливают на основании комплекса показателей, которые включают клинические данные и результаты лабораторного подтверждения. Относительное значение имеют эпидемиологические предпосылки, такие как контакт с кошками, условия общения с ними, особенности пищевых привычек (употребление сырого, полусырого мяса, проба сырого фарша, немытых овощей, фруктов), соблюдение личных гигиенических навыков, профессия и др.
Чрезвычайное многообразие клинических проявлений, отсутствие симптомов, характерных только для токсоплазмоза, затрудняет клиническую диагностику и позволяет в определенных случаях только предположить диагноз, который формируется при проведении полноценной дифференциальной диагностики и при анализе результатов лабораторного исследования.
ИФА в соответствии с ориентацией на международный стандарт ВОЗ является наиболее объективным методом. О положительной реакции свидетельствуют оптические показатели более 1,5, в иммуноферметных единицах — больше 60; в международных — больше 125, в титрах антител — 1:1600 и больше.
Своеобразной нормой анализа на токсоплазмоз считается обнаружение антител (Ig) в крови с антигеном «G» — (IgG). Что свидетельствует о перенесенной ранее инфекции и о наличии к ней иммунитета.
Лечение Токсоплазмоза:
Зараженный человек не опасен для окружающих, так как не выделяет возбудителя во внешнюю среду и не передает ее при интимной близости. К тому же, не всех зараженных обязательно необходимо лечить. Если пораженный токсоплазмозом организм человека обладает сильным иммунитетом — он мало уязвим.
Профилактика инфицирования
Профилактика инфицирования токсоплазмами заключается в употреблении в пищу только хорошо термически обработанного мяса и мясопродуктов, чисто вымытых овощей, фруктов и ягод. В процессе приготовления пищи запрещается пробовать на вкус сырой мясной фарш. Необходимо тщательно мыть руки после обработки сырых мясопродуктов, работе в саду, огороде, детям после игры на детской площадке и, особенно, в песочнице. Следует тщательно соблюдать санитарно-гигиенические правила содержания в квартире домашних животных, не забывая мыть руки после контактов с ними.
Следует тщательно соблюдать санитарно-гигиенические правила содержания в квартире домашних животных, не забывая мыть руки после контактов с ними.
При наступлении беременности каждая женщина должна быть обследована на токсоплазмоз в женской консультации. При выявлении у беременной клинических проявлений токсоплазмоза, а также обнаружение антител к токсоплазмам класса IgM, следует решить вопрос о необходимости лечения или прерывания беременности.
Количество просмотров: 1289
БУ «Сургутская городская клиническая поликлиника №2»
Токсоплазмоз
- Подробности
- Обновлено 22.02.2017
Токсоплазмоз
Токсоплазмоз принадлежит к классу паразитарных болезней. Он вызывает стойкие поражения многих органов и систем.
Однако, существует немало случаев, когда болезнь протекает абсолютно бессимптомно и не приносит серьезных осложнений.
Токсоплазмоз является очень распространенным заболеванием, практически у каждого второго взрослого человека в крови находятся антитела, которые свидетельствуют о перенесенной болезни.
Чаще всего болеют молодые люди и дети. Наибольшая опасность представляет для беременных женщин и новорожденных, именно поэтому болезнь нуждается как в качественном и своевременном лечении, так и в проведении профилактических мер.
Причины заражения
Токсоплазмоз у человека вызывает возбудитель под названием Toxoplasma gondii, который принадлежит к классу простейших. Обычно Toxoplasma gondii люди заражаются от больных животных, путь передачи от человека к человеку более редкий. Возбудитель содержится в слюне, молоке, или экскрементах, которые выделяют животные.
Главный путь передачи — через пищу, в которую тем или иным способом попала Toxoplasma gondii. Более редким является трансмиссивный путь передачи — через поврежденные кожные покровы, или слизистые оболочки органов.
Еще реже встречается заражение через переливание крови или при пересадке органов. Кроме того, Toxoplasma gondii легко проникает через плацентарный барьер, поэтому при заражении беременной женщины болезнь практически во всех случаях передается также и будущему ребенку.
Таким образом, причиной токсоплазмоза чаще всего бывает употребление в пищу плохо прожаренного мяса, или несоблюдение соответствующих норм при разделывании и приготовлении блюд из сырого мяса. Также высокий риск заражения наблюдается при уходе за туалетом домашних животных, если при этом пренебрегать правилами личной гигиены.
Симптомы токсоплазмоза у человека
Симптомы токсоплазмоза зависит от того, какая форма болезни диагностирована у человека, — врожденная или приобретенная. Врожденный токсоплазмоз возникает в том случае, если заражение произошло еще в материнской утробе. Как правило, это форма болезни протекает очень тяжело и нередко заканчивается летальным исходом.
При врожденном токсоплазмозе присутствуют такие симптомы как лихорадка, увеличение лимфатических узлов, желтуха, нарушение в работе нервной системы. У большинства детей присутствует гидроцефалия, значительные поражения глазного яблока.
Смерть, как правило, наступает, от сильного воздействия болезни на головной мозг. У новорожденных, которые выжили, часто остаются различные уродства, нередко отмечается также отставание в умственном развитии.
У новорожденных, которые выжили, часто остаются различные уродства, нередко отмечается также отставание в умственном развитии.
Приобретенный токсоплазмоз переносится намного легче. Болезнь начинается с инкубационного срока, который может длиться от 3 до 10 дней. По истечению этого термина возможно появление определенных симптомов токсоплазмоза: высокой температуры, рвоты, головной боли. Также возможно увеличение селезенки и печени, боль в мышцах и суставах, в редких случаях диагностируют воспаление легких.
Однако, надо заметить, что в подавляющего большинства людей острой формы токсоплазмоза не наблюдается. В таких случаях болезнь проходит латентно и очень часто человек о ней даже не подозревает.
Диагностика токсоплазмоза
Диагностические мероприятия при подозрении на токсоплазмоз включают в себя, в первую очередь, паразитологические методы исследования. Они предусматривают лабораторный анализ различного рода образцов на предмет присутствия в нем Toxoplasma gondii. Мазки для образцов берут из пораженных органов.
Мазки для образцов берут из пораженных органов.
Гораздо более распространенными являются иммунологические методы исследования, которые обязательно проводят при диагностике токсоплазмоза.
Для этого у пациента берут образец венозной крови. С помощью серологического анализа определяют наличие в крови антител класса G или антител класса М. Если в крови присутствуют иммуноглобулины G, то это значит, что человек уже переболел токсоплазмозом и у него выработался к нему стойкий иммунитет. А вот наличие антител М свидетельствует о том, что болезнь находится в острой стадии, и больной нуждается в лечении.
Токсоплазмоз при беременности
Не смотря на то, что для взрослой части населения в подавляющем большинстве случаев токсоплазмоз не несет угрозы, он является очень опасным для беременных женщин. Его опасность состоит в том, что он несет серьезную угрозу для жизни и здоровья плода.
Наиболее высокий риск осложнений фиксируется в том случае, когда заражение произошло в первом триместре беременности, когда происходит формирование всех самых важных органов и систем плода. Однако, чем меньший срок беременности, тем более низкая возможность заражения. При этом заражение на более поздних сроках приводит к меньшему количеству осложнений и значительно улучшает прогноз.
Однако, чем меньший срок беременности, тем более низкая возможность заражения. При этом заражение на более поздних сроках приводит к меньшему количеству осложнений и значительно улучшает прогноз.
Для того, чтобы избежать возможных осложнений во время беременности, всем женщинам в стадии планирования рекомендовано провести иммунологический анализ крови, который покажет, если ли у женщины иммунитет к токсоплазмозу.
В том случае, если антитела G присутствуют в крови, можно беременеть без опаски, так как сформированный иммунитет защитит беременную от первичного заражения. В противоположной ситуации, в период беременности необходимо строгое соблюдение профилактических мер, которое обезопасит от возможного первичного заражения.
Лечение токсоплазмоза
Лечение приобретенного токсоплазмоза у человека проводится только в том случае, если болезнь протекает в острой форме и имеет ярко выраженные признаки. В случаях с врожденной формой болезни терапия применяется в обязательном порядке. Носителям инфекции, находящейся в хронической форме, лечение не требуется.
Носителям инфекции, находящейся в хронической форме, лечение не требуется.
Для лечения токсоплазмоза традиционно используют сульфаниламиды, в комбинации с хлоридином и делагилом. Также нередко применяют антибиотики тетрациклиновой группы. Если присутствует поражение ЦНС, то целесообразным является применение глюкокортикоидов. Практически во всех случаях заболевания токсоплазмозом врачи рекомендуют прием иммуномодуляторов, а также витаминов и антигистаминных средств.
При заражении токсоплазмозом беременной женщины лечение следует проводить только после 12 недели. Как правило в подобных случаях используют комбинацию сульфадиазина и пириметамина. В данном случае терапия направлена не на полное уничтожение возбудителя болезни, но на значительное уменьшение его активности.
Осложнения токсоплазмоза
Осложнения при токсоплазмозе чаще всего диагностируют при его врожденной форме, или в случаях, когда иммунитет больного сильно ослаблен. Особенно тяжело переносят болезнь люди со статусом ВИЧ-инфицированного или больные СПИДом. Такие пациенты, как правило, вынуждены проводить лечение токсоплазмоза практически всю жизнь.
Особенно тяжело переносят болезнь люди со статусом ВИЧ-инфицированного или больные СПИДом. Такие пациенты, как правило, вынуждены проводить лечение токсоплазмоза практически всю жизнь.
Чаще всего токсоплазмоз приводит к значительному ухудшению зрения. Самым распространенным осложнениям является атрофия зрительного нерва. Сильно страдает от последствий токсоплазмоза и центральная нервная система.
Болезнь может вызвать такие состояния как отек мозга, паралич, энцефалит, эпилептиформный синдром, арахноидит.
Что касается сердечнососудистой системы, то тут тоже нередко встречаются осложнения в виде эндокардита или миокардита. Также токсоплазмоз может спровоцировать пневмонию, инфекционно-токсический шок.
Профилактика
Профилактика токсоплазмоза особенно актуальна для беременных женщин, которые не имеют иммунитета к данной болезни. В подобных случаях рекомендуется употреблять в пищу только хорошо прожаренное мясо. После контакта с сырым мясом обязательно надо хорошо вымыть руки и тщательно убраться на кухне.
Также надо хорошо мыть фрукты, зелень и овощи, особенно только что вырванные на грядке. Лучше всего будет обдать их кипятком. Так как в большинстве случаев люди заражаются токсоплазмозом от домашних животных, очень важно соблюдать правила личной гигиены при общении и уходе за питомцами.
Обязательно надо мыть руки после ухода за их туалетом, а также перед любым приемом пищи. Беременным женщинам, у которых нет иммунитета к токсоплазмозу, на весь период беременности лучше максимально ограничить общение с любыми видами животных. Домашних животных в этом случае можно проверить на носительство Toxoplasma gondii, сдав в лабораторию на анализ их фекалии.
Токсоплазмоз — причины, диагностика и лечение
Что это такое?
Довольно широко распространено по всему миру.
Источником токсоплазмоза являются кошки. Дело в том, что половое размножение токсоплазм происходить только в клетках, выстилающих кишечник котов. Яйца токсоплазм (ооцисты) выделяются с калом животного и могут быть проглочены домашним скотом и другими животными.
Инфицирование людей происходит при близком общении с кошкой, при употреблении инфицированного сырого мяса, а также при контакте с почвой, содержащей ооцисты, которые попали туда с кошачьими фекалиями.
У беременных токсоплазмоз может передаваться через плаценту плоду.
Что при этом происходит?
Существует несколько форм токсоплазмоза.
Симптомы легкого лимфатического токсоплазмоза сходны с проявлением инфекционного мононуклеоза. Происходит увеличение лимфатических узлов шеи и подмышечных областей, наблюдается чувство общего недомогания, боль в мышцах, периодическое повышение температуры. Возможны легкая анемия, снижение артериального давления, увеличение числа лимфоцитов и снижение уровня лейкоцитов в крови.
При хроническом токсоплазмозе наблюдается воспаление внутренних структур глаза.
Острый диссеминированный токсоплазмоз проявляется в виде сыпи, повышенной температуры и выраженного истощения. Чаще всего эта форма токсоплазмоза встречается у людей со сниженным иммунитетом. В худшем варианте эта форма проявляется у больных СПИДом, у которых токсоплазмы могут распространиться по всему организму. При этом развивается воспаление мозга (энцефалит), что приводит к параличу, судорогам, головным болям и коме.
В худшем варианте эта форма проявляется у больных СПИДом, у которых токсоплазмы могут распространиться по всему организму. При этом развивается воспаление мозга (энцефалит), что приводит к параличу, судорогам, головным болям и коме.
Крайне опасен токсоплазмоз у беременной женщины. Врожденный токсоплазмоз у новорожденных может протекать в тяжелой форме и приводить к летальному исходу. Однако нередко врожденный токсоплазмоз проявляется не сразу, а через несколько месяцев или даже лет. Среди симптомов – воспаление глаз, приводящее к слепоте, тяжелая желтуха, судороги, нарушение развития костей черепа, задержка умственного развития.
Диагностика и лечение
Диагноз ставят по результатам анализа крови, в ходе которого в крови выявляют наличие антител против токсоплазмы. При серьезных нарушениях используется компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) головного мозга.
У большинства взрослых людей с нормальной иммунной системой заболевание проходит самостоятельно, если не поражены жизненно важные органы и в процесс не вовлекается весь организм.
У новорожденных и у людей с ослабленным иммунитетом лечение токсоплазмоза обязательно и проводится только под контролем врача.
анализ крови, показания, причины, обследование
Токсоплазмоз — это заболевание человека, вызванное микроскопическим одноклеточным паразитом Toxoplasma gondii. Отличается большим разнообразием клинических проявлений, в основном поражает:
- Нервную систему.
- Глаза.
- Скелетные и сердечную мышцы.
- Лимфатическую систему.
Возбудитель очень распространен в природе, его переносят несколько сотен видов животных и птиц, в том числе – домашних. Паразит легко проникает в организм, но часто не приводит к развитию острой инфекции. Заболевание обычно развивается у людей со сниженной иммунной реакцией – больных СПИДом и другими иммунодефицитными состояниями, при приеме иммуносупрессоров.
Возбудители заболевания, его источники
Наиболее опасным является внутриутробное инфицирование, которое нередко заканчивается выкидышем либо тяжелыми врожденными патологиями. По этой причине анализ на токсоплазмоз должен обязательно проводится при подготовке к беременности и вынашиванию ребенка.
По этой причине анализ на токсоплазмоз должен обязательно проводится при подготовке к беременности и вынашиванию ребенка.
По статистическим данным токсоплазма обнаруживается у 25-80% населения планеты. В отдельных регионах степень заражения достигает 95%.
Токсоплазма – внутриклеточный паразитический организм, который способен существовать в трех формах:
- Тахиозоиты. Имеют форму полумесяца и размер 2-4 мкм. Характерная особенность – при специальной окраске (по Романовскому-Гимзе) ядро приобретает красный цвет, а цитоплазма становится серо-голубой. В этой форме паразит проникает в клетки иммунной системы (макрофаги, фагоциты), в которых быстро размножается. После гибели клетки тахиозоиты высвобождаются и заражают здоровых макрофагов.
- Брадиозоиты (псевдоцисты). Это защитная форма токсоплазмы, в которой происходит большая часть жизнедеятельности возбудителя при нормальной иммунной реакции со стороны зараженного организма. Форма клетки брадиозоитов удлиненная, ядро смещено к одному из окончаний.
 Токсоплазмы в этой форме часто формируют тканевые псевдоцисты состоящие из множества клеток паразиты покрытых общей защитной оболочкой.
Токсоплазмы в этой форме часто формируют тканевые псевдоцисты состоящие из множества клеток паразиты покрытых общей защитной оболочкой. - Ооцисты. Эта форма токсоплазмы встречается только в эпителиальных клетках кишечника домашней кошки и ее диких родственников. Образуется в результате полового размножения паразита внутри клеток животного. Затем незрелые ооцисты выделяются в окружающую среду вместе с фекалиями. При достаточной температуре и притоке свежего кислорода ооцисты созревают в течение 2-7 дней. После завершения созревания ооцисты становятся способны заражать промежуточных хозяев токсоплазмы, в том числе – людей.
Основным источником заражения являются представители семейства кошачьих, в подавляющем большинстве – домашняя кошка. Механизм передачи паразита – фекально-оральный. Реализуется за счет:
- Употребления недостаточно термически обработанных мясных продуктов (особенно свинины и баранины).
- Через плохо вымытые овощи, зелень, фрукты.
- Несоблюдение правил личной гигиены (немытые руки).

Изредка возможно прямое заражение токсоплазмой через микроповреждения кожных покровов. От матери к ребенку паразит передается редко. В среднем одно заражение на 2-3,5 тыс. беременных. Наиболее вероятно инфицирование плода токсоплазмой если в процессе вынашивания организм беременной впервые столкнулся с паразитом.
Восприимчивость к токсоплазме крайне высока, для заражения достаточно единичных ооцист. Наиболее восприимчивы молодые люди, у пожилых (после 60 лет) паразит выявляется значительно реже.
Приобретенный токсоплазмоз, симптомы
Явные клинические симптомы у большей части заразившихся отсутствуют, болезнь сразу переходит в латентную фазу носительства. Инкубационный период составляет от 1 до 3 недель.
При проявлении выраженной клинической картины симптоматика нарастает медленно. Обычно болезнь начинается бессимптомно с увеличения региональных лимфатических узлов (паховых, подмышечных, шейных). Лимфоузлы эластичны, безболезненны, больные в этот период не предъявляют никаких жалоб.
Затем температура тела поднимается до 38-39 градусов, появляется головные боли, развиваются симптомы острого гастроэнтерита. В особо тяжелых случаях токсоплазмоза лихорадка начинается внезапно, температура тела может повышаться до 40 и более градусов. Наблюдается интенсивное потоотделение, выраженная интоксикация, боли в животе и макулезная сыпь.
После первой недели развития инфекционного процесса происходит увеличение селезенки и печени. Могут возникать ноющие боли в крупных мышечных группах нижних и верхних конечностей. У каждого пятого в этот период развивается хориоретинит проявляющийся в выпадении участков поля зрения.
Начиная со второй недели симптоматика поражения ЖКТ начинает затухать. Уменьшаются и быстро исчезают симптомы энтерита, снижается общая интоксикация организма. Одновременно развивается поражение:
- Опорно-двигательной системы. Усиливается болевой синдром в конечностях, суставах, возможно нарушение подвижности и мелкой моторики.
- Ретикулоэндотелиальной.
 Проявляется гепатолиенальным синдромом, мезаденитом.
Проявляется гепатолиенальным синдромом, мезаденитом. - Сердечно-сосудистой. Нередко развиваются нарушения ритма сердечных сокращений, симптомы миокардита либо перикардита.
На 3-4 неделе заболевание завершается затуханием всех проявлений и переходом токсоплазмоза в бессимптомное носительство. При воздействии негативных факторов, ослабляющих иммунитет возможна манифестация заболевания с развитием вышеописанной клинической картины, которая снова переходит в латентную фазу.
Частые рецидивы острой формы токсоплазмоза, особенно на фоне иммуноподавляющих факторов, могут приводить к серьезным осложнениям. Чаще встречаются:
- Миокардиодистрофия.
- Психоневрологические патологии.
- Снижение интеллекта.
- Атрофия зрительного нерва вплоть до полной слепоты.
- Синдром хронической усталости.
Острый токсоплазмоз у женщин может приводит к нарушению менструального цикла, выкидышам и другим патологиям со стороны половой системы.
Хронический приобретенный токсоплазмоз – достаточно редкое явление, считается СПИД-ассоциированной формой заболевания. Протекает с периодическими обострениями, часто развиваются осложнения со стороны ЦНС в виде энцефалитов и поражения органов зрения.
Протекает с периодическими обострениями, часто развиваются осложнения со стороны ЦНС в виде энцефалитов и поражения органов зрения.
Наиболее тяжелое следствие хронического токсоплазмоза – генерализованная инфекция в ходе которой быстро развивается полиорганная недостаточность, иногда данное осложнение завершается смертью больного.
Врожденный токсоплазмоз, возникающий при беременности
Возникает при проникновении паразита через плацентарный барьер и заражении плода. В большинстве случаев происходит при первичном заражении во время беременности, реже – при рецидиве токсоплазмоза связанном со снижением иммунитета. Основная группа риска – женщины, которые не были заражены токсоплазмой до наступления беременности. Если в результате контакта с возбудителем произойдет манифестация заболевания в процессе вынашивания плода – достаточно высока вероятность развития врожденного токсоплазмоза.
Процент выживаемости детей при внутриутробном инфицировании зависит от срока, на котором оно произошло:
- При инфицировании на первом триместре шанс на выживание плода – 15%
- На втором – 30%.

- На третьем – 60%
Даже если беременность успешно завершается, сохраняется крайне высокая степень развития врожденных патологий и врожденного токсоплазмоза. Болезнь протекает тяжело, особенно если инфицирование произошло на ранних сроках. Развивается характерная тетрада патологигй:
- Гидроцефалия.
- Двусторонний ретинохороидит.
- Задержка психофизического развития.
- Церебральные кальцификаты.
Прогноз в случае врожденного токсоплазмоза неблагоприятный, в большинстве случаев болезнь завершается смертью новорожденного либо тяжелой инвалидизацией. Даже если после внутриутробного заражения острая клиническая картина не возникла такие дети находятся в группе риска развития:
- Умственной недостаточности.
- Эпилепсии.
Возможно развития многих других патологий, которые проявляются спустя месяцы и годы после рождения. По этой причине острая форма токсоплазмоза, возникшая во время беременности – показание к проведению аборта даже на поздних сроках. При беременности необходимо сдавать массу анализов, которые помогают выявить наличие не только токсоплазмоза, но и ЦМВ-инфекции.
При беременности необходимо сдавать массу анализов, которые помогают выявить наличие не только токсоплазмоза, но и ЦМВ-инфекции.
Показания к обследованию
Анализ чаще всего назначают в двух случаях:
- При планировании беременности в составе стандартного пакета лабораторной диагностики TORCH-инфекции.
- При подозрении на токсоплазмоз и определенных симптомах.
Также лабораторная диагностика используется при выявлении симптомов острого токсоплазмоза у взрослых либо детей.
В общей врачебной практике данный анализ назначают в случае проявления у пациентов специфических симптомов (нарушение зрения, судороги) а также ВИЧ-инфицированным.
Дифференциальная диагностика
Проводится с болезнями, симптомы которых схожи с острой и хронической формой токсоплазменной инфекции. В их число входят:
- Инфекционный мононуклеаз.
- Микоплазмоз.
- Хламидиоз.
- Цитомегалия.
- Туберкулез.
Также необходимо исключить онкологические патологии и системные заболевания (ревматизм, лимфогранулематоз). Окончательный диагноз устанавливается после получения результатов специфичных серологических исследований и ПЦР. Существует достаточно много лабораторных методик обнаружения специфических антител к токсоплазме. В их число входят:
Окончательный диагноз устанавливается после получения результатов специфичных серологических исследований и ПЦР. Существует достаточно много лабораторных методик обнаружения специфических антител к токсоплазме. В их число входят:
- ИФА. Иммуноферментный анализ.
- РНИФ. Реакция непрямой иммунофлюоресценции. Становится позитивной с первой недели заболевания. Высокий титр антител может сохранятся до 15 лет.
- РСК. Реакция связывания комплемента. Становится положительной с 10-14 дня развития болезни, сохраняется на протяжении 2-3 лет.
Материал для исследования
Для обнаружения специфических антител к токсоплазме производится забор крови из вены, особой подготовки процедура не требует. Для проведения ПЦР-реакции подходит любой биологический материал – кровь, слюна, образцы тканей, другие биологические жидкости (ликвор, моча).
Если возникает потребность в диагностике токсоплазмоза у плода возможен забор крови из пупочного канатика. Процедура назначается редко потому что связана с высоким риском осложнений и преждевременного прерывания беременности. Более щадящая методика – взятие на анализ околоплодной жидкости путем пункции. Эти методики применяют в случае, когда результаты специфических анализов беременной с подозрением на токсоплазмоз не дают достаточной ясности диагноза.
Процедура назначается редко потому что связана с высоким риском осложнений и преждевременного прерывания беременности. Более щадящая методика – взятие на анализ околоплодной жидкости путем пункции. Эти методики применяют в случае, когда результаты специфических анализов беременной с подозрением на токсоплазмоз не дают достаточной ясности диагноза.
Показания к применению различных лабораторных исследований и особенности интерпретации результатов у разных категорий обследуемых
В зависимости от категории пациента (возрастной группы, группы риска) показано применения различных наборов методик диагностики. Особенно важен правильный выбор диагностических методов в случае подозрений на токсоплазмоз у беременных женщин.
Обследование на токсоплазмоз при беременности
Если в процессе беременности у беременной выявлены симптомы которые могут свидетельствовать о развитии острого токсоплазмоза необходимо при помощи серологических методов установить уровень специфических иммуноглобулинов.
Для выявления острой стадии заболевания лучше всего подходит иммуноферментный метод (ИФА). Он наиболее точно показывает концентрацию IgM, повышение уровня которого свидетельствует о протекающем, либо недавно присутствовавшем остром токсоплазмозе.
Определение уровней IgG менее информативно так как эти антитела сохраняются долгое время после перенесенной инфекции и свидетельствуют скорее о носительстве, чем о недавнем заражении либо обострении. Женщины, перенесшие инфицирование токсоплазмой до беременности застрахованы от заражения плода и не входят в группу риска.
Также важно получение иммунологической картины в динамике, для чего специфические тесты проводятся не реже 1 раза в 2 недели. Изучение динамики изменений титров антител позволяют с большей точностью установить диагноз.
Нужно учитывать, что серологическая картина, свидетельствующая об инфицировании токсоплазмой не является 100% показанием для прерывания беременности. В этом случае потребуется проведение дополнительных анализов путем взятия крови плода из пупочного канатика и образцов амниотической жидкости пункционным методом.
Обследование новорожденных детей и детей раннего возраста
Направлено на раннее обнаружение возбудителя, до начала острой фазы врожденного токсоплазмоза и развития тяжелых осложнений. Назначается, когда есть подозрение на инфицирование токсоплазмой, включает в себя следующие тесты:
- Выделение паразита путем внесения материала из плаценты и пупочного канатика в живых мышей.
- Проведение ПЦР-анализа амниотической и люмбальной жидкостей.
- Компьютерная томография либо МРТ головы. Позволяет выявить на ранних стадиях специфические изменения в головном мозге, например, гидроцефалию.
Серологические методики также применяются, но они дают только дополнительную информацию. Иммунная система новорожденного недостаточно активна, часто неспособна выработать достаточно высокий титр специфических антител.
Обследование больных ВИЧ-инфекцией
Диагностика заключается в регулярном отслеживании титров иммуноглобулинов G серологическими методами.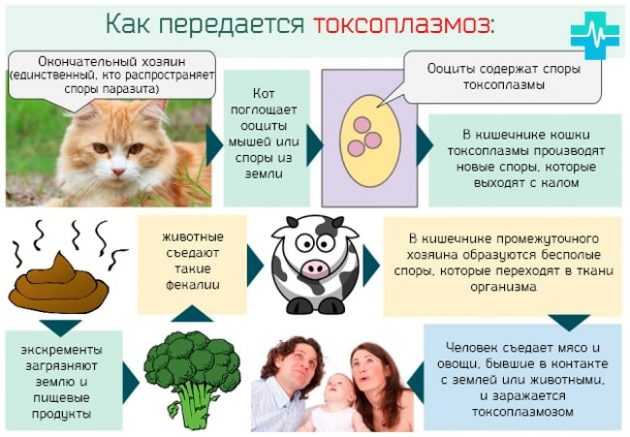 Титрование иммуноглобулинов M неинформативно так как у большинства ВИЧ-позитивных уровень антител этой группы крайне вариабелен.
Титрование иммуноглобулинов M неинформативно так как у большинства ВИЧ-позитивных уровень антител этой группы крайне вариабелен.
В прямом выявлении возбудителя путем микроскопии образцов ткани либо заражения лабораторных животных как правило необходимости нет. Диагноз достаточно точно можно установить за счет серологической диагностики и наличия специфической клиники токсоплазмоза. У ВИЧ-позитивных больных она более выражена, что значительно упрощает постановку диагноза.
Обследование в Медарт
На базе медицинского центра Медарт выполняется полный комплекс серологических анализов для выявления токсоплазмы в организме пациента. Иммунологическое исследование с целью выявления специфических иммуноглобулинов входит в состав комплексных тестов ЗППП, предназначенных для пар, планирующих рождение ребенка. Возможно выполнения забора крови и других биологических жидкостей для установления наличия токсоплазмы и уточнения клинической картины протекания заболевания.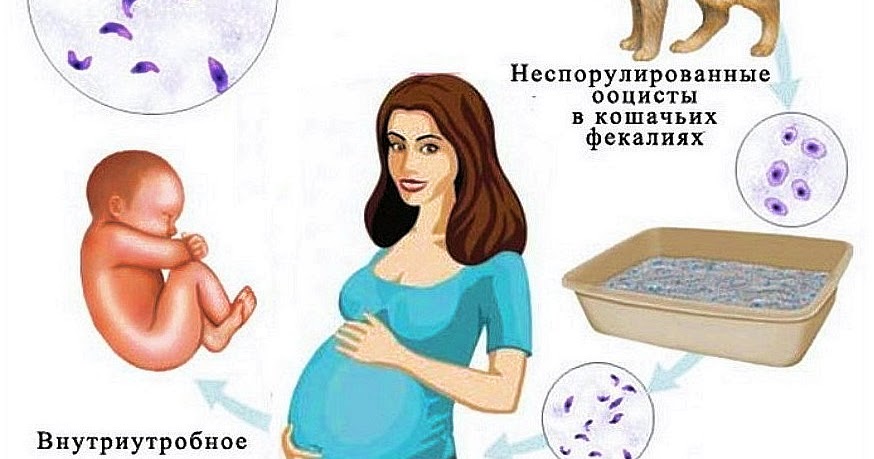
Высокоточное современное оборудование позволяет в кратчайшие сроки получить точные результаты исследований.
Преимущества медицинского центра Медарт:
- Квалифицированные специалисты.
- Возможность быстро получить точный результат исследования.
- Доступная стоимость.
На базе медцентра предоставляется полный комплекс услуг, от предварительного приема и консультаций до постановки и уточнения диагноза и назначения эффективных схем лечения и профилактики токсоплазмоза и других заболеваний.
Токсоплазмоз. Выявление и профилактика. — Учреждение здравоохранения «Гродненская областная инфекционная клиническая больница»
28.01.2020
Токсоплазмоз – болезнь, вызываемая простейшим паразитом Toxoplasma gondii, и в Европейском регионе ВОЗ ею заболевают свыше 2 миллионов человек в год.
Заболеваемость врожденным токсоплазмозом оценивается на уровне 190 100 случаев в год. Это соответствует 1,2 млн потерянных лет жизни. Высокие уровни заболеваемости отмечаются в Южной Америке, некоторых ближневосточных странах и странах с низким уровнем доходов. В Республике Беларусь вопрос врожденного токсоплазмоза и токсоплазмоза взрослых остается актуальным, поэтому профилактика населения, в т.ч. беременных, по поводу данного заболевания является необходимой мерой сохранения здоровья наших будущих поколений.
Высокие уровни заболеваемости отмечаются в Южной Америке, некоторых ближневосточных странах и странах с низким уровнем доходов. В Республике Беларусь вопрос врожденного токсоплазмоза и токсоплазмоза взрослых остается актуальным, поэтому профилактика населения, в т.ч. беременных, по поводу данного заболевания является необходимой мерой сохранения здоровья наших будущих поколений.
Toxoplasma может передаваться от матери ребенку во время беременности, при контакте с зараженной почвой или водой, при потреблении в пищу зараженных продуктов или, редко, при трансплантации крови или органов. Считается, что половина всех случаев заражения связана с потреблением зараженной пищи – ненадлежащим образом приготовленного мяса или немытых фруктов и овощей. Заражение может происходить при контакте с кошачьими фекалиями, однако следует учитывать, что кошки играют в жизненном цикле паразита немалую роль, но все же не являются главным путем передачи инфекции, т.к. выделяют в окружающую среду ооцисты только непродолжительное время.
Как заподозрить токсоплазмоз?
По имеющимся оценкам, у 95% людей со здоровой иммунной системой симптомы заражения токсоплазмой не проявляются вообще или проявляются в виде легкого гриппоподобного состояния, которое быстро проходит.
Именно поэтому многие люди даже не подозревают о том, что заражены. У людей с ослабленным иммунитетом токсоплазмоз может проявляться в виде более серьезных поражений глаз, мозга и других органов, например – воспаления глаз, которое способно привести к потере зрения.
Токсоплазмоз во время беременности
При заражении токсоплазмой во время беременности или непосредственно перед зачатием простейшие паразиты могут передаться плоду. Признаки заболевания проявляются не у всех детей, инфицированных в утробе матери, но заражение может привести к выкидышу, рождению мертвого ребенка, врожденным патологическим изменениям мозга и частичной или полной потере зрения. Нарушения зрения развиваются у вплоть до 85% детей, зараженных в утробе матери. Чаще всего симптомы проявляются в течение первого года жизни, однако необходимо помнить, что болезнь может протекать вплоть до подросткового возраста.
Чаще всего симптомы проявляются в течение первого года жизни, однако необходимо помнить, что болезнь может протекать вплоть до подросткового возраста.
Определить, была ли беременная женщина когда-либо инфицирована токсоплазмой, можно при помощи серологического исследования. Скрининг при планировании беременности и у беременных женщин направлен на выявление АТ-токсо IgМ, IgА, IgG. Диагноз недавнего заражения токсоплазмозом, как правило, ставится при появлении специфических АТ у пациента с ранее отрицательными результатами таких исследований. Отрицательные результаты исследования позволяют исключить токсоплазмоз. Если женщина уже заражалась ранее, до беременности, то риск передачи паразита плоду минимален. В противном случае ей угрожает риск заражения токсоплазмой во время беременности, с последующим инфицированием ребенка.
Если исследование показывает, что беременная женщина была заражена недавно или заражена в настоящее время, она может принять решение об исследовании плода через плацентарную кровь или околоплодные воды.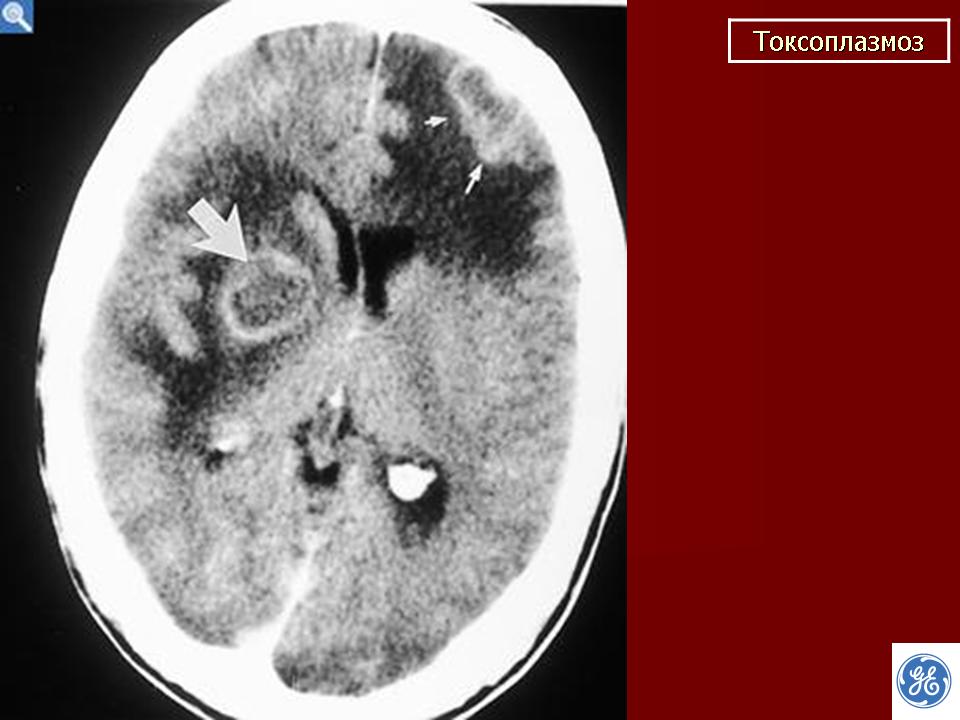 В нашей стране скрининг на предмет токсоплазмоза входит в число плановых процедур и не является обязательным.
В нашей стране скрининг на предмет токсоплазмоза входит в число плановых процедур и не является обязательным.
Безопасность пищевых продуктов
Для профилактики токсоплазмоза пищевого происхождения следует выполнять 5 принципов безопасного питания, сформулированных ВОЗ.
Источники:
- Бюллетень Всемирной организации здравоохранения Выпуск 91, Номер 7, июля 2013, 465-544 (https://www.who.int/bulletin/volumes/91/7/12-111732-ab/ru/).
- Токсоплазмоз: нам нужно больше информации, 09-11-2016 (http://euro.who.int/ru/health-topics/Life-stages/pages/news/news/2016/11/toxoplasmosis-greater-awareness-needed).
- ВОЗ — Пять важнейших принципов безопасного питания. Пособие, 2007 (https://www.who.int/foodsafety/publications/consumer/manual_keys_ru.pdf?ua=1).
Врач- интерн Екатерина Дятлова
Врач реаниматолог Игорь Денисов
Врожденный токсоплазмоз | Симптомы и причины
В Детской больнице Бостона мы понимаем, что у вас может возникнуть много вопросов, если вашему ребенку поставлен диагноз врожденный токсоплазмоз, например:
- Что это за состояние?
- Каковы возможные осложнения у моего ребенка?
- Какие методы лечения доступны?
- Возможны ли побочные эффекты от лечения?
- Как болезнь повлияет на моего ребенка в долгосрочной перспективе?
- Самое главное — будет ли мой ребенок в порядке?
Здесь мы постарались дать некоторые ответы на эти вопросы, и когда вы встретитесь с нашими экспертами, мы сможем полностью объяснить состояние вашего ребенка и варианты лечения.
Фон
По данным Центров по контролю и профилактике заболеваний, более 60 миллионов мужчин, женщин и детей в Соединенных Штатах больны токсоплазмозом. Большинство людей, инфицированных токсоплазмозом, не имеют симптомов (и не нуждаются в лечении). Однако беременным женщинам следует быть особенно осторожными с паразитами, потому что токсоплазмоз может быть очень серьезным у новорожденного.
К счастью, риск передачи паразита плоду от матери в течение первого триместра беременности (когда ребенок наиболее уязвим) относительно низок — от 15 до 20 процентов.Однако к третьему триместру беременная женщина с токсоплазмозом имеет 60-процентный шанс заразить своего ребенка.
Причины врожденного токсоплазмоза
Паразит toxoplasma gondii может проникать в организм разными путями (чаще всего через рот). Если вы беременны, будьте особенно осторожны, чтобы избежать следующих ситуаций:
- потребление сырого или недоваренного мяса
- есть сырые яйца
- для обработки кошачьих фекалий и / или наполнителя для кошачьих туалетов (хотя это не означает, что у вас не может быть домашнего кота — дополнительную информацию см.
 В разделе часто задаваемых вопросов.
В разделе часто задаваемых вопросов. - контакт с насекомыми (например,г., мухи), контактировавшие с кошачьими фекалиями
Симптомы врожденного токсоплазмоза
Многие (до 90 процентов) младенцев, рожденных с врожденным токсоплазмозом, не испытывают непосредственных симптомов. Однако один из признаков инфекции — преждевременные роды или аномально низкая масса тела при рождении.
По мере роста инфицированного ребенка признаков и симптомов может появиться больше. Сюда могут входить следующие:
Токсоплазмоз также может вызывать некоторые более серьезные проблемы, в том числе следующие:
- Повреждение сетчатки
- гидроцефалия — скопление спинномозговой жидкости в головном мозге
- внутричерепных кальцификатов — это области мозга, поврежденные паразитом, и часто связаны со следующими состояниями:
- умственная отсталость
- изъятий
- Задержка моторики и развития
- потеря слуха
Долгосрочная перспектива
Если ваш ребенок лечится рано, серьезных последствий токсоплазмоза быть не должно. Однако, если лечение откладывается, у вашего ребенка могут возникнуть серьезные проблемы со здоровьем в результате инфекции. Для получения дополнительной информации см. Вкладку «Лечение и уход».
Однако, если лечение откладывается, у вашего ребенка могут возникнуть серьезные проблемы со здоровьем в результате инфекции. Для получения дополнительной информации см. Вкладку «Лечение и уход».
Вопросы к врачу
Многие родители обеспокоены токсоплазмозом и могут задать множество вопросов об этом заболевании и о том, как оно может повлиять на их ребенка.
Возможно, вам будет полезно записывать вопросы по мере их возникновения — так, когда вы поговорите со своим врачом, вы можете быть уверены, что все ваши проблемы будут решены.
Вот несколько вопросов для начала:
- Стоит ли сдавать анализ крови на токсоплазмоз?
- В нашей семье есть кот. Как я могу обеспечить безопасное обращение с кошачьим туалетом и отходами, чтобы паразиты не распространялись?
- Нужно ли мне избегать работы в саду или других дворовых работ, чтобы избежать контакта с зараженной почвой?
- Что еще я могу сделать, чтобы предотвратить заражение?
- Я заражен.
 Есть ли способ избежать передачи этого моему ребенку?
Есть ли способ избежать передачи этого моему ребенку? - Что мы можем предпринять, если мой ребенок заразился? Какое лечение вы рекомендуете и почему?
- Есть ли побочные эффекты от лечения?
- Каковы долгосрочные перспективы для ребенка с токсоплазмозом?
Часто задаваемые вопросы о врожденном токсоплазмозе
В: Что такое токсоплазмоз?
A: Токсоплазмоз — это заболевание, вызываемое паразитом toxoplasma gondii и обычно передающееся паразитом, попадающим в организм через рот (например, при употреблении в пищу недоваренного мяса).
В: Почему токсоплазмоз является проблемой?
A: В то время как у большинства людей, инфицированных токсоплазмозом, нет никаких симптомов (и не требуется никакого лечения), беременным женщинам следует быть особенно осторожными, чтобы не подвергаться воздействию паразита, поскольку токсоплазмоз может быть очень серьезным заболеванием у новорожденного.
В: Что я могу сделать, чтобы предотвратить заражение?
A: Если вы беременны, будьте особенно осторожны, чтобы избежать следующих ситуаций:
- потребление сырого или недоваренного мяса
- потребление сырых яиц
- садоводство или другие работы в саду, которые позволяют вам напрямую контактировать с почвой
- Воздействие кошачьего фекалия и кошачьего туалета
- контакт с насекомыми (например,г., мухи), контактировавшие с кошачьими фекалиями
В: В нашей семье есть домашние кошки. Надо ли от них избавляться, чтобы не пострадать от токсоплазмоза?
A: Нет. Хотя кошки могут передавать паразита toxoplasma gondii беременным женщинам через фекалии (где могут выделяться яйца инфицированных паразитов), доказанной связи между токсоплазмозом и простым владением кошкой нет. Вот почему:
Сами кошки могут заразиться toxoplasma gondii только в том случае, если они съедят добычу, содержащую паразита, или вступят в контакт с зараженной почвой. По этим причинам кошки, содержащиеся в помещении, вряд ли станут переносчиками паразита. Кроме того, только беременные женщины подвергаются повышенному риску токсоплазмоза из-за обращения с кошачьим туалом и / или фекалиями. Другие члены семьи, включая маленьких детей, не подвергаются повышенному риску.
По этим причинам кошки, содержащиеся в помещении, вряд ли станут переносчиками паразита. Кроме того, только беременные женщины подвергаются повышенному риску токсоплазмоза из-за обращения с кошачьим туалом и / или фекалиями. Другие члены семьи, включая маленьких детей, не подвергаются повышенному риску.
Многие беременные женщины (и их семьи) опасаются, что им нужно расстаться с семейной кошкой, чтобы не пострадать от токсоплазмоза, но это совсем не так. Вы можете держать свою кошку, принимая следующие меры для предотвращения заражения токсоплазмозом:
- Держите кошек дома .Кошка, которая не выходит на улицу, не может есть зараженную добычу или контактировать с зараженной почвой.
- Не вступайте в прямой контакт с кошачьим туалетом или фекалиями. Попросите другого члена семьи очистить туалетный лоток и вывозить кошачий мусор. Если вам приходится самостоятельно выполнять обязанности туалетного лотка, всегда надевайте одноразовые перчатки и не забудьте после этого тщательно вымыть руки.

В: Каковы шансы, что мой ребенок заразится, если я заболею?
A: Это зависит от того, когда вы заражены.
- Риск передачи паразита плоду от матери в течение первого триместра беременности (когда ребенок наиболее уязвим) относительно низок — от 15 до 20 процентов.
- Однако к третьему триместру беременная женщина с токсоплазмозом имеет 60-процентный шанс заразить своего ребенка.
В: Как диагностируется токсоплазмоз?
A: Анализ крови до или во время беременности может определить, подвергались ли вы воздействию паразита toxoplasma gondii .
- Если вы инфицированы, другой тип теста может определить, инфицирован ли ваш ребенок.
- Кроме того, ультразвуковое исследование плода может определить, повреждены ли органы вашего ребенка.
В настоящее время врачи в Соединенных Штатах Америки не проводят регулярный скрининг беременных женщин на предмет toxoplasma gondii , поэтому, если вы подозреваете, что подверглись воздействию паразита, попросите своего врача сделать анализ крови.
В: Какие симптомы могут быть у моего ребенка?
A: Многие младенцы не проявляют непосредственных признаков инфекции.Однако по мере роста ребенка у него может появиться больше признаков инфекции, в том числе следующие:
В: Каковы наши варианты лечения?
A: Здесь, в Бостонской детской больнице, врачи отделения инфекционных болезней лечат врожденный токсоплазмоз у младенцев.
- При раннем обнаружении с помощью анализа крови противопаразитарные препараты могут устранить токсоплазмоз до того, как паразит нанесет вред плоду.
- Мы лечим детей, рожденных с врожденным токсоплазмозом, лекарствами от токсоплазмоза, обычно в течение 1 года после рождения.
- Один из наших экспертов определит, какая комбинация лекарств лучше всего подходит для вашего ребенка.
В: Каковы долгосрочные перспективы моего ребенка?
A: Если ваш ребенок лечится рано, серьезных последствий токсоплазмоза быть не должно. Однако, если лечение откладывается, у вашего ребенка могут возникнуть серьезные проблемы со здоровьем в результате инфекции.
Однако, если лечение откладывается, у вашего ребенка могут возникнуть серьезные проблемы со здоровьем в результате инфекции.
В: Что отличает Boston Children от других?
A: Наши врачи опытные, отзывчивые и привержены делу целого ребенка, а не только его состояния — это одна из причин, по которой нас часто называют ведущей детской больницей в США.
В Boston Children’s мы считаем вас и вашего ребенка неотъемлемой частью команды по уходу, а не просто получателями ухода. Вы и ваша группа по уходу будете работать вместе, чтобы разработать план ухода за вашим ребенком.
Программа фетально-неонатальной неврологии
Узнайте больше о нашей программе для детей с врожденными неврологическими заболеваниями.
Токсоплазмоз — Симптомы и причины
Обзор
Токсоплазмоз (tok-so-plaz-MOE-sis) — это заболевание, которое возникает в результате заражения паразитом Toxoplasma gondii, одним из самых распространенных паразитов в мире. Заражение обычно происходит в результате употребления недоваренного зараженного мяса, контакта с инфицированными фекалиями кошек или передачи инфекции от матери ребенку во время беременности.
Заражение обычно происходит в результате употребления недоваренного зараженного мяса, контакта с инфицированными фекалиями кошек или передачи инфекции от матери ребенку во время беременности.
Токсоплазмоз может вызывать симптомы, похожие на грипп, у некоторых людей, но у большинства больных симптомы никогда не появляются. Для младенцев, рожденных от инфицированных матерей, и для людей с ослабленной иммунной системой токсоплазмоз может вызвать серьезные осложнения.
Если вы в целом здоровы, не беременны и у вас диагностирован токсоплазмоз, вам, вероятно, не потребуется никакого лечения, кроме консервативного.Если вы беременны или имеете пониженный иммунитет, вам может потребоваться медицинская помощь, чтобы избежать серьезных осложнений. Однако лучший подход — это профилактика.
Симптомы
Большинство здоровых людей, инфицированных токсоплазмозом, не имеют никаких признаков или симптомов и не знают, что они инфицированы. Однако у некоторых людей появляются признаки и симптомы, похожие на симптомы гриппа, в том числе:
Однако у некоторых людей появляются признаки и симптомы, похожие на симптомы гриппа, в том числе:
- Боли в теле
- Увеличение лимфатических узлов
- Головная боль
- Лихорадка
- Усталость
У людей с ослабленной иммунной системой
Если у вас ВИЧ / СПИД , вы получаете химиотерапию или недавно перенесли трансплантацию органа, перенесенная ранее токсоплазменная инфекция может возобновиться.В этом случае у вас могут развиться более серьезные признаки и симптомы инфекции, в том числе:
- Головная боль
- Путаница
- Плохая координация
- Изъятия
- Проблемы с легкими, которые могут напоминать туберкулез или пневмонию, вызванную Pneumocystis jiroveci, распространенную оппортунистическую инфекцию, которая встречается у людей с СПИДом
- Затуманенное зрение из-за тяжелого воспаления сетчатки (глазного токсоплазмоза)
У младенцев
Если вы впервые заразились незадолго до или во время беременности, вы можете передать инфекцию своему ребенку (врожденный токсоплазмоз), даже если у вас нет признаков и симптомов.
Ваш ребенок подвергается наибольшему риску заражения токсоплазмозом, если вы заразились в третьем триместре, и наименьшему риску, если вы заразились в течение первого триместра. С другой стороны, чем раньше у вас возникнет инфекция, тем серьезнее будет исход для вашего ребенка.
Многие ранние инфекции заканчиваются мертворождением или выкидышем. Выжившие младенцы, вероятно, родятся с серьезными проблемами, такими как:
- Изъятия
- Увеличение печени и селезенки
- Пожелтение кожи и белков глаз (желтуха)
- Тяжелые глазные инфекции
Лишь у небольшого числа детей с токсоплазмозом признаки заболевания проявляются при рождении.Часто у инфицированных младенцев не появляются признаки, которые могут включать потерю слуха, умственную отсталость или серьезные глазные инфекции, до подросткового возраста или позже.
Когда обращаться к врачу
Если вы живете с ВИЧ или СПИДом , беременны или собираетесь забеременеть, поговорите со своим врачом о тестировании, если вы считаете, что могли заразиться токсоплазмозом.
Признаки и симптомы тяжелого токсоплазмоза — помутнение зрения, спутанность сознания, потеря координации — требуют немедленной медицинской помощи, особенно если ваша иммунная система ослаблена.
Причины
Toxoplasma gondii (T. gondii) — одноклеточный паразитический организм, который может инфицировать большинство животных и птиц. Поскольку инфекционные организмы T. gondii выделяются только с фекалиями кошек, дикие и домашние кошки являются основным хозяином паразита.
Хотя вы не можете «заразиться» токсоплазмозом от инфицированного ребенка или взрослого, вы можете заразиться, если вы:
- Контакт с кошачьими фекалиями, которые содержат паразита. Вы можете случайно проглотить паразитов, если дотронетесь до рта после работы в саду, очистки туалетного лотка или прикосновения к чему-либо, что контактировало с инфицированными кошачьими фекалиями.
 Кошки, которые охотятся или которых кормят сырым мясом, чаще всего являются укрывателями T. gondii .
Кошки, которые охотятся или которых кормят сырым мясом, чаще всего являются укрывателями T. gondii . - Ешьте или пейте зараженную пищу или воду. Ягненок, свинина и оленина наиболее подвержены заражению T. gondii . Иногда паразит может содержаться в непастеризованных молочных продуктах.Вода, загрязненная T. gondii , не распространена в США.
- Используйте загрязненные ножи, разделочные доски или другую посуду. Кухонная утварь, соприкасающаяся с сырым мясом, может служить убежищем для паразитов, если посуду тщательно не мыть в горячей мыльной воде.
- Ешьте немытые фрукты и овощи. На поверхности фруктов и овощей может содержаться паразит. В целях безопасности тщательно вымойте и очистите все продукты, особенно те, которые вы едите в сыром виде.
- Получить трансплантат инфицированного органа или перелить кровь.
 В редких случаях токсоплазмоз может передаваться при трансплантации органов или переливании крови.
В редких случаях токсоплазмоз может передаваться при трансплантации органов или переливании крови.
Когда человек заражается T. gondii , паразит образует цисты, которые могут поражать практически любую часть тела — часто мозг и мышечную ткань различных органов, включая сердце.
Если вы в целом здоровы, ваша иммунная система держит паразитов под контролем.Они остаются в вашем организме в неактивном состоянии, обеспечивая вам пожизненный иммунитет, чтобы вы не могли снова заразиться паразитом. Но если ваша иммунная система ослаблена болезнью или некоторыми лекарствами, инфекция может быть реактивирована, что приведет к серьезным осложнениям.
Факторы риска
Любой человек может заразиться токсоплазмозом. Паразит встречается по всему миру.
Вы подвергаетесь риску серьезных проблем со здоровьем в результате заражения токсоплазмозом, если:
- У вас ВИЧ / СПИД .
 Многие люди с ВИЧ / СПИДом также есть токсоплазмоз, либо недавняя инфекция, либо старая инфекция, которая реактивировалась.
Многие люди с ВИЧ / СПИДом также есть токсоплазмоз, либо недавняя инфекция, либо старая инфекция, которая реактивировалась. - Вы проходите курс химиотерапии. Химиотерапия влияет на вашу иммунную систему, затрудняя борьбу вашего организма даже с незначительными инфекциями.
- Вы принимаете стероиды или другие иммунодепрессанты. Лекарства, используемые для лечения некоторых незлокачественных заболеваний, подавляют вашу иммунную систему и повышают вероятность развития осложнений токсоплазмоза.
Осложнения
Если у вас нормальная иммунная система, вы вряд ли столкнетесь с осложнениями токсоплазмоза, хотя у здоровых людей иногда возникают глазные инфекции. Без лечения эти инфекции могут привести к слепоте.
Но если ваша иммунная система ослаблена, особенно в результате ВИЧ / СПИД , токсоплазмоз может привести к судорогам и опасным для жизни заболеваниям, таким как энцефалит — серьезная инфекция мозга.
У людей с СПИДом нелеченый энцефалит от токсоплазмоза приводит к летальному исходу.Рецидивы — постоянная проблема для людей с токсоплазмозом, у которых также ослаблена иммунная система.
У детей с врожденным токсоплазмозом могут развиться инвалидизирующие осложнения, включая потерю слуха, умственную отсталость и слепоту.
Профилактика
Определенные меры предосторожности могут помочь предотвратить токсоплазмоз:
- Надевайте перчатки при работе в саду или при работе с почвой. Надевайте перчатки всякий раз, когда вы работаете на открытом воздухе, а затем тщательно мойте руки с мылом.
- Не ешьте сырое или недоваренное мясо. Мясо, особенно баранина, свинина и говядина, может содержать микроорганизмы токсоплазмы. Не пробуйте мясо, пока оно полностью не приготовится. Избегайте сырого вяленого мяса.
- Тщательно вымойте кухонную утварь.
 После приготовления сырого мяса вымойте разделочные доски, ножи и другую посуду в горячей мыльной воде, чтобы предотвратить перекрестное загрязнение других продуктов. Мойте руки после работы с сырым мясом.
После приготовления сырого мяса вымойте разделочные доски, ножи и другую посуду в горячей мыльной воде, чтобы предотвратить перекрестное загрязнение других продуктов. Мойте руки после работы с сырым мясом. - Вымойте все фрукты и овощи. Очистите свежие фрукты и овощи, особенно если вы планируете есть их сырыми. По возможности удаляйте кожуру, но только после мытья.
- Не пейте непастеризованное молоко. Непастеризованное молоко и другие молочные продукты могут содержать паразитов токсоплазмы.
- Крышка детской песочницы. Если у вас есть песочница, накройте ее, когда дети не играют в ней, чтобы кошки не использовали ее в качестве лотка.
Для любителей кошек
Если вы беременны или иным образом подвержены риску токсоплазмоза или его осложнений, примите следующие меры, чтобы защитить себя:
- Помогите своей кошке оставаться здоровой. Держите кошку в помещении и кормите ее сухим или консервированным кормом, а не сырым мясом.
 Кошки могут заразиться после употребления в пищу зараженной добычи или недоваренного мяса, содержащего паразита.
Кошки могут заразиться после употребления в пищу зараженной добычи или недоваренного мяса, содержащего паразита. - Избегайте бездомных кошек и котят. Хотя всем бездомным животным нужен хороший дом, лучше позволить кому-нибудь их усыновить. У большинства кошек нет признаков инфекции T. gondii , и, хотя они могут быть проверены на токсоплазмоз, получение результатов может занять до месяца.
- Попросите кого-нибудь почистить туалетный лоток вашей кошки. Если это невозможно, наденьте перчатки и маску, чтобы сменить подстилку. Затем хорошо вымойте руки. Ежедневно меняйте подстилку, чтобы выделенные цисты не успевали заразиться.
13 октября 2020 г.
Лечение токсоплазмоза: историческая перспектива, модели на животных и текущая клиническая практика
ВИЧ-инфицированных пациентов. Токсоплазмоз обычно проявляется как токсоплазмозный энцефалит (ТЭ) у ВИЧ-инфицированных пациентов с числом CD4 <100 / мм 3 .Другие проявления (легочные, желудочно-кишечные [ЖКТ], глазные и диссеминированные) встречаются реже, но метод лечения аналогичен таковому для ТЕ. TE обычно возникает в результате реактивации ранее приобретенной латентной инфекции и проявляется либо одиночными, либо множественными (обычно увеличивающими кольцо) паренхиматозными поражениями на изображениях головного мозга (38, 39). Также может возникать диффузный энцефалит без объемных очагов на магнитно-резонансной томографии (МРТ). Общие клинические проявления включают головную боль, судороги, измененное мышление и очаговые неврологические симптомы.Лихорадка может присутствовать или отсутствовать, и на нее нельзя полагаться, чтобы исключить диагноз ТЕ (38, 40). Клиническое течение TE всегда заканчивается летальным исходом, если его не лечить. Не следует откладывать антимикробную терапию для подтверждения диагноза биопсией ткани у серопозитивных на токсоплазмы пациентов с продвинутой стадией ВИЧ с клиническими и радиологическими признаками, соответствующими реактивации токсоплазмы.
Токсоплазмоз обычно проявляется как токсоплазмозный энцефалит (ТЭ) у ВИЧ-инфицированных пациентов с числом CD4 <100 / мм 3 .Другие проявления (легочные, желудочно-кишечные [ЖКТ], глазные и диссеминированные) встречаются реже, но метод лечения аналогичен таковому для ТЕ. TE обычно возникает в результате реактивации ранее приобретенной латентной инфекции и проявляется либо одиночными, либо множественными (обычно увеличивающими кольцо) паренхиматозными поражениями на изображениях головного мозга (38, 39). Также может возникать диффузный энцефалит без объемных очагов на магнитно-резонансной томографии (МРТ). Общие клинические проявления включают головную боль, судороги, измененное мышление и очаговые неврологические симптомы.Лихорадка может присутствовать или отсутствовать, и на нее нельзя полагаться, чтобы исключить диагноз ТЕ (38, 40). Клиническое течение TE всегда заканчивается летальным исходом, если его не лечить. Не следует откладывать антимикробную терапию для подтверждения диагноза биопсией ткани у серопозитивных на токсоплазмы пациентов с продвинутой стадией ВИЧ с клиническими и радиологическими признаками, соответствующими реактивации токсоплазмы. Проведение гистопатологического подтверждения может задержать проведение соответствующей терапии и, как следствие, привести к плохому результату.В одном исследовании, хотя и ограниченного небольшим размером выборки, было обнаружено, что общий клинический ответ и выживаемость пациентов с подтвержденной биопсией TE аналогичны таковым для пациентов, которые лечились эмпирически (41). Фактически, некоторым из не ответивших на лечение в когорте подтвержденной биопсией было отложено лечение из-за биопсии, и они уже находились в коме, когда лечение было начато. Поскольку дифференциальная диагностика увеличивающих кольцо поражений головного мозга у пациентов с продвинутой стадией ВИЧ включает лимфому и, иногда, другие инфекции центральной нервной системы (ЦНС) (например,g., бактериальный абсцесс, инфекция нокардии, инфекция криптококка и т. д.), за этими эмпирически пролеченными пациентами следует внимательно наблюдать на предмет неэффективности лечения. Пациенты со СПИДом с множественными кольцевидными поражениями, положительными результатами Toxoplasma IgG и количеством CD4 <100 / мм 3 и которые не получают профилактику Toxoplasma, имеют высокую вероятность развития TE и должны лечиться эмпирически (41).
Проведение гистопатологического подтверждения может задержать проведение соответствующей терапии и, как следствие, привести к плохому результату.В одном исследовании, хотя и ограниченного небольшим размером выборки, было обнаружено, что общий клинический ответ и выживаемость пациентов с подтвержденной биопсией TE аналогичны таковым для пациентов, которые лечились эмпирически (41). Фактически, некоторым из не ответивших на лечение в когорте подтвержденной биопсией было отложено лечение из-за биопсии, и они уже находились в коме, когда лечение было начато. Поскольку дифференциальная диагностика увеличивающих кольцо поражений головного мозга у пациентов с продвинутой стадией ВИЧ включает лимфому и, иногда, другие инфекции центральной нервной системы (ЦНС) (например,g., бактериальный абсцесс, инфекция нокардии, инфекция криптококка и т. д.), за этими эмпирически пролеченными пациентами следует внимательно наблюдать на предмет неэффективности лечения. Пациенты со СПИДом с множественными кольцевидными поражениями, положительными результатами Toxoplasma IgG и количеством CD4 <100 / мм 3 и которые не получают профилактику Toxoplasma, имеют высокую вероятность развития TE и должны лечиться эмпирически (41). Чем больше пациенты со СПИДом отклоняются от этого профиля, тем выше вероятность поражений, не связанных с TE; этих пациентов следует рассматривать как кандидатов на биопсию головного мозга.Около 85% из тех, кто в конечном итоге реагирует на лечение, делают это в течение первой недели, а 90% — в течение 2 недель (38, 42). Следовательно, отсутствие реакции в течение первых 1-2 недель должно вызвать подозрение на другую основную этиологию, и следует рассмотреть возможность проведения биопсии головного мозга. Позднее обращение со снижением сенсориума не имеет благоприятного прогноза, несмотря на оптимальное лечение (40, 43, 44). Важно отметить, что радиологическое улучшение отстает от клинического улучшения и не обязательно означает безуспешную терапию (44–48).Интересно отметить, что лекарственная устойчивость (врожденная или возникающая во время терапии) не является проблемой при лечении токсоплазмоза, а отсутствие ответа на соответствующую терапию связано с задержкой постановки диагноза и факторами хозяина (например, слабым иммунным ответом).
Чем больше пациенты со СПИДом отклоняются от этого профиля, тем выше вероятность поражений, не связанных с TE; этих пациентов следует рассматривать как кандидатов на биопсию головного мозга.Около 85% из тех, кто в конечном итоге реагирует на лечение, делают это в течение первой недели, а 90% — в течение 2 недель (38, 42). Следовательно, отсутствие реакции в течение первых 1-2 недель должно вызвать подозрение на другую основную этиологию, и следует рассмотреть возможность проведения биопсии головного мозга. Позднее обращение со снижением сенсориума не имеет благоприятного прогноза, несмотря на оптимальное лечение (40, 43, 44). Важно отметить, что радиологическое улучшение отстает от клинического улучшения и не обязательно означает безуспешную терапию (44–48).Интересно отметить, что лекарственная устойчивость (врожденная или возникающая во время терапии) не является проблемой при лечении токсоплазмоза, а отсутствие ответа на соответствующую терапию связано с задержкой постановки диагноза и факторами хозяина (например, слабым иммунным ответом).
В таблице 2 представлен обзор схем лекарств, используемых для лечения токсоплазмоза у пациентов с ослабленным иммунитетом. Ранние исследования во время эпидемии ВИЧ продемонстрировали эффективность пир-сульфата в лечении ТЕ. Частота ответа составляет около 80% во время индукционной фазы терапии (38, 49–51).Однако терапевтическая эффективность омрачена серьезными побочными реакциями, а именно гематологической токсичностью (38, 40, 41, 44, 49–51). Побочные реакции, связанные с пир-сульфом, были отмечены у 60% пациентов с ТЕ, что привело к прекращению терапии у 45% пациентов. Лейкопения, тромбоцитопения, кожная сыпь и лихорадка были зарегистрированы у 40%, 12%, 19% и 10% пациентов соответственно (40). Лейкопения может возникнуть в любое время в течение курса лечения (в среднем 26 дней) (38). Фолиновая кислота обычно рекомендуется для минимизации гематологической токсичности, связанной с пириметамином.Следует отметить, что фолиевая кислота отличается от фолиевой кислоты.
ТАБЛИЦА 2Лечение токсоплазмоза у пациентов с ослабленным иммунитетом
Частота неприемлемых побочных реакций, а также большое количество таблеток, связанных с пир-сульфом, привели к поиску других терапевтических возможностей. Первоначальные нерандомизированные исследования показали эффективность схем на основе клиндамицина, но частота рецидивов была высокой при поддерживающей терапии только клиндамицином (42, 52). Два рандомизированных исследования впоследствии установили эквивалентную эффективность схемы пириметамин-клиндамицин для лечения ТЕ (44, 51).Рандомизированное исследование фазы II пир-сульф по сравнению с пириметамин-клиндамицином включало 59 пациентов с ТЕ. После 6 недель лечения 70% и 65% пациентов в группах пир-сульф и пириметамин-клиндамицин, соответственно, показали частичный или полный клинический ответ. В многофакторном анализе выживаемость и клинический ответ имели тенденцию быть выше в группе пир-сульф, но большинство смертей не были напрямую связаны с ТЕ. Радиологический ответ оказался лучше в группе пириметамин-клиндамицин, но не был статистически значимым.Обе группы имели похожие побочные реакции. На основании этих результатов был сделан вывод, что пириметамин-клиндамицин так же эффективен, как пир-сульф, и может использоваться в качестве альтернативной схемы лечения ТЕ (44).
Первоначальные нерандомизированные исследования показали эффективность схем на основе клиндамицина, но частота рецидивов была высокой при поддерживающей терапии только клиндамицином (42, 52). Два рандомизированных исследования впоследствии установили эквивалентную эффективность схемы пириметамин-клиндамицин для лечения ТЕ (44, 51).Рандомизированное исследование фазы II пир-сульф по сравнению с пириметамин-клиндамицином включало 59 пациентов с ТЕ. После 6 недель лечения 70% и 65% пациентов в группах пир-сульф и пириметамин-клиндамицин, соответственно, показали частичный или полный клинический ответ. В многофакторном анализе выживаемость и клинический ответ имели тенденцию быть выше в группе пир-сульф, но большинство смертей не были напрямую связаны с ТЕ. Радиологический ответ оказался лучше в группе пириметамин-клиндамицин, но не был статистически значимым.Обе группы имели похожие побочные реакции. На основании этих результатов был сделан вывод, что пириметамин-клиндамицин так же эффективен, как пир-сульф, и может использоваться в качестве альтернативной схемы лечения ТЕ (44). В европейском многоцентровом проспективном исследовании 299 пациентов с TE были рандомизированы в группы пир-сульф и пириметамин-клиндамицин. Не наблюдалось различий в полном или частичном клиническом ответе в группах пир-сульф и пириметамин-клиндамицин (76 против 68%) после индукционной терапии.Однако было обнаружено, что рецидивы поддерживающей терапии были значительно выше в группе пириметамин-клиндамицин. Кроме того, не было разницы в выживаемости между двумя группами. Хотя побочные реакции были схожими, диарея чаще встречалась в группе пириметамин-клиндамицин, тогда как кожные реакции и лихорадка чаще встречались в группе пир-сульф. Хотя не было значительной разницы в доле пациентов, которые перешли в другую группу лечения во время фазы индукции лечения, 98% переходов с группы пир-сульфида были вызваны побочными реакциями, связанными с лекарствами, в то время как 54% переключений из группы пириметамин-клиндамицин были обусловлены субоптимальным ответом (51).Взятые вместе, данные показывают, что пириметамин-клиндамицин, по-видимому, более переносим, чем пир-сульф, и в равной степени эффективен при разрешении острого ТЭ, но может быть менее эффективным для предотвращения рецидива во время поддерживающей фазы лечения.
В европейском многоцентровом проспективном исследовании 299 пациентов с TE были рандомизированы в группы пир-сульф и пириметамин-клиндамицин. Не наблюдалось различий в полном или частичном клиническом ответе в группах пир-сульф и пириметамин-клиндамицин (76 против 68%) после индукционной терапии.Однако было обнаружено, что рецидивы поддерживающей терапии были значительно выше в группе пириметамин-клиндамицин. Кроме того, не было разницы в выживаемости между двумя группами. Хотя побочные реакции были схожими, диарея чаще встречалась в группе пириметамин-клиндамицин, тогда как кожные реакции и лихорадка чаще встречались в группе пир-сульф. Хотя не было значительной разницы в доле пациентов, которые перешли в другую группу лечения во время фазы индукции лечения, 98% переходов с группы пир-сульфида были вызваны побочными реакциями, связанными с лекарствами, в то время как 54% переключений из группы пириметамин-клиндамицин были обусловлены субоптимальным ответом (51).Взятые вместе, данные показывают, что пириметамин-клиндамицин, по-видимому, более переносим, чем пир-сульф, и в равной степени эффективен при разрешении острого ТЭ, но может быть менее эффективным для предотвращения рецидива во время поддерживающей фазы лечения.
TMP-SMX в различных дозах (от 6,6 до 20 мг / кг / день компонента TMP) также было обнаружено в небольших исследованиях как эффективный для лечения TE у ВИЧ-инфицированных и хорошо переносимый (43, 53–56) . В ретроспективном исследовании 71 пациента с TE, связанной со СПИДом, у 87% пациентов было полное или частичное исчезновение симптомов после 4 недель терапии TMP-SMX (10 мг / кг / день компонента TMP).У 31% пациентов наблюдались побочные кожные реакции, а у 7% был рецидив при поддерживающем режиме (48). Другое проспективное исследование 83 пациентов с TE также показало аналогичную эффективность TMP-SMX, при этом рецидив наблюдался в основном у пациентов, не соблюдающих комплаенс (57). В многоцентровом проспективном пилотном исследовании 77 пациентов с ТЕ были рандомизированы в группу пир-сульф по сравнению с группой TMP-SMX (10 мг / кг / день компонента TMP) (48). После 30 дней лечения 86% против 84% пациентов имели полный или частичный ответ на лечение.Поддерживающая терапия продолжалась в половине дозы индукционного режима в течение 3 месяцев, в течение которых только у 1 пациента в группе TMP-SMX случился рецидив. Хотя разницы в выживаемости не было, побочные эффекты чаще наблюдались в группе пир-сульф. Удивительно, но небольшое рандомизированное исследование пир-сульф по сравнению с TMP-SMX показало более высокую смертность в группе TMP-SMX (58). Однако результаты в значительной степени не поддаются интерпретации, поскольку испытание было преждевременно прекращено, а размер выборки был очень маленьким — всего 10 пациентов в группе TMP-SMX.Более того, частота неудач (совокупность показателей смертности и частоты серьезных нежелательных явлений) была одинаковой в двух группах.
Хотя разницы в выживаемости не было, побочные эффекты чаще наблюдались в группе пир-сульф. Удивительно, но небольшое рандомизированное исследование пир-сульф по сравнению с TMP-SMX показало более высокую смертность в группе TMP-SMX (58). Однако результаты в значительной степени не поддаются интерпретации, поскольку испытание было преждевременно прекращено, а размер выборки был очень маленьким — всего 10 пациентов в группе TMP-SMX.Более того, частота неудач (совокупность показателей смертности и частоты серьезных нежелательных явлений) была одинаковой в двух группах.
Кокрановский метаанализ 2006 г. обнаружил только три рандомизированных испытания, в которых изучалась эффективность различных схем лечения ТЕ у ВИЧ-инфицированных пациентов; не было обнаружено значительной разницы в эффективности между пир-сульфом, пириметамин-клиндамицином и TMP-SMX (59). Недавние системные обзоры и метаанализы также пришли к аналогичным выводам (60–62). Один метаанализ, в котором использовались менее строгие критерии и включал рандомизированные контролируемые испытания, а также анализ намерения лечить, продемонстрировал немного лучший клинический ответ на пир-сульф, чем на пириметамин-клиндамицин, хотя и за счет более высокой токсичности препарата (63 ). Однако не было существенной разницы в клиническом ответе между пир-сульфом и TMP-SMX.
Однако не было существенной разницы в клиническом ответе между пир-сульфом и TMP-SMX.
Клинический опыт применения других схем лечения ограничен. Более ранние исследования атоваквона показали, что это в некоторой степени полезный агент для терапии спасения пациентов, которые либо не переносили, либо не отвечали на стандартную терапию TE. В исследовании с участием 93 пациентов таблетки атоваквона (750 мг 4 раза в день) использовались в качестве лечебного средства с некоторой эффективностью. На 6 неделе 52% пациентов показали некоторый клинический ответ, но к 18 неделе только 26% пациентов имели клинический ответ (64).Другое исследование, в котором атоваквон, отдельно (75% пациентов) или с пириметамином или клиндамицином, использовался в качестве поддерживающей терапии у пациентов, которые не переносили стандартную схему лечения, продемонстрировало, что атоваквон хорошо переносится, и только 26% пациентов рецидивировали через 1-летний период (51). Следует отметить, что в этих исследованиях использовалась таблетированная форма атоваквона, которая имеет более низкую биодоступность, чем имеющаяся в настоящее время суспензия; это могло подорвать его эффективность. Также монотерапия атоваквоном может быть не очень эффективной. В несравнительном рандомизированном исследовании суспензии атоваквона с пириметамином или сульфадиазином 75 и 82% пациентов соответственно ответили на индукционную терапию. Только у 1 из 20 пациентов развился рецидив. Примечательно, что 28% пациентов прекратили терапию, в основном из-за непереносимости желудочно-кишечного тракта (65). Следовательно, атоваквон следует использовать в сочетании с пириметамином или сульфадиазином как для индукционной, так и для поддерживающей терапии, поскольку при его использовании в качестве монотерапии может возникнуть высокий риск неудачи.
Также монотерапия атоваквоном может быть не очень эффективной. В несравнительном рандомизированном исследовании суспензии атоваквона с пириметамином или сульфадиазином 75 и 82% пациентов соответственно ответили на индукционную терапию. Только у 1 из 20 пациентов развился рецидив. Примечательно, что 28% пациентов прекратили терапию, в основном из-за непереносимости желудочно-кишечного тракта (65). Следовательно, атоваквон следует использовать в сочетании с пириметамином или сульфадиазином как для индукционной, так и для поддерживающей терапии, поскольку при его использовании в качестве монотерапии может возникнуть высокий риск неудачи.
В одном небольшом исследовании пириметамина плюс кларитромицин 11 из 13 пациентов дали клинический ответ через 3 недели, но только 8 пациентов смогли завершить 6-недельный курс лечения. Побочные эффекты произошли у 38% пациентов и включали желудочно-кишечную непереносимость, кожную сыпь, гематологические нарушения и потерю слуха (45). В этом исследовании использовалась высокая доза кларитромицина (2 г в день).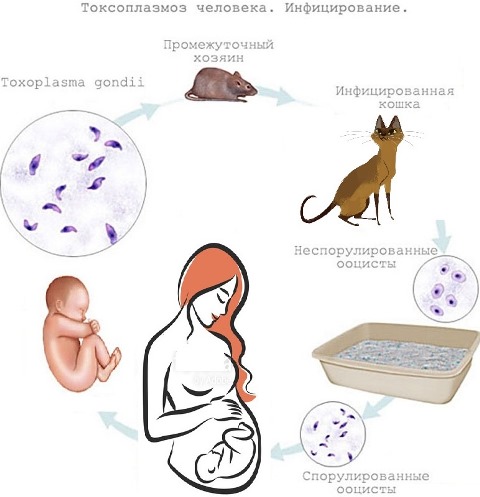 Такая высокая доза связана с желудочно-кишечной непереносимостью, проблемами со слухом и удлиненным интервалом QT и потенциально может увеличить смертность у ВИЧ-инфицированных пациентов с сопутствующей инфекцией Mycobacterium avium complex (66).Более низкая доза 500 мг два раза в день кажется разумной, но ее эффективность не ясна. В исследовании пириметамина и азитромицина 67% из 30 поддающихся оценке пациентов дали клинический ответ, но почти у 50% возник рецидив во время поддерживающей терапии. Интересно отметить, что не наблюдалось улучшения эффективности при дозах выше 900 мг азитромицина в день. Фактически, побочные эффекты были очевидны при использовании азитромицина в дозе 1500 мг в день (67). Пириметамин плюс азитромицин в более низкой дозе азитромицина (500 мг / день) также может быть эффективным во время индукционной терапии, но интерпретация исследования ограничена очень небольшим размером выборки (68).
Такая высокая доза связана с желудочно-кишечной непереносимостью, проблемами со слухом и удлиненным интервалом QT и потенциально может увеличить смертность у ВИЧ-инфицированных пациентов с сопутствующей инфекцией Mycobacterium avium complex (66).Более низкая доза 500 мг два раза в день кажется разумной, но ее эффективность не ясна. В исследовании пириметамина и азитромицина 67% из 30 поддающихся оценке пациентов дали клинический ответ, но почти у 50% возник рецидив во время поддерживающей терапии. Интересно отметить, что не наблюдалось улучшения эффективности при дозах выше 900 мг азитромицина в день. Фактически, побочные эффекты были очевидны при использовании азитромицина в дозе 1500 мг в день (67). Пириметамин плюс азитромицин в более низкой дозе азитромицина (500 мг / день) также может быть эффективным во время индукционной терапии, но интерпретация исследования ограничена очень небольшим размером выборки (68).
Как правило, индукционную терапию следует продолжать не менее 6 недель. Поскольку имеющиеся в настоящее время анти-T. gondii не может уничтожить простейшие, за индукционной терапией должна следовать поддерживающая терапия, пока у пациента сохраняется значительная иммуносупрессия. Риск рецидива составляет более 50% при отсутствии поддерживающей терапии (38, 40, 49, 69). Более того, длительная поддерживающая терапия может полностью устранить неврологический дефицит у пациентов, которые лишь частично ответили на индукционную терапию (49).Поддерживающую терапию можно безопасно прекратить, как только число CD4 будет поддерживаться выше 200 / мм 3 в течение не менее 6 месяцев на антиретровирусной терапии (АРТ), при условии, что пациент хорошо отреагировал (70–73). Как правило, ежедневный поддерживающий режим следует продолжать с половиной индукционной дозы. Хотя некоторые небольшие исследования показали хорошую эффективность терапии пир-сульфом или пириметамин-сульфадоксином два раза в неделю, рандомизированное открытое многоцентровое исследование показало худшие результаты с более высокими показателями рецидивов и смертности для режима дважды в неделю, чем для ежедневного режима (69, 74, 75).
Поскольку имеющиеся в настоящее время анти-T. gondii не может уничтожить простейшие, за индукционной терапией должна следовать поддерживающая терапия, пока у пациента сохраняется значительная иммуносупрессия. Риск рецидива составляет более 50% при отсутствии поддерживающей терапии (38, 40, 49, 69). Более того, длительная поддерживающая терапия может полностью устранить неврологический дефицит у пациентов, которые лишь частично ответили на индукционную терапию (49).Поддерживающую терапию можно безопасно прекратить, как только число CD4 будет поддерживаться выше 200 / мм 3 в течение не менее 6 месяцев на антиретровирусной терапии (АРТ), при условии, что пациент хорошо отреагировал (70–73). Как правило, ежедневный поддерживающий режим следует продолжать с половиной индукционной дозы. Хотя некоторые небольшие исследования показали хорошую эффективность терапии пир-сульфом или пириметамин-сульфадоксином два раза в неделю, рандомизированное открытое многоцентровое исследование показало худшие результаты с более высокими показателями рецидивов и смертности для режима дважды в неделю, чем для ежедневного режима (69, 74, 75).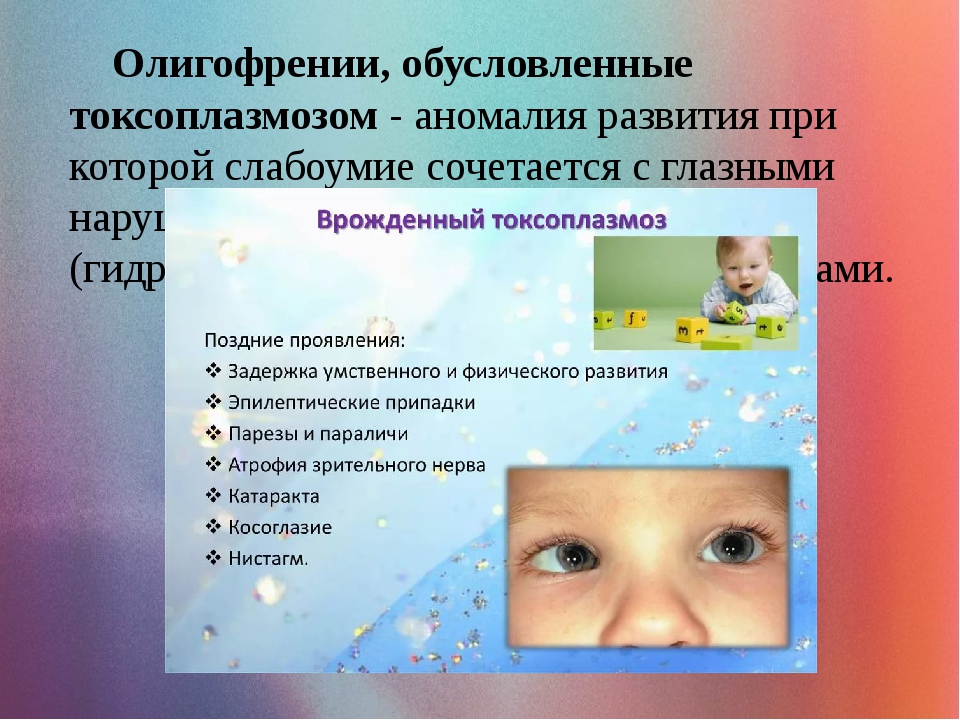 Тем не менее, трижды в неделю прием пир-сульфата сопоставим с ежедневным режимом (76), но поддерживающий режим реже, чем в день, обычно не рекомендуется.
Тем не менее, трижды в неделю прием пир-сульфата сопоставим с ежедневным режимом (76), но поддерживающий режим реже, чем в день, обычно не рекомендуется.
Стоит подчеркнуть, что для лечения ТЭ следует использовать комбинированную терапию двумя противомикробными препаратами. В то время как комбинированная терапия пир-сульфом является в настоящее время золотым стандартом лечения острой TE у ВИЧ-инфицированных, пириметамин-клиндамицин и TMP-SMX также кажутся столь же эффективными; однако не было обнаружено ни одного режима, превосходящего пир-сульф.Пириметамин-клиндамицин оказался несколько менее эффективным, чем пир-сульф, в предотвращении рецидивов во время поддерживающей терапии в европейском многоцентровом проспективном исследовании (51), хотя другие, нерандомизированные исследования показали, что оба комбинированных лечения одинаково эффективны для предотвращения рецидивов (38, 41). ). Опыт применения TMP-SMX меньше, но доступная литература предполагает эффективность, сравнимую с эффективностью пир-сульф. К сожалению, режим пир-сульф чреват серьезными побочными эффектами.Пириметамин-клиндамицин и TMP-SMX также имеют серьезные побочные эффекты, но, по-видимому, лучше переносятся. При выборе терапии следует руководствоваться доступностью, переносимостью и способностью пациентов принимать лекарства энтерально. Например, внутривенное введение TMP-SMX может быть более подходящим для пациентов с тяжелым оральным мукозитом или нарушением кишечной абсорбции, тогда как пациентам с недавней инфекцией Clostridium difficile следует по возможности избегать терапии на основе клиндамицина. Стоимость препаратов также следует учитывать при выборе подходящей терапии.Это особенно верно в отношении пириметамина, поскольку цена в США за последние годы взлетела на 5000%; Ежегодная стоимость в настоящее время оценивается примерно в 645 000 долларов, что делает его недоступным для многих пациентов в США (3). С другой стороны, TMP-SMX намного дешевле и успешно используется во многих развивающихся странах. Фолиновую кислоту следует использовать в дополнение к схемам на основе пириметамина, чтобы минимизировать гематологическую токсичность.
К сожалению, режим пир-сульф чреват серьезными побочными эффектами.Пириметамин-клиндамицин и TMP-SMX также имеют серьезные побочные эффекты, но, по-видимому, лучше переносятся. При выборе терапии следует руководствоваться доступностью, переносимостью и способностью пациентов принимать лекарства энтерально. Например, внутривенное введение TMP-SMX может быть более подходящим для пациентов с тяжелым оральным мукозитом или нарушением кишечной абсорбции, тогда как пациентам с недавней инфекцией Clostridium difficile следует по возможности избегать терапии на основе клиндамицина. Стоимость препаратов также следует учитывать при выборе подходящей терапии.Это особенно верно в отношении пириметамина, поскольку цена в США за последние годы взлетела на 5000%; Ежегодная стоимость в настоящее время оценивается примерно в 645 000 долларов, что делает его недоступным для многих пациентов в США (3). С другой стороны, TMP-SMX намного дешевле и успешно используется во многих развивающихся странах. Фолиновую кислоту следует использовать в дополнение к схемам на основе пириметамина, чтобы минимизировать гематологическую токсичность. Клинический опыт применения других схем (монотерапия атоваквоном, атоваквоном с пириметамином или сульфадиазином и пириметамином с азитромицином или кларитромицином) ограничен, и их следует использовать только при отсутствии альтернатив.В частности, следует избегать поддерживающей терапии пириметамином и азитромицином из-за высокой частоты рецидивов.
Клинический опыт применения других схем (монотерапия атоваквоном, атоваквоном с пириметамином или сульфадиазином и пириметамином с азитромицином или кларитромицином) ограничен, и их следует использовать только при отсутствии альтернатив.В частности, следует избегать поддерживающей терапии пириметамином и азитромицином из-за высокой частоты рецидивов.
Другие рекомендации для ВИЧ-инфицированных пациентов включают следующее.
(i) Роль АРТ. В эпоху АРТ выживаемость ВИЧ-инфицированных пациентов с оппортунистическими инфекциями резко возросла; Таким образом, пациенты с TE должны без промедления начинать АРТ (77). Воспалительный синдром восстановления иммунитета (ВСВИ) возникает редко после начала АРТ для ТЕ (78). До начала АРТ общая выживаемость была низкой, несмотря на оптимальную антимикробную терапию (40).В эпоху АРТ снизились как смертность, так и рецидивы TE (57, 76, 79–82). Удивительно, но недавний системный обзор показал более высокую частоту рецидивов ТЕ у пациентов, получающих поддерживающую терапию TMP-SMX в эпоху АРТ, чем в эпоху до АРТ (19,2% против 14,9%) (83). Однако к этому следует относиться осторожно из-за значительной неоднородности и небольшого размера выборки изучаемых пациентов. Другие факторы, такие как плохое соблюдение лекарств, также могли объяснить этот вывод.
Однако к этому следует относиться осторожно из-за значительной неоднородности и небольшого размера выборки изучаемых пациентов. Другие факторы, такие как плохое соблюдение лекарств, также могли объяснить этот вывод.
(ii) Роль стероидов.Хотя положительные эффекты стероидов не ясны, их можно рассмотреть при значительном отеке мозга (40, 42, 84). Однако следует избегать неоправданного использования стероидов, так как это может быть вредным (56).
(iii) Профилактика PJP. Лечение и профилактика инфекции, вызванной Toxoplasma и Pneumocystis jirovecii, значительно перекрываются. Схемы на основе пир-сульф, TMP-SMX и атоваквона, используемые для лечения токсоплазмы, обеспечивают адекватный охват пневмонии, вызванной P. jirovecii (PJP), и отдельная профилактика PJP не требуется (85, 86).Другие схемы, используемые для профилактики токсоплазмы, за исключением пириметамина плюс дапсон, не обладают надежной активностью против PJP. Точно так же некоторые схемы, используемые для профилактики или лечения P. jirovecii (аэрозольный пентамидин, клиндамицин плюс примахин и дапсон без пириметамина), не обеспечивают адекватной защиты от токсоплазмоза.
jirovecii (аэрозольный пентамидин, клиндамицин плюс примахин и дапсон без пириметамина), не обеспечивают адекватной защиты от токсоплазмоза.
Лабораторная диагностика инфекции Toxoplasma gondii и токсоплазмоза | Журнал инфекционных болезней
Аннотация
В течение последних 40 лет серологическая лаборатория Toxoplasma в Исследовательском институте медицинского фонда Пало-Альто (TSL-PAMFRI) была посвящена лабораторной диагностике инфекции Toxoplasma gondii и токсоплазмоза .TSL-PAMFRI — это детище Джека С. Ремингтона. Непрерывная приверженность Джека объективности и бескомпромиссному превосходству сделала TSL-PAMFRI справочной лабораторией токсоплазмы для Центров по контролю и профилактике заболеваний, Управления по контролю за продуктами и лекарствами США, а также поставщиков медицинских услуг и клинических лабораторий в Соединенных Штатах и других странах. Лидерство и видение Джека создали, определили и внесли значительный вклад в развитие лабораторных методов диагностики инфекции и заболеваний, вызываемых T.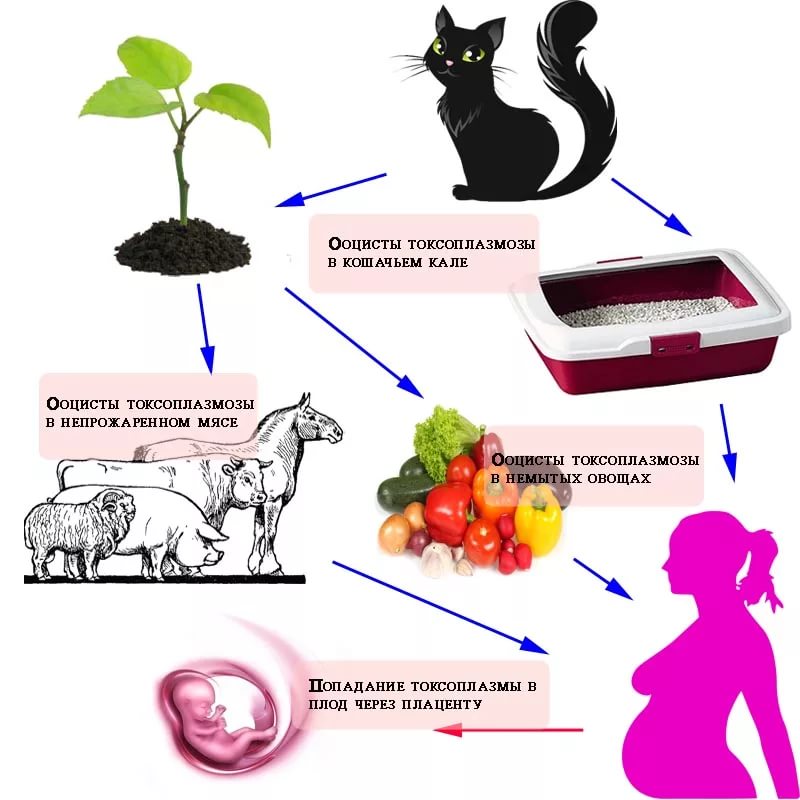 gondii . Здесь представлен обзор лабораторных тестов, доступных в настоящее время в TSL-PAMFRI для диагностики инфекций и заболеваний, вызванных паразитом.
gondii . Здесь представлен обзор лабораторных тестов, доступных в настоящее время в TSL-PAMFRI для диагностики инфекций и заболеваний, вызванных паразитом.
Общие положения
Термин «токсоплазмоз» используется для описания клинического или патологического заболевания, вызываемого инфекцией Toxoplasma gondii и T. gondii для бессимптомной первичной инфекции или персистенции паразита в тканях (хроническая или латентная инфекция) [1].
Рассматривая токсоплазмоз при дифференциальной диагностике болезни пациента, важно помнить, что не следует делать акцент на том, контактировал ли пациент с кошками или нет. Передача паразитов, по существу, происходит без ведома пациента и может не быть связана с прямым контактом с кошкой (например, при употреблении овощей или воды, загрязненных ооцистами, или проглатывания недоваренного мяса, зараженного цистами). С другой стороны, пациенты с домашней кошкой, которую кормят только приготовленной пищей, не подвержены риску заражения от этой кошки.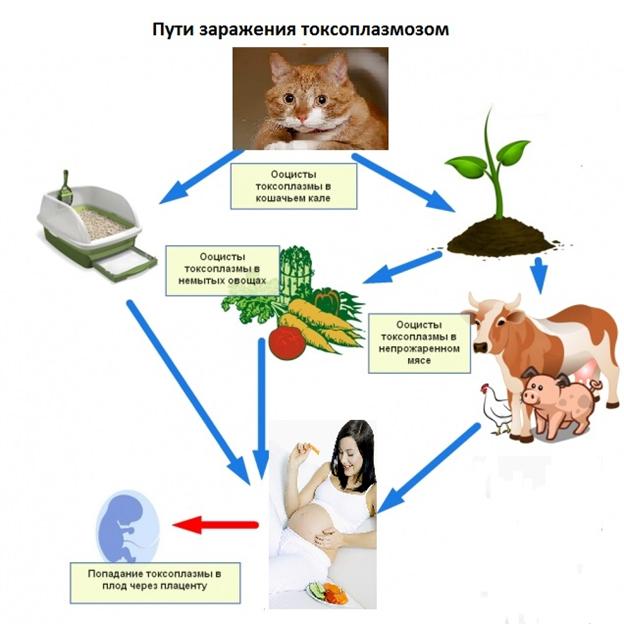 Не рекомендуется проводить серологическое обследование кошки, чтобы установить, является ли она потенциальным источником инфекции; Распространенность антител T. gondii среди кошек в данном регионе обычно аналогична их распространенности у людей. Серопозитивность у кошки не означает, что ооцисты откладываются.
Не рекомендуется проводить серологическое обследование кошки, чтобы установить, является ли она потенциальным источником инфекции; Распространенность антител T. gondii среди кошек в данном регионе обычно аналогична их распространенности у людей. Серопозитивность у кошки не означает, что ооцисты откладываются.
Для клинических целей токсоплазмоз можно разделить для удобства на пять категорий инфекций, включая инфекции (1) приобретенные у иммунокомпетентных пациентов, (2) приобретенные во время беременности, (3) приобретенные врожденным путем; и (4) приобретены или повторно активированы у пациентов с иммунодефицитом, включая (5) глазные инфекции.В любой категории клинические проявления не специфичны для токсоплазмоза, и необходимо учитывать широкий дифференциальный диагноз. Кроме того, методы диагностики и их интерпретация могут отличаться для каждой клинической категории.
Методы диагностики
Диагноз инфекции T. gondii или токсоплазмоза может быть установлен серологическими тестами, амплификацией конкретных последовательностей нуклеиновых кислот (например, полимеразной цепной реакцией [ПЦР]), гистологической демонстрацией паразита и / или его антигенов (т. е.например, окраска иммунопероксидазой), либо путем выделения организма [1]. Другие редко используемые методы включают демонстрацию антигенемии и антигена в сыворотке и биологических жидкостях, кожную пробу на токсоплазмин и трансформацию антиген-специфических лимфоцитов [1].
е.например, окраска иммунопероксидазой), либо путем выделения организма [1]. Другие редко используемые методы включают демонстрацию антигенемии и антигена в сыворотке и биологических жидкостях, кожную пробу на токсоплазмин и трансформацию антиген-специфических лимфоцитов [1].
Серологические тесты
Использование серологических тестов для демонстрации специфических антител к T. gondii является начальным и основным методом диагностики. Различные серологические тесты часто измеряют разные антитела, которые обладают уникальными паттернами роста и падения со временем после заражения [2].Обычно требуется комбинация серологических тестов, чтобы установить, был ли человек наиболее вероятно инфицирован в далеком прошлом или был инфицирован недавно. Клиницист и клинические лаборатории должны быть знакомы с этими проблемами и при необходимости консультироваться со справочными лабораториями.
Панель тестов (серологический профиль Toxoplasma [TSP]), состоящая из теста с красителем Сабина-Фельдмана (DT) [3], двойного сэндвич-ELISA на IgM [4], IgA ELISA [5], IgE ELISA [6 , 7], а тест AC / HS [8] успешно использовался нашей группой для определения того, соответствуют ли результаты серологического теста инфекции, приобретенной в недавнем или более отдаленном прошлом [2, 9, 10]. Тест AC / HS интерпретируется, как описано ранее [8], путем сравнения титров IgG, полученных с фиксированными формалином тахизоитами (антиген HS), с титрами, полученными с тахизоитами, фиксированными в ацетоне (антиген AC).
Тест AC / HS интерпретируется, как описано ранее [8], путем сравнения титров IgG, полученных с фиксированными формалином тахизоитами (антиген HS), с титрами, полученными с тахизоитами, фиксированными в ацетоне (антиген AC).
TSP успешно использовался при токсоплазматическом лимфадените [2], миокардите [11], полимиозите [11] и хориоретините [10], а также во время беременности [9]. Для сывороток с положительными результатами тестов на IgG и IgM способность TSP различать недавно приобретенную инфекцию и хроническую инфекцию, вероятно, превосходит любой другой отдельный серологический тест.
Текущая интерпретация результатов теста TSP в серологической лаборатории Toxoplasma Научно-исследовательского института медицинского фонда Пало-Альто (TSL-PAMFRI) выглядит следующим образом: сыворотки, положительные на DT, отрицательные на IgM, IgA и IgE ELISA и выявление хронической картины в тесте AC / HS обычно обнаруживаются у пациентов, инфицированных в самом далеком прошлом. Сочетание высоких титров в DT, положительных IgM, IgA и IgE ELISA и острой картины в тесте AC / HS с большой вероятностью указывает на недавно приобретенную инфекцию.Напротив, наличие положительных результатов ELISA на DT и IgM, но отрицательный, слабоположительный или сомнительный результат в ELISA на IgA и IgE и двусмысленную картину в тесте AC / HS интерпретировать труднее. В последнем случае обычно получают последующий образец, 2 образца обрабатывают параллельно и сравнивают результаты серологического теста на титр. Если титры, полученные в двух образцах, существенно не изменяются, скорее всего, инфекция была приобретена в далеком прошлом.Напротив, значительные изменения (повышение или снижение), обнаруженные в титрах двух образцов, считаются свидетельством недавно приобретенной инфекции.
Сочетание высоких титров в DT, положительных IgM, IgA и IgE ELISA и острой картины в тесте AC / HS с большой вероятностью указывает на недавно приобретенную инфекцию.Напротив, наличие положительных результатов ELISA на DT и IgM, но отрицательный, слабоположительный или сомнительный результат в ELISA на IgA и IgE и двусмысленную картину в тесте AC / HS интерпретировать труднее. В последнем случае обычно получают последующий образец, 2 образца обрабатывают параллельно и сравнивают результаты серологического теста на титр. Если титры, полученные в двух образцах, существенно не изменяются, скорее всего, инфекция была приобретена в далеком прошлом.Напротив, значительные изменения (повышение или снижение), обнаруженные в титрах двух образцов, считаются свидетельством недавно приобретенной инфекции.
Антитела IgG . Наиболее часто используемые тесты для измерения антител IgG — это DT, ELISA, IFA и модифицированный тест прямой агглютинации [1, 12]. В этих тестах антитела IgG обычно появляются в течение 1-2 недель после заражения, достигают пика в течение 1-2 месяцев, снижаются с различной скоростью и обычно сохраняются на всю жизнь.
Когда два разных соединения (т. Е. Ацетон и формалин) используются для фиксации паразитов для использования в тесте агглютинации, получается «дифференциальный» тест агглютинации (также известный как «тест AC / HS») из-за того, что разные антигенные препараты различаются по своей способности распознавать сыворотки, полученные во время острой и хронической стадии инфекции. Этот тест оказался полезным для дифференциации острых инфекций от хронических [8], но его лучше всего использовать в сочетании с панелью других тестов (например,г., ТСП).
Недавно был введен ряд тестов на авидность антител Toxoplasma IgG, чтобы помочь отличить недавно приобретенную инфекцию от отдаленной [13–15]. Было замечено, что функциональное сродство специфических антител IgG изначально низкое после первичного антигенного заражения и что оно увеличивается в течение последующих недель и месяцев за счет отбора В-клеток, управляемого антигеном. Реагенты, денатурирующие белок, включая мочевину, используются для диссоциации комплекса антитело-антиген. Результат авидности определяют с использованием соотношений кривых титрования антител для образцов, обработанных мочевиной, и необработанных.
Результат авидности определяют с использованием соотношений кривых титрования антител для образцов, обработанных мочевиной, и необработанных.
Антитела IgM . Антитела IgM могут появляться раньше и снижаться быстрее, чем антитела IgG. Наиболее часто используемые тесты для измерения антител IgM — это наборы с двойным сэндвичем или захватом IgM-ELISA [4], тест IFA и иммуноферментный анализ агглютинации (IgM-ISAGA; доступен от bioMérieux) [1]. Ложноположительные результаты из-за ревматоидного фактора и антинуклеарных антител в некоторых тестах на IgM-IFA не обнаруживаются с помощью наиболее часто используемых коммерческих двойных сэндвич-тестов или иммуноферментных IgM-тестов [4].Несмотря на широкое распространение коммерческих тест-наборов для измерения антител IgM, эти тесты часто имеют низкую специфичность, а полученные результаты часто неверно интерпретируются [16, 17].
Тест на IgM до сих пор используется большинством лабораторий для определения того, был ли пациент инфицирован недавно или в далеком прошлом, и из-за препятствий, возникающих при интерпретации положительного результата теста на IgM, всегда следует проводить подтверждающее тестирование.
У пациентов с недавно перенесенной первичной инфекцией T.gondii — специфические антитела IgM выявляются изначально, и в большинстве случаев эти титры становятся отрицательными в течение нескольких месяцев. Однако у некоторых пациентов положительные T. gondii — специфические титры IgM все еще могут наблюдаться во время хронической фазы инфекции [16]. Некоторые исследователи сообщают, что антитела IgM могут быть обнаружены через 12 лет после острой инфекции [18]. Сохранение этих антител IgM не имеет никакого клинического значения, и таких пациентов следует считать хронически инфицированными.Дальнейшее затруднение интерпретации положительного результата теста на IgM состоит в том, что несколько методов его обнаружения все еще могут приводить к относительно высокой частоте ложноположительных результатов [16, 17]. Таким образом, положительный результат теста на IgM в одном образце сыворотки можно интерпретировать как истинно-положительный результат в случае недавно приобретенной инфекции, как истинно-положительный результат в случае инфекции, приобретенной в далеком прошлом, или как ложный результат. -положительный результат.
-положительный результат.
Антитела IgA .Антитела IgA могут быть обнаружены в сыворотках остро инфицированных взрослых и врожденно инфицированных младенцев с помощью ELISA или ISAGA [5]. Как и в случае антител IgM к паразиту, антитела IgA могут сохраняться в течение многих месяцев или более года. По этой причине они мало помогают в диагностике острой инфекции у взрослых. Напротив, повышенная чувствительность тестов IgA по сравнению с тестами IgM для диагностики врожденного токсоплазмоза представляет собой прогресс в диагностике инфекции у плода и новорожденного.У ряда новорожденных с врожденным токсоплазмозом и отрицательными антителами IgM серологический диагноз устанавливается по наличию антител IgA и IgG [5].
Антитела IgE . IgE-антитела выявляются с помощью ELISA в сыворотках остро инфицированных взрослых, врожденно инфицированных младенцев и детей с врожденным токсоплазматическим хориоретинитом [6, 7]. Их демонстрация, по-видимому, не особенно полезна для диагностики инфекции T.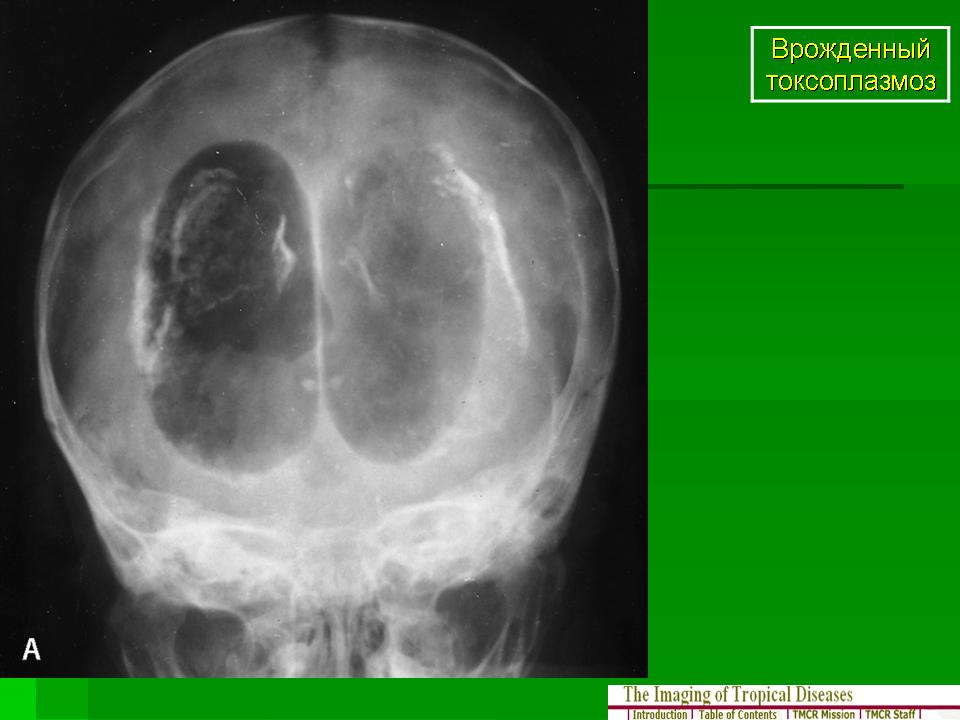 gondii у плода или новорожденного по сравнению с тестами на IgA.Продолжительность серопозитивности IgE короче, чем у антител IgM или IgA, и, следовательно, она полезна для выявления недавно приобретенных инфекций [2, 7].
gondii у плода или новорожденного по сравнению с тестами на IgA.Продолжительность серопозитивности IgE короче, чем у антител IgM или IgA, и, следовательно, она полезна для выявления недавно приобретенных инфекций [2, 7].
PCR
ПЦР-амплификация для обнаружения T. gondii ДНК в жидкостях и тканях организма успешно использовалась для диагностики врожденного [19], глазного [20, 21], церебрального и диссеминированного [22, 23] токсоплазмоза. ПЦР произвела революцию в диагностике внутриутробной инфекции T. gondii , позволив поставить ранний диагноз, тем самым избегая использования более инвазивных процедур для плода.ПЦР позволила обнаружить T. gondii ДНК в ткани мозга [24], спинномозговой жидкости (CSF) [25], стекловидном теле и водной жидкости [20], жидкости бронхоальвеолярного лаважа (BAL) [26] и крови [23]. у больных СПИДом.
Гистологический диагноз
Демонстрация тахизоитов в срезах тканей или мазках биологической жидкости (например, спинномозговой жидкости, околоплодных вод или ЖБАЛ) позволяет установить диагноз острой инфекции [1]. Часто бывает трудно продемонстрировать тахизоиты на срезах тканей, окрашенных обычным способом.Метод иммунопероксидазы, в котором используется антисыворотка к T. gondii , оказался как чувствительным, так и специфичным: он успешно использовался для демонстрации присутствия паразита в центральной нервной системе (ЦНС) больных СПИДом [27]. Иммунопероксидазный метод применим к незафиксированным или формалинофиксированным срезам тканей, залитых парафином [27]. Быстрый, технически простой и недостаточно используемый метод — это обнаружение T. gondii на высушенных воздухом, окрашенных по Райту-Гимзе предметных стеклах центрифугированных (например,g., цитоцентрифуга) осадок спинномозговой жидкости или аспирата головного мозга, или в мазках-слепках биопсийной ткани. Множественные кисты тканей рядом с воспалительно-некротическим поражением, вероятно, позволяют установить диагноз острой инфекции или реактивации латентной инфекции.
Часто бывает трудно продемонстрировать тахизоиты на срезах тканей, окрашенных обычным способом.Метод иммунопероксидазы, в котором используется антисыворотка к T. gondii , оказался как чувствительным, так и специфичным: он успешно использовался для демонстрации присутствия паразита в центральной нервной системе (ЦНС) больных СПИДом [27]. Иммунопероксидазный метод применим к незафиксированным или формалинофиксированным срезам тканей, залитых парафином [27]. Быстрый, технически простой и недостаточно используемый метод — это обнаружение T. gondii на высушенных воздухом, окрашенных по Райту-Гимзе предметных стеклах центрифугированных (например,g., цитоцентрифуга) осадок спинномозговой жидкости или аспирата головного мозга, или в мазках-слепках биопсийной ткани. Множественные кисты тканей рядом с воспалительно-некротическим поражением, вероятно, позволяют установить диагноз острой инфекции или реактивации латентной инфекции.
Изоляция
T. gondii
gondii Выделение T. gondii из крови или биологических жидкостей указывает на острую инфекцию. Попытки изоляции паразита могут быть выполнены путем инокуляции мышей или инокуляции культур тканевых клеток практически любой ткани человека или жидкости организма.
Диагностика конкретных клинических состояний
Первым шагом в постановке диагноза инфекции T. gondii или токсоплазмоза является определение того, подвергался ли человек воздействию паразита. Практически во всех случаях любой из тестов для обнаружения антител IgG надежно устанавливает наличие или отсутствие инфекции. У небольшого числа пациентов антитела IgG могут не обнаруживаться в течение 2–3 недель после первоначального контакта с паразитом; однако это редко.Кроме того, зарегистрированы редкие случаи токсоплазматического хориоретинита и токсоплазматического энцефалита у пациентов с ослабленным иммунитетом у пациентов с отрицательными T. gondii -специфическими антителами IgG.
gondii -специфическими антителами IgG.
Второй шаг заключается в установлении того, есть ли у пациента недавно перенесенная инфекция или инфекция, приобретенная в более отдаленном прошлом. В целом, истинно-отрицательный тест на IgM существенно исключает, что инфекция была приобретена в последние месяцы. Положительный тест на IgM труднее правильно интерпретировать.Не следует полагать, что положительный результат теста на IgM является диагностическим признаком недавно приобретенной инфекции (см. Выше в разделе «Антитела IgM » в разделе «Серологические тесты»). Подтверждающее тестирование следует проводить во всех случаях, когда результаты теста на IgM положительны [9, 17, 28]. Серологические тесты не следует считать полезными для измерения ответа на терапию.
Третий шаг — установить, связано ли состояние или болезнь пациента токсоплазмозом (недавно приобретенная инфекция или рецидив скрытой инфекции) или не связано с инфекцией.
Токсоплазмоз у иммунокомпетентного пациента
Подавляющее большинство случаев заражения T. gondii у взрослых и детей протекает бессимптомно [29]. Лимфаденопатия является наиболее частым проявлением у 10–20% процентов людей, обладающих остальным иммунитетом, у которых первичная инфекция T. gondii является симптоматической. Менее распространенные проявления у этих пациентов включают, помимо прочего, хориоретинит, миокардит и / или полимиозит [30].
gondii у взрослых и детей протекает бессимптомно [29]. Лимфаденопатия является наиболее частым проявлением у 10–20% процентов людей, обладающих остальным иммунитетом, у которых первичная инфекция T. gondii является симптоматической. Менее распространенные проявления у этих пациентов включают, помимо прочего, хориоретинит, миокардит и / или полимиозит [30].
Тесты на антитела IgG и IgM должны использоваться для первоначальной оценки этих пациентов. Тестирование серийных образцов, полученных с интервалом 3–4 недели (параллельно), обеспечивает наилучшую дискриминационную способность, если результаты на исходном образце неоднозначны. Отрицательные результаты обоих тестов практически исключают диагноз токсоплазмоз. В редких случаях на ранней стадии инфицирования антитела IgG могут не обнаруживаться, тогда как антитела IgM присутствуют (следовательно, необходимо провести оба теста).Острая инфекция подтверждается документально подтвержденной сероконверсией антител IgG и IgM или более чем четырехкратным увеличением титра антител IgG в сыворотках, взятых параллельно. Одного высокого титра какого-либо иммуноглобулина недостаточно для постановки диагноза, поскольку антитела IgG могут сохраняться с высокими титрами в течение многих лет [1], а антитела IgM могут обнаруживаться в течение> 12 месяцев. TSP, проводимый на одном образце сыворотки, полезен для определения вероятности острой инфекции.
Одного высокого титра какого-либо иммуноглобулина недостаточно для постановки диагноза, поскольку антитела IgG могут сохраняться с высокими титрами в течение многих лет [1], а антитела IgM могут обнаруживаться в течение> 12 месяцев. TSP, проводимый на одном образце сыворотки, полезен для определения вероятности острой инфекции.
Характерные гистологические критерии и TSP, соответствующие недавно приобретенной инфекции, устанавливают диагноз токсоплазматического лимфаденита у детей старшего возраста и взрослых [2, 31].
Эндомиокардиальная биопсия и биопсия скелетных мышц были успешно использованы для установления T. gondii как этиологического агента миокардита и полимиозита у иммунокомпетентных пациентов [11]. Исследования изоляции и ПЦР редко оказываются полезными для диагностики у иммунокомпетентных пациентов.
Глазной токсоплазмоз
Токсоплазматический хориоретинит может возникнуть в результате врожденной или постнатальной инфекции.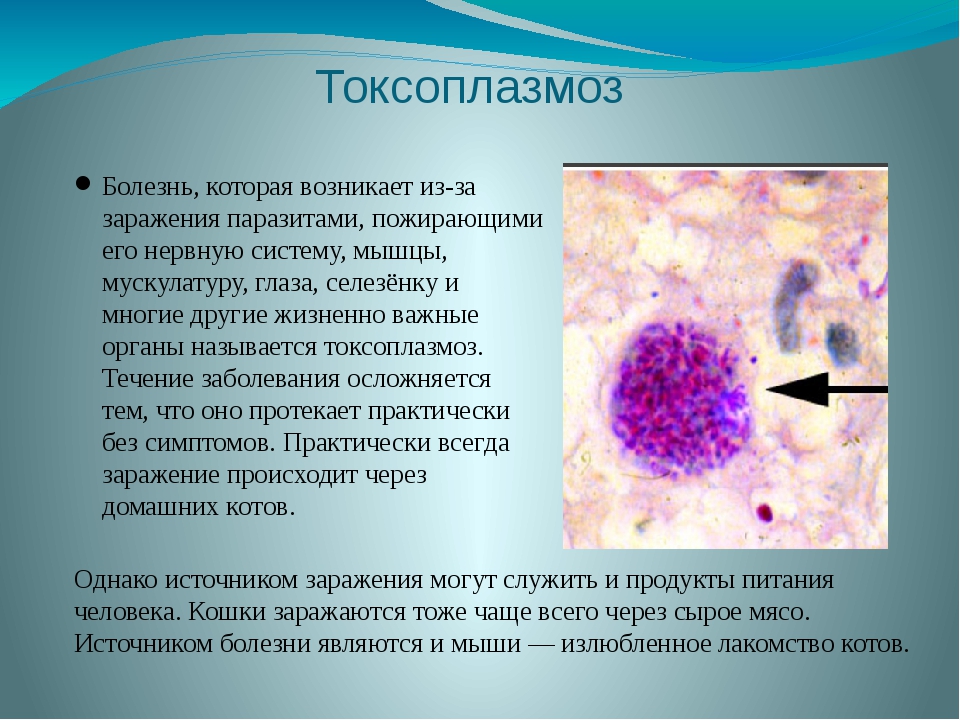 В обеих этих ситуациях поражения могут возникать во время острой или латентной (хронической) стадии инфекции [10, 32, 33].
В обеих этих ситуациях поражения могут возникать во время острой или латентной (хронической) стадии инфекции [10, 32, 33].
Низкие титры антител IgG обычно наблюдаются у пациентов с активным хориоретинитом из-за реактивации врожденной инфекции T. gondii ; Антитела IgM обычно не обнаруживаются. Когда сыворотки таких пациентов исследуются с использованием DT, сначала следует определить титры с неразбавленной сывороткой, поскольку в некоторых случаях обычное начальное разведение 1:16 может быть отрицательным.
В большинстве случаев токсоплазматический хориоретинит диагностируется при офтальмологическом обследовании, и на основании клинических данных и результатов серологических тестов часто назначают эмпирическую терапию, направленную против организма.У ряда пациентов морфология поражения сетчатки может быть недиагностической и / или реакция на лечение неоптимальна. В таких случаях (неясный клинический диагноз и / или неадекватный клинический ответ), обнаружение местного и повышенного ответа антител T. gondii в глазных жидкостях (иммунная нагрузка), демонстрация паразита путем выделения или гистопатологии или увеличение T ДНК .gondii (как в водной, так и в стекловидной жидкости) успешно использовалась для постановки диагноза [21, 34, 35].
gondii в глазных жидкостях (иммунная нагрузка), демонстрация паразита путем выделения или гистопатологии или увеличение T ДНК .gondii (как в водной, так и в стекловидной жидкости) успешно использовалась для постановки диагноза [21, 34, 35].
Токсоплазмоз у пациента с иммунодефицитом
В отличие от относительно благоприятного течения токсоплазмоза почти у всех иммунокомпетентных людей, у пациентов с иммунологическими нарушениями обычно развивается ужасное и часто опасное для жизни заболевание [36]. Пациенты с ослабленным иммунитетом с повышенным риском токсоплазмоза включают пациентов с гематологическими злокачественными новообразованиями (особенно пациентов с лимфомой), трансплантатом костного мозга, трансплантацией твердых органов (включая сердце, легкие, печень или почки) или СПИДом.
Токсоплазматический энцефалит — наиболее частое проявление токсоплазмоза у пациентов с ослабленным иммунитетом [36] и наиболее частая причина очаговых поражений ЦНС у больных СПИДом [37]. Неясно, проникает ли T. gondii в мозг легче, чем другие органы, или же для мозга, как иммунологически привилегированного участка, труднее уничтожить организм во время начальной острой инфекции и после того, как остаточная инфекция была установлена [ 38]. У пациентов с токсоплазматическим энцефалитом наблюдается широкий спектр клинических проявлений, включая изменение психического состояния, судороги, слабость, нарушения черепных нервов, сенсорные аномалии, мозжечковые симптомы, менингизм, двигательные расстройства и нейропсихиатрические проявления [39].Другими органами, обычно поражающимися у пациентов с ослабленным иммунитетом и токсоплазмозом, являются легкие, глаза и сердце.
Неясно, проникает ли T. gondii в мозг легче, чем другие органы, или же для мозга, как иммунологически привилегированного участка, труднее уничтожить организм во время начальной острой инфекции и после того, как остаточная инфекция была установлена [ 38]. У пациентов с токсоплазматическим энцефалитом наблюдается широкий спектр клинических проявлений, включая изменение психического состояния, судороги, слабость, нарушения черепных нервов, сенсорные аномалии, мозжечковые симптомы, менингизм, двигательные расстройства и нейропсихиатрические проявления [39].Другими органами, обычно поражающимися у пациентов с ослабленным иммунитетом и токсоплазмозом, являются легкие, глаза и сердце.
У подавляющего большинства пациентов с ослабленным иммунитетом токсоплазмоз возникает в результате реактивации латентной инфекции. Напротив, у пациентов с трансплантацией сердца и у небольшого числа других пациентов с ослабленным иммунитетом самый высокий риск развития заболевания возникает в условиях первичной инфекции (т. Е. У серонегативного реципиента, который приобретает паразита от серопозитивного донора через трансплантат) [40 , 41].
Е. У серонегативного реципиента, который приобретает паразита от серопозитивного донора через трансплантат) [40 , 41].
Поскольку реактивация хронической инфекции является наиболее частой причиной токсоплазмоза у пациентов со злокачественными новообразованиями или СПИДом или у реципиентов трансплантатов органов (кроме трансплантатов сердца), первоначальная оценка этих пациентов должна обычно включать анализ на T. gondii IgG антитела. Те, у кого есть положительный результат, подвергаются риску реактивации инфекции; люди с отрицательным результатом должны быть проинструктированы о том, как они могут предотвратить заражение.
При подозрении на токсоплазмоз у пациентов с ослабленным иммунитетом, хронически инфицированных этим паразитом (пациентов с подтвержденным положительным результатом T.gondii — специфические IgG-антитела до начала иммуносупрессии) дополнительное серологическое тестирование очень мало добавляет (или может вводить в заблуждение) диагностической оценке [41, 42].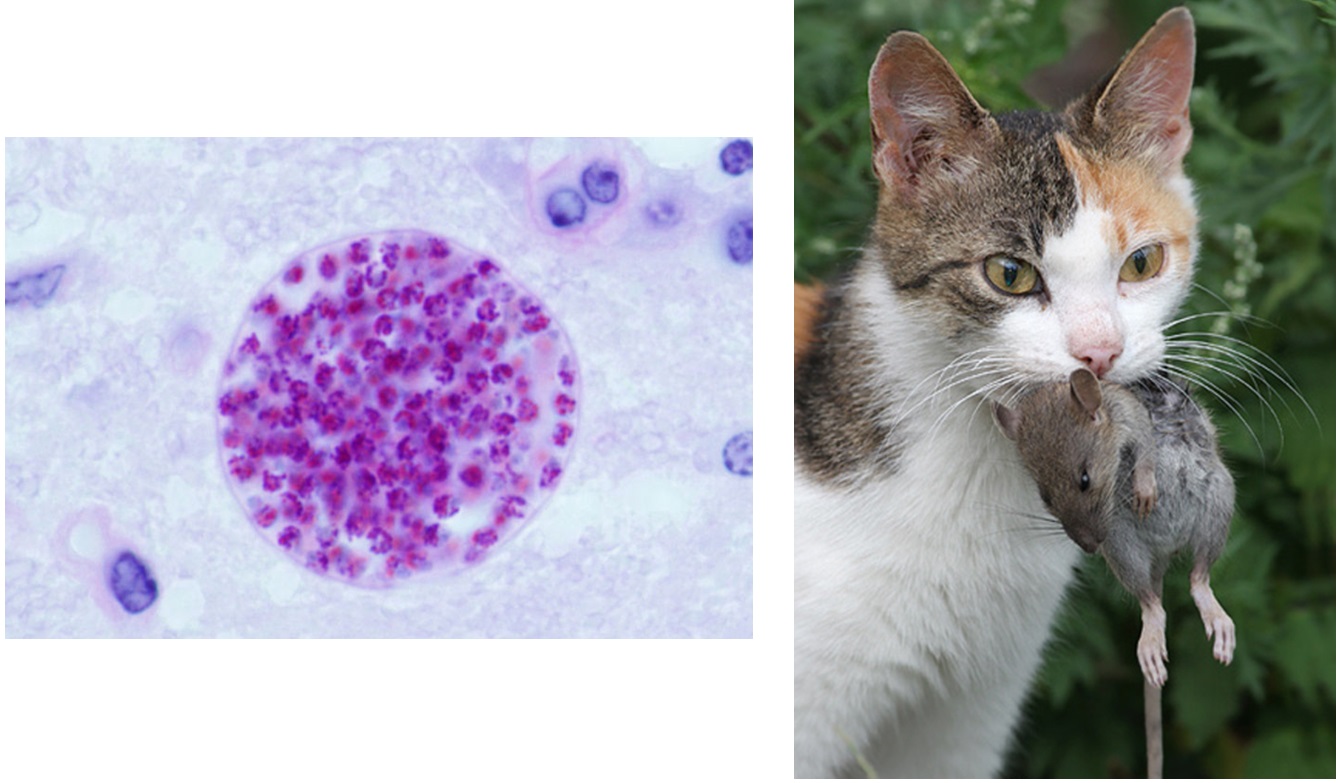 У этих пациентов результаты, указывающие на очевидную реактивацию (повышение титров IgG и IgM), могут присутствовать при отсутствии клинически очевидной инфекции. Кроме того, при наличии токсоплазмоза можно увидеть результаты серологических тестов, соответствующие хронической инфекции [36, 42]. Таким образом, для пациентов с ослабленным иммунитетом, у которых есть подозрение на токсоплазмоз, настоятельно рекомендуются дополнительные методы диагностики, чтобы попытаться установить диагноз.Эти методы включают в себя ПЦР-амплификацию для обнаружения ДНК T. gondii в крови или биологических жидкостях с подозрением на заражение, выделение паразита из крови или биологических жидкостей, которые могут содержать паразита, и гистологическое исследование доступных тканей с использованием T. gondii. — специфические красители, такие как иммунопероксидаза.
У этих пациентов результаты, указывающие на очевидную реактивацию (повышение титров IgG и IgM), могут присутствовать при отсутствии клинически очевидной инфекции. Кроме того, при наличии токсоплазмоза можно увидеть результаты серологических тестов, соответствующие хронической инфекции [36, 42]. Таким образом, для пациентов с ослабленным иммунитетом, у которых есть подозрение на токсоплазмоз, настоятельно рекомендуются дополнительные методы диагностики, чтобы попытаться установить диагноз.Эти методы включают в себя ПЦР-амплификацию для обнаружения ДНК T. gondii в крови или биологических жидкостях с подозрением на заражение, выделение паразита из крови или биологических жидкостей, которые могут содержать паразита, и гистологическое исследование доступных тканей с использованием T. gondii. — специфические красители, такие как иммунопероксидаза.
Когда клинические признаки указывают на поражение ЦНС и / или спинного мозга, тесты должны включать компьютерную томографию или магнитно-резонансную томографию (МРТ) головного и / или спинного мозга. Следует рассмотреть возможность нейровизуализационных исследований головного мозга, даже если неврологическое обследование не выявляет очаговых нарушений. Эмпирическая терапия против T. gondii для пациентов с множественными кольцевыми увеличивающими поражениями головного мозга (обычно устанавливается с помощью МРТ), положительными титрами антител IgG против T. gondii и выраженным иммунодефицитом (т. Е. Количество клеток CD4 <200 клеток / мм 3 ) является общепринятой клинической практикой; Клинический и радиологический ответ на специфическую терапию против T. gondii рассматривается как поддерживающий диагноз токсоплазмоза ЦНС.Биопсию головного мозга следует рассмотреть у пациентов с ослабленным иммунитетом и предполагаемым токсоплазмозом ЦНС, если на МРТ имеется единичное поражение, отрицательный результат теста на антитела IgG или неадекватный клинический ответ на оптимальную схему лечения или на то, что врач считает эффективной схемой профилактики против T.
Следует рассмотреть возможность нейровизуализационных исследований головного мозга, даже если неврологическое обследование не выявляет очаговых нарушений. Эмпирическая терапия против T. gondii для пациентов с множественными кольцевыми увеличивающими поражениями головного мозга (обычно устанавливается с помощью МРТ), положительными титрами антител IgG против T. gondii и выраженным иммунодефицитом (т. Е. Количество клеток CD4 <200 клеток / мм 3 ) является общепринятой клинической практикой; Клинический и радиологический ответ на специфическую терапию против T. gondii рассматривается как поддерживающий диагноз токсоплазмоза ЦНС.Биопсию головного мозга следует рассмотреть у пациентов с ослабленным иммунитетом и предполагаемым токсоплазмозом ЦНС, если на МРТ имеется единичное поражение, отрицательный результат теста на антитела IgG или неадекватный клинический ответ на оптимальную схему лечения или на то, что врач считает эффективной схемой профилактики против T. gondii (например, триметопримсульфаметоксазол) [30]. Если серологические и радиологические исследования T. gondii не подтверждают рекомендацию по эмпирическому лечению или неубедительны, и если биопсия головного мозга невозможна, следует рассмотреть возможность проведения люмбальной пункции, если ее выполнение безопасно; Затем можно провести ПЦР на образце спинномозговой жидкости.ЦСЖ также можно использовать для исследований по изоляции, хотя T. gondii редко выделяется из ЦСЖ от пациентов с ослабленным иммунитетом. Следует отметить, что ПЦР-исследование спинномозговой жидкости также может использоваться для обнаружения вируса Эпштейна-Барра, вируса JC или ДНК цитомегаловируса у пациентов, у которых при дифференциальной диагностике учитывались первичная лимфома ЦНС, прогрессирующая мультифокальная лейкоэнцефалопатия или цитомегаловирусный вентрикулит соответственно. .
gondii (например, триметопримсульфаметоксазол) [30]. Если серологические и радиологические исследования T. gondii не подтверждают рекомендацию по эмпирическому лечению или неубедительны, и если биопсия головного мозга невозможна, следует рассмотреть возможность проведения люмбальной пункции, если ее выполнение безопасно; Затем можно провести ПЦР на образце спинномозговой жидкости.ЦСЖ также можно использовать для исследований по изоляции, хотя T. gondii редко выделяется из ЦСЖ от пациентов с ослабленным иммунитетом. Следует отметить, что ПЦР-исследование спинномозговой жидкости также может использоваться для обнаружения вируса Эпштейна-Барра, вируса JC или ДНК цитомегаловируса у пациентов, у которых при дифференциальной диагностике учитывались первичная лимфома ЦНС, прогрессирующая мультифокальная лейкоэнцефалопатия или цитомегаловирусный вентрикулит соответственно. .
T. gondii Инфекция при беременности
т. gondii , приобретенная во время беременности, может привести к серьезным повреждениям или смерти плода и долгосрочным последствиям у потомства. Поскольку врожденный токсоплазмоз возникает почти исключительно у женщин, инфицированных во время беременности, очень важно определить, произошло ли инфицирование во время беременности. Заболеваемость врожденным токсоплазмозом у потомков женщин, инфицированных до беременности, чрезвычайно редка, если только женщина не имеет иммунодефицита (например, получает кортикостероиды или иммунодепрессанты или не инфицирована вирусом иммунодефицита человека [ВИЧ]).
gondii , приобретенная во время беременности, может привести к серьезным повреждениям или смерти плода и долгосрочным последствиям у потомства. Поскольку врожденный токсоплазмоз возникает почти исключительно у женщин, инфицированных во время беременности, очень важно определить, произошло ли инфицирование во время беременности. Заболеваемость врожденным токсоплазмозом у потомков женщин, инфицированных до беременности, чрезвычайно редка, если только женщина не имеет иммунодефицита (например, получает кортикостероиды или иммунодепрессанты или не инфицирована вирусом иммунодефицита человека [ВИЧ]).
В настоящее время в Соединенных Штатах окончательный диагноз острой инфекции и время ее возникновения затруднены из-за отсутствия систематического скрининга и того факта, что на тестирование подается только один образец сыворотки. Когда доступен только 1 образец сыворотки, тесты для определения наличия антител IgG и IgM обычно используются для определения того, заразилась ли беременная женщина острой инфекцией во время беременности.
Отрицательный результат теста на IgM у беременной в первые 24 недели беременности с низким титром теста IgG (т.е., DT <1024) по существу указывает на заражение до беременности. В третьем триместре отрицательный тест-титр IgM, скорее всего, соответствует хронической материнской инфекции, но не исключает возможности острой инфекции, приобретенной на ранних сроках беременности; это особенно верно для тех пациентов, у которых наблюдается быстрое снижение титров IgM во время острой инфекции. В таких случаях особую помощь может оказать использование других серологических тестов (например, IgA, IgE, AC / HS, авидность).
Напротив, положительный результат теста на IgM требует дальнейшей оценки с подтверждающим серологическим тестированием. Ложноположительный результат теста на IgM или его ошибочная интерпретация могут ввести в заблуждение и привести к ненужным абортам [9]. При тестировании в TSL-PAMFRI было обнаружено, что 60 процентов беременных женщин с положительными результатами IgM, не являющимися справочными лабораториями, были хронически инфицированы [9]. Потенциальные ошибки, связанные с использованием исключительно теста на IgM как дискриминационного метода, позволяющего проводить такое различие и низкую надежность коммерческого T.gondii —специфические наборы IgM при получении положительных результатов сообщались нашей группой и другими [16, 17].
Потенциальные ошибки, связанные с использованием исключительно теста на IgM как дискриминационного метода, позволяющего проводить такое различие и низкую надежность коммерческого T.gondii —специфические наборы IgM при получении положительных результатов сообщались нашей группой и другими [16, 17].
Таким образом, при положительном результате теста на IgM рекомендуется всегда проходить подтверждающее тестирование в референс-лаборатории [16, 17]. В сыворотках с положительным результатом теста на IgM TSP использовался, чтобы помочь отличить недавно приобретенную инфекцию от отдаленной [2, 9].
Ряд тестов на авидность антител Toxoplasma IgG был недавно введен, чтобы помочь отличить недавно приобретенную инфекцию от отдаленной [13–15].Совсем недавно мы сообщили о полезности тестирования на авидность IgG у беременных женщин в первые 12 недель беременности в TSL-PAMFRI [15]. Измерение авидности IgG выполняли с помощью метода ИФА авидности T. gondii IgG (Labsystems). При использовании этого метода была установлена высокая авидность, чтобы исключить инфекцию, произошедшую в предыдущие 12 недель. Таким образом, наибольшее значение имеет сыворотка, полученная от беременных женщин в первом триместре беременности.
При использовании этого метода была установлена высокая авидность, чтобы исключить инфекцию, произошедшую в предыдущие 12 недель. Таким образом, наибольшее значение имеет сыворотка, полученная от беременных женщин в первом триместре беременности.
Может ли тест авидности заменить какой-либо из существующих тестов в TSP или просто быть добавлен к этой панели, требует дальнейшей оценки продаваемых тестов на авидность.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США не выпустило никаких тестов на авидность для маркетинга в США. В настоящее время мы регулярно используем тест авидности в качестве дополнительного подтверждающего диагностического инструмента в TSP для пациентов с положительным и / или сомнительным результатом теста на IgM или острым и / или сомнительным паттерном в тесте AC / HS. Медицинские работники и клинические лаборатории, занимающиеся уходом за беременными женщинами, должны знать, что проверка авидности — это только подтверждающий тест, а не окончательный тест для принятия решений. Его наибольшее значение наблюдается при обнаружении антител с высокой авидностью IgG и получении сыворотки в течение временного окна исключения острой инфекции для конкретного метода (например, 12 недель для метода Labsystems и 16 недель для иммуноанализа Vidas [bioMérieux]). .
Его наибольшее значение наблюдается при обнаружении антител с высокой авидностью IgG и получении сыворотки в течение временного окна исключения острой инфекции для конкретного метода (например, 12 недель для метода Labsystems и 16 недель для иммуноанализа Vidas [bioMérieux]). .
После того, как предположительно установлен диагноз острой приобретенной инфекции во время беременности, диагностические усилия должны быть сосредоточены на определении того, инфицирован ли плод.
Врожденная инфекция плода и новорожденного
Пренатальная диагностика .Пренатальный диагноз инфекции плода рекомендуется, когда диагноз острой инфекции установлен или сильно подозревается у беременной женщины или если аномалия у плода предполагает врожденный токсоплазмоз. От методов получения крови плода, таких как забор образцов околопупочной крови плода, в значительной степени отказались из-за риска для плода и задержки в получении окончательных результатов с помощью обычных паразитологических тестов [43].
В настоящее время пренатальная диагностика врожденного токсоплазмоза основывается на ультразвуковом исследовании и амниоцентезе.ПЦР на околоплодных водах для обнаружения T. gondii — специфическая ДНК, выполняемая начиная с 18 недель беременности, должна использоваться во всех случаях установленной острой материнской инфекции или в случаях, когда результаты серологических тестов сильно указывают на острую приобретенную инфекцию во время беременности [43] . В недавнем отчете общая чувствительность ПЦР на околоплодных водах оценивается в 64%, отрицательная прогностическая ценность — в 87,8%, а специфичность и положительная прогностическая ценность — в 100% [44]; в этом исследовании наблюдались заметные различия в чувствительности в зависимости от срока беременности на момент проведения амниоцентеза [44].Достоверность теста ПЦР до 18 недель гестации неизвестна [43, 44]. ПЦР на околоплодных водах не рекомендуется ВИЧ-инфицированным женщинам из-за риска передачи вируса ВИЧ плоду во время процедуры амниоцентеза.
Диагностика новорожденного . Материнские IgG-антитела, присутствующие у новорожденного, могут отражать прошлую или недавнюю инфекцию матери. По этой причине тесты для обнаружения антител IgA и IgM обычно используются для диагностики инфекции у новорожденных.Предпочтительны образцы сыворотки, полученные из периферической крови. Не следует использовать образцы из пуповины, поскольку они могут быть загрязнены материнской кровью. Демонстрация антител IgA оказывается более чувствительной, чем обнаружение антител IgM для установления инфекции у новорожденного [5]. T. gondii — специфический IgA может присутствовать, когда нет T. gondii — специфический IgM, и может иметь место и обратное. Если у новорожденного обнаруживаются антитела IgA, тест следует повторить примерно через 10 дней после рождения, чтобы убедиться, что измеряемые антитела не загрязняют материнские антитела IgA.Кроме того, если новорожденному сделали переливание крови, серологические тесты могут определять экзогенно введенные, а не эндогенные антитела.
У младенцев, рожденных от матерей, хронически инфицированных T. gondii , в периферической крови будут обнаружены материнские Toxoplasma -специфические антитела IgG. У этих младенцев серологические тесты Toxoplasma на антитела IgM и IgA обычно отрицательны, и попытки обнаружить T. gondii в жидкостях или тканях организма (путем выделения или ПЦР) должны дать отрицательные результаты.Этим пациентам следует проводить последующее серологическое тестирование до тех пор, пока антитела IgG не станут неопределяемыми. Антитела IgG, переданные от матери, должны исчезнуть в течение первых 6–12 месяцев жизни. Отрицательный результат теста на T. gondii — специфический IgG в возрасте 1 года по существу исключает врожденный токсоплазмоз.
Дополнительные методы диагностики, которые успешно использовались для диагностики инфекции у младенцев, включают прямую демонстрацию организма путем выделения паразита (например,g., инокуляция мышей или инокуляция в тканевые культуры спинномозговой жидкости, мочи, плацентарной ткани или периферической крови) и амплификация T. gondii — специфической ДНК (например, ПЦР в спинномозговой жидкости, периферической крови или моче) [1]. Обследование младенцев с подозрением на врожденный токсоплазмоз всегда должно включать офтальмологическое обследование, неконтрастную компьютерную томографию или УЗИ головного мозга (для определения наличия гидроцефалии или кальцификатов) и исследование спинномозговой жидкости [1]. Обнаружение кальцификатов в головном мозге новорожденного с помощью рентгена, ультразвука или компьютерной томографии должно усилить подозрение на T.gondii как причина заболевания. У серьезно пораженных детей с врожденным токсоплазмозом нередко встречается одностороннее или, чаще, двустороннее и симметричное расширение желудочков [1]. Стойкий плеоцитоз в спинномозговой жидкости и повышенное содержание белка должны побуждать врача рассматривать диагноз врожденного токсоплазмоза даже в субклинических случаях [1].
Хотя клинически недоступны, антиген-специфическая трансформация лимфоцитов и типирование лимфоцитов в ответ на воздействие T.gondii успешно использовался для диагностики врожденной инфекции у детей старше 2 месяцев [45, 46]. Специфическая анергия лимфоцитов к организму может также возникать у врожденно инфицированных младенцев [47].
Сводка
Диагноз инфекции T. gondii или токсоплазмоза может быть установлен с помощью серологических тестов, ПЦР, гистологического исследования или выделения паразита. T. gondii Инфекция может протекать бессимптомно, а клинические проявления у пациентов с симптоматическим токсоплазмозом разнообразны и неспецифичны.Выбор подходящего диагностического метода (ов) и его (их) интерпретация могут отличаться для каждой клинической категории (например, иммунокомпетентный или иммунодефицитный пациент). Перед диагностическими процедурами следует связаться со справочными лабораториями, чтобы оптимизировать выбор и обработку образцов, а также их выход.
На заре двадцать первого века TSL-PAMFRI предлагает современные методы диагностики и консультации для врачей, которые встречаются с пациентами с диагнозом T.gondii инфекция или токсоплазмоз. Сегодня это возможно только благодаря непрерывным усилиям и лидерству Джека С. Ремингтона в течение последних 4 десятилетий в продвижении понимания, диагностики и лечения инфекций и заболеваний, вызываемых T. gondii .
Благодарности
Хорошо известная репутация Джека в отношении внимания к деталям и объективности изображена на рисунке 1. Примеры рукописей и главы, показанные здесь, вполне могут быть на ее четвертом или пятом черновике.Что касается его более чем 700 публикаций, видение Джека и его бесконечное стремление к совершенству сделали возможным, чтобы такой черновик мог стать полноценной публикацией в журнале или книге. Он обладает легендарной способностью преобразовывать то, что кажется хаотичным, несвязанным и фрагментированным, в то, что логично, полно и актуально. Мы, его товарищи, в огромном долгу перед ним благодарности и уважения и хотим поблагодарить его за всю помощь и руководство, которое он нам предоставил.Рисунок 1.
Выберите страницы из черновиков главы ( A ) и рукописей ( B, C ), изображающих исправления и предложения Джека, написанные его собственным почерком.Все это привело к публикациям ( A [38], B [2], C [10]) после обширных обсуждений, индивидуальных работ и обзора с Джеком.
Рисунок 1.
Выберите страницы из черновиков главы ( A ) и рукописей ( B, C ), изображающих поправки и предложения Джека, написанные его собственным почерком. Все это привело к публикациям ( A [38], B [2], C [10]) после обширных обсуждений, индивидуальных работ и обзора с Джеком.
Список литературы
1.Remington
JS
,McLeod
R
,Thulliez
P
,Desmonts
G
.Remington
JS
,Klein
J
.Токсоплазмоз
,Инфекционные болезни плода и новорожденного
,2001
5-е изд.Филадельфия
W.B. Saunders
(стр.205
—346
) 2.Montoya
JG
,Remington
JS
.Исследования по серодиагностике токсоплазматического лимфаденита
,Clin Infect Dis
,1995
, vol.20
(стр.781
—9
) 3.Сабин
AB
,Feldman
HA
.Красители как микрохимические индикаторы нового феномена иммунитета, поражающего простейших паразитов ( Toxoplasma )
,Science
,1948
, vol.108
(стр.660
—3
) 4.Naot
Y
,Barnett
EV
,Remington
JS
.Метод предотвращения ложноположительных результатов, возникающих в иммуноферментных анализах иммуноглобулина М из-за присутствия ревматоидного фактора и антинуклеарных антител
,J Clin Microbiol
,1981
, vol.14
(стр.73
—8
) 5.Stepick-Biek
P
,Thulliez
P
,Araujo
FG
,Remington
JS
.IgA-антитела для диагностики острого врожденного и приобретенного токсоплазмоза
,J Infect Dis
,1990
, vol.162
(стр.270
—3
) 6.Pinon
JM
,Toubas
D
,Marx
C
и др.Определение специфического иммуноглобулина Е у больных токсоплазмозом
,J Clin Microbiol
,1990
, vol.28
(стр.1739
—43
) 7.Wong
SY
,Hadju
MP
,Ramirez
R
,Thulliez
P
,McLeod
R
,Remington
Роль специфического иммуноглобулина E в диагностике острой инфекции Toxoplasma и токсоплазмоза
,J Clin Microbiol
,1993
, vol.31
(стр.2952
—9
) 8.Dannemann
BR
,Vaughan
WC
,Thulliez
P
,Remington
JS
.Дифференциальный тест агглютинации для диагностики недавно приобретенной инфекции Toxoplasma gondii
,J Clin Microbiol
,1990
, vol.28
(стр.1928
—33
) 9.Liesenfeld
O
,Montoya
JG
,Tathineni
NJ
, et al.Подтверждающие серологические тесты на острый токсоплазмоз и частоту искусственных абортов среди женщин с положительными результатами. Toxoplasma Титры иммуноглобулинов M
,Am J Obstet Gynecol
,2001
, vol.184
(стр.140
—5
) 10.Montoya
JG
,Remington
JS
.Токсоплазматический хориоретинит на фоне острого приобретенного токсоплазмоза
,Clin Infect Dis
,1996
, vol.23
(стр.277
—82
) 11.Montoya
JG
,Jordan
R
,Lingamneni
S
,Berry
GB
,Remington
JS
.Токсоплазматический миокардит и полимиозит у пациентов с острым приобретенным токсоплазмозом, диагностированным при жизни
,Clin Infect Dis
,1997
, vol.24
(стр.676
—83
) 12.Thulliez
P
,Remington
JS
,Santoro
F
,Ovlaque
G
,Sharma
S
,Desmonts G
9.Новый тест агглютинации для диагностики острой и хронической инфекции Toxoplasma
,Pathol Biol
,1986
, vol.34
(стр.173
—7
) 13.Hedman
K
,Lappalainen
M
,Seppala
I
,Makela
O
.Недавняя первичная инфекция Toxoplasma , на которую указывает низкая авидность специфических IgG
,J Infect Dis
,1989
, vol.159
(стр.736
—9
) 14.Jenum
PA
,Stray-Pedersen
B
,Gundersen
AG
.Улучшенная диагностика первичной инфекции Toxoplasma gondii на ранних сроках беременности путем определения активности антитоксоплазменного иммуноглобулина G
,J Clin Microbiol
,1997
, vol.35
(стр.1972
—7
) 15.Liesenfeld
O
,Montoya
JG
,Kinney
S
,Press
C
,Remington
JS
.Влияние тестирования на авидность IgG в диагностике инфекции Toxoplasma gondii у беременных женщин: опыт в справочной лаборатории США
,J Infect Dis
,2001
, vol.183
(стр.1248
—53
) 16.Лизенфельд
O
,Пресс
C
,Montoya
JG
, et al.Ложноположительные результаты иммуноглобулина M (IgM). Тесты на антитела к Toxoplasma и важность подтверждающего тестирования: тест Platelia toxo IgM
,J Clin Microbiol
,1997
, vol.35
(стр.174
—8
) 17.Wilson
M
,Remington
JS
,Clavet
C
,Varney
G
,Пресс
C
,Ware
9000DG
D
Оценка шести коммерческих наборов для обнаружения антител человеческого иммуноглобулина М к Toxoplasma gondii
,J Clin Microbiol
,1997
, vol.35
(стр.3112
—5
) 18.Бобич
B
,Sibalic
D
,Djurkovic-Djakovic
O
.Высокий уровень антител IgM, специфичных к Toxoplasma gondii во время беременности 12 лет после первичной токсоплазменной инфекции
,Gynecol Obstet Invest
,1991
, vol.31
(стр.182
—4
) 19.Grover
CM
,Thulliez
P
,Remington
JS
,Boothroyd
JD
.Быстрая пренатальная диагностика врожденной инфекции Toxoplasma с использованием полимеразной цепной реакции и околоплодных вод
,J Clin Microbiol
,1990
, vol.28
(стр.2297
—2301
) 20.Johnson
MW
,Greven
CM
,Jaffe
GJ
,Sudhalkar
H
,Vine
AK
.Атипичный, тяжелый токсоплазматический ретинохориоидит у пожилых пациентов
,Офтальмология
,1997
, т.104
(стр.48
—57
) 21.Montoya
JG
,Parmley
S
,Liesenfeld
O
,Jaffe
GJ
,Remington
JS
.Использование полимеразной цепной реакции для диагностики токсоплазмоза глаз
,Офтальмология
,1999
, vol.106
(стр.1554
—63
) 22.Брезин
AP
,Egwuagu
CE
,Burnier
M
и др.Идентификация Toxoplasma gondii в парафиновых срезах с помощью полимеразной цепной реакции
,Am J Ophthalmol
,1990
, vol.110
(стр.599
—604
) 23.Dupouy-Camet
J
,Lavareda de Souza
L
,Maslo
C
и др.Обнаружение Toxoplasma gondii в венозной крови больных СПИДом методом полимеразной цепной реакции
,J Clin Microbiol
,1993
, vol.31
(стр.1866
—9
) 24.Холлиман
RE
,Johnson
JD
,Savva
D
.Диагностика церебрального токсоплазмоза в связи со СПИДом с использованием полимеразной цепной реакции
,Scand J Infect Dis
,1990
, vol.22
(стр.243
—4
) 25.Parmley
SF
,Goebel
FD
,Remington
JS
.Обнаружение ДНК Toxoplasma gondii в спинномозговой жидкости больных СПИДом методом полимеразной цепной реакции
,J Clin Microbiol
,1992
, vol.30
(стр.3000
—2
) 26.Roth
A
,Roth
B
,Höffken
G
,Zablocki
P
,Steuber
S
,Janitschke
Применение полимеразной цепной реакции для диагностики легочного токсоплазмоза у пациентов с ослабленным иммунитетом
,Eur J Clin Microbiol Infect Dis
,1992
, vol.11
(стр.1177
—81
) 27.Conley
FK
,Jenkins
KA
,Remington
JS
.Toxoplasma gondii Инфекция центральной нервной системы. Использование метода пероксидаза-антипероксидаза для демонстрации Toxoplasma в фиксированных формалином и залитых парафином срезах ткани
,Hum Pathol
,1981
, vol.12
(стр.690
—8
) 28.Liesenfeld
O
,Press
C
,Flanders
R
,Ramirez
R
,Remington
JS
.Исследование системы Abbott toxo IMx для обнаружения антител к иммуноглобулину G и иммуноглобулину M Toxoplasma: ценность подтверждающих тестов для диагностики острого токсоплазмоза
,J Clin Microbiol
,1996
, vol.34
(стр.2526
—30
) 29.Remington
JS
.Токсоплазмоз у взрослых
,Bull N Y Acad Med
,1974
, vol.50
(стр.211
—27
) 30.Montoya
JG
,Remington
JS
.Манделл
GL
,Беннет
JE
,Долин
R
.Toxoplasma gondii
,Принципы и практика инфекционных болезней
,2000
Филадельфия
Черчилль Ливингстон
(стр.2858
—88
) 31.Dorfman
RF
,Remington
JS
.Значение биопсии лимфатических узлов в диагностике острого приобретенного токсоплазмоза
,N Engl J Med
,1973
, vol.289
(стр.878
—81
) 32.Silveira
C
,Belfort
R
Jr,Burnier
M
Jr,Nussenblatt
R
.Приобретенная токсоплазматическая инфекция как причина токсоплазматического ретинохориоидита в семьях
,Am J Ophthalmol
,1988
, vol.106
(стр.362
—4
) 33.Couvreur
J
,Thulliez
P
.Toxoplasmose Acquise àlocalisation Oculaire or Neuroologique
,Presse Med
,1996
, vol.25
(стр.438
—42
) 34Голландия
GN
,О’Коннор
GR
,Белфорт
R
Jr,Remington
JS
Pepose
JS
,Голландия
GN
,Wilhelmus
KR
.Токсоплазмоз
,Инфекция глаз и иммунитет
,1996
Сент-Луис
Ежегодник Мосби
(стр.1183
—223
) 35.Diaz
MG
,Miller
D
,Perez
E
,Rosa
RH
,Davis
JL
,Alfonso
EC
Извлечение и идентификация Toxoplasma gondii в культуре клеток как возбудителя некротического ретинита
,Труды 97-го ежегодного собрания Американского общества микробиологов (Майами-Бич, Флорида, 4-8 мая 1997 г.)
,1997
Вашингтон, округ Колумбия
ASM
36.Израильский
DM
,Remington
JS
.Токсоплазмоз у хозяина с ослабленным иммунитетом, не связанного со СПИДом
,Curr Clin Top Infect Dis
,1993
, vol.13
(стр.322
—56
) 37.Люфт
BJ
,Remington
JS
.Токсоплазматический энцефалит при СПИДе
,Clin Infect Dis
,1992
, vol.15
(стр.211
—22
) 38.Montoya
JG
,Remington
JS
.Peterson
PK
,Remington
JS
.Токсоплазмоз центральной нервной системы
,Защита мозга: современные концепции иммунопатогенеза и клинические аспекты инфекций ЦНС
,1997
Бостон
Blackwell Scientific
(стр.163
—88
) 39 .Лизенфельд
О
,Вонг
SY
,Ремингтон
JS
.Бартлетт
JG
,Мериган
TC
,Болоньези
D
.Токсоплазмоз на фоне СПИДа
,Учебник по медицине СПИДа
,1999
2-е изд.Балтимор
Williams & Wilkins
(стр.225
—9
) 40.Derouin
F
,Gluckman
E
,Beauvais
B
, et al.Инфекция Toxoplasma после аллогенной трансплантации костного мозга человеку: клинико-серологическое исследование 80 пациентов
,Пересадка костного мозга
,1986
, т.1
(стр.67
—73
) 41.Luft
BJ
,Naot
Y
,Araujo
FG
,Stinson
EB
,Remington
JS
.Первичная и реактивированная инфекция Toxoplasma у пациентов с трансплантатами сердца / Клинический спектр и проблемы диагностики в определенной популяции
,Ann Intern Med
,1983
, vol.99
(стр.27
—31
) 42.Люфт
BJ
,Биллингем
M
,Remington
JS
.Эндомиокардиальная биопсия в диагностике токсоплазматического миокардита
,Transplant Proc
,1986
, vol.18
(стр.1871
—3
) 43.Hohlfeld
P
,Daffos
F
,Costa
JM
,Thulliez
P
,Forestier
F
,Vidaud
.Пренатальная диагностика врожденного токсоплазмоза с помощью теста полимеразной цепной реакции на амниотической жидкости
,N Engl J Med
,1994
, vol.331
(стр.695
—9
) 44.Romand
S
,Wallon
M
,Franck
J
,Thulliez
P
,Peyron
F
,Dumon
H
Пренатальная диагностика с использованием полимеразной цепной реакции на амниотической жидкости при врожденном токсоплазмозе
,Obstet Gynecol
,2001
, vol.97
(стр.296
—300
) 45.Krahenbuhl
JL
,Gaines
JD
,Remington
JS
.Трансформация лимфоцитов при токсоплазмозе человека
,J Infect Dis
,1972
, vol.125
(стр.283
—8
) 46.Wilson
CB
,Desmonts
G
,Couvreur
J
,Remington
JS
.Трансформация лимфоцитов в диагностике врожденной Toxoplasma инфекции
,N Engl J Med
,1980
, vol.302
(стр.785
—8
) 47.McLeod
R
,Mack
DG
,Boyer
K
и др.Фенотипы и функции лимфоцитов при врожденном токсоплазмозе
,J Lab Clin Med
,1990
, vol.116
(стр.623
—35
)© 2002 Американским обществом инфекционных болезней
Без названия
% PDF-1.4 % 65 0 объект > endobj 66 0 объект > поток application / pdf
Врожденный токсоплазмоз — Министерство здравоохранения Италии
TY — JOUR
T1 — Врожденный токсоплазмоз
AU — Боллани, Лина
—AU — Bollani, Lina
AU — Stronati, Mauro
PY — 2013
Y1 — 2013
N2 — Токсоплазмоз — всемирное паразитарное заболевание, врожденная инфекция является наиболее тяжелым проявлением и возникает у потомков женщины, впервые заразившейся инфекцией Toxoplasma gondii. время при беременности.Частота и тяжесть врожденной инфекции зависят от того, когда во время беременности мать заразилась. Риск вертикальной передачи паразита резко возрастает с увеличением срока беременности (GA) при инфицировании матери. Хотя около 85% инфицированных младенцев полностью бессимптомны при рождении, врожденный токсоплазмоз может проявляться при рождении или в первые месяцы жизни с крайней неоднородностью по тяжести заболевания и поражению органов. Офтальмологические проявления представляют собой основные последствия врожденного токсоплазмоза, наиболее частым проявлением которого является ретинохориоидит. Комбинация пириметамина с сульфадиазином в настоящее время представляет собой золотой стандарт лечения.Сопутствующие патологии глаз могут возникать в более позднем возрасте. Адекватная программа наблюдения за пациентами с врожденным токсоплазмозом должна включать офтальмологические, неврологические, аудиометрические и серологические обследования.
AB — Токсоплазмоз — это паразитарное заболевание во всем мире, врожденная инфекция является наиболее тяжелым проявлением и возникает у потомков женщины, впервые заразившейся инфекцией Toxoplasma gondii во время беременности. Частота и тяжесть врожденной инфекции зависят от того, когда во время беременности мать заразилась.Риск вертикальной передачи паразита резко возрастает с увеличением срока беременности (GA) при инфицировании матери. Хотя около 85% инфицированных младенцев полностью бессимптомны при рождении, врожденный токсоплазмоз может проявляться при рождении или в первые месяцы жизни с крайней неоднородностью по тяжести заболевания и поражению органов. Офтальмологические проявления представляют собой основные последствия врожденного токсоплазмоза, наиболее частым проявлением которого является ретинохориоидит. Комбинация пириметамина с сульфадиазином в настоящее время представляет собой золотой стандарт лечения.Сопутствующие патологии глаз могут возникать в более позднем возрасте. Адекватная программа наблюдения за пациентами с врожденным токсоплазмозом должна включать офтальмологические, неврологические, аудиометрические и серологические обследования.
KW — Врожденный токсоплазмоз
KW — Последующее наблюдение
KW — Новорожденный
KW — Ретинохориоидит
UR — http://www.scopus.com/inward/record.url?scp=84886286285 UR — http://www.scopus.com/inward/citedby.url? scp = 84886286285 & partnerID = 8YFLogxK
U2 — 10.1016 / S0378-3782 (13) 70107-5
DO — 10.1016 / S0378-3782 (13) 70107-5
M3 — Артикул
82 AN — SC — SC.
VL — 89
JO — Раннее человеческое развитие
JF — Раннее человеческое развитие
SN — 0378-3782
IS — SUPPL4
ER —
Гистопатологические особенности глазного токсоплазмоза у плода и младенца | Неонатология | JAMA Офтальмология
Фон Заболевания глаз — частое проявление врожденной инфекции Toxoplasma gondii .В литературе имеются лишь ограниченные данные о ранних стадиях этого заболевания у плодов и младенцев. Целью нашего исследования было охарактеризовать гистопатологические особенности глаз 10 плодов и 2 новорожденных с врожденным токсоплазмозом.
Методы С помощью световой микроскопии исследовали 15 глаз от 10 плодов, 3 глаза от 2 недоношенных детей и оба глаза 2-летнего ребенка с врожденным токсоплазмозом. Был проведен иммуногистохимический анализ для идентификации воспалительных клеток и антигенов T gondii .Результаты на инфицированных глазах сравнивали с данными контрольных глаз того же возраста.
Результаты Характерными признаками были ретинит (10/18 глаз), некроз сетчатки (4/18 глаз), нарушение пигментного эпителия сетчатки (12/18 глаз), а также воспаление и гиперемия сосудистой оболочки (15/18 глаз). Неврит зрительного нерва присутствовал в 5 из 8 глаз плода с ассоциированным зрительным нервом, доступным для оценки. Глаз, полученный у 32-недельного плода, имел розетки сетчатки на краю рубца.Т-клетки преобладали в поражениях сетчатки и сосудистой оболочки. Паразиты были идентифицированы иммуногистохимическим анализом в 10 из 18 глаз.
Выводы Глазной токсоплазмоз вызывает необратимое повреждение сетчатки внутриутробно. У плода и младенца развиваются воспалительные реакции, которые могут способствовать повреждению глаз. Эти результаты имеют важное значение для программ серологического скрининга и внутриутробной терапии.
Глазной токсоплазмоз является основной причиной ухудшения зрения и составляет от 30% до 50% всех случаев заднего увеита. 1 Люди могут заразиться простейшим паразитом, Toxoplasma gondii , проглатывая тканевые цисты в мясе инфицированных животных или ооцисты, выделяемые с фекалиями недавно инфицированных кошек. Если женщина заразилась впервые во время беременности, трансплацентарная передача T gondii может привести к врожденному токсоплазмозу у ее ребенка. По оценкам, врожденная инфекция ежегодно поражает 3000 младенцев, рожденных в Соединенных Штатах. Это стоит от 0 долларов.4 и 8,8 миллиардов долларов в год на медицинское обслуживание этих детей и последующую потерю производительности. 2 -4
Хотя врожденная инфекция может поражать любой орган, наиболее частым проявлением является заболевание глаз. 5 -7 Проспективное клиническое исследование, проведенное Чикагской исследовательской группой по изучению токсоплазмоза в рамках Национального исследования совместного лечения в США, определило офтальмологические проявления врожденного токсоплазмоза у лиц, как леченных, так и нелеченных в течение первого года жизни. 8 Ретинохориоидальные рубцы были наиболее частыми находками, присутствующими у 79% пациентов. У 29% пациентов наблюдалась значительная двусторонняя потеря зрения, а еще у 28% — односторонняя потеря зрения.
В нескольких отчетах описаны патологические особенности глазных поражений у взрослых, детей и младенцев. 9 -12 К ним относятся очаговые ретинохориоидальные рубцы в заживших поражениях и некроз сетчатки при активных поражениях. Однако ранние стадии токсоплазмоза глаз во время острой инфекции плода не были широко изучены.Мы нашли только одно исследование 4 плодов в возрасте от 22 до 27,5 недель. 13 В 2 из этих случаев глаза были нормальными; тем не менее, в двух других случаях были выявлены некроз сетчатки, неоваскуляризация и выраженное хориоретинальное воспаление.
Целью нашего исследования было документировать глазные поражения у 10 плодов, 2 младенцев и 2-летнего ребенка с врожденным токсоплазмозом, охарактеризовать ассоциированные воспалительные клетки и определить, присутствовали ли паразиты.Глаза изучали с помощью стандартной световой микроскопии, а также с помощью иммуногистохимических методов для выявления инфильтрирующих воспалительных клеток и антигенов T gondii . Полученные данные сравнивали с уже описанными и коррелировали с признанными клиническими признаками и симптомами.
Пятнадцать глаз были взяты после смерти у 10 плодов с врожденным токсоплазмозом. Эти глаза поступили из Франции, где с 1978 года проводится рутинный серологический скрининг на инфекцию T gondii .Материнские инфекции были подтверждены сероконверсией как в тесте с красителем Сабина-Фельдмана, так и в анализе агглютинации с иммуносорбентом IgM. Плоды были прерваны между 19 и 32 неделями беременности после положительного диагноза токсоплазмоза с помощью полимеразной цепной реакции, которая продемонстрировала присутствие гена T gondii B1 в амниотической жидкости. 14 До прерывания беременности в 5 случаях были получены дополнительные доказательства тяжелой инфекции T gondii , о чем свидетельствует внутримозговая дилатация желудочков на УЗИ.В 6 случаях мать получала терапию спирамицином в попытке предотвратить трансплацентарную передачу паразита. Спирамицин не может проникать через плаценту и не лечит инфекцию у плода. Мать 26-недельного плода получала терапию пириметамином и сульфадиазином в течение 3 недель до прерывания беременности. В большинстве случаев для подтверждения диагноза проводили аутопсию и / или субинокуляцию плацентарной ткани, околоплодных вод или головного мозга мышам. Один плод во втором триместре также был инфицирован цитомегаловирусом.
Младенцы и ребенок в этом исследовании умерли от осложнений врожденного токсоплазмоза. Три глаза младенца были доступны в 2 случаях. Оба ребенка родились преждевременно, один на сроке беременности 34 недели, второй не был зарегистрирован. Младенцы прожили 7 и 5 дней соответственно. Для каждого из этих случаев было либо серологическое подтверждение инфекции в течение жизни, документация вскрытия, либо положительная субинокуляция тканей мышам. Гистопатологические находки одного младенца были ранее описаны в отчете о болезни Френкеля и Фридлендера. 15 У 2-летнего ребенка были хорошо задокументированные изменения тяжелого глазного и церебрального токсоплазмоза, которые были частично вылечены. Этот случай был включен в исследование для сравнения с более ранними стадиями заболевания у плода и младенца.
Глаза нормальных, неинфицированных плодов соответствующего возраста, младенцев и двухлетнего ребенка использовали в качестве контроля. Для этого исследования было получено одобрение институционального наблюдательного совета.
Гистопатологический анализ
Образцы, извлеченные из архивов, уже были залиты парафином.Остальные глаза помещали в 10% забуференный формалин. Их открыли горизонтально, обработали и залили парафином. Срезы (6 мкм) вырезали и окрашивали гематоксилин-эозином и периодной кислотой-Шиффом для световой микроскопии.
Иммуногистохимический анализ
После получения антигена иммуногистохимический анализ на пан-В-клетки (анти-CD20; 1: 200), пан-Т-клетки (анти-CD3; 1:10), CD4 + Т-клетки (анти-CD4; 1:25), CD8 + Т-клетки (анти-CD8; 1:50) и макрофаги (анти-CD68; 1: 100) (все поставляются DAKO, Санта-Барбара, Калифорния) были получены с использованием стандартной методики ABC.Слайды визуализировали с помощью 3-3′-диаминобензидина и окрашивали гематоксилином.
Аналогичным образом, для иммуногистохимического анализа T gondii слайды инкубировали с моноклональным антителом (L43; предоставлено доктором философии Э. Петерсеном, Копенгаген, Дания), которое распознает стадии жизненного цикла как брадизоитов, так и тахизоитов. Иммуногистохимическое окрашивание проводили с использованием метода непрямой щелочной фосфатазы, антищелочной фосфатазы (APAAP).Слайды визуализировали с использованием раствора субстрата APAAP, содержащего нафтол-AS-BI-фосфат (субстрат) и новый фушин (хромаген) (Sigma-Aldrich Chemical Corp, Сент-Луис, Миссури). Это дает красный продукт реакции, который позволяет отличить внеклеточные организмы от коричневых гранул меланина нарушенного пигментного эпителия сетчатки (RPE).
На неинфицированных контрольных глазах соответствующего возраста не было обнаружено повреждений или воспаления.Гистопатологические данные суммированы в таблице 1 и показаны на рисунке 1.
Два глаза у 21- и 26-недельного плода, соответственно, были нормальными. Во всех остальных случаях в переднем сегменте наблюдалось легкое хроническое воспаление радужки и цилиарного тела. В заднем сегменте очаговые поражения сетчатки выявлены на 8 из 15 глаз. Некоторые поражения представляли собой явный некроз сетчатки с нарушением лежащего в основе РПЭ (рис. 1А).Свободные гранулы пигмента были разбросаны по участкам некроза. Другие поражения были лишены сетчатки и состояли из разрушения и пролиферации РПЭ. Сосудистая оболочка, лежащая в основе поражения, была переполнена хроническим воспалением. Был диффузный хориоидит. Поражения различались по размеру от менее 1 мм до более 7 мм у 22-недельного плода. Из 4 случаев, когда были доступны оба глаза, поражения были двусторонними только в 1 случае. Наиболее частым местом поражения был задний полюс, пораженный на 5 глазах.В 3 из этих случаев поражения ограничивались перипапиллярной областью. Остальные глаза имели поражения периферической сетчатки. В 2 случаях поражались как перипапиллярная, так и периферическая сетчатка. Поражение периферической сетчатки 32-недельного плода было необычным по сравнению с другими поражениями сетчатки. В отличие от других случаев, которые демонстрировали доказательства продолжающегося воспаления, в этом поражении почти не было воспалительных клеток. На краю этого поражения сетчатка показала аномальное созревание с потерей различий ядерных слоев и образованием розеток Flexner-Wintersteiner (рис. 1B, внизу).Вдали от этого поражения сетчатка имела созревание, соответствующее гестационному возрасту. Эти проявления были интерпретированы как форма очаговой дисплазии сетчатки. Помимо очаговых поражений сетчатки, в 5 глазах наблюдался глиоз сетчатки и неоваскуляризация (рис. 1С, справа). На 3 глазах, в которых не было выявлено очаговых поражений сетчатки, сетчатка была нормальной на 2 глазах, но имел обширный глиоз и неоваскуляризацию на 1 глазу.
Воспаление распространилось на стекловидное тело 7 глаз с конденсационными полосами, разбросанными воспалительными клетками и некротическими остатками.Остатки оболочки vasculosa lentis обнаружены в 9 глазах. Гиалоидная артерия и первичное стекловидное тело присутствовали в 2 глазах и были окружены воспалительными клетками (рис. 1D).
Зрительный нерв присутствовал на срезах 8 глаз и был нормальным только на 3 глазах. В 5 глазах был лептоменингит, связанный с невритом зрительного нерва (рис. 1E и 1F). В 3 из этих глаз архитектура нерва была нарушена. На 2 глазах с невритом зрительного нерва было перипапиллярное поражение.
Оба глаза 7-дневного младенца имели большую отслойку сетчатки с атрофией фоторецепторов и субретинальным серозным экссудатом (рис. 1С, слева). Обнаружен двусторонний обширный некроз сетчатки с поражениями, простирающимися от pars plana до заднего полюса. Внутри участков некроза сетчатки были разбросаны гранулы пигмента и очаговая кальцификация. Соседний РПЭ был разрушен, показывая тубулоацинарную пролиферацию. Был диффузный хориоидит.В другом месте RPE не был поврежден; однако сетчатка показала отек, глиоз и инфильтрацию мононуклеарных клеток. Был организованный витрит с продолжающимся воспалением. На исследованных срезах зрительный нерв отсутствовал.
В глазу 5-дневного младенца также была большая отслойка сетчатки с субретинальным экссудатом и атрофией фоторецепторов (Рисунок 1C, слева). Однако были только небольшие очаги некроза сетчатки, и РПЭ не был поврежден. Сетчатка показала изменения, аналогичные описанным выше, но, кроме того, были скопления внутриклеточных организмов.Зрительный нерв показал лептоменингит. Полосы конденсации присутствовали в стекловидном теле с некротическими остатками и мононуклеарными клетками. В обоих случаях передний сегмент был нормальным.
На обоих глазах были признаки терминальной стадии болезни. Правый глаз содержал 2 ретинохориоидных рубца, расположенных в заднем полюсе и верхней области периферической сетчатки (рис. 1А, внизу). Поверх этих поражений была организация стекловидного тела. Левый глаз был твердым, частично разрушенным и меньше правого.При открытии передняя камера была неглубокой с катарактой линзой, смещенной в заднюю камеру. В задней камере — массивный глиоз сетчатки.
Результаты были аналогичными для глаз плода и младенца и суммированы в таблице 2 и проиллюстрированы на рисунке 2. Воспалительные клетки, присутствующие в очагах поражения, состояли из лимфоцитов, плазматических клеток и макрофагов. Иммуногистохимическое окрашивание показало как В-, так и Т-лимфоциты.В целом, преобладали Т-лимфоциты, хотя присутствовали разбросанные В-лимфоциты, ограниченные в основном сосудистой оболочкой. Были очаговые скопления Т-лимфоцитов в подлежащих поражениях сосудистой оболочки и в сетчатке, прилегающей к поражениям (рис. 2В). Это были подтипы CD4 + и CD8 +, хотя преобладали клетки CD4 + (рис. 2C). Кроме того, в случаях с невритом зрительного нерва нерв содержал В-клетки, а также Т-клетки подтипов CD4 + и CD8 +. Подобно воспалительному инфильтрату в сетчатке и сосудистой оболочке, CD4 + Т-клетки преобладали в зрительных нервах.Глаз 32-недельного плода и оба глаза 2-летнего ребенка содержали только редкие лимфоциты. В 2 глазах плода в хориоидеи, лежащей в основе поражений сетчатки, были обнаружены многочисленные макрофаги (рис. 2D). Во всех остальных глазах в сосудистой оболочке глаза обнаруживались только случайные макрофаги.
Иммуногистохимическое окрашивание на T gondii было отрицательным в контрольных глазах. Результаты суммированы в Таблице 2 и проиллюстрированы на Рисунках 2 E и 2F.Тканевые кисты не были обнаружены с помощью световой микроскопии ни в одном из глаз, хотя, как упоминалось ранее, скопления внутриклеточных организмов были идентифицированы в глазу 5-дневного младенца. 15 Иммуногистохимический анализ T gondii антигенов продемонстрировал наличие внеклеточных организмов и аморфных антигенов в 10 глазах (7 плодов, 3 новорожденных и 0 детей) и 9 глазах (6 плодов, 3 новорожденных и 0 детей) соответственно. В глазах плода паразиты были наиболее многочисленны в сетчатке, непосредственно прилегающей к участкам некроза.В глазу 5-дневного младенца, помимо групп внутриклеточных паразитов, видимых с помощью световой микроскопии, многочисленные внеклеточные паразиты были обнаружены в аномальной сетчатке с иммуногистохимическим окрашиванием. В одном месте были обнаружены паразиты, окружающие внутренний сосуд сетчатки. В глазу 7-дневного младенца было идентифицировано очень мало паразитов, несмотря на наличие обширного некроза.
Паразиты не были идентифицированы в сосудистой оболочке, несмотря на наличие множества воспалительных клеток.В 1 глазу плода с невритом зрительного нерва несколько внеклеточных паразитов были идентифицированы в периваскулярном пространстве вокруг центральных сосудов сетчатки. Однако в веществе зрительного нерва паразитов не обнаружено.
Ретинит, некроз сетчатки и нарушение РПЭ с выраженным воспалением и застоем сосудистой оболочки — характерные признаки в глазах плодов с врожденным токсоплазмозом. Эти поражения представляют собой необратимые повреждения сетчатки в утробе матери.Они часто поражают обширные области, включая перипапиллярную область, задний полюс и периферическую сетчатку. У двух младенцев в этом исследовании было тяжелое глазное заболевание с некрозом сетчатки, отслоением сетчатки и большим субретинальным экссудатом. В выжившей сетчатке наблюдались неоваскуляризация и глиоз. Большая часть этих повреждений, должно быть, произошла в утробе матери, поскольку послеродовое выживание составляло всего несколько дней.
Невозможно задокументировать кинетику инфекции T gondii у плодов человека в утробе матери.В этом исследовании время от сероконверсии матери до диагностики плода и последующего прерывания беременности оценивается как максимальная продолжительность инфицирования плода в среднем 11,5 недель. Однако на самом деле он, вероятно, намного короче, чем это, потому что существует задержка между инфицированием матери и плода. 16 Продолжительность этой отсрочки варьируется, но может превышать 16 недель. Кроме того, может возникнуть задержка между инфицированием плода и поражением глаз. Кроме того, в отличие от модели на животных, при инфекциях человека редко возможно задокументировать клональное происхождение паразита (т. Е. Клональный тип I, II или III), стадию жизненного цикла паразита 17 или размер посевного материала. которым инфицирована мать.Несмотря на эти разные параметры, результаты исследования глаз плода очень похожи и, кажется, представляют собой континуум одного и того же процесса. В частности, некроз сетчатки возникает при острых поражениях глазного токсоплазмоза. По мере заживления этих повреждений остается ранний рубец, лишенный нормальной сетчатки, но с разрастанием RPE. Конечной стадией этого процесса является образование ретинохориоидального рубца. Подобные рубцы в конечной стадии были видны на глазах у 2-летнего ребенка.
Острый ретинит с некрозом может также наблюдаться у детей и взрослых после реактивации токсоплазмоза глаз. 10 Это редко бывает так обширно, как у плода, за исключением иммунодефицитного хозяина. 18
Клинически установленные ретинохориоидальные рубцы были идентифицированы при рождении у некоторых младенцев, 8 , 19 , что означает, что повреждение глаза, заживление и восстановление могут происходить внутриутробно. Действительно, ретинохориоидный рубец, почти лишенный воспалительных клеток, был основной аномалией, обнаруженной в глазу 32-недельного плода. Прилегающие к этому рубцу дезорганизация сетчатки и розетки, которые, как мы считаем, представляют собой форму дисплазии сетчатки, были необычным открытием.Дисплазия сетчатки чаще всего возникает при множественных врожденных аномалиях, связанных с хромосомными аберрациями. 20 , 21 При аутопсии этот плод (случай 10) не был дисморфическим и не имел никаких признаков каких-либо пороков развития, кроме тех, которые связаны с врожденным токсоплазмозом. Кроме того, дисплазия сетчатки была ограничена областью, непосредственно прилегающей к рубцу.
Насколько нам известно, это первое сообщение о дисплазии сетчатки, связанной с инфекцией T gondii .Было несколько сообщений об инфекционных агентах, отличных от T gondii , вызывающих дисплазию сетчатки у животных. Например, дисплазия сетчатки развивается у двухдневных хомячков, но не у 25-дневных хомяков после внутримозгового введения вируса кори. 22 Точно так же дисплазия сетчатки была наиболее частой находкой после внутриглазной инъекции вируса лейкемии кошек эмбриональным котятам. 23 Наконец, собачья герпесвирусная инфекция у щенков вызывает тяжелое воспаление глаз с последующей дисплазией сетчатки. 24 Механизм (ы), посредством которых эти инфекционные агенты вызывают аномальное развитие сетчатки, еще предстоит определить. Однако было высказано предположение, что прогрессирующая дезорганизация сетчатки и некроз сопровождаются дифференциальным восстановлением слоев сетчатки. 23 -25 Кроме того, RPE, по-видимому, важен для нормального развития сетчатки. 20 , 21 Следовательно, нарушение РПЭ также может способствовать дисплазии сетчатки и образованию розетки, возможно, из-за потери полярности клеток сетчатки или отсутствия специфических факторов роста или созревания, продуцируемых РПЭ. 26 , 27 При глазном токсоплазмозе возникают как некроз сетчатки, так и нарушение РПЭ. Следовательно, эта форма дисплазии сетчатки может представлять собой редкое осложнение ранней инфекции T gondii , когда поражение происходит до организации слоев сетчатки.
Расположение поражений важно, потому что пациенты подвержены риску потери зрения, если поражены такие ткани, как макула или зрительный нерв. Согласно клиническим исследованиям, у пациентов с врожденным токсоплазмозом наблюдается явная предрасположенность к макулярной области.В исследовании Чикаго периферические рубцы присутствовали у 64% пациентов, тогда как рубцы желтого пятна присутствовали у 58%. 8 Учитывая гораздо меньшую площадь желтого пятна, эти результаты подтверждают предпочтение макулярной области.
Развитие макулярной области заметно замедлено по сравнению с развитием остальной части сетчатки, и дифференцировка в этой области продолжается, по крайней мере, в течение первых 4 лет жизни. 28 Ввиду отсутствия специализации и небольшого размера мы не смогли идентифицировать макулярную область в глазах плода или младенца.Однако там, где поражения были обширными и затрагивали задний полюс, вероятно, были вовлечены клетки, образующие макулу.
При врожденной инфекции T gondii , вероятно, достигает глаза гематогенным путем. Идентификация паразитов вокруг внутреннего сосуда сетчатки в одном из наших случаев подтверждает гематогенный путь. Следовательно, это пристрастие к заднему полюсу может отражать тот факт, что он васкуляризуется раньше в развитии, чем другие части сетчатки.Кроме того, хотя макула бессосудистая, она получает кровоснабжение от концевых артериол, которые образуют вокруг нее капиллярное сплетение. Попадание паразитов в эти капилляры может способствовать возникновению инфекции в этой чувствительной области глаза.
Зрительный нерв присутствовал на срезах только 8 глаз плода; однако неврит зрительного нерва присутствовал у 5 из них с нарушением нормальной архитектуры нерва в 3 случаях. Искажение структуры нерва может представлять собой еще один случай, когда воспаление структуры на ранних сроках беременности приводит к ее аномальному развитию.Из-за отсутствия соответствующих нейронных связей атрофия зрительного нерва может быть клиническим исходом у выживших пациентов. В чикагском исследовании атрофия зрительного нерва присутствовала у 20% пациентов с врожденным токсоплазмозом. 8 Однако известно, что у плодов в нашем исследовании внутричерепное заболевание с дилатацией желудочков, а неврит зрительного нерва может просто отражать тяжесть энцефалита. Папиллит, отек диска зрительного нерва и атрофия зрительного нерва являются признанными клиническими проявлениями токсоплазматического энцефалита. 8 , 29
Истинный неврит зрительного нерва — редкое осложнение реактивации заболевания, хотя T gondii может поражать диск зрительного нерва или сетчатку, непосредственно прилегающие к диску зрительного нерва, что приводит к папиллиту, который иногда называют юкстапапиллярным ретинитом Дженсена . 30 Это может представлять собой клинический коррелят для 2 случаев неврита зрительного нерва, связанного с перипапиллярным поражением. Оптический неврит с некрозом и многочисленными паразитами был описан у пациента с глазным токсоплазмозом, ассоциированным с вирусом иммунодефицита человека, 31 , и у пациента с молниеносной врожденной инфекцией. 32 Это привело к предположению, что врожденные инфекции могут передаваться в глаз из головного мозга через зрительный нерв. В качестве альтернативы паразиты, заражающие зачаток глаза, могут сопровождать его в развивающийся глаз. Однако в наших случаях, несмотря на воспаление и нарушение нормальной нервной архитектуры, некроза или паразитов не было. Возможно, воспалительная реакция убила паразитов в зрительном нерве. Однако маловероятно, что зрительный нерв является обычным средством распространения T gondii в глаз.Действительно, присутствие паразитов в зрительном нерве может просто отражать гематогенное распространение через глазные ветви офтальмологической артерии. Это подтверждается обнаружением нескольких паразитов, окружающих центральную артерию сетчатки в одном глазу плода.
Иммунитет к T gondii требует клеточно-опосредованного иммунного ответа, который включает макрофаги, естественные клетки-киллеры и их монокины и цитокиновые продукты. 33 В частности, интерферон γ (IFN-γ), по-видимому, является критическим цитокином для эффективного иммунитета. 34 Плод и новорожденный чрезмерно восприимчивы к инфекциям, вызываемым внутриклеточными патогенами, такими как T gondii . Тем не менее, наличие воспалительных клеток в глазах инфицированных плодов предполагает, что плод способен вызывать, хотя и менее эффективный, иммунный ответ на инфекцию T gondii . На ранних сроках беременности количество Т-клеток и их репертуар для распознавания антигенов ограничены по сравнению со второй половиной беременности. 35 Действительно, у младенцев с врожденным токсоплазмозом отсутствуют или снижены бластогенные ответы лимфоцитов на антиген T gondii , и продукция интерлейкина 2 и IFN-γ снижена. 36 Их лимфоциты, однако, способны нормально реагировать на другие раздражители. Эта анергия к T gondii может отражать различия в путях приобретения, цитокиновом окружении или костимулирующих молекулах, присутствующих во время беременности. Мышиные модели показали, что цитокины IFN-γ, фактор некроза опухоли α и лимфоциты CD4 + и CD8 + важны при приобретенном токсоплазмозе глаза. 37 Поскольку Т-лимфоциты явно присутствуют в глазу плода во время инфицирования, сниженная продукция IFN-γ или других цитокинов этими лимфоцитами может способствовать разрушению тканей из-за неконтролируемой пролиферации паразитов.В наших будущих исследованиях мы изучим локальную продукцию цитокинов и распределение костимулирующих молекул в этих глазах плода с помощью иммуногистохимических методов.
Тканевые кисты не были идентифицированы в глазах любого из плодов или младенцев с помощью световой микроскопии, хотя они были обнаружены в головном мозге 5 из 7 плодов и 1 младенца. У иммунокомпетентного взрослого человека тканевые кисты могут быть обнаружены на краю ретинохориоидных рубцов или внутри нормально нормальной сетчатки на некотором расстоянии от предыдущих поражений. 38 Инцистментация обычно происходит с началом эффективного иммунитета, и исследования показали роль иммунных медиаторов, таких как IFN-γ, в превращении тахизоитов в брадизоит и, следовательно, в образовании кист. 39 Внеклеточные организмы присутствовали в поражениях, особенно в областях некроза, и многочисленные внутриклеточные паразиты присутствовали в 1 случае младенца. Это может отражать ранний острый характер этого заболевания глаз, а также отсутствие эффективного иммунитета.
Наша работа демонстрирует, что серьезные необратимые заболевания глаз могут возникать внутриутробно.Это открытие имеет важное значение для лечения плода и младенца. В таких странах, как Франция, где есть программы пренатального скрининга, исследования показывают, что лечение противомикробными препаратами в утробе матери может уменьшить количество заболеваний глаз, вызываемых этим паразитом. 40 , 41 Точно так же раннее постнатальное лечение токсоплазмоза связано с быстрым разрешением активного ретинохориоидита. 8 Документирование ранних стадий этого заболевания при неудачных беременностях, следовательно, важно для проведения клинических сравнений и оценки эффективности лечения.Дальнейшие исследования для изучения глазного иммунного ответа могут помочь нам понять сложные взаимодействия между незрелым хозяином и T gondii в глазу. Нетоксичное, нетератогенное лекарство, проникающее через плаценту и убивающее тахизоиты и брадизоиты, и которое можно использовать на ранних сроках беременности, как только необходимо диагностировать инфекцию.
Принята к печати 23 июня 2000 г.
Эта работа была поддержана грантом AI 27530 Национального института здоровья, Бетесда, Мэриленд; Research to Prevent Blindness Inc, Нью-Йорк, штат Нью-Йорк; и Научно-исследовательский институт токсоплазмоза, Чикаго, Иллинойс.Доктор Робертс получил стипендию от Патологического общества Великобритании и Северной Ирландии в Лондоне. Доктор Маклеод — профессор исследования Джулса и Дорис Штайн по предотвращению слепоты в Чикагском университете.
Мы благодарим Джека Френкеля, MD, PhD, за предоставленные материалы, полезные обсуждения и советы. Мы также благодарим Вики Эйчисон и Эллен Холфельс за их прекрасную помощь в подготовке рукописи.
Автор, отвечающий за переписку, и перепечатки: Рима МакЛеод, доктор медицины, Департамент офтальмологии / визуальных наук, Чикагский университет, 939 E 57th St, Chicago, IL 60637 (электронная почта: rmcleod @ midway.uchicago.edu).
1.McCannel Холланд GNHelm CJ и другие. Причины увеита в общей практике офтальмологии. Am J Ophthalmol. 1996; 12135-46Google Scholar2.Roberts Т.Френкель JK Оценка потерь дохода и других предотвратимых затрат, вызванных токсоплазмозом у людей в Соединенных Штатах. J Am Vet Med Assoc. 1990; 196249-256 Google Scholar3. Робертс TMurrell KDMarks S Экономический ущерб от паразитарных болезней пищевого происхождения. Паразитол сегодня. 1994; 10419-423Google ScholarCrossref 4. Wilson CBRemington JS Что можно сделать, чтобы предотвратить врожденный токсоплазмоз? Am J Obstet Gynecol. 1980; 138357-363Google Scholar5.Couvreur JDesmonts GTournier GSzuterkac M Однородная серия из 210 случаев врожденного токсоплазмоза у детей в возрасте от 0 до 11 месяцев, выявленных проспективно. Ann Pediatr (Париж). 1984; 31815-819Google Scholar6.McAuley JBoyer КМПатель D и другие.Ранние и продольные оценки младенцев и детей, получавших лечение, и нелеченных исторических пациентов с врожденным токсоплазмозом: испытание коллаборативного лечения в Чикаго. Clin Infect Dis. 1994; 1838-72Google ScholarCrossref 7.Koppe JGLoewerSieger DHDe RH Результаты 20-летнего наблюдения по поводу врожденного токсоплазмоза. Ланцет. 1986; 1254-256Google ScholarCrossref 8.Mets MBHolfels EBoyer Км и другие. Глазные проявления врожденного токсоплазмоза. Am J Ophthalmol. 1996; 122309-324Google Scholar 10. Циммерман Л.Е. Глазная патология токсоплазмоза. Surv Ophthalmol. 1961; 6832-838Google Scholar 12.Хоган MJ Глазной токсоплазмоз . Нью-Йорк, издательство Колумбийского университета штата Нью-Йорк, 1951;
13.Brézin APKasner LThulliez п и другие. Глазной токсоплазмоз у плода: иммуногистохимический анализ и амплификация ДНК. Retina. 1994; 1419-26.Hohlfeld PDaffos FCosta J-MThulliez П.Форестье FCox Vidaud M Пренатальная диагностика врожденного токсоплазмоза с помощью теста на полимеразную цепную реакцию околоплодных вод. N Engl J Med. 1994; 331695-699Google ScholarCrossref 15.Frenkel JKFriedlander S Патология неонатальных заболеваний. Патогенез, диагностика и лечение. Вашингтон, округ Колумбия Департамент общественного здравоохранения США 2951; публикация службы общественного здравоохранения 141
16.Ремингтон JSMcLeod RDesmonts G Токсоплазмоз. Ремингтон JSKlein JOeds Инфекционные болезни плода и новорожденного. 4-я Филадельфия, Пенсильвания У. Б. Сондерс, 1995; 140 — 263 Google Scholar 17 Сибли LDBoothroyd JC Вирулентные штаммы Toxoplasma gondii составляют единственную клональную линию. Природа. 1992; 35982-85Google ScholarCrossref 18. Голландия GN Глазной токсоплазмоз у хозяина с ослабленным иммунитетом. Int Ophthalmol. 1989; 13399-402Google ScholarCrossref 19. Геррина NGHsu HWMeissner HC и другие. Серологический скрининг новорожденных и раннее лечение врожденной инфекции Toxoplasma gondii . N Engl J Med. 1994; 3301858-1863Google ScholarCrossref 20.Fulton ABCraft JLHoward РОАльберт DM Дисплазия сетчатки глаза человека. Am J Ophthalmol. 1978; 85690-698Google Scholar22.Khalifa MARodrigues MMRajagopalan SSwoveland P Патология глаз, связанная с коричным энцефалитом у хомяков. Arch Virol. 1991; 119165-173Google ScholarCrossref 23. Альберт Д.М.Лахав MColby EDShadduck JASang DN Неоплазия и дисплазия сетчатки, I: индукция вирусом лейкемии кошек. Invest Ophthalmol Vis Sci. 1977; 16325-337Google Scholar24.Albert Д.М.Лахав MCarmichael LEPercy DH Собачья дисплазия сетчатки, вызванная герпесом, и связанные с ней глазные аномалии. Инвест офтальмол. 1976; 15267-278 Google Scholar 25.Пархад IMJohnson К.П. Волински JSSwoveland P Ретинопатия кори: модель острых и хронических поражений на хомяке. Lab Invest. 1980; 4352-60Google Scholar 26.Steinberg RH Взаимодействие между пигментным эпителием сетчатки и нервной сетчаткой. Док офтальмол. 1985; 60327-346Google ScholarCrossref 27.Tanihara Хинатани MHonda Y Факторы роста и их рецепторы в сетчатке и пигментном эпителии. Prog Retinal Eye Res. 1997; 16271-301Google ScholarCrossref 28.Yuodelis CAHendrickson Качественный и количественный анализ ямки человека в процессе развития. Vision Res. 1986; 26847-855Google ScholarCrossref 30.Holland GNO’Connor GRBelfort Дж. Р. Ремингтон JS Токсоплазмоз. Pepose JSHolland Г.Н.Вильгельмус Кредс Глазная инфекция и иммунитет Сент-Луис, Мо Мосби, 1996; 1183-1223 Google Scholar 31.Голландия GNEngstrom RE JrGlasgow Минет и другие. Глазной токсоплазмоз у больных с синдромом приобретенного иммунодефицита. Am J Ophthalmol. 1988; 106653-667Google Scholar32.Manshot WADaamen CBF Коннатальный глазной токсоплазмоз. Arch Ophthalmol. 1965; 7449-51 Google Scholar 34.Subauste CJS Роль гамма-интерферона в инфекции Toxoplasma gondii . Eur J Clin Microbiol Infect Dis. 1991; 1058-67Google ScholarCrossref 35.Джордж JF Младший Шредер HW Jr Регуляция развития старая рамка считывания бета и разнообразие соединений в транскриптах Т-клеточного рецептора бета из тимуса человека. J Immunol. 1992; 1481230-1239Google Scholar 36.McLeod RMack DGBoyer K и другие. Фенотипы и функции лимфоцитов при врожденном токсоплазмозе. J Lab Clin Med. 1990; 116623-635Google Scholar 37.Gazzinelli RTBrézin Али QNussenblatt РБЧан CC Toxoplasma gondii : приобретенный глазной токсоплазмоз на мышиной модели, защитная роль TNF-альфа и IFN-гамма. Exp Parasitol. 1994; 78217-229Google ScholarCrossref 38.McMenamin PGDutton GNHay JCameron S Ультраструктурная патология врожденного мышиного токсоплазматического ретинохориоидита, часть I: локализация и морфология кист токсоплазмы в сетчатке. Exp Eye Res. 1986; 43529-543Google ScholarCrossref 39.Bohne WHeesemann JGross U Индукция специфических для брадизоитов антигенов Toxoplasma gondii в макрофагах мышей, обработанных гамма-интерфероном. Infect Immun. 1993; 611141–1145Google Scholar 40.Hohlfeld PDaffos FThulliez п и другие. Токсоплазмоз плода: исход беременности и наблюдение новорожденного после внутриутробного лечения. J Pediatr. 1989; 115765-769Google ScholarCrossref 41.Berrebi А.Кобуч WEBessieres MH и другие. Прерывание беременности при токсоплазмозе матери. Ланцет.

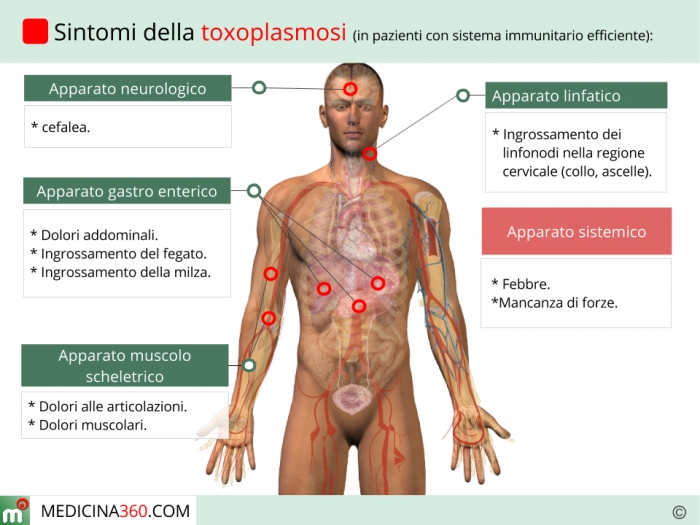
 Токсоплазмы в этой форме часто формируют тканевые псевдоцисты состоящие из множества клеток паразиты покрытых общей защитной оболочкой.
Токсоплазмы в этой форме часто формируют тканевые псевдоцисты состоящие из множества клеток паразиты покрытых общей защитной оболочкой.
 Проявляется гепатолиенальным синдромом, мезаденитом.
Проявляется гепатолиенальным синдромом, мезаденитом.
 В разделе часто задаваемых вопросов.
В разделе часто задаваемых вопросов. Есть ли способ избежать передачи этого моему ребенку?
Есть ли способ избежать передачи этого моему ребенку?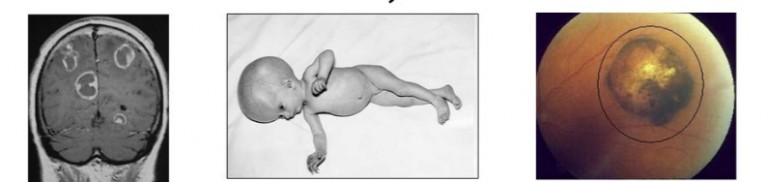
 Кошки, которые охотятся или которых кормят сырым мясом, чаще всего являются укрывателями T. gondii .
Кошки, которые охотятся или которых кормят сырым мясом, чаще всего являются укрывателями T. gondii . В редких случаях токсоплазмоз может передаваться при трансплантации органов или переливании крови.
В редких случаях токсоплазмоз может передаваться при трансплантации органов или переливании крови. Многие люди с ВИЧ / СПИДом также есть токсоплазмоз, либо недавняя инфекция, либо старая инфекция, которая реактивировалась.
Многие люди с ВИЧ / СПИДом также есть токсоплазмоз, либо недавняя инфекция, либо старая инфекция, которая реактивировалась. После приготовления сырого мяса вымойте разделочные доски, ножи и другую посуду в горячей мыльной воде, чтобы предотвратить перекрестное загрязнение других продуктов. Мойте руки после работы с сырым мясом.
После приготовления сырого мяса вымойте разделочные доски, ножи и другую посуду в горячей мыльной воде, чтобы предотвратить перекрестное загрязнение других продуктов. Мойте руки после работы с сырым мясом. Кошки могут заразиться после употребления в пищу зараженной добычи или недоваренного мяса, содержащего паразита.
Кошки могут заразиться после употребления в пищу зараженной добычи или недоваренного мяса, содержащего паразита.