Прогестерон (Progesterone)
Прогестерон (Progesterone)
Прогестерон – это стероидный гормон, основной функцией которого является подготовка организма женщины к беременности. Он вырабатывается жёлтым телом яичников. Каждый месяц эстроген заставляет внутренний выстилающий слой матки – эндометрий – расти и обновляться, в то время как лютеинизирующий гормон (ЛГ) способствует высвобождению яйцеклетки в одном из яичников. На месте высвободившейся яйцеклетки образуется так называемое жёлтое тело, которое вырабатывает прогестерон. Прогестерон вместе с гормоном, выделяемым надпочечниками, останавливает рост эндометрия и подготавливает матку к возможной имплантации оплодотворенной яйцеклетки. Если оплодотворения не происходит, желтое тело исчезает, уровень прогестерона падает и наступает менструальное кровотечение. Если же оплодотворенная яйцеклетка прикрепляется к стенке матки, желтое тело продолжает производить прогестерон. Через несколько недель плацента берет на себя функцию желтого тела по выработке прогестерона, являясь основным источником данного гормона во время беременности.
Подготовка к исследованию
Исследование проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов. Анализ делается на 22-23 день менструального цикла, если другие сроки не указаны лечащим врачом.
Показания к исследованию
При выяснении, нормально ли протекает овуляция (иногда дважды в течение менструального цикла).
При стимулировании овуляции.
При симптомах внематочной беременности и угрозы выкидыша, таких как боли в животе и кровотечение.
Периодически при беременности с повышенным риском ее прерывания для контроля за состоянием плода и плаценты.
Когда у небеременной пациентки маточные кровотечения.
Интерпретация
Референсные значения : еденица измерения нмоль/л.
|
Фаза |
норма |
|
Фоликулярная фаза |
1.0-3.8 |
|
Лютеиновая фаза |
2.3-56.6 |
|
постменопауза |
< 3.2 |
|
Бер.,I триместр |
29.6-106 |
|
Бер.,II триместр |
93. |
|
Бер.,III триместр |
264-509 |
|
Общая норма |
0.86-2.9 |
Причины повышенного уровня прогестерона:
киста яичников, патологическая беременность, а также пузырный занос или хорионкарцинома,
редкие формы опухолей яичников, врождённая гиперплазия надпочечников.
Причины пониженного уровня прогестерона:
токсикоз на поздних сроках беременности, пониженная функциональная активность яичников,
отсутствие менструаций, внематочная беременность, угроза выкидыша.
На результаты могут влиять
На результат может влиять: приём пищевых добавок и фармацевтических препаратов, меняющих концентрацию эстрадиола и прогестерона.
Назначается в комплексе с
Фолликулостимулирующий гормон (ФСГ)
Лютеинизирующий гормон (ЛГ)
Бета-субъединица хорионического гонадотропина человека (бета-ХГЧ)
Тиреотропный гормон (ТТГ)
Тироксин свободный (Т4 свободный)
Определение уровня прогестерона в крови
Краткое описание:Прогестерон – это стероидный гормон, основной функцией которого является подготовка организма женщины к беременности. Он вырабатывается желтым телом яичников.
Синонимы (rus): Стероидный гормон желтого тела яичников
Синонимы (eng): Progesterone
Единицы измерения: Нг/мл (нанограмм на миллилитр)
Методы: Иммунохемилюминесцентный анализ
Подготовка к исследованию:
• Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
• Исключить прием стероидных и тиреоидных гормонов в течение 48 часов до исследования (по согласованию с врачом).
• Не курить в течение 3 часов до исследования.
Тип биоматериала: Венозная кровь
Тип пробирки: Вакуумные пробирки с активатором свертывания крови и гелем (Цвет крышки: красная с желтым кольцом)
Цена услуги: 343 руб
Срок выполнения: один рабочий день.
Референсные значения
Для мужчин: 0,2 – 1,4 нг/мл.
Для женщин: Фолликуляр.фаза 0.2-1.5 нг/мл
Фаза овуляции 0.8-3.0 нг/мл
Постменопауза 0.1-0.8 нг/мл
Беременность: 1 триместр 11,52-47,19 нг/мл
2 триместр 16,54-49,90 нг/мл
3 триместр 61,34-202,09 нг/мл
Причины повышенного уровня прогестерона:
киста яичников,
патологическая беременность, а также пузырный занос или хорионкарцинома,
редкие формы опухолей яичников,
врожденная гиперплазия надпочечников.
Причины пониженного уровня прогестерона:
токсикоз на поздних сроках беременности,
пониженная функциональная активность яичников,
отсутствие менструаций,
внематочная беременность,
угроза выкидыша.
Код: A09.05.151
Анализ крови на прогестерон в Москве. Расшифровка и норма. Сдать анализы в клинике Здоровье ЮАО (Варшавская и Аннино), ЦАО (Краснопресненская и Рижская).
Прогестерон — это стероидный гормон, который есть как в мужских организмах (вырабатывается яичками), так и в женских (вырабатывается яичниками). Также, в малом количестве, прогестерон продуцируют надпочечники. В основном, этот гормон влияет на половую сферу — в частности, при беременности прогестерон способствует закреплению оплодотворённой яйцеклетки и дальнейшему вынашиванию плода.
Что показывает анализ крови на прогестерон?
Анализ прогестерона — это один из основных диагностических методов исследования овуляции. Концентрация данного гормона в женском организме изменяется в соответствии с фазами менструального цикла, а перед овуляцией (при отсутствии нарушений) уровень прогестерона возрастает в 10 раз. Если анализ показывает, что повышения прогестерона нет, это прямое указание на то, что есть какие-то отклонения — возможно, опасные.
Концентрация данного гормона в женском организме изменяется в соответствии с фазами менструального цикла, а перед овуляцией (при отсутствии нарушений) уровень прогестерона возрастает в 10 раз. Если анализ показывает, что повышения прогестерона нет, это прямое указание на то, что есть какие-то отклонения — возможно, опасные.
Недостаточное количество прогестерона при беременности — это потенциальная угроза выкидыша. Исходя из этого, анализ на прогестерон является необходимым мероприятием. В другое время повышение прогестерона указывает на возможность наличия:
- Нарушений менструального цикла
- Кисты желтого тела
- Дисфункциальных маточных кровотечений
- Нарушений развития плаценты
- Нарушения функции надпочечников
- Почечной недостаточности
Нехватка прогестерона может указывать на:
- Нарушенную функцию плаценты либо желтого тела
- Отсутствие овуляции
- Задержку внутриутробного развития плода
- Высокий риск аборта, спровоцированного гормональным дисбалансом
- Хронические воспаления, затрагивающие половые органы
- Маточные кровотечения
Важно учитывать, что повышенный или пониженный прогестерон может быть результатом приёма различных медикаментозных препаратов.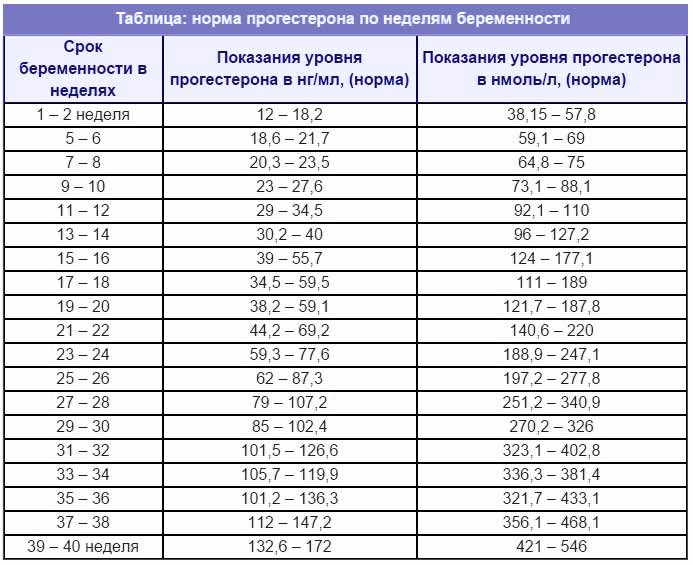
Как делают анализ на прогестерон?
Обычно анализ на прогестерон сдают в период после овуляции — как правило, на 23—24 день (при цикле 29—30 дней). Перед исследованием нужно 8—10 часов ничего не есть и не пить ничего, кроме воды. Анализ сдаётся утром, натощак.
Расшифровка результатов. Нормы прогестерона в крови
Нормы прогестерона (нмоль/л)
Взрослые мужчины:
Взрослые женщины:
- Фолликулярная фаза: от 0,32 до 2,23
- Овуляторная фаза: от 0,48 до 9,41
- Лютеиновая фаза: от 6,99 до 56,63
Беременные женщины:
- 1 триместр: от 8,9 до 468,4
- 2 триместр: от 71,5 до 303,1
- 3 триместр: от 88,7 до 771,5
Где сделать анализ крови на прогестерон?
Обратитесь в медицинский центр «Здоровье». Мы сделаем анализ точно и быстро, подробно объясним его результаты и, при необходимости, предложим необходимое лечение.
Сдать анализ крови на Прогестерон в лаборатории KDL
Прогестерон 7.2.А5.201 Общие сведения.
Прогестерон – это стероидный гормон, продуцируемый желтым телом яичника. Его основная функция – подготовка организма женщины к беременности и сопровождение развития плода на раннем сроке. Под его воздействием прогестерона во второй фазе цикла матка становится готовой к имплантации оплодотворенной яйцеклетки. Если же происходит имплантация оплодотворённой яйцеклетки в матку, то желтое тело продолжает продуцировать прогестерон, а яйцеклетка образует трофобласт, который вырабатывает хорионический гонадотропин человека (ХГЧ). Через несколько недель плацента заменяет желтое тело в качестве основного источника гормона, при этом его уровень сохраняется довольно высоким на протяжении всего срока беременности.
Прогестерон вырабатывается в небольшом количестве в надпочечниках. У мужчин играет важную роль в процессе сперматогенеза.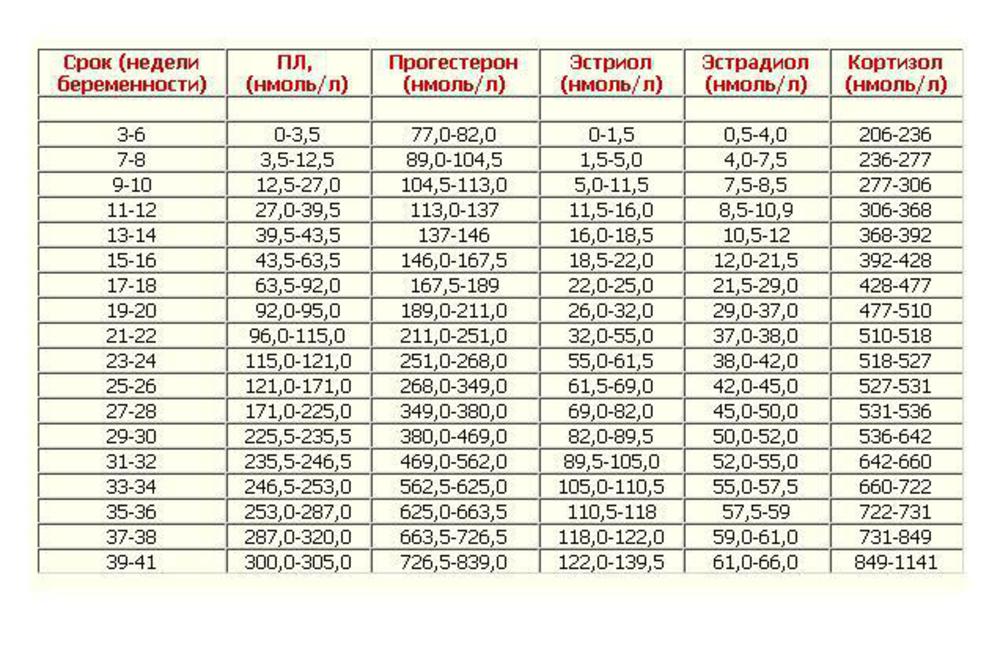
В каких случаях обычно назначают исследование?
Анализ на прогестерон – обычный тест при обследовании женщин с бесплодием или с нарушениями менструального цикла. Его также используют при диагностике внематочной или замершей беременности, совместно с измерением ХГЧ.
Что означают результаты теста?
Интерпретация результатов анализа зависит от причины назначения и требует знания фазы менструального цикла или срока беременности пациентки.
Если уровень прогестерона не повышается и не падает ежемесячно, это говорит об отсутствии овуляции и других нарушениях менструального цикла. Это может быть причиной бесплодия.
Отсутствие повышения концентрации гормона на ранних сроках может указывать на внематочную или замершую беременность, а также быть признаком недостаточной функции желтого тела.
Повышенный уровень прогестерона может наблюдаться при следующих состояниях:
- Нормальная беременность
- Прием гормональных препаратов
- Опухоли яичников
- Врожденная гиперплазия надпочечников
Сроки выполнения теста.

Обычно результат анализа можно получить уже на следующий день.
Как подготовиться к анализу?
Исследование обычно проводится на 19-23 день менструального цикла, если лечащий врач не назначил иначе.
Анализ крови прогестерон сдать платно в Воронеже
Прогестерон относится к стероидным гормонам, присутствует в организме обоих полов, но большее значение имеет для женщин. Данный половой гормон помогает телу готовиться к беременности, влияет на эмбриональное развитие, менструальный цикл. Дефицит или избыток прогестерона — состояния, которые требуют коррекции.
Описание
Синтез прогестерона или прогестина в женском организме происходит в желтом теле яичников в лютеиновую фазу цикла, а при успешном зачатии эту функцию выполняет плацента. Каждый месяц вместе с другими эстрогенами прогестерон создает благоприятные условия для имплантации оплодотворенной яйцеклетки. Если беременность наступает, то достаточный уровень этого гормона позволяет ее сохранить. Прогестерон обладает подавляющим иммунитет свойством, что помогает организму беременной женщины не отторгать плод. В случае же, когда зачатие не произошло, возросший уровень гормона приходит в норму, после чего начинается менструация.
Прогестерон обладает подавляющим иммунитет свойством, что помогает организму беременной женщины не отторгать плод. В случае же, когда зачатие не произошло, возросший уровень гормона приходит в норму, после чего начинается менструация.
Прогестерон выше нормы
Причина повышенного уровня может крыться не только в беременности, некоторые патологии диагностируются по этому признаку, например:
- дисфункция надпочечников
- опухоли яичек
- пузырчатый занос
- печеночная недостаточность
- киста яичника
- прием препаратов некоторых групп.
Высокие уровни гормона в фолликулярной фазе цикла мешают нормальному зачатию, подавляя овуляцию. Кроме того, существует связь между ним и ЖКТ, поэтому избыток прогестина может приводить к набору массы тела, негативно сказываться на пищеварении.
Прогестерон ниже нормы
Дефицит гормона негативно сказывается на здоровье женщины в целом и на протекании беременности в частности. Если у беременной вырабатывается прогестина меньше положенного, то это может быть чревато аномалиями развития плода и высоким риском выкидыша. При низком прогестероне женщины отмечают следующие состояния:
Если у беременной вырабатывается прогестина меньше положенного, то это может быть чревато аномалиями развития плода и высоким риском выкидыша. При низком прогестероне женщины отмечают следующие состояния:
- нарушения менструального цикла
- бесплодие
- низкое либидо
- утомляемость
- отеки и пр.
Анализ крови на прогестерон
Пройти данное исследование целесообразно в рамках контроля над овуляцией и беременностью, для оценки фертильности женщины, при наличии таких симптомов как:
- сложности с зачатием
- аменорея
- выраженный предменструальный синдром
- кровотечения неясного происхождения.
Так как присутствие гормона в крови у женщин имеет зависимость от фазы цикла, сдавать кровь на анализ нужно 21-23 день, при условии, что нет других рекомендаций от врача. Мужчины могут проходить исследование без привязки к дате. Лучшее время для процедуры — утро. Кровь сдается натощак, спустя 8-12 часов от последнего приема пищи. Желательно заранее отменить прием гормональных препаратов, отказаться от алкоголя, избегать перенапряжения любого рода.
Желательно заранее отменить прием гормональных препаратов, отказаться от алкоголя, избегать перенапряжения любого рода.
Сдать кровь на прогестерон в Воронеже предлагает клиника «Детский доктор» в Воронеже. У нас квалифицированный персонал и доступные цены на лабораторную диагностику.
Прогестерон
Прогестерон — гормон беременности. Прогестерон секретирует желтое тело (железа, образующаяся в яичнике после овуляции — выхода яйцеклетки из фолликула). Если зачатие не произошло, желтое тело гибнет через 12-14 дней и начинается менструация. Желтое тело вырабатывает гормон прогестерон до 16 недели беременности — до тех пор, пока сформированная плацента не возьмет на себя самостоятельную выработку гормонов. Прогестерон подготавливает ткани матки к имплантации оплодотворенной яйцеклетки и сохранению беременности. Прогестерон влияет на нервную систему, как бы подготавливая организм к вынашиванию беременности и родам. Прогестерон подавляет активность сокращения мускулатуры матки и реакцию отторжения плодного яйца, стимулирует рост матки. Оказывает влияние прогестерон и на развитие тех отделов молочных желез, которые отвечают за выработку молока. Кроме того, прогестерон стимулирует выработку кожного сала.
Оказывает влияние прогестерон и на развитие тех отделов молочных желез, которые отвечают за выработку молока. Кроме того, прогестерон стимулирует выработку кожного сала.
Прогестерон вырабатывается не только в яичниках, некоторое количество прогестерона вырабатывают надпочечники, поэтому прогестерон одновременно и женский гормон, и мужской, хотя и значительно ниже нормы прогестерона у женщин.
Анализ прогестерона — незаменимый метод исследования овуляции. Его уровень в организме женщины колеблется в зависимости от фазы менструального цикла. В норме прогестерон перед овуляцией повышается в 10 раз. Если повышения его уровня не происходит, значит возможны различные отклонения в организме женщины.
Во время беременности наблюдается постепенное повышение уровня прогестерона между 9 и 32 неделями и часто в 100 раз превышает уровень до начала беременности. Концентрация прогестерона выше в случае многоплодной беременности, по сравнению с одноплодной. Нехватка прогестерона во время беременности может приводить к ее прерыванию. Поэтому анализ прогестерона — необходимый этап в диагностике состояние плода во второй половине беременности.
Поэтому анализ прогестерона — необходимый этап в диагностике состояние плода во второй половине беременности.
Если прогестерон повышен, для врача этот результат анализа крови дает основания предполагать беременность, дисфункциональные маточные кровотечения, нарушения менструального цикла (аменорея), отклонения в развитии плаценты, кисту желтого тела, почечную недостаточность, отклонения в образовании гормонов в надпочечниках. Повышенный уровень прогестерона может быть следствием приема некоторых медицинских препаратов.
Недостаток прогестерона может быть симптомом следующих отклонений в организме женщины: отсутствие овуляции, недостаточная функция желтого тела или плаценты, угрожающий аборт как следствие гормонального дисбаланса, задержка внутриутробного развития плода, истинное перенашивание беременности, хронические воспалительные заболевания женской половой сферы, маточные кровотечения, нарушения менструального цикла (аменорея). Низкий прогестерон может быть следствием приема некоторых лекарственных препаратов.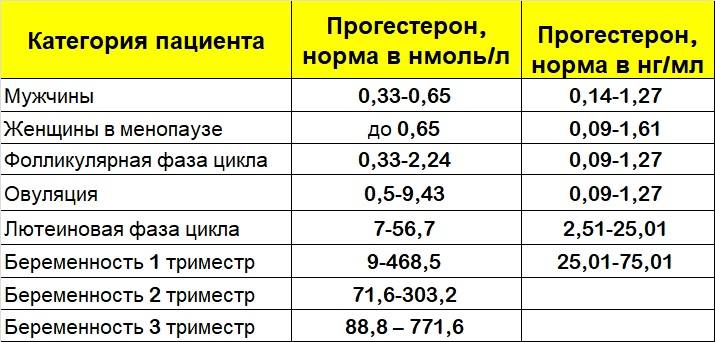
Обычно врачи советуют женщинам сдавать кровь на анализ прогестерона на 19-21 день менструального цикла. Между последним приемом пищи и взятием крови u1076 должно пройти не менее 8 часов. Если у Вас регулярный менструальный цикл, то уровень прогестерона определяют за неделю до менструации, при нерегулярном цикле — несколько раз. Мужчинам анализ на прогестерон можно сдавать в любой день.
Прогестерон (S-Prog) – SYNLAB Eesti
Прогестерон – это стероидный гормон, который синтезируется в яичниках, но, в отличие от эстрадиола,, в основном, в corpus luteum и при беременности в плаценте. Прогестерон стимулирует секрецию желез эндометрия, подготавливая его для имплантации оплодотворенной яйцеклетки и уменьшая контрактильность матки при беременности. Увеличенный синтез прогестерона в лютеиновую фазу повышает базальную температуру на 0,3-0,5°C. Синтез прогестерона в желтом теле индуцируют LH и hCG, прогестерон же в свою очередь ингибирует синтез гонадотропинов. Для проявления биологического действия прогестерона необходима эстрогенная стимуляция.
Для проявления биологического действия прогестерона необходима эстрогенная стимуляция.
Показания:
- Диагностика гипофункции corpus luteum (оценка риска раннего спонтанного аборта)
- Определение овуляторного и неовуляторного цикла
- Определение внематочной беременности (определяется вместе с hCG)
- Контроль при лечении прогестероном Метод анализа: Хемилюминисцентный метод
Референтные значения:
| < 11 л | 0,67 – 3,5 nmol/L |
| Фаза фолликула, Ж | < 2,89 nmol/L |
| Лютеиновая фаза, Ж | 8,58 – 68,4 nmol/L |
| Постменопауза, Ж | < 1,24 nmol/L |
| Беременные I триместр, Ж | 13,0 –108 nmol/L |
| Беременные II триместр, Ж | 76 – 241 nmol/L |
| Беременные III триместр, Ж | 165 – 960 nmol/L |
| > 11 л M | < 4,11 nmol/L |
Интерпретация результата:
- Определение концентрации прогестерона подходит для оценки функции corpus luteum.
 Значение прогестерона больше 25 nmol/L на 7 день после предполагаемой овуляции – признак овуляторного цикла. Для более точной оценки функции желтого тела рекомендуется назначать анализ за 4 -10 дней до начала нового менструального цикла три раза с трехдневными интервалами.
Значение прогестерона больше 25 nmol/L на 7 день после предполагаемой овуляции – признак овуляторного цикла. Для более точной оценки функции желтого тела рекомендуется назначать анализ за 4 -10 дней до начала нового менструального цикла три раза с трехдневными интервалами. - Функция желтого тела считается нормальной, если сумма трех полученных измерений содержания прогестерона >60 nmol/L.
- Определение прогестерона вместе с ультразвуковой диагностикой помогает диа- гностировать эктопическую беременность. Если на 5 неделе беременности значение прогестерона остается ниже 48 nmol/L, то с большой вероятностью беременность внематочная.
Тест на прогестерон в сыворотке: цель, результаты и риски
Что такое тест на прогестерон в сыворотке?
Прогестерон — это гормон, который вырабатывается вашим организмом. Его производят и мужчины, и женщины. Но в основном он вырабатывается в яичниках, а это значит, что у женщин его, как правило, больше.
У мужчин прогестерон участвует в образовании сперматозоидов или сперматогенезе. У женщин это помогает подготовить матку к оплодотворению яйцеклетки. Если вы забеременели, прогестерон поможет вам сохранить беременность.
У женщин это помогает подготовить матку к оплодотворению яйцеклетки. Если вы забеременели, прогестерон поможет вам сохранить беременность.
Прогестерон также подавляет выработку молока во время беременности. Когда вы начинаете роды, уровень прогестерона падает, что способствует выработке молока.
Чтобы измерить уровень прогестерона в крови, ваш врач может назначить анализ сывороточного прогестерона. Они могут заказать его, если у вас возникнут проблемы с беременностью. Результаты могут дать им представление о том, происходит ли у вас овуляция. В свою очередь, это может помочь им диагностировать потенциальные проблемы с фертильностью и управлять ими.
Ваш врач также может назначить этот тест, если вы беременны и подозревают, что у вас есть риск внематочной беременности или выкидыша. Внематочная беременность происходит, когда оплодотворенная яйцеклетка прикрепляется к фаллопиевой трубе, брюшной полости или шейке матки, а не к матке. Выкидыш случается, когда вы теряете плод на ранних сроках беременности. Оба вызывают низкий уровень прогестерона.
Оба вызывают низкий уровень прогестерона.
Для проведения анализа сывороточного прогестерона ваш врач возьмет образец вашей крови для отправки в лабораторию.
Они могут попросить вас предпринять определенные шаги для подготовки к тесту. Например, вам следует сообщить своему врачу о любых лекарствах, которые вы принимаете. Некоторые лекарства, такие как противозачаточные таблетки и добавки с прогестероном, могут повлиять на результаты вашего теста.
Некоторые лекарства, такие как антикоагулянты, также могут повысить риск осложнений после взятия крови. Ваш врач может попросить вас прекратить прием определенных лекарств до того, как вы сдадите кровь.
Ваш врач может взять образец вашей крови в своем кабинете или отправить вас в другое место для сдачи крови.Человек, собирающий вашу кровь, начнет с очистки участка вашей кожи прямо над веной.
Затем они вставят иглу в вашу вену. Через иглу они наберут кровь во флакон или пробирку. Затем они отправят ваш образец крови в лабораторию для анализа.
Каждый раз, когда у вас берется кровь, вы сталкиваетесь с некоторыми рисками. Для большинства людей эти риски незначительны.
Вероятно, вы почувствуете некоторую боль, когда игла введена в вену. И у вас может начаться кровотечение в течение нескольких минут после удаления иглы.Синяк также может образоваться в области, окружающей место прокола.
Более серьезные осложнения возникают редко. К ним относятся обморок, воспаление вены и инфекция в месте прокола. Если у вас нарушение свертываемости крови, риск взятия крови выше.
Уровень прогестерона в сыворотке будет измеряться в нанограммах на децилитр (нг / дл). Как только ваши результаты будут готовы, лаборатория отправит их вашему врачу. Нормальные результаты могут различаться в зависимости от вашего пола, возраста, менструального цикла и того, беременны вы или нет.
Если вы женщина, у которой менструация, уровень прогестерона в крови должен быть низким в начале каждого менструального цикла. Он должен достигнуть своего пика через несколько дней после овуляции.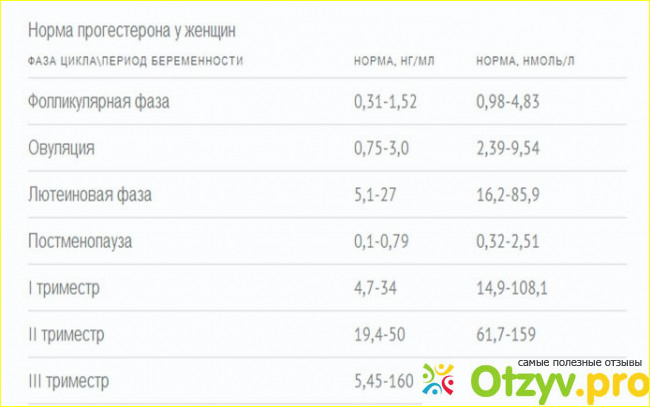 Затем он должен вернуться к низкому уровню, если вы не забеременели.
Затем он должен вернуться к низкому уровню, если вы не забеременели.
Нормальные результаты анализов
В целом нормальные результаты анализа сывороточного прогестерона попадают в следующие диапазоны:
- мужчин, женщин в постменопаузе и женщин в начале менструального цикла: 1 нг / мл или менее
- женщин в в середине менструального цикла: от 5 до 20 нг / мл
- беременных женщин в первом триместре: 11.От 2 до 90 нг / мл
- беременных женщин во втором триместре: от 25,6 до 89,4 нг / мл
- беременных женщин в третьем триместре: от 48,4 до 42,5 нг / мл
Аномальные результаты анализов
Результаты ваших анализов считаются ненормальными если они выходят за пределы нормального диапазона. В некоторых случаях один ненормальный результат теста отражает нормальные колебания уровня прогестерона.
Уровень прогестерона может сильно колебаться даже в течение одного дня. В других случаях аномально высокий или низкий уровень прогестерона может быть признаком основной проблемы со здоровьем.
Помимо беременности, высокий уровень прогестерона может быть вызван:
- раком яичников
- раком надпочечников
- врожденной гиперплазией надпочечников, группой заболеваний, которые влияют на ваш надпочечник
Низкий уровень прогестерона может быть вызван:
- отсутствие месячных
- отсутствие овуляции
- внематочная беременность
- выкидыш
- смерть плода
Спросите своего врача, что означают результаты ваших анализов.Они могут помочь вам понять потенциальные причины аномально высокого или низкого уровня прогестерона. Они также могут обсудить соответствующие последующие шаги. В зависимости от результатов вашего обследования врач может порекомендовать дополнительные анализы или лечение.
Повышение уровня прогестерона в день срабатывания триггера ХГЧ оказывает пагубное влияние на частоту живорождений у пациентов с низким и средним уровнем ответа на яичники, но не у лиц с высоким уровнем ответа.
 Преждевременная лютеинизация в циклах оплодотворения in vitro с использованием агониста гонадотропин-рилизинг-гормона (GnRH-a) и рекомбинантного фолликулостимулирующего гормона (FSH) и GnRH-a и мочевого FSH. Fertil. Стерил. 66 , 275–280 (1996).
Преждевременная лютеинизация в циклах оплодотворения in vitro с использованием агониста гонадотропин-рилизинг-гормона (GnRH-a) и рекомбинантного фолликулостимулирующего гормона (FSH) и GnRH-a и мочевого FSH. Fertil. Стерил. 66 , 275–280 (1996).CAS Статья Google ученый
Wu, Z. et al. . Влияние ХГЧ-дневных концентраций прогестерона и эстрадиола в сыворотке на исходы беременности в циклах агонистов ГнРГ. Репродукция. Биомед. Интернет: 24 , 511–520, https://doi.org/10.1016/j.rbmo.2012.02.003 (2012).
CAS Статья PubMed Google ученый
Bu, Z. и др. . Повышение уровня прогестерона в сыворотке отрицательно влияет на кумулятивную частоту живорождений у различных яичников, ответивших на лечение во время оплодотворения in vitro и переноса эмбриона : большое ретроспективное исследование. PLoS One 9 , e100011, https://doi.org/10.1371/journal.pone.0100011 (2014).
PLoS One 9 , e100011, https://doi.org/10.1371/journal.pone.0100011 (2014).
ADS CAS Статья PubMed PubMed Central Google ученый
Хуанг, Ю. и др. . Повышение уровня прогестерона в день введения хорионического гонадотропина человека отрицательно влияет на исход ЭКО с перенесенными эмбрионами на разных стадиях развития. Репродукция. Биол. Эндокринол. 13 , 82, https://doi.org/10.1186/s12958-015-0075-3 (2015).
CAS Статья PubMed PubMed Central Google ученый
Демир Б. и др. . Изменение прогестерона в поздней фолликулярной фазе влияет на частоту наступления беременности как с агонистами, так и с антагонистическими протоколами у нормальных респондентов: исследование «случай-контроль» в циклах ИКСИ. Gynecol. Эндокринол. 32 , 361–365, https://doi.org/10.3109/09513590.2015.1121226 (2016).
Gynecol. Эндокринол. 32 , 361–365, https://doi.org/10.3109/09513590.2015.1121226 (2016).
CAS Статья PubMed Google ученый
Fanchin, R. et al. . Последствия преждевременного повышения прогестерона на исход экстракорпорального оплодотворения : понимание противоречий. Fertil. Стерил. 68 , 799–805 (1997).
CAS Статья Google ученый
Bourgain, C. & Devroey, P. Эндометрий в циклах стимуляции для ЭКО. Гм. Репрод. Обновление 9 , 515–522 (2003).
Артикул Google ученый

Папаниколау, Э. Г. и др. . Повышение уровня прогестерона в день введения хорионического гонадотропина человека ухудшает исход беременности на 3-й день переноса одного эмбриона, в то время как не влияет на 5-й день переноса единичной бластоцисты. Fertil.Стерил. 91 , 949–952, https://doi.org/10.1016/j.fertnstert.2006.12.064 (2009).
CAS Статья PubMed Google ученый
Хуанг Б. и др. . Повышенный уровень прогестерона в день созревания ооцитов может повлиять на циклы ЭКО эмбрионов высшего качества. PLoS One 11 , e0145895, https://doi.org/10.1371/journal.pone.0145895 (2016).
CAS Статья PubMed PubMed Central Google ученый

Сантос-Рибейро, С. и др. . Уровень живорождений после ЭКО снижается как из-за низкого, так и из-за высокого уровня прогестерона в день введения хорионического гонадотропина человека. Гм. Репрод. 29 , 1698–1705, https://doi.org/10.1093/humrep/deu151 (2014).
CAS Статья PubMed Google ученый
Урман Б. и др. . Повышенный уровень прогестерона в сыворотке крови в день введения хорионического гонадотропина человека не оказывает отрицательного влияния на частоту имплантации после интрацитоплазматической инъекции сперматозоидов и переноса эмбриона. Fertil. Стерил. 72 , 975–979 (1999).
CAS Статья Google ученый
Venetis, C. A. et al. . Связано ли повышение прогестерона в день введения хорионического гонадотропина человека с вероятностью беременности при оплодотворении in vitro ? Систематический обзор и метаанализ. Гм. Репрод. Обновление 13 , 343–355, https: // doi.org / 10.1093 / humupd / dmm007 (2007).
A. et al. . Связано ли повышение прогестерона в день введения хорионического гонадотропина человека с вероятностью беременности при оплодотворении in vitro ? Систематический обзор и метаанализ. Гм. Репрод. Обновление 13 , 343–355, https: // doi.org / 10.1093 / humupd / dmm007 (2007).
CAS Статья PubMed Google ученый
Griesinger, G. et al. . Повышение уровня прогестерона не снижает частоту наступления беременности у лиц с высоким уровнем ответа: объединенный анализ пациенток с оплодотворением in vitro, пациенток, получавших рекомбинантный фолликулостимулирующий гормон / антагонист гонадотропин-рилизинг-гормона, в шести испытаниях. Fertil. Стерил. 100 (1622–1628), e1621–1623, https: // doi.org / 10.1016 / j.fertnstert.2013.08.045 (2013).
CAS Статья Google ученый
Venetis, C.A. et al. . Оценка чистого эффекта повышения прогестерона в день ХГЧ на частоту живорождений после ЭКО: когортный анализ 3296 циклов ЭКО. Гм. Репрод. 30 , 684–691, https://doi.org/10.1093/humrep/deu362 (2015).
CAS Статья PubMed Google ученый
Сюй, Б. и др. . Влияние уровня прогестерона в сыворотке на исход оплодотворения in vitro у пациентов с различным ответом яичников: анализ более 10 000 циклов. Fertil. Стерил. 97 (1321–1327), e1321–1324, https://doi.org/10.1016/j.fertnstert.2012.03.014 (2012).
CAS Статья Google ученый
Ли В. К. и др. . Влияние преовуляторного повышения прогестерона и продолжительности повышения прогестерона на частоту наступления беременности при переносе замороженных-оттаявших эмбрионов в естественных циклах.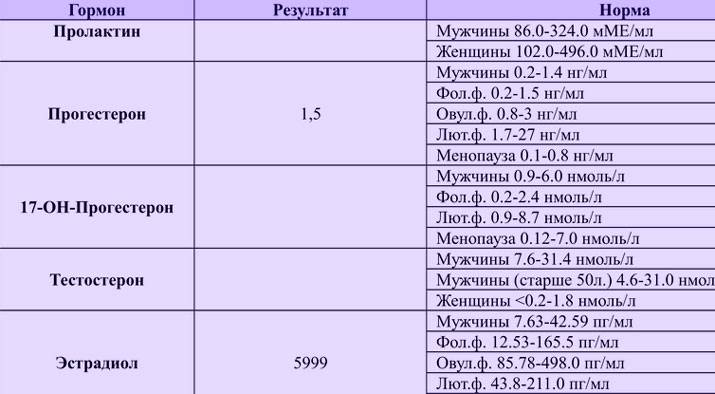 Fertil. Стерил. 101 , 1288–1293, https://doi.org/10.1016/j.fertnstert.2014.01.040 (2014).
Fertil. Стерил. 101 , 1288–1293, https://doi.org/10.1016/j.fertnstert.2014.01.040 (2014).
CAS Статья PubMed Google ученый
Велева, З., Орава, М., Нуоджуа-Хуттунен, С., Тапанайнен, Дж. С. и Мартикайнен, Х. Факторы, влияющие на исход переноса замороженных-размороженных эмбрионов. Гм. Репрод. 28 , 2425–2431, https://doi.org/10.1093/humrep/det251 (2013).
Артикул PubMed Google ученый
Фанчин Р. и др. . Преждевременное повышение уровня прогестерона позволяет избежать бластуляции, но не снижает частоту наступления беременности при оплодотворении in vitro и совместном культивировании. Fertil. Стерил. 68 , 648–652 (1997).
CAS Статья Google ученый
Huang, R., Fang, C., Xu, S., Yi, Y. & Liang, X. Преждевременное повышение прогестерона отрицательно коррелирует с частотой живорождений в циклах ЭКО с агонистом ГнРГ: анализ 2566 циклы. Fertil. Стерил. 98 , 664–670 e662, https://doi.org/10.1016/j.fertnstert.2012.05.024 (2012).
CAS Статья PubMed Google ученый
Граймс, Д. А. и Шульц, К. Ф. Предвзятость и причинно-следственные связи в обсервационных исследованиях. Lancet 359 , 248–252, https://doi.org/10.1016/S0140-6736(02)07451-2 (2002).
Артикул PubMed Google ученый
Ротман, К. Дж. И Гренландия, С. Причинность и причинно-следственные связи в эпидемиологии. Am. J. Public. Здравоохранение 95 (Дополнение 1), S144–150, https://doi.org/10.2105/AJPH.2004.059204 (2005).
Артикул PubMed Google ученый
Penzias, A. S. et al. . Нафарелин против лейпролида в индукции овуляции для оплодотворения in vitro : рандомизированное клиническое испытание. Акушерство.Гинеколь. 79 , 739–742 (1992).
CAS PubMed Google ученый
Prien, S. D., Canez, M. S. и Messer, R.H. Повышение уровня прогестерона после введения хорионического гонадотропина человека может предсказать исход цикла у пациентов, перенесших in vitro оплодотворение и перенос эмбриона. Fertil. Стерил. 62 , 1066–1068 (1994).
Fertil. Стерил. 62 , 1066–1068 (1994).
CAS Статья Google ученый
Мартинес, Ф. и др. . Следует ли все же измерять прогестерон в день хорионического гонадотропина человека? Fertil. Стерил. 105 , 86–92, https://doi.org/10.1016/j.fertnstert.2015.09.008 (2016).
CAS Статья PubMed Google ученый
Ванни, В. С. и др. . Является ли чрезвычайно высокий уровень прогестерона проблемой при ЭКО? J. Endocrinol. Вкладывать деньги. 40 , 69–75, https: // doi.org / 10.1007 / s40618-016-0531-8 (2017).
CAS Статья PubMed Google ученый
Martinez, F. et al. . Концентрация прогестерона в сыворотке крови в день введения ХГЧ не может предсказать беременность в циклах вспомогательной репродукции. Репродукция. Биомед. Интернет: 8 , 183–190 (2004).
CAS Статья Google ученый
Ку, Х.С. и др. . Высокий ответ на контролируемую стимуляцию яичников вызывает преждевременную лютеинизацию с отрицательным влиянием на исход беременности в цикле антагонистов гонадотропин-рилизинг-гормона. Clin. Exp. Репрод. Med. 42 , 149–155, https://doi.org/10.5653/cerm.2015.42.4.149 (2015).
Артикул PubMed PubMed Central Google ученый
Ли, Р., Цяо, Дж. , Ван, Л., Zhen, X. & Lu, Y. Концентрация прогестерона в сыворотке в день введения ХГЧ и исход ЭКО. Репродукция. Биомед. Интернет: 16 , 627–631 (2008).
, Ван, Л., Zhen, X. & Lu, Y. Концентрация прогестерона в сыворотке в день введения ХГЧ и исход ЭКО. Репродукция. Биомед. Интернет: 16 , 627–631 (2008).
CAS Статья Google ученый
Киличдаг, Э. Б., Хайдардедеоглу, Б., Кок, Т., Хадживелиоглу, С. О. и Багис, Т. Преждевременное повышение уровня прогестерона ухудшает имплантацию и снижает уровень живорождений в циклах ЭКО / ИКСИ с агонистами ГнРГ. Arch. Гинеколь.Акушерство. 281 , 747–752, https://doi.org/10.1007/s00404-009-1248-0 (2010).
CAS Статья PubMed Google ученый
Андерсен, А. Н., Витьес, Х., Гордон, К. и Маннаертс, Б. и Xpect, i. Факторы прогнозирования ответа яичников и клинического исхода после ЭКО / ИКСИ по протоколу антагонистов рФСГ / ГнРГ с предварительным лечением пероральными контрацептивами или без него. Гм. Репрод. 26 , 3413–3423, https: // doi.org / 10.1093 / humrep / der318 (2011).
Гм. Репрод. 26 , 3413–3423, https: // doi.org / 10.1093 / humrep / der318 (2011).
CAS Статья PubMed Google ученый
Ochsenkuhn, R. et al. . Незначительное повышение прогестерона в день введения хорионического гонадотропина человека связано с более низким уровнем живорождения у женщин, перенесших вспомогательные репродуктивные технологии: ретроспективное исследование с 2555 пересадками свежих эмбрионов. Fertil. Стерил. 98 , 347–354, https: // doi.org / 10.1016 / j.fertnstert.2012.04.041 (2012).
CAS Статья PubMed Google ученый
Долди, Н. и др. . Повышенный уровень прогестерона в сыворотке крови в день введения ХГЧ при ЭКО связан с более высокой частотой наступления беременности при синдроме поликистозных яичников. Гм. Репрод. 14 , 601–605 (1999).
Гм. Репрод. 14 , 601–605 (1999).
CAS Статья Google ученый
Роке, М. и др. . Перенос свежих эмбрионов по сравнению с переносом замороженных эмбрионов в циклах оплодотворения in vitro : систематический обзор и метаанализ. Fertil. Стерил. 99 , 156–162, https://doi.org/10.1016/j.fertnstert.2012.09.003 (2013).
Артикул PubMed Google ученый
Lu, X. et al. . Повышенный уровень прогестерона в триггерный день не ухудшает исход циклов лечения менотропинами, гонадотропином и медроксипрогестерона ацетатом человека. Sci. Отчет 6 , 31112, https://doi.org/10.1038/srep31112 (2016).
ADS CAS Статья PubMed PubMed Central Google ученый
Lahoud, R. et al. . Повышенный уровень прогестерона в агонистах гонадолиберин подавляет циклов оплодотворения in vitro (IVFICSI) снижает частоту живорождений, но не качество эмбрионов. Arch. Гинеколь. Акушерство. 285 , 535–540, https: // doi.org / 10.1007 / s00404-011-2045-0 (2012).
CAS Статья PubMed Google ученый
Ди Паола, Р. и др. . Выбираем ли мы правильную начальную дозу ФСГ во время контролируемой стимуляции яичников для циклов внутриматочной инсеминации? Возможное применение номограммы в зависимости от возраста женщины и маркеров овариального резерва. Arch Gynecol Obstet 298 , 1029–1035, https://doi.org/10.1007/s00404-018-4906-2 (2018).
CAS Статья PubMed Google ученый
Рейес-Муньос, Э. и др. . Синдром поликистозных яичников: влияние на метаболизм лекарств для вспомогательных репродуктивных технологий — обзор литературы. Adv Ther 35 , 1805–1815, https://doi.org/10.1007/s12325-018-0810-1 (2018).
CAS Статья PubMed PubMed Central Google ученый
Vitale, S. G. et al. . Как получить ооциты высокого качества? Ключевая роль мио-инозита и мелатонина. Int J Endocrinol 2016 , 4987436, https://doi.org/10.1155/2016/4987436 (2016).
CAS Статья PubMed PubMed Central Google ученый
Лагана, А. С., Гарсон, С., Касарин, Дж., Франки, М. и Геззи, Ф. Инозитол при синдроме поликистозных яичников: восстановление фертильности с помощью подхода, основанного на патофизиологии. Trends Endocrinol Metab 29 , 768–780, https://doi.org/10.1016/j.tem.2018.09.001 (2018).
Trends Endocrinol Metab 29 , 768–780, https://doi.org/10.1016/j.tem.2018.09.001 (2018).
CAS Статья PubMed Google ученый
Larue, L. et al. . Трансвагинальный перенос эмбрионов под контролем УЗИ при ЭКО. J Gynecol Obstet Hum Reprod 46 , 411–416, https://doi.org/10.1016/j.jogoh.2017.02.015 (2017).
CAS Статья PubMed Google ученый
Cozzolino, M. и др. . Перенос эмбрионов под ультразвуковым контролем: сводка данных и новые перспективы. Систематический обзор и метаанализ. Reprod Biomed Online 36 , 524–542, https://doi.org/10.1016/j.rbmo.2018.01.015 (2018).
Артикул PubMed Google ученый
Balaban, B. et al. . Влияние морфологии пронуклеусов на параметры качества эмбриона и исход переноса бластоцисты. Гм. Репрод. 16 , 2357–2361 (2001).
CAS Статья Google ученый
Эльнашар, А. М. Повышение прогестерона в день введения ХГЧ (преждевременная лютеинизация) при ЭКО: запоздалое обновление. J. Assist. Репрод. Genet. 27 , 149–155, https://doi.org/10.1007/s10815-010-9393-8 (2010).
Артикул PubMed PubMed Central Google ученый
Венетис, К. А., Колибианакис, Э. М., Босду, Дж. К. и Тарлатзис, Б. С. Повышение уровня прогестерона и вероятность беременности после ЭКО: систематический обзор и метаанализ более 60 000 циклов. Гм. Репрод. Обновление 19 , 433–457, https://doi.org/10.1093/humupd/dmt014 (2013).
Гм. Репрод. Обновление 19 , 433–457, https://doi.org/10.1093/humupd/dmt014 (2013).
CAS Статья PubMed Google ученый
Пороговый уровень прогестерона 25 нг / мл для поддержания беременности в первом триместре у женщин с бесплодием или выкидышем в анамнезе
Абстрактные
Введение : Важность выработки прогестерона желтым телом для поддержания беременности в первом триместре была впервые признана в 1970-х годах.С тех пор профилактический прогестерон использовался для снижения частоты абортов в первом триместре у женщин с выкидышами в анамнезе. Однако до недавнего времени исследования не смогли установить целевой уровень прогестерона, при котором можно было бы поддерживать беременность в этой популяции.
Цель : Целью исследования было оценить эффективность порогового значения сывороточного прогестерона 25 нг / мл для поддержания беременности в первом триместре у пациенток с бесплодием или выкидышем в анамнезе.
Дизайн исследования : В этот ретроспективный обзор диаграммы мы включили 182 пациентки (329 беременностей) в возрасте от 22 до 45 лет, у которых была хотя бы одна попытка беременности в частной клинике бесплодия в период с 1996 по 2013 год. Мы исключили пациентов с анатомическими дефектами, внематочными беременностями, молярными беременностями, пораженными яйцеклетками, аномальным уровнем иммунитета или использованием донорских яйцеклеток. Все пациенты прошли полное обследование, включая анатомический скрининг и иммунные медиаторы. Уровни прогестерона регистрировали при первом посещении и через 10 недель.Дополнительный прогестерон вводили в течение первого триместра беременности, если уровни сыворотки опускались ниже 25 нг / мл, и продолжали до тех пор, пока не было установлено, что плацента взяла на себя выработку прогестерона. Женщины были разделены по возрасту на две группы: возраст первичной фертильности (22–34 года) и пожилой возраст матери (35–45 лет).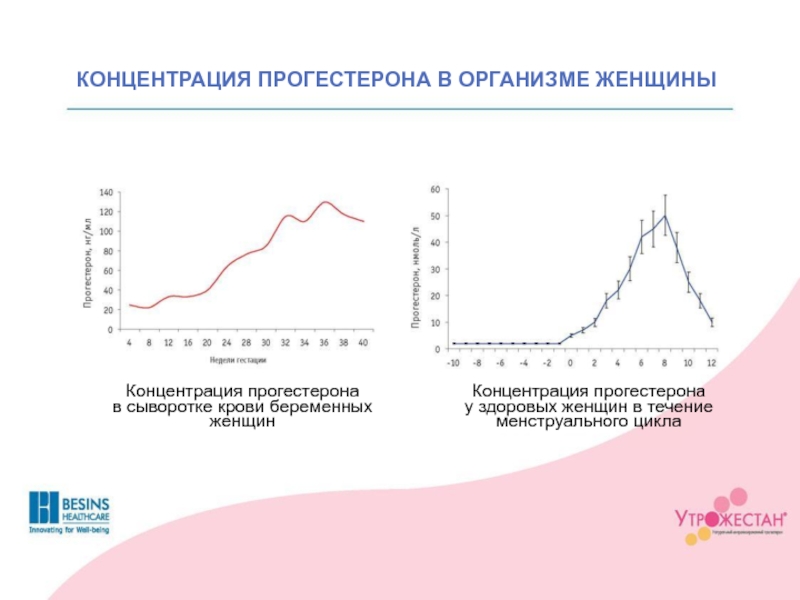 Тесты хи-квадрат были выполнены на 329 беременностях для анализа связи между жизнеспособными беременностями в первом триместре и адекватными уровнями прогестерона в сыворотке (≥ 25 нг / мл при первоначальном и / или 10-недельном посещении) для каждой возрастной группы.
Тесты хи-квадрат были выполнены на 329 беременностях для анализа связи между жизнеспособными беременностями в первом триместре и адекватными уровнями прогестерона в сыворотке (≥ 25 нг / мл при первоначальном и / или 10-недельном посещении) для каждой возрастной группы.
Результаты : Статистически значимая разница в уровне жизнеспособной беременности в первом триместре и адекватных (≥ 25 нг / мл) уровнях прогестерона в сыворотке была обнаружена для обеих возрастных групп первичной фертильности (X 2 = 57,424, N = 221, p <0,0001) и пожилой возрастной группе матери (X 2 = 10,973, N = 108, p = 0,001).
Выводы : Это исследование демонстрирует, что поддержание сывороточного уровня прогестерона 25 нг / мл или выше снижает риск выкидыша в первом триместре у женщин любого репродуктивного возраста.
Ключевые слова
первый триместр, бесплодие, выкидыш, прогестерон, самопроизвольный аборт
Введение
Прогестерон считается «гормоном беременности» из-за его важной роли в подготовке эндометрия к имплантации и поддержании беременности [1]. В течение первого триместра беременности желтое тело в первую очередь отвечает за выработку прогестерона. Желтое тело регрессирует примерно через 9 недель, после чего происходит синтез прогестерона из плаценты [2].Важность выработки прогестерона желтым телом была впервые признана Чапо, который продемонстрировал, что удаление желтого тела до 7-недельного гестационного возраста всегда приводит к выкидышу. Во время этого исследования он наблюдал постоянное снижение прогестерона, повышение внутриматочного давления и развитие расширения шейки матки перед неизбежным абортом [3]. Основываясь на этих знаниях, он назначил дополнительный прогестерон для предотвращения выкидышей, связанных с отменой прогестерона, вызванной лютеэктомией, что в конечном итоге привело к устойчивой беременности [4].
В течение первого триместра беременности желтое тело в первую очередь отвечает за выработку прогестерона. Желтое тело регрессирует примерно через 9 недель, после чего происходит синтез прогестерона из плаценты [2].Важность выработки прогестерона желтым телом была впервые признана Чапо, который продемонстрировал, что удаление желтого тела до 7-недельного гестационного возраста всегда приводит к выкидышу. Во время этого исследования он наблюдал постоянное снижение прогестерона, повышение внутриматочного давления и развитие расширения шейки матки перед неизбежным абортом [3]. Основываясь на этих знаниях, он назначил дополнительный прогестерон для предотвращения выкидышей, связанных с отменой прогестерона, вызванной лютеэктомией, что в конечном итоге привело к устойчивой беременности [4].
Выкидыш — частое осложнение беременности на ранних сроках, большинство случаев выкидыша приходится на срок до 8 недель [2,5]. Общий показатель потери беременности на ранних сроках (≥ 12 недель) составляет около 13,5%. Этот показатель увеличивается с возрастом матери после 20 лет, увеличиваясь с 11,5% у женщин 20-24 лет до 18,6% у женщин старше 30 лет [6]. Кроме того, у женщин с бесплодием в анамнезе наблюдалась более высокая частота выкидышей по сравнению с населением в целом [7].
Этот показатель увеличивается с возрастом матери после 20 лет, увеличиваясь с 11,5% у женщин 20-24 лет до 18,6% у женщин старше 30 лет [6]. Кроме того, у женщин с бесплодием в анамнезе наблюдалась более высокая частота выкидышей по сравнению с населением в целом [7].
Было высказано предположение, что профилактическое применение прогестерона можно использовать для снижения риска самопроизвольных абортов в первом триместре у женщин с невынашиванием беременности в анамнезе [8]. До недавнего времени исследования не могли установить целевой уровень прогестерона, выше которого беременность, скорее всего, будет продолжаться в этой популяции. McCord et al. [9] провел ретроспективный анализ 3674 беременностей, чтобы изучить вероятность жизнеспособной внутриутробной беременности для данной концентрации прогестерона в сыворотке.Исследование показало, что вероятность жизнеспособной внутриутробной беременности в зависимости от концентрации прогестерона увеличивалась в виде сигмовидной кривой. Эта кривая выровнялась около 25 нг / мл и коррелировала с вероятностью жизнеспособной внутриутробной беременности 89%, что предполагает 25 нг / мл как важную целевую концентрацию прогестерона для поддержания беременности.
Эта кривая выровнялась около 25 нг / мл и коррелировала с вероятностью жизнеспособной внутриутробной беременности 89%, что предполагает 25 нг / мл как важную целевую концентрацию прогестерона для поддержания беременности.
Цель
Мы стремимся оценить эффективность порогового уровня прогестерона 25 нг / мл для поддержания беременности в первом триместре у женщин с выкидышем или бесплодием в анамнезе.
Материалы и методы
Был проведен ретроспективный обзор пациентов из частной клиники по лечению бесплодия в Рокфорде, штат Иллинойс, в период с 1996 по 2013 год. Подходили женщины, у которых была хотя бы одна попытка беременности в клинике. Мы исключили пациентов с анатомическими дефектами, внематочными беременностями, молярными беременностями, пораженными яйцеклетками, аномальным уровнем иммунитета или использованием донорских яйцеклеток. Все другие эндокринопатии были устранены и исправлены. В исследовании приняли участие 182 женщины в возрасте от 22 до 45 лет, в общей сложности 329 беременных. Эти пациенты были разделены на две группы: первичного фертильного возраста (22-34 года) и пожилого возраста матери (35-45 лет).
В исследовании приняли участие 182 женщины в возрасте от 22 до 45 лет, в общей сложности 329 беременных. Эти пациенты были разделены на две группы: первичного фертильного возраста (22-34 года) и пожилого возраста матери (35-45 лет).
Все пациенты прошли полное обследование, включая полный анамнез и физикальное, трансвагинальное ультразвуковое исследование, гистеросальпингограмму и / или соногистерограмму с инфузией физиологического раствора. Уровни прогестерона в сыворотке регистрировали при первом посещении (2-6 недель после зачатия) и 10-недельном посещении и контролировали каждые 2 недели до завершения перехода от выработки прогестерона яичниками к плацентарной.Это было определено путем изучения тенденции сывороточного прогестерона в течение первого триместра. После того, как уровни сыворотки крови поднялись до точки, при которой после отмены добавки пациенты все еще оставались на уровне 25 нг / мл или выше, добавление прогестерона было прекращено.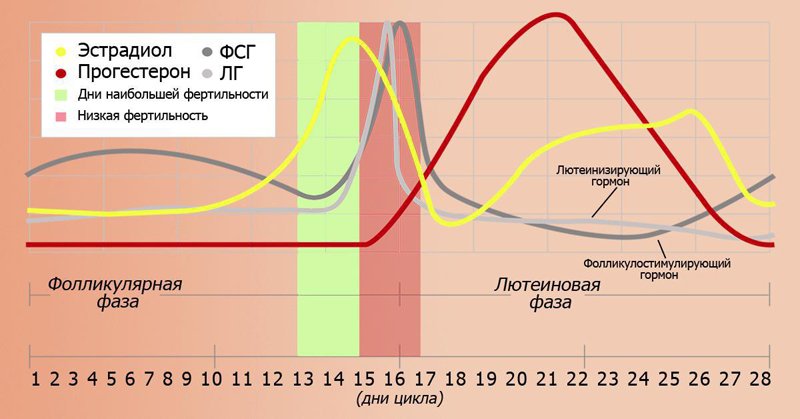 Уровни прогестерона проверяли через 2-3 дня после прекращения приема, чтобы убедиться, что уровни были на уровне 25 нг / мл или выше, что подтверждает переход к выработке прогестерона плацентой. После выработки прогестерона плацентой уход за пациентом был передан общественным акушерам.За 12 лет беременности требовалась гормональная поддержка на протяжении всей беременности. В течение второго триместра за этими пациентами уход за пациентами по-прежнему передавался местным акушерам, но мы продолжали контролировать уровень их гормонов на протяжении всей беременности.
Уровни прогестерона проверяли через 2-3 дня после прекращения приема, чтобы убедиться, что уровни были на уровне 25 нг / мл или выше, что подтверждает переход к выработке прогестерона плацентой. После выработки прогестерона плацентой уход за пациентом был передан общественным акушерам.За 12 лет беременности требовалась гормональная поддержка на протяжении всей беременности. В течение второго триместра за этими пациентами уход за пациентами по-прежнему передавался местным акушерам, но мы продолжали контролировать уровень их гормонов на протяжении всей беременности.
В этом исследовании адекватные уровни прогестерона в сыворотке были определены как ≥ 25 нг / мл при первоначальном и / или 10-недельном посещении. Дополнительный прогестерон вводили пациентам, если уровень прогестерона в сыворотке упал ниже 25 нг / мл во время первоначального или 10-недельного визита.В случаях, когда пациенты уже получали дополнительный прогестерон, доза прогестерона была увеличена для достижения адекватных уровней прогестерона в сыворотке. Метод добавления прогестерона был определен на основе предпочтений пациента и побочных эффектов и включал: пероральное, вагинальное и внутримышечное введение. Пациентам с плохой абсорбцией или плохой переносимостью прогестерона перорально или вагинально вводили внутримышечно прогестерон в масле.
Метод добавления прогестерона был определен на основе предпочтений пациента и побочных эффектов и включал: пероральное, вагинальное и внутримышечное введение. Пациентам с плохой абсорбцией или плохой переносимостью прогестерона перорально или вагинально вводили внутримышечно прогестерон в масле.
Первичным результатом была жизнеспособная беременность в первом триместре.Жизнеспособная беременность определялась детальным морфологическим ультразвуковым исследованием плода на сроке 11-13 недель. Мы не вели наблюдение после того, как пациентку передали общественному акушеру, за исключением 12 случаев, описанных ранее, которые требовали постоянного наблюдения в течение всего срока беременности. Следует отметить, что все 12 беременностей достигли конца третьего триместра.
Было проведено тестов хи-квадрат для анализа связи между жизнеспособной беременностью и адекватным уровнем прогестерона в сыворотке.Был использован a priori альфа-уровень 0,05. Для всего статистического анализа использовалась версия 24 SPSS Statistics.
Для всего статистического анализа использовалась версия 24 SPSS Statistics.
Результаты
Всего было охвачено 329 беременностей, из которых 221 — в возрастной группе первичной фертильности (22–34 года) и 108 — в возрастной группе пожилой матери (35–45 лет). Для женщин всех возрастов в 287 из 329 (87%) беременностей был достигнут адекватный уровень прогестерона (≥ 25 нг / мл при первоначальном и / или 10-недельном посещении). 188 из 221 (85%) беременностей в возрастной группе с высокой фертильностью и 99 из 108 (92%) в возрастной группе пожилых матерей достигли адекватного уровня прогестерона (Таблица 1).
Адекватный уровень прогестерона с разбивкой по возрастным группам | ||
Недостаточный уровень прогестерона в сыворотке a | Достаточный уровень прогестерона в сыворотке b | |
Все возрасты (22-45 лет) | 42 (13%) | 287 (87%) |
Первичный возраст фертильности (22-34 года) | 33 (15%) | 188 (85%) |
Пожилой возраст матери (35-45 лет) | 9 (8%) | 99 (92%) |
a Менее 25 нг / мл при первоначальном и 10-недельном посещении b Больше или равно 25 нг / мл при первоначальном и / или 10-недельном посещении | ||
Таблица 1.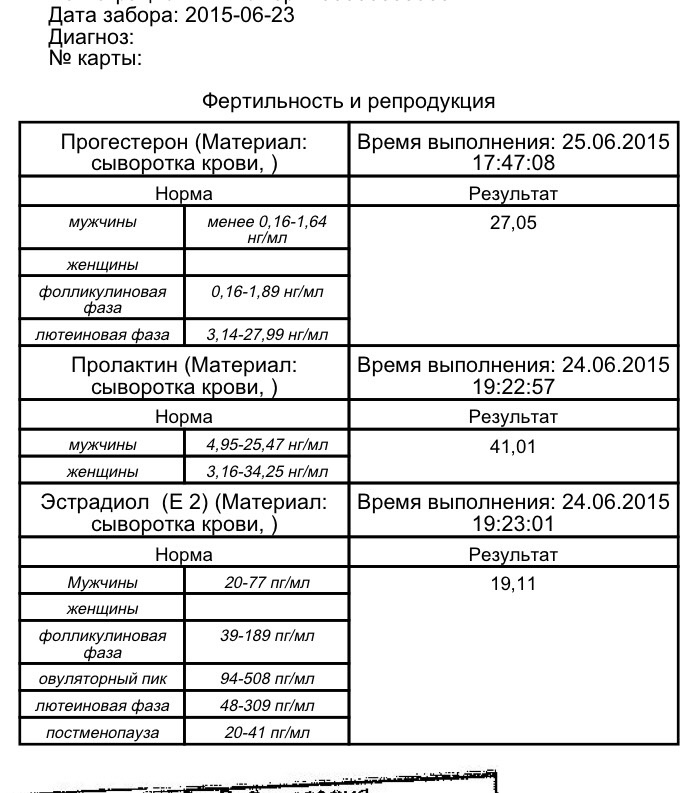 Адекватный уровень прогестерона с разбивкой по возрастным группам.
Адекватный уровень прогестерона с разбивкой по возрастным группам.
Показатель жизнеспособной беременности был неизменно выше во всех возрастных группах у тех, у кого был адекватный уровень прогестерона, по сравнению с теми, у кого уровень прогестерона недостаточен. В общей сложности 208 из 287 (72%) беременностей с адекватным уровнем прогестерона закончились жизнеспособной беременностью, в то время как только 5 из 42 (12%) беременностей с недостаточным уровнем прогестерона закончились жизнеспособной беременностью (n = 329, X 2 58,883 , p <0.0001). В возрастной группе основной фертильности (22-34 года) 151 из 188 (80%) беременностей с адекватным уровнем прогестерона закончилась жизнеспособной беременностью, в то время как только 5 из 33 (15%) беременностей с недостаточным уровнем прогестерона закончились жизнеспособной беременностью. (n = 221, X 2 57,424, p <0,0001). В возрастной группе матери преклонного возраста (35-45 лет) 57 из 99 (58%) беременностей с адекватным уровнем прогестерона закончились жизнеспособной беременностью, а 0 из 9 (0%) беременностей с недостаточным уровнем прогестерона привели к жизнеспособной беременности ( п = 108, Х 2 10. 973, p = 0,001) (таблица 2).
973, p = 0,001) (таблица 2).
Жизнеспособность беременностей в первом триместре с разбивкой по возрастным группам | |||
Жизнеспособная беременность в первом триместре a | Статистическое сравнение d | ||
Недостаточный уровень прогестерона в сыворотке b | Достаточный уровень прогестерона в сыворотке c | ||
Все возрасты (22-45 лет) | 5 (12%) | 208 (72%) | р <0. |
Первичный возраст фертильности (22-34 года) | 5 (15%) | 151 (80%) | р <0,0001 |
Пожилой возраст матери (35-45 лет) | 0 (0%) | 57 (58%) | р = 0.001 |
a Определено детальным морфологическим ультразвуковым исследованием через 11-13 недель b Менее 25 нг / мл при первом посещении и посещении через 10 недель c Больше или равно 25 нг / мл при первоначальном и / или 10-недельном посещении d X 2 Тест в квадрате для категориальных значений для оценки связи между жизнеспособной беременностью и адекватным уровнем прогестерона в сыворотке | |||
Таблица 2. Жизнеспособность беременностей в первом триместре с разбивкой по возрастным группам.
Жизнеспособность беременностей в первом триместре с разбивкой по возрастным группам.
Обсуждение
Насколько нам известно, это первое исследование, посвященное изучению порогового уровня прогестерона для поддержания беременности. Результаты показывают, что 25 нг / мл — это эффективный пороговый уровень прогестерона в сыворотке крови для поддержания беременности в первом триместре у женщин с выкидышем или бесплодием в анамнезе как у женщин первичного фертильного возраста (22-34 года), так и у женщин пожилого возраста матери (35-35 лет). 45 лет).Данные показывают, что поддержание уровня прогестерона 25 нг / мл в течение первого триместра беременности снижает риск выкидыша в этой популяции.
Это исследование имеет несколько ограничений. Поскольку все пациенты были из одного центра по лечению бесплодия, результаты могут иметь ограниченную применимость к другим группам населения. Будущие многоцентровые исследования с более разнообразным населением и большим размером выборки расширили бы демографические результаты и позволили бы провести дальнейшую стратификацию.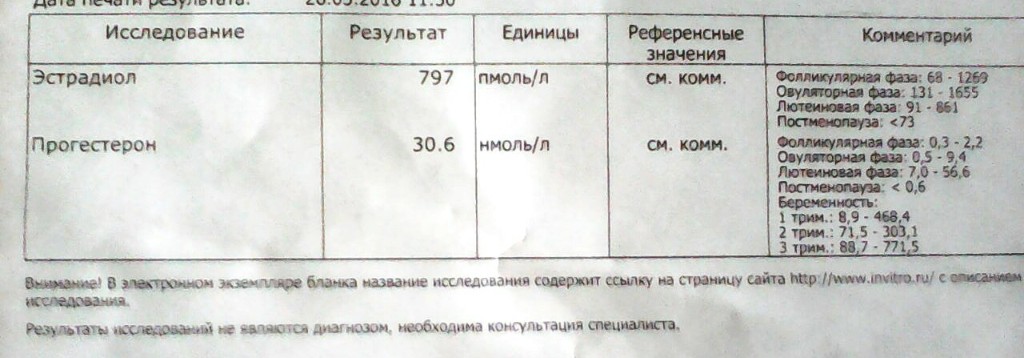
Кроме того, в этом исследовании у пациентов различались методы зачатия.Было высказано предположение, что у ранее бесплодных пациенток, зачатых с помощью искусственных репродуктивных технологий (ВРТ), частота самопроизвольных абортов была лишь немного выше или схожа с ними по сравнению с естественными беременностями [10,11]. Поскольку наша популяция пациентов включает женщин с бесплодием в анамнезе, бесплодные пациенты, зачатые с помощью АРТ, могут не отражать эффекты порогового уровня прогестерона 25 нг / мл для этой группы пациентов.
Метод добавления прогестерона также не контролировался в этом исследовании.Было высказано предположение, что разные способы приема прогестерона по-разному влияют на эндометрий, скорость всасывания и выведения, а также профили распределения. Например, было обнаружено, что пероральный прогестерон неэффективен для секреторной трансформации эндометрия на уровне сывороточного прогестерона, который считается адекватным для этого процесса. Точно так же вагинальный прогестерон проявлял свое действие на эндометрий при более низких концентрациях в сыворотке крови из-за его выраженного воздействия на матку, так называемый эффект первого прохождения через матку [12].В нашем исследовании предполагалось, что концентрация прогестерона в сыворотке крови 25 нг / мл или выше, независимо от способа доставки прогестерона, была достаточной для оказания его воздействия на матку во время внутриутробной беременности. Будущие исследования, контролирующие метод приема добавок прогестерона, могут уменьшить несоответствия в изменениях матки, вызванных прогестероном.
Точно так же вагинальный прогестерон проявлял свое действие на эндометрий при более низких концентрациях в сыворотке крови из-за его выраженного воздействия на матку, так называемый эффект первого прохождения через матку [12].В нашем исследовании предполагалось, что концентрация прогестерона в сыворотке крови 25 нг / мл или выше, независимо от способа доставки прогестерона, была достаточной для оказания его воздействия на матку во время внутриутробной беременности. Будущие исследования, контролирующие метод приема добавок прогестерона, могут уменьшить несоответствия в изменениях матки, вызванных прогестероном.
Наконец, это исследование не контролировало многоплодную беременность (например, двойню). Исследования подтвердили, что прогестерон является самым сильным предиктором жизнеспособной беременности, и предположили, что для поддержания беременности может потребоваться уровень прогестерона в сыворотке до 58 нг / мл [13,14].В то время как в нашем исследовании было зафиксировано 35 беременностей двойней и тройней в первом триместре с порогом 25 нг / мл, в этих беременностях средний уровень прогестерона превышал 100 нг / мл, что почти вдвое превышает средний показатель жизнеспособных беременностей при одноплодной беременности (65 нг / мл).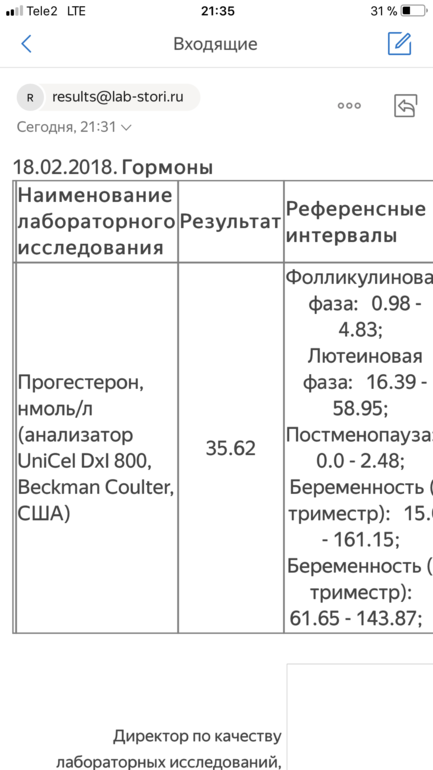 . Таким образом, часть нежизнеспособных беременностей в нашем исследовании может быть связана с недостаточным уровнем прогестерона у женщин, вынашивающих многоплодную беременность. Дальнейшие исследования помогут определить, нужны ли разные пороги сывороточного прогестерона для одноплодной или многоплодной беременности.
. Таким образом, часть нежизнеспособных беременностей в нашем исследовании может быть связана с недостаточным уровнем прогестерона у женщин, вынашивающих многоплодную беременность. Дальнейшие исследования помогут определить, нужны ли разные пороги сывороточного прогестерона для одноплодной или многоплодной беременности.
Наши результаты также поддерживают будущие исследования, направленные на установление более высоких пороговых значений сывороточного прогестерона для женщин пожилого возраста матери. В нашем исследовании значительная часть женщин с адекватным уровнем прогестерона в сыворотке в пожилой возрастной группе матери все еще приводила к выкидышу. Кроме того, 0% женщин пожилой возрастной группы с недостаточным уровнем прогестерона имели жизнеспособную беременность. Это говорит о том, что женщинам 35 лет и старше может потребоваться более высокий пороговый уровень прогестерона, чем женщинам моложе 35 лет.Поскольку все больше женщин откладывают беременность до достижения возраста 35 лет, дальнейшее исследование более высокого порогового уровня для женщин пожилого возраста матери будет полезным [15].
Насколько нам известно, это первое исследование, в котором был установлен эффективный целевой уровень прогестерона для поддержания беременности в первом триместре у женщин с бесплодием или выкидышем в анамнезе. Это исследование демонстрирует необходимость быть более бдительным при мониторинге уровня прогестерона в первом триместре беременности и при необходимости вмешиваться женщинам с бесплодием или выкидышем в анамнезе.
Конфликт интересов
Авторы сообщают об отсутствии конфликта интересов
Финансирование
В данном исследовании не использовались источники финансирования исследований.
Список литературы
- Ragusa A, de Carolis C, dal Lago A, Miriello D, Ruggiero G и др. (2004) Добавка прогестерона во время беременности: иммунологическая терапия? Волчанка 13: 639-642.[Crossref]
- Габбе С.
 Г., Нибил Дж. Р., Галан Х. Л. (2012) Акушерство: нормальные и проблемные беременности: нормальные и проблемные беременности. Сент-Луис, США: Saunders 17: 592-593.
Г., Нибил Дж. Р., Галан Х. Л. (2012) Акушерство: нормальные и проблемные беременности: нормальные и проблемные беременности. Сент-Луис, США: Saunders 17: 592-593. - Csapo A, Pulkkinen M, Kaihola HL (1972) Значение желтого тела человека в поддержании беременности: предварительные исследования. Am J Obstet Gynecol 112: 1061-1067. [Crossref]
- Csapo AI, Pulkkinen MO, Wiest WG (1973) Эффекты лютеэктомии и заместительной терапии прогестероном у пациенток на ранних сроках беременности. Am J Obstet Gynecol 115: 759-765. [Crossref]
- Regan L, Rai R (2000) Эпидемиология и медицинские причины выкидыша. Baillieres Best Practices Clin Obstet Gynaecol 14: 839-854. [Crossref]
- Rossen L, Ahren K, Branum A (2017) Тенденции риска потери беременности среди женщин в США, 1990-2011 гг. Детская и перинатальная эпидемиол.
- Coulam CB (1992) Связь между бесплодием и самопроизвольным абортом.
 Am J Reprod Immunol 27: 128-129. [Crossref]
Am J Reprod Immunol 27: 128-129. [Crossref] - Check JH, Chase JS, Nowroozi K, Wu CH, Adelson HG (1987) Прогестероновая терапия для уменьшения самопроизвольных абортов в первом триместре у предыдущих абортов. Int J Fertil 32: 192-193. [Crossref]
- МакКорд М., Мурам Д., Бастер Дж., Архарт К., Стовалл Т. и др. (1996) Прогестерон одной сыворотки как скрининг на внематочную беременность: обмен специфичностью и чувствительностью для получения оптимальных результатов теста.Fertil Steril 66: 513-516. [Crossref]
- Wang JX, Norman RJ, Wilcox AJ (2004) Частота самопроизвольных абортов среди беременностей, вызванных вспомогательными репродуктивными технологиями. Hum Reprod 19: 272-277. [Crossref]
- Schieve LA, Tatham L, Peterson HB, Toner J, Jeng G (2003) Самопроизвольный аборт среди беременных, зачатых с использованием вспомогательных репродуктивных технологий в Соединенных Штатах.
 Акушерский гинеколь 101: 959-967.[Crossref]
Акушерский гинеколь 101: 959-967.[Crossref] - Tavaniotou A, Smitz J, Bourgain C, Devroey P (2000) Сравнение между различными путями введения прогестерона в качестве поддержки лютеиновой фазы при лечении бесплодия. Обновление Hum Reprod 6: 139-148. [Crossref]
- Элсон Дж., Салим Р., Тейлор А., Банерджи С., Зосмер Н. (2003) Прогнозирование жизнеспособности беременности на ранних сроках при отсутствии эмбриона, определяемого ультразвуком. Ультразвуковой акушерский гинеколь 21: 57-61.[ Crossref]
- Гоктолга У, Гунгор С., Джейхан С., Кескин У, Фидан У и др. (2008) Оценка прогностической ценности сывороточного прогестерона для прогноза ранней беременности при спонтанных двойных беременностях: проспективное исследование. Eur J Obstet Gynecol Reprod Biol 137: 185-188. [Crossref]
- Мартин Дж., Гамильтон Б.
 , Остерман М., Дрисколл А., Мэтьюз Т. (2017) Рождение: окончательные данные за 2015 год. Natl Vital Stat Rep .
, Остерман М., Дрисколл А., Мэтьюз Т. (2017) Рождение: окончательные данные за 2015 год. Natl Vital Stat Rep .
Измерение эстрадиола и прогестерона в сыворотке за день до переноса замороженных эмбрионов улучшает показатели живорождения | Исследования и практика в области фертильности
Национальный сводный отчет за 2016 год. В: Национальный центр профилактики хронических заболеваний и укрепления здоровья DoRH. 2016.
Google ученый
Shapiro BS, Daneshmand ST, Garner FC, Aguirre M, Hudson C.Клиническое обоснование криоконсервации целых когорт эмбрионов вместо переноса свежих эмбрионов. Fertil Steril. 2014; 102 (1): 3–9.
Артикул Google ученый
Каспер РФ, Янушпольский Э.Х. Оптимальная подготовка эндометрия к циклам переноса замороженных эмбрионов: окно имплантации и прогестероновая поддержка. Fertil Steril. 2016; 105 (4): 867–72.
CAS Статья Google ученый
Велева З., Орава М., Нуоджуа-Хуттунен С., Тапанайнен Дж. С., Мартикайнен Х. Факторы, влияющие на результат переноса замороженных-размороженных эмбрионов. Hum Reprod. 2013. 28 (9): 2425–31.
Артикул Google ученый
Берг П.А., Навот Д. Влияние эмбрионального развития и зрелости эндометрия на сроки имплантации. Fertil Steril. 1992. 58 (3): 537–42.
CAS Статья Google ученый
Саймон К., Мартин Дж. К., Пеллисер А. Паракринные регуляторы имплантации. Baillieres Best Practices Clin Obstet Gynaecol. 2000. 14 (5): 815–26.
CAS Статья Google ученый
Лоуренс Б., Фатеми Х.М. Влияние повышения прогестерона в фолликулярной фазе циклов ЭКО на восприимчивость эндометрия. Репродукция Biomed Online. 2017; 34 (4): 422–8.
CAS Статья Google ученый
Bosch E, Valencia I, Escudero E, Crespo J, Simon C, Remohi J и др. Преждевременная лютеинизация во время циклов антагонистов гонадотропин-рилизинг-гормона и ее связь с исходом оплодотворения in vitro. Fertil Steril. 2003. 80 (6): 1444–9.
Артикул Google ученый
Ван Вэренберг И., Фатеми Х.М., Блокил С., Ван Ломмель Л., Ин’т Велд П., Скуит Ф. и др. Повышение прогестерона в день ХГЧ в циклах, стимулированных антагонистом ГнРГ / рФСГ, влияет на экспрессию гена эндометрия.Репродукция Biomed Online. 2011; 22 (3): 263–71.
Артикул Google ученый
Glujovsky D, Pesce R, Fiszbajn G, Sueldo C, Hart RJ, Ciapponi A. Подготовка эндометрия для женщин, перенесших перенос эмбрионов с замороженными эмбрионами или эмбрионами, полученными из донорских ооцитов. Кокрановская база данных Syst Rev.2010 (1): Cd006359.
Groenewoud ER, Cantineau AE, Kollen BJ, Macklon NS, Cohlen BJ. Каковы оптимальные способы подготовки эндометрия в циклах переноса замороженных-размороженных эмбрионов? Систематический обзор и метаанализ. Обновление Hum Reprod. 2017; 23 (2): 255–61.
Обновление Hum Reprod. 2017; 23 (2): 255–61.
CAS PubMed Google ученый
Mackens S, Santos-Ribeiro S, van de Vijver A, Racca A, Van Landuyt L, Tournaye H, et al. Перенос замороженных эмбрионов: обзор оптимальной подготовки эндометрия и сроков. Hum Reprod. 2017; 32 (11): 2234–42.
CAS Статья Google ученый
Давар Р., Джанати С., Мохсени Ф., Хабазхооб М., Асгари С.Сравнение эффектов трансдермального эстрадиола и эстрадиола валерата на восприимчивость эндометрия в циклах переноса замороженных-размороженных эмбрионов: рандомизированное клиническое испытание. J Reprod Infertil. 2016; 17 (2): 97–103.
PubMed PubMed Central Google ученый
Шапиро Д. Б., Паппадакис Дж. А., Эллсуорт Н. М., Хайт Г. И., Надь З. П.. Замена прогестерона вагинальным гелем по сравнению с в / м. инъекции: цикл и исходы беременности у пациенток ЭКО, получавших витрифицированные бластоцисты.Hum Reprod. 2014. 29 (8): 1706–11.
CAS Статья Google ученый
Дивайн К., Рихтер К.С., Видра Е.А., Маккиби Дж. Л.. Циклы переноса витрифицированных бластоцист с использованием только вагинального замещения прогестерона эндометрином имеют более низкие показатели продолжающейся беременности: результаты запланированного промежуточного анализа трехгруппового рандомизированного контролируемого исследования не меньшей эффективности. Fertil Steril. 2018; 109 (2): 266–75.
CAS Статья Google ученый
Nawroth F, Ludwig M. Какова «идеальная» продолжительность приема прогестерона до переноса криоконсервированных-размороженных эмбрионов в протоколах замещения эстроген / прогестерон? Hum Reprod. 2005. 20 (5): 1127–34.
CAS Статья Google ученый
ван де Виджвер А., Полизос Н. П., Ван Ландейт Л., Маккенс С., Ступ Д., Камю М. и др. Какова оптимальная продолжительность введения прогестерона перед переносом витрифицированного нагретого эмбриона на стадии дробления? Рандомизированное контролируемое исследование.Hum Reprod. 2016; 31 (5): 1097–104.
Артикул Google ученый
Kofinas JD, Blakemore J, McCulloh DH, Grifo J. Уровни прогестерона в сыворотке, превышающие 20 нг / дл в день переноса эмбриона, связаны с более низким уровнем живорождений и более высоким уровнем выкидышей. J Assist Reprod Genet. 2015; 32 (9): 1395–9.
J Assist Reprod Genet. 2015; 32 (9): 1395–9.
Артикул Google ученый
Brady PC, Kaser DJ, Ginsburg ES, Ashby RK, Missmer SA, Correia KF, et al.Концентрация прогестерона в сыворотке крови в день переноса эмбриона в циклах донорских ооцитов. J Assist Reprod Genet. 2014; 31 (5): 569–75.
Артикул Google ученый
Гаджотти-Марре С., Мартинес Ф., Колл Л., Гарсия С., Альварес М., Парриего М. и др. Низкий уровень прогестерона в сыворотке крови за день до переноса замороженных эмбрионов эуплоидных эмбрионов связан со значительным снижением показателей живорождения. Гинекол Эндокринол. 2018: 1–4.

Labarta E, Mariani G, Holtmann N, Celada P, Remohi J, Bosch E. Низкий уровень прогестерона в сыворотке в день переноса эмбриона связан с уменьшением продолжающейся беременности в циклах донорства ооцитов после искусственной подготовки эндометрия: проспективное исследование. Hum Reprod. 2017; 32 (12): 2437–42.
CAS Статья Google ученый
Niu Z, Feng Y, Sun Y, Zhang A, Zhang H. Мониторинг уровня эстрогена в циклах переноса искусственно замороженных-размороженных эмбрионов с использованием повышающего режима без подавления гипофиза: необходимо ли? J Exp Clin Assist Reprod.2008; 5: 4.
Артикул Google ученый
Риттенберг В., Сешадри С., Сункара С.К., Собалева С., Отенг-Нтим Э, Эль-Тухи Т. Влияние индекса массы тела на результат лечения ЭКО: обновленный систематический обзор и метаанализ. Репродукция Biomed Online. 2011; 23 (4): 421–39.
Влияние индекса массы тела на результат лечения ЭКО: обновленный систематический обзор и метаанализ. Репродукция Biomed Online. 2011; 23 (4): 421–39.
Артикул Google ученый
Шах Д.К., Миссмер С.А., Берри К.Ф., Раковски С., Гинзбург Е.С.Влияние ожирения на качество ооцитов и эмбрионов у женщин, подвергшихся экстракорпоральному оплодотворению. Obstet Gynecol. 2011. 118 (1): 63–70.
Артикул Google ученый
Тремеллен К., Пирс К., Зандер-Фокс Д. Увеличение количества выкидышей при эуплоидной беременности у женщин с ожирением, перенесших криоконсервированный перенос эмбрионов. Репродукция Biomed Online. 2017; 34 (1): 90–7.
Артикул Google ученый
Zhang D, Zhu Y, Gao H, Zhou B, Zhang R, Wang T и др. Избыточный вес и ожирение негативно влияют на результаты стимуляции яичников и экстракорпорального оплодотворения: когортное исследование 2628 китайских женщин. Гинекол Эндокринол. 2010. 26 (5): 325–32.
Артикул Google ученый
Критерии количества эмбрионов для переноса: заключение комитета. Fertil Steril. 2013. 99 (1): 44–6.
Руководство по ограничению количества эмбрионов для переноса: заключение комитета.Fertil Steril. 2017; 107 (4): 901–3.
Определение оптимальной продолжительности приема прогестерона перед переносом криоконсервированных эмбрионов и его влияние на частоту имплантации и беременности: пилотное исследование
Цель.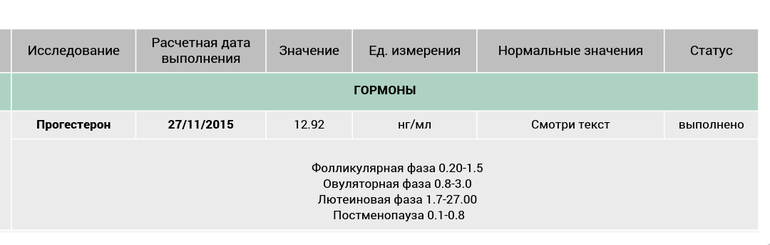 Определить оптимальную продолжительность приема прогестерона до переноса криоконсервированных эмбрионов и его влияние на имплантацию и частоту наступления беременности. Дизайн исследования . Проспективное рандомизированное исследование. Материалы и методы .В отделение ЭКО третичного центра были включены шестьдесят шесть пациентов, перенесших циклы переноса криоконсервированных эмбрионов. Для подготовки эндометрия применяли валерат эстрадиола. Как только он достиг минимум 7 мм, пациентов случайным образом распределили на группу I () и группу II (). Затем начали вводить 100 мг прогестерона в день в течение 3 и 4 дней соответственно. За этим следовали перенос по крайней мере одного размороженного эмбриона на стадии 2-го дня дробления хорошего качества. Группы I и II сравнивали с точки зрения клинической беременности и частоты имплантации. Результатов . В группе I (3-дневный прогестерон) и группе II (4-дневный прогестерон) частота наступления беременности составила 41,02% (16/39) и 18,51% (5/27) соответственно.
Определить оптимальную продолжительность приема прогестерона до переноса криоконсервированных эмбрионов и его влияние на имплантацию и частоту наступления беременности. Дизайн исследования . Проспективное рандомизированное исследование. Материалы и методы .В отделение ЭКО третичного центра были включены шестьдесят шесть пациентов, перенесших циклы переноса криоконсервированных эмбрионов. Для подготовки эндометрия применяли валерат эстрадиола. Как только он достиг минимум 7 мм, пациентов случайным образом распределили на группу I () и группу II (). Затем начали вводить 100 мг прогестерона в день в течение 3 и 4 дней соответственно. За этим следовали перенос по крайней мере одного размороженного эмбриона на стадии 2-го дня дробления хорошего качества. Группы I и II сравнивали с точки зрения клинической беременности и частоты имплантации. Результатов . В группе I (3-дневный прогестерон) и группе II (4-дневный прогестерон) частота наступления беременности составила 41,02% (16/39) и 18,51% (5/27) соответственно. С другой стороны, частота имплантации составила 16,82% (18/107) и 7,69% (6/78) соответственно. Разница была статистически значимой (значения 0,0172 и 0,0386 соответственно). Заключение . Прием прогестерона в течение трех дней перед переносом стадии дробления (день 2) криоконсервированных эмбрионов имеет значительно более высокие показатели беременности и имплантации по сравнению с четырехдневным приемом.
С другой стороны, частота имплантации составила 16,82% (18/107) и 7,69% (6/78) соответственно. Разница была статистически значимой (значения 0,0172 и 0,0386 соответственно). Заключение . Прием прогестерона в течение трех дней перед переносом стадии дробления (день 2) криоконсервированных эмбрионов имеет значительно более высокие показатели беременности и имплантации по сравнению с четырехдневным приемом.
1. Введение
Имеются убедительные доказательства того, что у людей существует временное окно максимальной восприимчивости эндометрия, соответствующее 5-7 дням после овуляции. Восприимчивость эндометрия заключается в приобретении лигандов адгезии с потерей ингибирующих компонентов, которые действуют как барьер для прикрепляющегося эмбриона. Это окно восприимчивости определяется большим количеством молекулярных медиаторов, которые активируются уровнями прогестерона. Теоретически можно предположить, что количество дней воздействия прогестерона будет влиять на восприимчивость эндометрия и, следовательно, на имплантацию, хотя воздействие эстрогена на эндометрий во время фолликулярной фазы не менее важно, чтобы прогестерон проявил свой максимальный эффект позже. Неадекватная восприимчивость матки является причиной примерно двух третей неудач имплантации в циклах ЭКО, тогда как сам эмбрион ответственен только за одну треть этих неудач [1, 2].
Неадекватная восприимчивость матки является причиной примерно двух третей неудач имплантации в циклах ЭКО, тогда как сам эмбрион ответственен только за одну треть этих неудач [1, 2].
Имеется множество данных о дозировках и способах введения прогестерона после переноса эмбриона в качестве поддержки лютеиновой фазы, а также мало работ было сделано по дозировкам и режимам приема добавок прогестерона до переноса эмбриона, но таких данных мало. об оптимальной продолжительности приема прогестерона до переноса эмбриона и его влиянии на имплантацию и частоту наступления беременности [3–8].
Оптимальную продолжительность приема прогестерона и развитие максимальной восприимчивости эндометрия, то есть окна имплантации, можно изучить, взяв биопсию эндометрия и оценив наличие пиноподов (при сканирующей электронной микроскопии) и других биомаркеров имплантации (например, экспрессия генов @ Vb3, PP14 и HOXA 10) или путем переноса эмбрионов и наблюдения за темпами беременности и имплантации. Первый метод невозможен в циклах передачи, и, более того, в большинстве центров могут быть недоступны средства.
Первый метод невозможен в циклах передачи, и, более того, в большинстве центров могут быть недоступны средства.
Это исследование проводится с целью определить, повлияет ли количество дней воздействия прогестерона до переноса криоконсервированных эмбрионов на частоту имплантации и наступления беременности, и если да, то какова оптимальная продолжительность приема прогестерона до переноса. перенос эмбриона?
Циклы переноса криоконсервированных эмбрионов выбраны для изучения, так как это, по-видимому, лучшая модель для человека для определения оптимальной продолжительности приема прогестерона, когда количество дней воздействия прогестерона может быть изменено, сохраняя стадию переноса эмбриона постоянной. .Циклы переноса криоконсервированных эмбрионов будут включать (а) избыточные эмбрионы для использования в последующем цикле, (б) эмбрионы из циклов донор-реципиент.
2. Цели и задачи
Целями являются определение оптимальной продолжительности приема прогестерона до переноса криоконсервированных эмбрионов и его влияние на имплантацию и частоту наступления беременности.
3. Материал и метод
3.1. Дизайн исследования
Это проспективное рандомизированное исследование.
Исследование проводилось в отделении ЭКО и репродукции человека центра третичной медицинской помощи в Индии в течение 9 месяцев.
3.2. Популяция исследования
Шестьдесят шесть индийских женщин, перенесших циклы переноса криоконсервированных эмбрионов, были включены в исследование после рассмотрения критериев включения и исключения (рис. 1). Соответствующее согласие было получено от пациентов, а одобрение было получено от наблюдательного совета учреждения.
Критерии включения следующие: (a) Все эмбрионы, криоконсервированные от женщин моложе 37 лет. (B) Криоконсервированные эмбрионы на стадии дробления. (C) Толщина эндометрия в день начала введения прогестерона> 7 мм.(d) Перенос по крайней мере 1 полностью интактного эмбриона после оттаивания.
Критерии исключения следующие: (a) Возраст пациента (и донора ооцитов)> 37 лет. (B) Естественные циклы без добавления эстрогенов. (C) Толщина эндометрия в день начала приема прогестерона <7 мм. (D ) Аденомиоз или интрамуральная миома> 4 см. (E) Очевидный гидросальпинкс. (F) История 3 предыдущих неудачных циклов ЭКО. Трансвагинальное сканирование было выполнено на третий день менструального цикла вместе с базальным уровнем ФСГ, ЛГ и эстрадиола.Подтвердив, что исходный уровень эндометрия составляет менее 4 мм, а уровень эстрадиола менее 50 пг / мл, было начато искусственное приготовление эндометрия с эстрадиола валерата 2 мг трижды в день в течение 12 дней, после чего было повторено трансвагинальное сканирование, чтобы увидеть толщину эндометрия и шаблон. Если толщина эндометрия достигала минимум 7 мм, пациентов случайным образом распределяли на группу I и группу II. Если было обнаружено, что ЕТ меньше 7 мм, эстрадиола валерат продолжали еще на 2-3 дня и повторно оценивали.Первоначально планировалось, что, если толщина эндометрия останется субоптимальной, пациенты будут исключены из исследования, но, к счастью, у всех пациентов она достигла минимум 7 мм.
(B) Естественные циклы без добавления эстрогенов. (C) Толщина эндометрия в день начала приема прогестерона <7 мм. (D ) Аденомиоз или интрамуральная миома> 4 см. (E) Очевидный гидросальпинкс. (F) История 3 предыдущих неудачных циклов ЭКО. Трансвагинальное сканирование было выполнено на третий день менструального цикла вместе с базальным уровнем ФСГ, ЛГ и эстрадиола.Подтвердив, что исходный уровень эндометрия составляет менее 4 мм, а уровень эстрадиола менее 50 пг / мл, было начато искусственное приготовление эндометрия с эстрадиола валерата 2 мг трижды в день в течение 12 дней, после чего было повторено трансвагинальное сканирование, чтобы увидеть толщину эндометрия и шаблон. Если толщина эндометрия достигала минимум 7 мм, пациентов случайным образом распределяли на группу I и группу II. Если было обнаружено, что ЕТ меньше 7 мм, эстрадиола валерат продолжали еще на 2-3 дня и повторно оценивали.Первоначально планировалось, что, если толщина эндометрия останется субоптимальной, пациенты будут исключены из исследования, но, к счастью, у всех пациентов она достигла минимум 7 мм.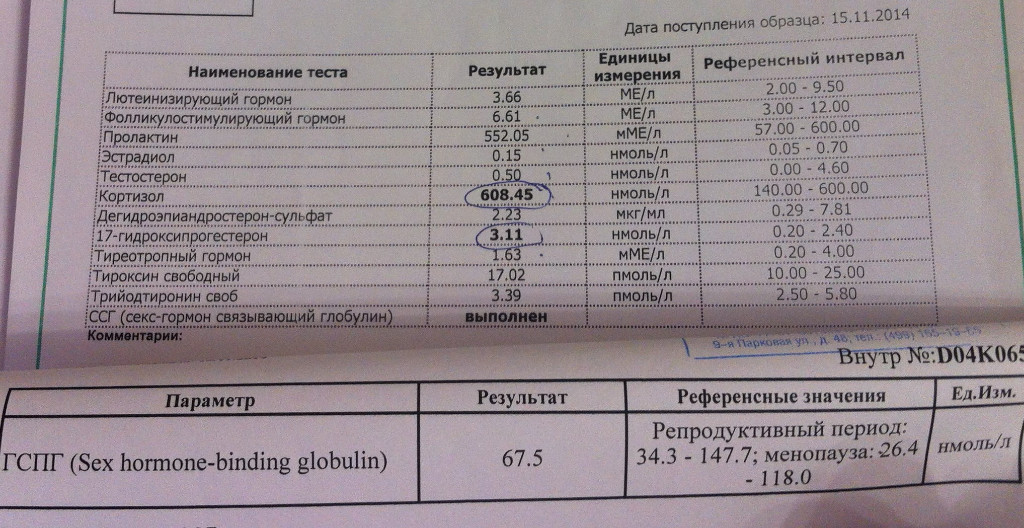 Когда эндометрий достиг минимума 7 мм, пациенты были случайным образом распределены медсестрой по группам I и II, которые распределили участников по группам (рис. 1). Рандомизация проводилась на основе таблицы рандомизации, созданной компьютером. Команда, выполняющая перенос эмбрионов, не понимала группового назначения.Испытание не контролировалось плацебо, поскольку результаты были объективными. Затем пациенты получали инъекционный прогестерон 100 мг в день в течение 3 и 4 дней соответственно.
Когда эндометрий достиг минимума 7 мм, пациенты были случайным образом распределены медсестрой по группам I и II, которые распределили участников по группам (рис. 1). Рандомизация проводилась на основе таблицы рандомизации, созданной компьютером. Команда, выполняющая перенос эмбрионов, не понимала группового назначения.Испытание не контролировалось плацебо, поскольку результаты были объективными. Затем пациенты получали инъекционный прогестерон 100 мг в день в течение 3 и 4 дней соответственно.
Группа I . В этой группе инъекционный прогестерон вводили в течение 3 дней, а ЭТ — на 4-й день.
Группа II . В этой группе инъекционный прогестерон вводили в течение 4 дней, а ЭТ — на 5-й день.
Криоконсервированные эмбрионы размораживали в день переноса эмбрионов.После размораживания эмбрионы исследовали, и цикл включали в исследование, если хотя бы один эмбрион хорошего качества [24] оказался полностью неповрежденным.
За этим последовал перенос эмбриона, по крайней мере, одного после оттаивания полностью интактного эмбриона на стадии дробления (день 2) хорошего качества. Лютеиновая поддержка вводилась в виде микронизированного прогестерона 800 мг интравагинально в два приема вместе с эстрадиола валератом 2 мг трижды в день. Все пациентки были проверены на беременность через 14 дней после переноса эмбрионов путем проверки уровня сывороточного ХГЧ.При подтверждении беременности лютеиновая поддержка продолжалась до 14 недель. Через 4 недели после переноса эмбриона было проведено трансвагинальное сканирование, чтобы увидеть гестационный мешок и подтвердить клиническую беременность. Проведен сравнительный анализ показателей клинической беременности и имплантации в I и II группах.
Лютеиновая поддержка вводилась в виде микронизированного прогестерона 800 мг интравагинально в два приема вместе с эстрадиола валератом 2 мг трижды в день. Все пациентки были проверены на беременность через 14 дней после переноса эмбрионов путем проверки уровня сывороточного ХГЧ.При подтверждении беременности лютеиновая поддержка продолжалась до 14 недель. Через 4 недели после переноса эмбриона было проведено трансвагинальное сканирование, чтобы увидеть гестационный мешок и подтвердить клиническую беременность. Проведен сравнительный анализ показателей клинической беременности и имплантации в I и II группах.
Показатели результата (i) Первичный результат выглядит следующим образом: (a) Частота клинической беременности. (B) Частота имплантации. Частота клинической беременности (CPR) рассчитывалась отдельно для каждой группы как число пациенток, которые забеременели (подтверждено). по наличию гестационного мешка при транвагинальном сканировании через 4 недели после переноса эмбриона), деленное на количество пациентов, перенесших перенос эмбрионов.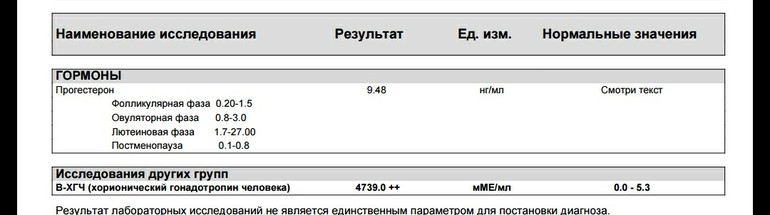 Частота имплантации (IR) также рассчитывалась для каждой группы как количество гестационных мешков, деленное на количество перенесенных эмбрионов.
Частота имплантации (IR) также рассчитывалась для каждой группы как количество гестационных мешков, деленное на количество перенесенных эмбрионов.
3.3. Статистический анализ
Результаты циклов лечения с точки зрения беременности и частоты имплантации сравнивали с использованием критерия Стьюдента. Значение <0,05 считалось статистически значимым.
4. Результаты
Всего в исследование было включено 66 пациентов, 39 в группе I и 27 во II группе.
Существенной разницы по возрасту в обеих группах не было.Пациенты в обеих группах были сопоставимы с точки зрения количества дней воздействия эстрогенов, толщины эндометрия во время переноса эмбрионов и количества перенесенных эмбрионов (Таблица 1).
| ||||||||||||||||||||||||||||||
В группе I (3 дня воздействия прогестерона) и группе II (4 дня воздействия прогестерона) частота наступления беременности составила 41,02% (16/39) и 18.51% (5/27) соответственно. С другой стороны, частота имплантации составила 16,82% (18/107) и 7,69% (6/78), соответственно, тогда как частота многоплодной беременности составила 12,5% (2/16) и 20% (1/5) для группы I. и II. Разница была статистически значимой как для беременности (значение 0,0172), так и для частоты имплантации (значение 0,0386) (рисунки 2 и 3).
В обеих группах наблюдалась настолько значительная разница в показателях беременности и имплантации, что исследование пришлось преждевременно прервать, прежде чем было достигнуто заранее заданное целевое значение в 100 пациенток.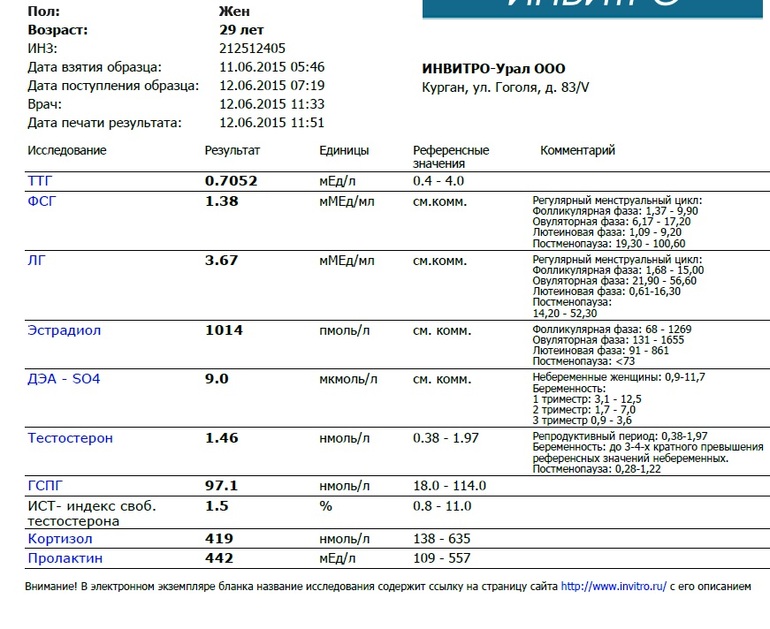
5. Обсуждение
Для успешной имплантации жизнеспособный эмбрион должен встретиться с эндометрием в правильной фазе восприимчивости, известной как окно имплантации. Об обнаружении остроконечных ножек как маркера восприимчивости матки сообщалось в прошлом [25–27]. Экспрессия определенных генов, которые сигнализируют о путях клеточной адгезии, необходима эндометрием для имплантации. Воздействие прогестерона вызывает изменения в эндометрии, примированном эстрогеном, что делает его восприимчивым к имплантации эмбриона.Окно имплантации у людей начинается через 5-7 дней после овуляции и остается открытым еще 4-5 дней. Это означает, что максимальная восприимчивость эндометрия в естественном 28-дневном менструальном цикле составляет с 19-го по 24-й день.
В большинстве клиник ЭКО во всем мире практика заключается в добавлении прогестерона в течение 3 дней перед переносом криоконсервированного эмбриона на 3-й день и в течение 5 дней до переноса. перенос криоконсервированной бластоцисты 5-го дня.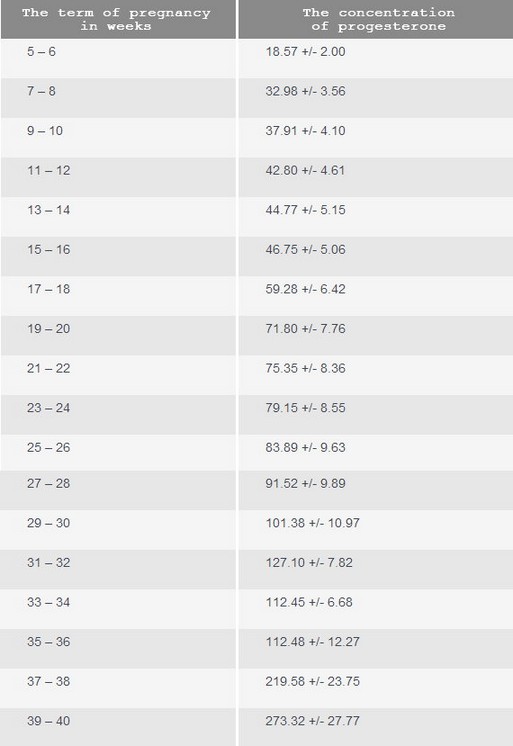 Таким образом, количество дней воздействия прогестерона перед переносом эмбриона зависит от стадии переносимого замороженного эмбриона.Логика состоит в том, чтобы довести эндометрий до того же уровня зрелости, который был бы при естественной имплантации. Но насколько нам известно, нет рандомизированных контролируемых испытаний, подтверждающих эту логическую практику. Более того, небольшое беспокойство здесь заключается в том, что в естественном цикле синтез некоторого количества прогестерона начинается после всплеска ЛГ, даже до овуляции. Точно так же в новом цикле ЭКО прогестерон начинает расти после триггера ХГЧ. Таким образом, кажется, что в цикле переноса замороженного размороженного эмбриона эндометрий отстает с точки зрения зрелости и воздействия прогестерона, если прогестерон вводится в течение того же количества дней, что и стадия переносимого эмбриона.Об этом также упоминали Навот и др. в 1986 году, во время нормальной имплантации эмбрион на стадии 4-8 клеток совпадает с развитием эндометрия через 3-4 дня после выброса ЛГ in vivo [28].
Таким образом, количество дней воздействия прогестерона перед переносом эмбриона зависит от стадии переносимого замороженного эмбриона.Логика состоит в том, чтобы довести эндометрий до того же уровня зрелости, который был бы при естественной имплантации. Но насколько нам известно, нет рандомизированных контролируемых испытаний, подтверждающих эту логическую практику. Более того, небольшое беспокойство здесь заключается в том, что в естественном цикле синтез некоторого количества прогестерона начинается после всплеска ЛГ, даже до овуляции. Точно так же в новом цикле ЭКО прогестерон начинает расти после триггера ХГЧ. Таким образом, кажется, что в цикле переноса замороженного размороженного эмбриона эндометрий отстает с точки зрения зрелости и воздействия прогестерона, если прогестерон вводится в течение того же количества дней, что и стадия переносимого эмбриона.Об этом также упоминали Навот и др. в 1986 году, во время нормальной имплантации эмбрион на стадии 4-8 клеток совпадает с развитием эндометрия через 3-4 дня после выброса ЛГ in vivo [28].
В подтверждение этого несколько, а точнее несколько исследований показали, что частота наступления беременности была выше, когда прогестерон принимался в течение 4 или 5 дней перед переносом эмбрионов на стадии дробления (стадия 4-8 клеток) [28]. Prapas et al. в 1998 г. также сообщалось о более высокой частоте беременностей (40%) и имплантации (14.1%) при добавлении прогестерона в течение 4 дней по сравнению с 3 днями до 2-го дня стадии переноса эмбрионов [5]. Они изучили окно имплантации в циклах донорства ооцитов в зависимости от продолжительности терапии прогестероном [5] и обнаружили, что частота имплантации и наступления беременности была значительно выше после введения прогестерона в течение 4 и 5 дней (40% и 48,3% соответственно), поскольку по сравнению с 0%, 12% и 20,4% после приема прогестерона в течение 2, 3 и 6 дней соответственно. Все пересадки были выполнены в течение 48 часов после осеменения (стадия эмбриона 2 дня).Они обнаружили, что воздействие прогестерона должно продолжаться минимум 48 часов, чтобы произошла имплантация.
Напротив, есть еще пара исследований, которые показывают, что частота наступления беременности и имплантации выше, если дни воздействия прогестерона совпадают со стадией перенесенного эмбриона. Ding et al. в 2007 г. изучали 49 циклов переноса замороженных оттаявших бластоцист и обнаружили, что частота клинических беременностей, продолжающаяся беременность и частота имплантации были выше, когда прогестерон вводился за 5 дней до переноса по сравнению с 6 днями (60.9% против 53,8%, 56,5% против 50,0% и 40,7% против 30,0% соответственно), но различия не достигли статистической значимости (s> 0,05). Однако это исследование включало циклы переноса размороженных бластоцист, когда существует критический запас перед закрытием окна имплантации и один дополнительный день приема прогестерона может отрицательно повлиять на результаты [7].
Тем не менее, еще несколько авторов не отметили различий в частоте наступления беременности или имплантации с 3, 4 или 5 днями приема прогестерона до переноса эмбриона. В проспективном исследовании Navot et al. (1991) 60 реципиентов программы донорства ооцитов были изучены, и перенос эмбрионов (2 или 3 день) после и 6 дней введения прогестерона не оказал значительного влияния на частоту наступления беременности и абортов [3]. Это было показано Michalas et al. в 1996 г. выяснилось, что изменение введения прогестерона за 2–4 дня до переноса эмбриона (день 2) не влияет на исход беременности [4].
В проспективном исследовании Navot et al. (1991) 60 реципиентов программы донорства ооцитов были изучены, и перенос эмбрионов (2 или 3 день) после и 6 дней введения прогестерона не оказал значительного влияния на частоту наступления беременности и абортов [3]. Это было показано Michalas et al. в 1996 г. выяснилось, что изменение введения прогестерона за 2–4 дня до переноса эмбриона (день 2) не влияет на исход беременности [4].
Недавно на китайском языке был опубликован ретроспективный анализ 1103 циклов переноса замороженных оттаявших эмбрионов, в котором изучалась частота наступления беременности в течение 3 и 4 дней введения прогестерона с последующим переносом эмбрионов на 3 день [8].Они также изучили результаты циклов замороженного оттаивания, когда бластоцисты 5-го дня переносились через 5 и 6 дней введения прогестерона. Они обнаружили, что частота имплантации, частота беременностей, частота внематочных беременностей, частота многоплодных беременностей и частота ранних абортов существенно не различались, когда эмбрионы 3-го дня были перенесены через 3 или 4 дня прогестерона, а также когда бластоцисты 5-го дня были перенесены через 5 или 5 дней.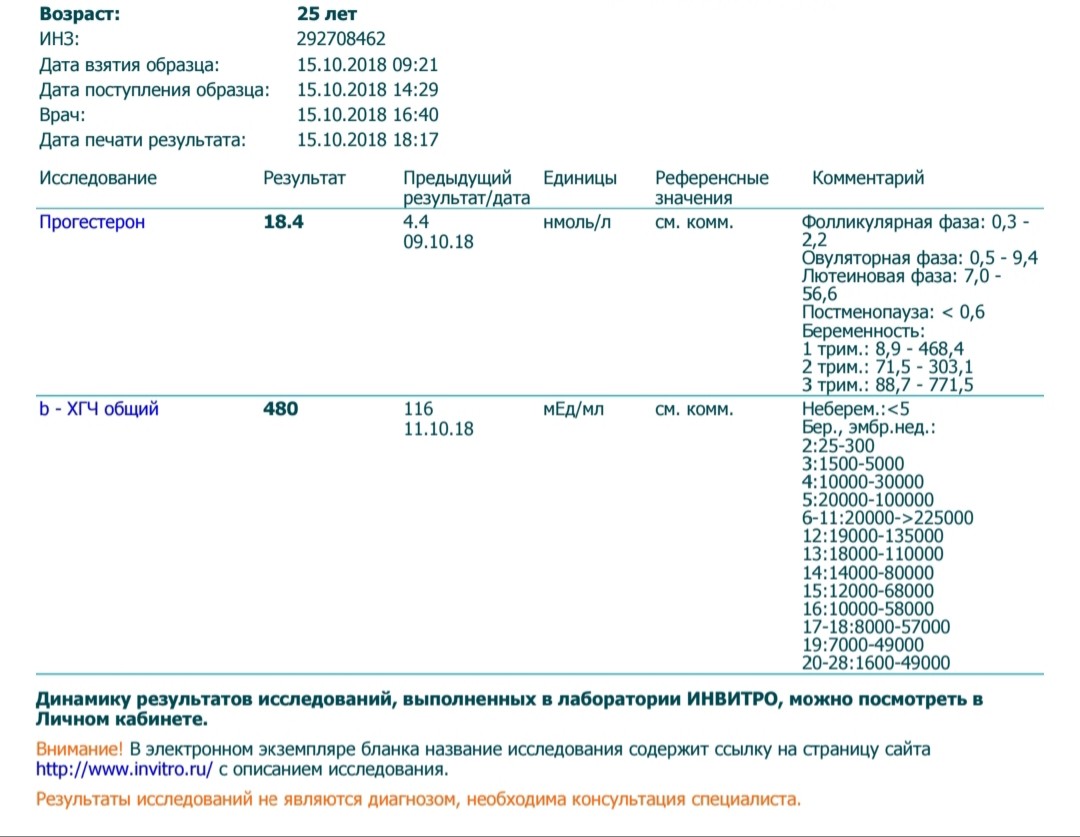 6 дней прогестерона. Интересно, что 3 или 4 дня приема прогестерона для переноса бластоцисты на 5 день или 5 или 6 дней прогестерона до переноса эмбриона на 3 день не изучались, вероятно, потому, что наша многолетняя логическая практика и удовлетворительные результаты сами по себе развеяли некоторые сомнения.
6 дней прогестерона. Интересно, что 3 или 4 дня приема прогестерона для переноса бластоцисты на 5 день или 5 или 6 дней прогестерона до переноса эмбриона на 3 день не изучались, вероятно, потому, что наша многолетняя логическая практика и удовлетворительные результаты сами по себе развеяли некоторые сомнения.
В таблице 2 показаны некоторые исследования, посвященные добавлению эстрогена / прогестерона для подготовки эндометрия перед переносом замороженных размороженных эмбрионов. Здесь следует подчеркнуть, что даже до переноса эмбриона на второй день большинство центров предпочитают вводить прогестерон не менее трех дней, а не 2. Однако для переноса на третий и пятый день количество дней введения прогестерона была такой же, как и на стадии перенесенных эмбрионов. Это соответствует исследованию Prapas et al.[5], где они пришли к выводу, что для открытия окна имплантации необходимо не менее 48 часов воздействия прогестерона.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Источник: Nawroth and Ludwig [6]. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Однако, насколько нам известно, до настоящего времени не существует проспективного рандомизированного контролируемого исследования для решения вопроса об оптимальной продолжительности введения прогестерона до переноса криоконсервированных эмбрионов и его влиянии на имплантацию и частоту наступления беременности.
В нашем исследовании мы обнаружили, что продолжительность приема прогестерона имеет решающее значение для имплантации. В этом исследовании добавка прогестерона в течение трех дней до переноса криоконсервированных эмбрионов на стадии дробления (день 2; стадия 4–6 клеток) имела значительно более высокие показатели беременности и имплантации по сравнению с 4 днями введения прогестерона. Более того, до начала этого исследования наша практика заключалась в переносе размороженных эмбрионов на второй день после 2-3 дней воздействия прогестерона в цикле переноса криоконсервированных эмбрионов, результаты были удовлетворительными и сопоставимыми.Таким образом, мы заключаем, что частота наступления беременности и имплантации будет лучше, если количество дней прогестерона будет таким же или на один день больше, чем стадия переноса замороженного эмбриона. Но разница в два дня может испортить результат. Прежде чем будет определена точная продолжительность приема прогестерона, необходимы большие многоцентровые рандомизированные контролируемые исследования.
Проспективное рандомизированное исследование проводится в Центре репродуктивной медицины больницы Брюссельского университета под официальным названием «Оптимальная продолжительность приема прогестерона перед переносом криоконсервированных (замороженных) -отмороженных эмбрионов третьего дня в искусственном цикле с экзогенными Эстроген и прогестерон (ПРОФЕТА-3) »(ClinicalTrials.gov ID NCT01940653), где они сравнивают свою практику начала приема прогестерона за 5 дней до переноса эмбриона третьего дня с более распространенной практикой в большинстве центров, когда его начинают за 3 дня до переноса третьего дня [29].
Аналогичным образом, в том же центре проводится еще одно испытание (PROFETA-5) ( ClinicalTrials.gov, идентификатор NCT02032797), где они снова сравнивают свою практику начала приема прогестерона за 7 дней до переноса бластоцисты 5-го дня. , с более распространенной практикой в большинстве центров начинать его за 5 дней до этого [30].Мы надеемся получить результаты к концу 2016 года.
6. Заключение
Добавка прогестерона за три дня до переноса стадии дробления (день 2) криоконсервированных эмбрионов имеет значительно более высокие показатели беременности и имплантации по сравнению с четырьмя дневная добавка.
Дополнительные точки
Капсула . В проспективном исследовании было обнаружено, что прием прогестерона за три дня до переноса криоконсервированных эмбрионов на стадии дробления имеет значительно более высокие показатели беременности и имплантации по сравнению с четырехдневным приемом.
Раскрытие информации
Нынешний адрес Сангиты Шармы — дом № 1, колония Вишну, Лакшми Нагар, Джайпур 302006, Раджастхан, Индия. Авторы заявляют, что описанная здесь работа является оригинальной, не была отправлена и не опубликована в каком-либо другом журнале и не рассматривается. Эта работа не была представлена ни на одной встрече.
Конкурирующие интересы
У авторов нет конфликта интересов, подлежащего раскрытию.
Вклад авторов
Сангита Шарма и Абха Маджумдар внесли равный вклад в рукопись, участвуя на всех этапах разработки дизайна исследования, анализа данных и подготовки рукописи.Абха Маджумдар помог в сборе данных, а Сангита Шарма провела статистический анализ и написала рукопись. Абха Маджумдар критически отредактировал рукопись. Все авторы дали окончательное одобрение представленной версии.
Благодарности
Авторы хотели бы выразить признательность доктору М. Кочару, доктору С. Талвару, доктору С. Митталу и доктору Н. Тивари за их щедрую помощь и постоянное вдохновение. Они благодарны доктору Р. Сатвику за помощь в статистическом анализе и доктору Р.Д. Инамдару за заключительный вклад в редактирование рукописи. Они также хотели бы поблагодарить доктора Г. Маджумдара, который занимался аспектами эмбриологии исследования. Авторы благодарят всех женщин, принявших участие в этом исследовании.
Границы | Роль ХГЧ, запускающего уровни прогестерона: реальное ретроспективное когортное исследование, включающее более 8000 циклов ЭКО / ИКСИ
Введение
Связь между уровнями прогестерона (Р) в сыворотке, измеренными в день триггера овуляции, и исходом циклов оплодотворения (ЭКО) in vitro, , была одним из основных противоречий в области эндокринологии стимуляции яичников (1, 2).С 1991 г. во многих исследованиях подчеркивалось, что преждевременное и чрезмерное повышение P непосредственно перед индукцией овуляции может отрицательно повлиять на исход цикла ЭКО (3–6). Однако в большом количестве публикаций также приводятся противоположные выводы (7–10). До сих пор причина увеличения P точно не известна. Высокие дозы экзогенного фолликулярного стимулирующего гормона (ФСГ), используемые в циклах стимуляции яичников, могут вызвать повышение уровня фосфора к концу фолликулярной фазы.ФСГ напрямую индуцирует ферментативную активность 3-бета-гидроксистероиддегидрогеназы и, таким образом, увеличивает превращение прегненолона в Р. Более того, низкие уровни лютеинизирующего гормона (ЛГ) могут снижать превращение прегненолона и фосфора в андрогены тека-клетками (11). Некоторые авторы сообщают, что преждевременное повышение P во время стимуляции яичников может быть вызвано потерей активности ЛГ и хорионических гонадотропинов человека (ХГЧ) (12, 13).
Связь между чрезмерным повышением P и отрицательным исходом цикла ЭКО является предметом все еще продолжающихся дебатов.Большой метаанализ, насчитывающий более 55000 циклов, предоставил убедительные данные, подтверждающие гипотезу о том, что повышение уровня P в сыворотке крови связано с более низкой частотой наступления беременности (14). Однако обширный обзор литературы вместо того, чтобы дать окончательный ответ о роли P в вероятности беременности, породил новые важные клинические вопросы. Есть ли порог P, который может предсказать исход цикла ЭКО? Может ли перенос эмбрионов на стадии бластоцисты обратить негативное влияние, которое может иметь высокий уровень фосфора? Может ли протокол агонистов или антагонистов гонадотропин-рилизинг-гормона (GnRH) изменить уровни прогестерона? Одинаковы ли эффекты высоких уровней фосфора для всех пациентов, независимо от их характеристик и их реакции на стимуляцию яичников?
Целью данного исследования является обзор набора данных единого университетского центра для оценки влияния преждевременных высоких уровней P в сыворотке на исход циклов переноса свежих эмбрионов с точки зрения частоты клинических беременностей (CPR) и частоты живорождений ( LBR).На протяжении многих лет в литературе рассматривались различные пороговые уровни прогестерона, которые были проанализированы в настоящих реальных данных (15), чтобы оценить их применимость и осуществимость в нашей популяции для выявления их возможного различного воздействия на разные категории пациентов или на разные этапы созревания эмбриона. Фактически, кроме того, настоящее исследование ретроспективно исследует, может ли перенос бластоцист на 5-й день после оплодотворения (D5-ET) улучшить СЛР и LBR у пациентов с повышением P.
Материалы и методы
Одноцентровое ретроспективное когортное исследование было выполнено в академическом центре репродуктивной медицины третичного уровня (Центр репродуктивной медицины Humanitas, Роццано, Милан, Италия).
Были включены все переносы свежих эмбрионов как на стадии дробления (день 2 и день 3), так и на стадии бластоцисты (день 5), выполненные с января 2012 по декабрь 2016 года.
Были проанализированы следующие клинические переменные: возраст, привычка к курению, индекс массы тела (ИМТ), причины бесплодия, время, в течение которого они пытались зачать ребенка, и протоколы стимуляции яичников.Другие измеренные параметры включали базальные уровни ФСГ и антимюллерова гормона (АМГ), уровни эстрадиола (E2) и P в день индукции овуляции, количество извлеченных ооцитов, стадию эмбриона в день переноса и количество перенесенных эмбрионов.
Протокол контролируемой стимуляции яичников (COS) предусматривал использование рекомбинантного ФСГ (рФСГ), чМГ или рФСГ + рекомбинантный ЛГ (рФСГ + рЛГ). Начальную дозу гонадотропина определяли в соответствии с параметрами резерва яичников, такими как АМГ, количество антральных фолликулов (AFC) и ИМТ.COS выполняли с использованием четырех различных протоколов: длинный протокол агонистов GnRH; Короткий протокол агонистов ГнРГ; Протокол антагонистов ГнРГ; протокол обострения агонистов ГнРГ. Большая часть антагонистов COS началась с использования предварительной обработки комбинированными оральными контрацептивами.
Протокол COS был выбран на основе характеристик пациентов и заключения гинекологов, в основном в соответствии с критериями Посейдона (16–18).
Протокол длинных агонистов ГнРГ был основан на ежедневном введении лейпрорелина (Enantone die; Takeda, Италия) или лейпролина ацетата 0.1 мг / день (Фертипептил; Abbott Pharmaceutical Products, США) на 21 день предыдущей лютеиновой фазы цикла стимуляции. Когда была достигнута десенсибилизация гипофиза (через 14 дней после начала применения агониста ГнРГ), о чем свидетельствует отсутствие фолликулов яичников> 5 мм и толщина эндометрия <5,4 мм при трансвагинальном ультразвуковом исследовании, была начата стимуляция гонадотропинами. В кратком протоколе агонистов ГнРГ агонист (лейпролин 0,1 мг / день) вводился с 21 дня предыдущего цикла и индукция с 1-го или 2-го дня цикла (день 1 является началом менструального кровотечения), снижая дозу агониста до 0.05 мг / день и продолжая стимуляцию до дня введения ХГЧ. В протоколе антагонистов ГнРГ в первый день спонтанного менструального цикла у женщин или кровотечения отмены после приема низких доз оральных контрацептивов начиналась стимуляция гонадотропинами, и когда ведущий фолликул достигал 13–14 мм в среднем диаметре и / или в плазме. E2 превышал 400 пг / мл, инъекция 0,25 мг антагониста GnRH (Cetrotide, Merck Serono SpA, Рим, Италия; Orgalutran, Organon, MSD-Италия) вводилась подкожно (п / к) ежедневно до дня триггера овуляции. .
Наконец, в протоколе обострения ГнРГ, ежедневный агонист вводился в 1 день цикла с трипторелином (0,1 мг / день), а затем гонадотропины были начаты в соответствии с параметром резерва яичников на 2 день цикла. Начальная переменная доза гонадотропина [чМГ (Meropur; Ferring, Милан, Италия) или rFSH (Puregon, MSD-Италия; Gonal-F, Merck Serono SpA, Рим, Италия)] с добавлением или без добавления r-LH для первые 4 дня, а затем вводили индивидуальную дозу в соответствии с параметрами, полученными при трансвагинальном ультразвуковом исследовании и уровнях эстрадиола и прогестерона, до дня триггера овуляции.Протокол индукции и доза вводимых гонадотропинов подбирались индивидуально в зависимости от возраста пациента, гормонального фона в сыворотке и AFC. Трансвагинальное ультразвуковое исследование, определение эстрадиола и прогестерона проводилось во время COS. Когда наблюдались не менее трех фолликулов со средним диаметром> 17 мм, подкожно вводили 250 мкг рекомбинантного ХГЧ (Ovitrelle; Merck Serono S.p.A.). Забор ооцитов проводили трансвагинально через 36 ч после инъекции ХГЧ.Перенос эмбрионов выполняли с 3-го по 5-й день после сбора ооцитов. Лютеиновая фаза поддерживалась у всех пациенток с вагинальным прогестероном (Crinone 8% два раза в день, Merck Serono S.p.A .; или Prometrium, Rottapharm 600 мг в день), начиная с вечернего забора ооцитов и продолжалась у беременных до девятой недели гестации.
У пациентов с высоким ответом (HR) (более 18 фолликулов диаметром ≥12 мм на момент индукции овуляции) триггер был получен с помощью трипторелина 0,2 мг подкожно.В этой когорте, если было извлечено <18 ооцитов, пациенты считались подверженными промежуточному риску синдрома гиперстимуляции яичников (СГЯ), и выполнялся свежий перенос. Была начата адекватная поддержка лютеиновой фазы: ХГЧ 1500 МЕ / пк в день извлечения + эстрадиол 4 мг + вагинальный прогестерон 400 мг в день (протокол спасения).
Уровень ХГЧ в сыворотке оценивался через 2 недели после переноса эмбриона, а затем каждые 48 часов до тех пор, пока не было обнаружено значение более 1000 мМЕ, и через 4 недели после переноса эмбриона было назначено вагинальное ультразвуковое исследование.
Анализ эстрадиола ARCHITECT (Abbott, Ирландия, отдел диагностики, Лонгфорд, Ирландия) — это иммуноферментный анализ на хемилюминесцентных микрочастицах (CMIA) для количественного определения эстрадиола в сыворотке и плазме человека. Аналитическая чувствительность теста ARCHITECT Estradiol составляет ≤ 10 пг / мл. Функциональная чувствительность теста ARCHITECT Estradiol ≤ 25 пг / мл. Тест ARCHITECT на прогестерон (Abbott, Ирландия, отдел диагностики, Лонгфорд, Ирландия) — это CMIA для количественного определения прогестерона в сыворотке и плазме человека.Анализатор прогестерона ARCHITECT имеет аналитическую чувствительность ≤ 0,1 нг / мл. Этот анализ разработан для обеспечения точности ≤ 10% общего CV (коэффициента вариации) между анализами и внутри анализа для концентраций в диапазоне ARCHITECT Progesterone Low Control.
На 3-й день после оплодотворения количество перенесенных эмбрионов варьировалось в зависимости от возраста, прогноза, результатов предыдущих циклов ЭКО, а также гинекологического и акушерского анамнеза.
У пациентов с хорошими прогностическими характеристиками (т.е., возраст <39 лет, более 4 зигот на 1-й день после оплодотворения, образец эякулированной спермы хорошего качества), был осуществлен перенос одного эмбриона на стадии бластоцисты. У пациентов с P > 3 нг / мл была выбрана стратегия замораживания всего (19).
Результаты по прогестерону были разделены на четыре группы: <1, 1–1,5, 1,5–1,75 и ≥1,75.
В отношении повышения P более 1,5 нг / мл была принята общая политика замораживания, даже если предел отсечения был должным образом введен в наши протоколы только с января 2018 года, когда наши предварительные данные показали четкую тенденцию к снижению частоты беременностей, даже если сокращение уже присутствовало на 1.0 нг / мл.
Мы также сравнили CPR и LBR с циклами размораживания того же периода, за исключением циклов, происходящих от PGTA (20).
Для целей настоящего исследования наша популяция была разделена на четыре группы в зависимости от возраста и количества извлеченных ооцитов:
Возраст ≤ 38, ооцит ≥8.
Возраст ≤ 38, яйцеклетка <8.
Возраст> 38, яйцеклетка ≥8.
Возраст> 38, ооцит <8.
Протокол цикла замороженных эмбрионов (FET): в естественных циклах пациенты проходили серийный трансвагинальный ультразвуковой мониторинг (TU), начиная с 8-го и 12-го дня цикла, для выявления доминантного фолликула и оценки развития эндометрия.Пациентам было рекомендовано начать мониторинг уровня ЛГ в моче при выявлении фолликула со средним диаметром> 11 мм. Тестирование на ЛГ проводилось рано утром перед ТЕ. Когда толщина эндометрия достигала 7 мм, а диаметр доминантного фолликула — 16–20 мм, пациенты считались готовыми к планированию переноса эмбриона. Пациентам с отсутствием положительного результата теста на ЛГ в моче, несмотря на наличие фолликула размером 16–20 мм и полоски эндометрия 7 мм и более, вводили 5000 ЕД ХГЧ в моче (Gonasi HP, Ibsa, Италия).Повторное нагревание и перенос эмбриона планировалось через 7 дней после спонтанного пика ЛГ или введения ХГЧ.
Гормональные заместительные циклы (AR-FET) состояли из перорального приема эстрадиола валерата (E2V, 6 мг) (Progynova; Bayer, Schweiz, AG, 2 мг) со второго дня менструального цикла до тех пор, пока толщина эндометрия не достигнет минимум 7 мм. Перенос эмбриона был запланирован через 3-5 дней после начала приема прогестерона, продолжая при той же дозе эстрадиола. Если через 12 дней E2V толщина эндометрия была менее 7 мм, дозу увеличивали до 8 мг / день.Подготовка эндометрия к переносу состояла из непрерывного приема эстрадиола (6–8 мг E2V в день) в сочетании с 600 мг вагинальных микронизированных таблеток прогестерона (Prometrium, Rottapharm SpA или Progeffik, Effik Italia SpA, 200 мг каждые 8 часов) или 180 мг микронизированных таблеток. вагинальный гель прогестерона (Crinone 8%, Merck, Serono, 90 мг два раза в день). Добавки экзогенного прогестерона также начали в день переноса эмбриона в группе NC-FET и через 2 дня после введения ХГЧ в группе mNC-FET с использованием вагинальных микронизированных таблеток прогестерона 200 мг (Prometrium, Rottapharm S.p.a., или Progeffik, Effik Italia S.p.a., 200 мг каждый день) или 90 мг микронизированного вагинального геля прогестерона (Crinone 8%, Merck, Serono, 90 мг один раз в день).
Тесты на беременность (сывороточный бета-ХГЧ) были получены через 12 после ЭТ, и в случае положительного результата уровни бета-ХГЧ контролировались каждые 48 часов, пока они не достигли уровня не менее 1000 МЕ / мл. Через 2 недели было выполнено трансвагинальное УЗИ для определения количества гестационных мешков и жизнеспособности плода.
Пациенты продолжали прием прогестерона и эстрадиола в AR-FET до 12 недели беременности.
Статистический анализ и описание переменных
Клиническая беременность была определена в соответствии с консенсусом ВОЗ-ICMART и регистром ESHRE: беременность, диагностированная с помощью ультразвуковой визуализации одного или нескольких гестационных мешков или окончательных клинических признаков беременности (21).
Статистический анализ и соображения относительно хранения данных
Все данные сначала были записаны в оцифрованные медицинские карты, которые обычно используются в Центре фертильности Humanitas; все базы данных защищены паролем.После этого наиболее важные данные были перемещены в другую базу данных для лучшего управления и упрощения обработки.
Исследователи гарантируют, что это исследование соответствовало Хельсинкской декларации (22) и национальному законодательству Италии в отношении защиты данных пациентов (23). Все пациенты подписали форму информированного согласия перед тем, как получить доступ к программе вспомогательных репродуктивных технологий (ВРТ) нашего центра; этот документ специально разрешает обработку персональных данных для ретроспективных исследований.
Настоящее исследование получило окончательное одобрение Институционального наблюдательного совета Humanitas (IRB) в январе 2020 года и было зарегистрировано в соответствии с Международным комитетом редакторов медицинских журналов в регистре ClinicalTrials.gov (ID NCT04253470).
Беременности определены согласно международному глоссарию (21) и более подробно в нашем центре; клиническая беременность определялась как положительный результат теста на бета-ХГЧ ≥1000 мМЕ / мл, в то время как живорождения включали все роды живого плода, произошедшие после 24-й недели беременности.
Все данные были выражены в виде числа и процента или среднего значения и стандартного отклонения. Влияние уровня P на CPR и LBR изучалось с помощью многомерной логистической регрессии. Возможные смешивающие переменные были выбраны на основе повседневной клинической практики и литературы, а не на основе ранее проведенного одномерного анализа и значений p . Значение p ниже 0,05 считалось значимым. Все анализы проводились с использованием Stata 15.0 (StataCorp. 2017. Статистическое программное обеспечение Stata: выпуск 15.Колледж-Стейшн, Техас: StataCorp LP).
Результаты
В течение периода исследования было выполнено 8 034 переноса эмбрионов: 7 597 переносов на стадии дробления (D3) и 437 переносов бластоцист (D5). Мы также включили 3112 циклов оттаивания, из которых 2003 (64,36%) были вызваны дополнительными циклами эмбрионов, 107 (3,44%) — увеличением P, 796 (25,58%) — OHSS и 206 (6,62%) — другими причинами (т. эндометрий, медицинские осложнения и т. д.).
Исходные характеристики и сравнение популяций на стадии дробления и бластоцисты показали статистически значимые различия в возрасте женщин (37.1 ± 4,0 против 35,7 ± 4,0, p <0,001), ИМТ (22,25 ± 3,30 против 21,61 ± 2,95, p <0,001), ФСГ (7,66 ± 3,03 против 6,76 ± 2,03, p <0,001 ), АМГ (2,18 ± 3,60 против 3,07 ± 2,70, p <0,001), диагноз снижения резерва яичников [1417 (18,65%) против 20 (4,58%), p <0,001], прогестерон в триггерный день ( 0,88 ± 0,45 против 1,09 ± 0,54, p <0,001), количество извлеченных ооцитов (8,31 ± 4,48 против 12,91 ± 4,38, p <0.001), зрелые ооциты (7,33 ± 4,21 против 11,54 ± 4,15, p <0,001), оплодотворенные ооциты (4,03 ± 2,22 против 6,68 ± 1,79, p <0,001) как по количеству перенесенных эмбрионов, замороженные эмбрионы , и замороженные ооциты (таблица 1).
Таблица 1 . Исходные характеристики.
Использование рекомбинантного ЛГ или ФСГ, ГМГ, тип протокола (агонист против антагониста), выбор циклов спасения с запуском агониста или прием пероральных противозачаточных таблеток перед лечением в качестве других переменных были рассмотрены в предварительном одномерном анализа, но результаты не были подтверждены в последующем многомерном анализе, в котором не было обнаружено различий между различными группами.
Анализ повышения прогестерона по сравнению с различными протоколами индукции не входил в число основных и вторичных результатов в первоначально утвержденном и представленном протоколе, и размер выборки не учитывался для этих переменных [Мол, Босуйт, Сункара, Гарсия Веласко, Венетис, Саккас, Лундин , Simón, Taylor, Wan, Longobardi, (24, 25)], и по этим причинам дальнейший анализ не проводился.
После поправки на возраст матери и количество извлеченных ооцитов и перенесенных эмбрионов, уровни P в сыворотке были обратно пропорциональны CPR и LBR, которые уменьшались, когда уровни P в сыворотке были> 1 нг / мл [0.72 (0,63–0,81), p <0,001 и 0,73 (0,64–0,84), p <0,001]. Для уровня прогестерона от 1 до 1,5 нг / мл OR для CPR составил 0,85 (0,76–0,96), p = 0,008 и для LBR было 0,85 (0,75–0,97), p = 0,016. Дальнейшее снижение наблюдалось при уровнях P> 1,75 нг / мл, что приводило к ОШ CPO 0,55 (0,43–0,71), p <0,001 и OR LBR 0,55 (0,42–0,73), p <0,001 (Таблица 2 ).
Таблица 2 .Влияние уровня прогестерона на частоту клинической беременности (CPR) и частоту живорождений (LBR).
Коэффициенты были проанализированы также с учетом дня переноса эмбрионов. В группе D3 уровень P в сыворотке ≥1 нг / мл значительно снизил CPR и LBR, что привело к OR 0,71 (0,62–0,80), p <0,001 и 0,73 (0,63–0,84), p <0,001, соответственно. Для уровней прогестерона от 1 до 1,5 нг / мл OR составил 0,87 (0,77–0,99), p = 0,030 для СЛР и 0.87 (0,76–1,00), p = 0,048 для LBR. При уровне P ≥ 1,75 нг / мл СЛР и LBR снизились еще больше, почти до половины своего значения с OR 0,53 (0,41–0,70), p ≤ 0,001 и 0,55 (0,40–0,74), p <0,001 .
Соотношение между уровнем P в сыворотке крови и CPR и LBR в группе D5, напротив, существенно не различается [OR 0,37 (0,49–1,09), p = 0,123 и 0,71 (0,46–1,10), p = 0,126]. Для значений прогестерона от 1 до 1.5 нг / мл, OR составил 0,60 (0,37–0,96), p = 0,034 для СЛР и 0,61 (0,36–1,02), p = 0,061 для LBR. В группе значений прогестерона от 1,5 до 1,75 нг / мл OR составил 0,95 (0,49–1,85), p = 0,877 для СЛР и 1,24 (0,63–2,47), p = 0,533 для LBR. Когда значения были ≥1,75 нг / мл, OR составлял 0,52 (0,26–1,03), p = 0,062 для СЛР и 0,45 (0,21–0,99), p = 0,047 для LBR. Эти результаты также представлены в таблице 2.
Для оценки возможных различий в СЛР в зависимости от разных пороговых значений P анализ впоследствии был проведен отдельно в разных подгруппах.
В подгруппе 2,555 переноса эмбрионов D3 с хорошим прогнозом (т.е. женщины в возрасте ≤ 38 лет и количество извлеченных ооцитов ≥8) СЛР составила 38,6%, а LBR — 32,2% для P <1 нг / мл. Эффект увеличения P до значений от 1 до 1,5 нг / мл привел к СЛР 34,7% [OR 0,84 (0,70–1,01), p = 0,061] и 28,4% LBR [OR 0,83 (0,69–1,00), p = 0,055]. Для P > 1,5 нг / мл СЛР составила 28,5% [OR 0,63 (0,47–0,85), p = 0.003] и 25,2% [OR 0,71 (0,52–0,97), p = 0,031] для LBR. В группе ≥1,75 P СЛР составила 29,4% [OR 0,66 (0,47–0,92), p = 0,015] и LBR составила 25,0% [OR 0,69 (0,49–0,99), p = 0,046] (Таблица 3).
Таблица 3 . Подгруппа переноса эмбрионов D3: влияние уровней P на частоту клинической беременности (CPR) и частоту живорождений (LBR), стратифицированное по возрасту женщины и количеству извлеченных ооцитов и скорректированное на количество перенесенных эмбрионов.
В 1964 году возраст ≤ 38, группа ооцитов <8, общая СЛР составила 26.6%, а LBR составлял 22,1% для P <1 нг / мл, а если P составлял от 1 до 1,5 нг / мл, CPR составлял 25,5% ( p = 0,541), а LBR составлял 20,3% ( p = 0,374). В группе 1,5–1,75 P СЛР составляла 24,1% ( p = 0,85), а LBR составляла 19,0% ( p = 0,469), а в группе ≥1,75 — 19,6% ( p = 0,63) и 10,9%. ( p = 0,058) соответственно.
В 1266 возрасте> 38, группе ооцитов ≥8, CPR составляла 29,9%, а LBR составляла 18,2% для P <1 нг / мл, и если P было между 1 и 1.5 нг / мл, CPR составляла 26,1% ( p = 0,147), а LBR составляла 14,9% ( p = 0,125). В группе 1,5–1,75 P СЛР составляла 20,6% ( p = 0,030), а LBR составляла 11,1% ( p = 0,054), а в группе ≥1,75 — 9,1% ( p ≤ 0,001) и 4,6%. ( p = 0,003) соответственно.
В 1812 году возраст> 38, группа ооцитов <8, CPR составляла 15,9%, а LBR составляла 9,5% для P <1 нг / мл, а если P составлял от 1 до 1,5 нг / мл, CPR составлял 14 .9% ( p = 0,305), а LBR составлял 10,4% ( p = 0,950). В группе 1,5–1,75 P СЛР составила 7,8% ( p = 0,067), а LBR — 5,9% ( p = 0,354), а в группе ≥1,75 — 10,9% ( p ≤ 0,001) и 4,4. % ( p = 0,244) соответственно (таблица 3).
В подгруппе переноса эмбрионов D5 отрицательный эффект повышения P на LBR и CPR был зарегистрирован только в том случае, если P был> 1,75 нг / мл, независимо от возраста женщины или количества извлеченных ооцитов.Это могло зависеть от того факта, что размера каждой подгруппы было недостаточно, чтобы гарантировать достаточную статистическую мощность для оценки таких различий. По этой причине результаты по этой подгруппе не были представлены ни в одной таблице.
В таблице 4 влияние уровней P на CPR и LBR, выраженное как OR с поправкой на возраст женщины, количество извлеченных ооцитов и количество перенесенных эмбрионов, показано у женщин, перенесших перенос свежих эмбрионов, как в группах D3, так и D5. , и те, кто прошел цикл замораживания-размораживания (независимо от эмбрионов D3 или D5).СЛР и LBR в циклах размораживания статистически значимо выше, чем в циклах свежего молока. Что касается группы D3, группа циклов размораживания привела к лучшему исходу беременности, как по СЛР, так и по НБР, даже по сравнению с пациентами с уровнем P <1 нг / мл. В группе D5 не было значительных различий между циклами размораживания и свежего продукта, независимо от уровней Р.
Таблица 4 . Сравнение между женщинами, перенесшими перенос свежих эмбрионов в группах на 3-й (D3) и 5-й (D5) день, и женщинами, перенесшими циклы замораживания-размораживания (независимо от эмбрионов D3 или D5): влияние уровней P на частоту клинической беременности ( CPR) и коэффициент живорождения (LBR) (OR корректируется в зависимости от возраста женщины, количества извлеченных ооцитов и количества перенесенных эмбрионов).
Обсуждение
Результаты настоящего исследования показывают, что высокие уровни фосфора, измеренные в день начала овуляции, снижают CPR, а также LBR при переносе свежих эмбрионов D3 и D5, как сообщается в литературе (14, 26, 27).
Точный механизм, объясняющий влияние, которое высокие уровни P, возникающие в день введения ХГЧ, могут оказывать на исход цикла ЭКО, все еще неясен. Качество ооцитов (27) и эндометрий играют существенную роль, но роль возвышения прогестерона в качестве ооцитов, зрелость и овуляция является спорной (28, 29), как показано в исследованиях по внутриматочной экспрессии генов (30, 31 ), а также в исследованиях, сравнивающих частоту живорождения свежих циклов с циклами донор / реципиент или циклами замороженного-размороженного эмбриона (14, 32).Ранее упомянутые исследования показывают, что повышение уровня P в день введения ХГЧ связано с пониженной вероятностью достижения беременности в свежих циклах ЭКО, но нет статистически значимой разницы между циклами с высоким уровнем P и циклами без использования замороженного-размороженного или донорского циклы. Это предполагает, что повышение уровня P до ХГЧ может влиять на рецептивность эндометрия, а не на качество эмбриона. В 1997 году Убалди и др. (33) продемонстрировали, что повышение P может изменять скорость имплантации в зависимости от времени, в которое это происходит.Если это отложить более чем на 3 дня, асинхронность между восприимчивостью эндометрия и стадией эмбриона может снизить частоту имплантации. Этот вывод можно объяснить гипотезой о том, что повышение уровня P может способствовать созреванию эндометрия.
Негативное влияние повышения уровня фосфора, которое, возможно, зависит от его воздействия на эндометрий, уже оценивалось в предыдущих исследованиях, которые не показали влияния фосфора на качество ооцитов или эмбрионов (34, 35). К такому же выводу пришли и другие исследования циклов донорства ооцитов, в которых не было доказательств отрицательного влияния уровня P донора в конце цикла стимуляции (36).
Как сообщается в недавних исследованиях и метаанализе (14, 27), отрицательный эффект P наблюдался при уровнях> 1 нг / мл, особенно при переносе эмбрионов с дроблением (D3). Следовательно, эти авторы рекомендовали поддерживать низкий уровень фосфора, чтобы избежать негативного воздействия на свежие циклы. В литературе описаны различные стратегии для этой цели, например, использование мягкой стимуляции яичников для поддержания низкого уровня эстрогена (37, 38) или индукция более ранней овуляции у пациентов с HR (39), а также у пациентов, у которых раннее повышение P в возможном предыдущем цикле.
В нашем наборе данных повышение уровня прогестерона (> 1 нг / мл) зарегистрировано более чем у одной трети нашей популяции (3092/8034 пациентов, которые прошли новые циклы в течение периода исследования). Интересно отметить, что у разных категорий пациентов наблюдалось разное влияние повышения уровня Р. В группе переноса эмбрионов D3, как правило, любой уровень P в сыворотке ≥1 нг / мл значительно снижал как CPR, так и LBR. Однако у пациентов с худшим прогнозом (число извлеченных ооцитов <8) было обнаружено, что эффект увеличения P не отличался, даже с учетом возраста женщины.Следует учитывать, что у этой категории пациентов худший исход может зависеть от множества факторов, особенно от качества ооцитов и эмбрионов, в то время как восприимчивость эндометрия может играть второстепенную роль.
Взаимосвязь между высокими уровнями P в сыворотке и низким CPR и LBR в группе переноса эмбрионов D5 существенно не различалась даже для уровня P в сыворотке, превышающего порог 1,75 нг / мл.
Выводы
Из результатов нашего исследования следует, что перенос эмбриона на стадии бластоцисты позволяет установить порог P <1.75 нг / мл, чтобы избежать негативного влияния P на СЛР и LBR, но это не позволяет полностью решить проблему.
В группе D3 для уровней P ниже 1,75 нг / мл по нашим результатам можно было бы рассмотреть возможность ожидания, если это клинически возможно, до D5 для переноса эмбриона, и если уровень P составляет ≥1,75 нг / мл, это следует учитывать. чтобы заморозить все эмбрионы и отложить перенос эмбрионов до нормализации уровня P, проанализировав результаты витрификации и нагревания в центре, чтобы подтвердить этот выбор.
CPR и LBR в циклах размораживания, по нашему опыту, статистически значимо выше, чем в циклах свежего молока.Что касается группы D3, группа с циклами размораживания показала лучший исход беременности, как по СЛР, так и по LBR, даже по сравнению с пациентами с уровнем P <1 нг / мл. В группе D5 не было значительных различий между циклами размораживания и свежего продукта, независимо от уровней Р. С другой стороны, следует учитывать возможное смещение, заключающееся в том, что измерения уровня P у женщин не проводились в день триггера овуляции с помощью введения ЛГ, ХГЧ или прогестерона до оттаивания эмбриона, что может быть исследовано в будущих исследованиях, поскольку считается, что прогестерон физиологический триггер овуляции (28).
Согласно нашему анализу, криоконсервация эмбрионов является оптимальной стратегией для минимизации побочных эффектов повышения P, особенно если они витрифицированы на стадии бластоцисты, и недавно была подчеркнута важность эффективной программы замораживания для кумулятивной скорости доставки (40). Все центры нуждаются в строгом анализе своих ключевых показателей эффективности, таких как частота бластоцист, выживаемость при потеплении, а также свежая и послеродовая имплантация, а также частота развивающейся беременности при принятии решения о стратегии полного замораживания при пограничном повышении прогестерона (41, 42).Однако важно учитывать, что эта процедура не может быть проведена у всех пациентов, потому что их перенос эмбрионов не всегда может быть разрешен, поскольку эмбрионы могут не достичь стадии бластоцисты для витрификации или могут не выжить во время процедуры оттаивания. Даже в лучших условиях выживаемость не составляет 100%, и также возможно, что длительное культивирование эмбрионов может быть стрессом для эмбрионов у одной небольшой группы пациентов, чем у других.
Не было обнаружено различий, связанных с типом протокола индукции, и были обнаружены незначительные, но значимые различия в подгруппах пациентов с хорошим прогнозом по сравнению схудший прогноз. Однако размер нашей выборки был недостаточным для анализа других подгрупп пациентов, и другие данные необходимы для дальнейшего подтверждения доказательств в этой области.
В заключение, эффект повышения прогестерона очевиден в наших результатах, начиная со значений> 1 нг / мл, и значительно оказывает прогрессивное влияние на CPR и LBR при переносе стадии расщепления, но эти эффекты становятся очевидными при переносе стадии бластоцисты только для значений> 1,75 нг / мл.
Заявление о доступности данныхНеобработанные данные, подтверждающие выводы этой статьи, будут предоставлены авторами без излишних оговорок.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены Советом по этике Humanitas. Пациенты / участники предоставили письменное информированное согласие на участие в этом исследовании.
Авторские взносы
PL-S и RD написали исследовательский проект. EM проанализировал данные. FC, VC, CR, PP, AB и MS внесли свой вклад в извлечение данных, ссылки и последующий анализ. FC и CR внесли свой вклад в подготовку рукописи. PL-S подготовила окончательный вариант.Все авторы внесли свой вклад в статью и одобрили представленную версию.
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят весь медперсонал, эмбриологов и гинекологов, работающих в Центре фертильности Humanitas, Роццано, Милан, Италия.
Список литературы
1.Venetis CA, Kolibianakis EM, Bosdou JK, Lainas GT, Sfontouris IA, Tarlatzis BC, et al. Базальный уровень прогестерона в сыворотке и повышение прогестерона в анамнезе в день введения ХГЧ являются важными предикторами позднего повышения фолликулярного прогестерона в циклах ЭКО антагонистов ГнРГ. Репродукция Человека . (2016) 31: 1859–65. DOI: 10.1093 / humrep / dew141
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Венетис К.А., Колибианакис Э.М., Папаниколау Э., Бонтис Дж., Деврой П., Тарлатзис BC.Связано ли повышение прогестерона в день введения хорионического гонадотропина человека с вероятностью беременности при оплодотворении in vitro ? Систематический обзор и метаанализ. Обновление Hum Reprod . (2007) 13: 343–55. DOI: 10.1093 / humupd / dmm007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Bosch E, Valencia I, Escudero E, Crespo J, Simón C, Remohí J и др. Преждевременная лютеинизация во время циклов антагонистов гонадотропин-рилизинг-гормона и ее связь с исходом оплодотворения in vitro и . Фертил Стерил . (2003) 80: 1444–9. DOI: 10.1016 / j.fertnstert.2003.07.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Fanchin R, de Ziegler D, Taieb J, Hazout A, Frydman R. Преждевременное повышение уровня прогестерона в плазме изменяет частоту наступления беременности оплодотворения in vitro и переноса эмбриона. Fertil Steril. (1993) 59: 1090–4. DOI: 10.1016 / S0015-0282 (16) 55933-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Fanchin R, Righini C, Olivennes F, Ferreira AL, de Ziegler D, Frydman R. Последствия преждевременного повышения уровня прогестерона на исходе оплодотворения in vitro : понимание противоречий. Фертил Стерил . (1997) 68: 799–805. DOI: 10.1016 / S0015-0282 (97) 00337-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Колибианакис Е.М., Венетис Калифорния, Бонтис Дж., Тарлатзис, Британская Колумбия. Значительно более низкие показатели наступления беременности при повышении уровня прогестерона у пациентов, получавших антагонисты ГнРГ и гонадотропины: систематический обзор и метаанализ. Карр Фарм Биотехнология . (2012) 13: 464–70. DOI: 10.2174 / 138
2799361927
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Долди Н., Марсилио Э., Дестефани А., Гесси А., Мерати Г., Феррари А. Повышенный уровень прогестерона в сыворотке в день введения ХГЧ при ЭКО связан с более высокой частотой наступления беременности при синдроме поликистозных яичников. Репродукция Человека . (1999) 14: 601–5. DOI: 10.1093 / humrep / 14.3.601
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.Эдельштейн М.С., Селтман Х.Дж., Кокс Б.Дж., Робинсон С.М., Шоу Р.А., Муашер С.Дж. Уровни прогестерона в день введения хорионического гонадотропина человека в циклах с подавлением агонистов гонадотропин-рилизинг-гормона не позволяют прогнозировать исход беременности. Фертил Стерил . (1990) 54: 853–7. DOI: 10.1016 / S0015-0282 (16) 53945-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Харада Т., Йошида С., Катагири К., Такао Н., Икенари Т., Тода Т. и др. Снижение скорости имплантации, связанное с незначительным повышением концентрации прогестерона в сыворотке во время фолликулярной фазы циклов, стимулированных комбинацией агониста гонадотропин-рилизинг-гормона и гонадотропина. Hum Reprod. (1995) 10: 1060–4. DOI: 10.1093 / oxfordjournals.humrep.a136094
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Мартинес Ф., Королеу Б., Клуа Е., Тур Р., Буксадерас Р., Парера Н. и др. Концентрация прогестерона в сыворотке крови в день введения ХГЧ не может предсказать беременность в циклах вспомогательной репродукции. Репродукция Биомед Интернет . (2004) 8: 183–90. DOI: 10.1016 / S1472-6483 (10) 60514-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Лоуренс Б., Фатеми Х.М. Влияние повышения прогестерона в фолликулярной фазе циклов ЭКО на восприимчивость эндометрия. Репродукция Биомед Интернет . (2017) 34: 422–8. DOI: 10.1016 / j.rbmo.2017.01.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Вернер, доктор медицины, Форман Э.Дж., Хонг К.Х., Франасиак Д.М., Молинаро Т.А., Скотт Р.Т. Определение «зоны наилучшего восприятия» для введенных соотношений гонадотропина лютеинизирующего гормона и фолликулостимулирующего гормона во время стимуляции яичников для защиты от клинически значимого позднего фолликулярного увеличения прогестерона: анализ 10 280 первых циклов оплодотворения in vitro . Фертил Стерил . (2014) 102: 1312–7. DOI: 10.1016 / j.fertnstert.2014.07.766
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Андерсен А.Н., Деврой П., Арсе Дж. Клинический исход после стимуляции высокоочищенным чМГ или рекомбинантным ФСГ у пациентов, подвергающихся ЭКО: рандомизированное слепое контролируемое испытание оценщиком. Hum Reprod. (2006) 21: 3217–27. DOI: 10.1093 / humrep / del284
CrossRef Полный текст | Google Scholar
14.Venetis CA, Kolibianakis EM, Bosdou JK, Tarlatzis BC. Повышение уровня прогестерона и вероятность беременности после ЭКО: систематический обзор и метаанализ более 60 000 циклов. Обновление Hum Reprod . (2013) 19: 433–57. DOI: 10.1093 / humupd / dmt014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Мол Б.В., Боссайт П.М., Сункара С.К., Гарсия Веласко Дж. А., Венетис С., Саккас Д. и др. Персонализированная стимуляция яичников для вспомогательных репродуктивных технологий: рекомендации по дизайну исследования, чтобы перейти от ажиотажа к добавленной стоимости для пациентов. Фертил Стерил . (2018) 109: 968–79. DOI: 10.1016 / j.fertnstert.2018.04.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Эстевес С. К., Алвигги С., Хумайдан П., Фишер Р., Андерсен С. Ю., Конфорти А. и др. Критерии POSEIDON и их мера успеха глазами клиницистов и эмбриологов. Фронт эндокринол . (2019) 10: 814. DOI: 10.3389 / fendo.2019.00814
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17.Humaidan P, La Marca A, Alviggi C, Esteves SC, Haahr T. Будущие перспективы стратификации POSEIDON для клинической практики и исследований. Фронт эндокринол . (2019) 10: 439. DOI: 10.3389 / fendo.2019.00439
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Levi-Setti PE, Zerbetto I., Baggiani A, Zannoni E, Sacchi L, Smeraldi A, et al. Наблюдательное ретроспективное когортное исследование 4828 циклов ЭКО с оценкой различных пациентов с низким прогнозом в соответствии с критериями POSEIDON. Front Endocrinol. (2019) 10: 282. DOI: 10.3389 / fendo.2019.00282
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Махешвари А., Бхаттачарья С., Боулер Ю., Брисон Д., Чайлд Т., Коул С. и др. Протокол исследования: E-freeze — замораживание эмбрионов при вспомогательном зачатии: рандомизированное контролируемое исследование, оценивающее клиническую и экономическую эффективность политики замораживания эмбрионов с последующим переносом размороженных замороженных эмбрионов по сравнению с политикой переноса свежих эмбрионов у женщин, перенесших в vitro оплодотворение. Здоровье . (2019) 16:81. DOI: 10.1186 / s12978-019-0737-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Сакки Л., Албани Э., Чезана А., Смеральди А., Парини В., Фабиани М. и др. Преимплантационное генетическое тестирование на анеуплоидию улучшает клинические, гестационные и неонатальные исходы у пациенток пожилого материнского возраста без снижения совокупного коэффициента живорожденности. Джей Ассист Репрод Генет . (2019) 36: 2493–504. DOI: 10.1007 / s10815-019-01609-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21.Зегерс-Хохшильд Ф., Адамсон Г.Д., Дайер С., Раковски С., де Музон Дж., Сокол Р. и др. Международный глоссарий по лечению бесплодия и бесплодия, 2017 г. Fertil Steril . (2017) 108: 393–406. DOI: 10.1016 / j.fertnstert.2017.06.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Герхард Н. Хельсинкская декларация. В: Словарь по фармацевтической медицине. Вена: Springer (2009). п. 48. DOI: 10.1007 / 978-3-211-89836-9_367
CrossRef Полный текст | Google Scholar
25.Wang R, Chen ZJ, Vuong LN, Legro RS, Mol BW, Wilkinson J. Крупные рандомизированные контролируемые испытания по бесплодию. Фертил Стерил . (2020) 113: 1093–9. DOI: 10.1016 / j.fertnstert.2020.04.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Бош Э., Лабарта Э, Креспо Дж., Симон К., Ремохи Дж., Дженкинс Дж. И др. Уровни циркулирующего прогестерона и частота продолжающихся беременностей в контролируемых циклах стимуляции яичников для оплодотворения in vitro : анализ более 4000 циклов. Репродукция Человека . (2010) 25: 2092–100. DOI: 10.1093 / humrep / deq125
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Хуанг И, Ван ЭЙ, Ду Цюй, Сюн ЙДж, Гуо Сю, Юй Ип и др. Повышение уровня прогестерона в день введения хорионического гонадотропина человека отрицательно влияет на исход ЭКО с перенесенными эмбрионами на разных стадиях развития. Репрод Биол Эндокринол . (2015) 13:82. DOI: 10.1186 / s12958-015-0075-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Дозорцев Д, Пеллисер А, Даймонд М.П. Прогестерон является физиологическим триггером овуляторных гонадотропинов. Fertil Steril. (2020) 113: 923–4. DOI: 10.1016 / j.fertnstert.2019.12.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Дозорцев Д.И., Пеллисер А, Бриллиант М.П. Срок созревания ооцитов и срочная стимуляция яичников: влияние на компетентность ооцитов. Fertil Steril. (2020) 114: 221–2. DOI: 10.1016 / j.fertnstert.2020.04.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30.Лабарта Э., Мартинес-Конехеро Х.А., Алама П., Хоркахадас Х.А., Пеллисер А., Симон С. и др. Восприимчивость эндометрия нарушается у женщин с высоким уровнем циркулирующего прогестерона в конце фолликулярной фазы: анализ функциональной геномики. Репродукция Человека . (2011) 26: 1813–25. DOI: 10.1093 / humrep / der126
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Ван Вэренберг И., Ван Ломмель Л., Гислен В., Ин’т Велд П., Скуит Ф., Фатеми Х.М. и др. В циклах, стимулированных антагонистом GnRH / rec-FSH, ускоренное созревание эндометрия в день извлечения ооцитов коррелирует с измененной экспрессией гена. Hum Reprod. (2009) 24: 1085–91. DOI: 10.1093 / humrep / den501
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Лахуд Р., Квик М., Райан Дж., Аль-Джефут М., Фоли Дж., Иллингворт П. Повышенный уровень прогестерона в агонистах гонадолиберина, подавленный в циклах оплодотворения in vitro (IVFICSI), снижает частоту живорождений, но не качество эмбрионов. Арочный гинекол акушерский . (2012) 285: 535–40. DOI: 10.1007 / s00404-011-2045-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33.Ubaldi F, Bourgain C, Tournaye H, Smitz J, Van Steirteghem A, Devroey P. Оценка эндометрия с помощью аспирационной биопсии в день извлечения ооцитов в циклах переноса эмбрионов у пациентов с повышением уровня прогестерона в сыворотке во время фолликулярной фазы. Фертил Стерил . (1997) 67: 521–6. DOI: 10.1016 / S0015-0282 (97) 80080-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Hofmann GE, Bentzien F, Bergh PA, Garrisi GJ, Williams MC, Guzman I, et al. Преждевременная лютеинизация при контролируемой гиперстимуляции яичников не оказывает отрицательного воздействия на качество ооцитов и эмбрионов. Фертил Стерил . (1993) 60: 675–9. DOI: 10.1016 / S0015-0282 (16) 56221-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Fanchin R, Hourvitz A, Olivennes F, Taieb J, Hazout A, Frydman R. Преждевременное повышение уровня прогестерона сохраняет бластуляцию, но не снижает частоту наступления беременности при оплодотворении in vitro и сокультивированием. Фертил Стерил . (1997) 68: 648–52. DOI: 10.1016 / S0015-0282 (97) 80464-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36.Мело М.А., Месегер М., Гарридо Н., Бош Э., Пеллисер А., Ремохи Дж. Значение преждевременной лютеинизации в программе донорства ооцитов. Репродукция Человека . (2006) 21: 1503–7. DOI: 10.1093 / humrep / dei474
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Kolibianakis EM, Albano C, Camus M, Tournaye H, Van Steirteghem AC, Devroey P. Продление фолликулярной фазы при оплодотворении in vitro приводит к снижению продолжающейся беременности в циклах, стимулированных рекомбинантным фолликулостимулирующим гормоном и антагонисты гонадотропин-рилизинг-гормона. Фертил Стерил . (2004) 82: 102–7. DOI: 10.1016 / j.fertnstert.2004.01.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Лоуренс Б., Белиготти Ф., Энгельманн Н., Гейтс Д., Фатеми Х.М. Влияние типа гонадотропина на повышение уровня прогестерона во время стимуляции яичников в циклах антагонистов ГнРГ. Репродукция Человека . (2016) 31: 2554–60. DOI: 10.1093 / humrep / dew213
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Аль-Аземи М., Киру Д., Колибианакис Е.М., Хумайдан П., Ван Вэренберг И., Деврой П. и др.Повышенный прогестерон во время стимуляции яичников при ЭКО. Репродукция Биомед Интернет . (2012) 24: 381–8. DOI: 10.1016 / j.rbmo.2012.01.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Скаравелли Г., Леви-Сетти П.Е., Ливи К., Ла Сала Дж., Убальди Ф.М., Греко Е. и др. Вклад криоконсервации в совокупный коэффициент живорождения: большой многоцентровый анализ данных на основе цикла из Национального реестра Италии. Джей Ассист Репрод Генет . (2019) 36: 2287–95.DOI: 10.1007 / s10815-019-01566-y
CrossRef Полный текст | Google Scholar
41. Фабоцци Дж., Чимадомо Д., Маггиулли Р., Вайарелли А., Убальди Ф. М., Риенци Л. Какие ключевые показатели эффективности наиболее эффективны при оценке и управлении лабораторией оплодотворения in vitro ? Fertil Steril. (2020) 114: 9–15. DOI: 10.1016 / j.fertnstert.2020.04.054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Прогестерон может предотвратить 8450 выкидышей в год, согласно новому исследованию
Введение прогестерона женщинам с кровотечением на ранних сроках беременности и выкидышем в анамнезе может привести к рождению еще 8 450 детей ежегодно, говорится в новом исследовании, опубликованном сегодня.
Два новых исследования доказывают как научные, так и экономические преимущества назначения женщинам курса самостоятельного приема дважды в день прогестероновых пессариев с момента первого обращения с кровотечением на ранних сроках до 16 недель беременности для предотвращения выкидыша.
Прогестерон — это гормон, который естественным образом выделяется яичниками и плацентой на ранних сроках беременности и имеет жизненно важное значение для достижения и поддержания здоровой беременности.
Исследователи призывают предложить прогестерон в качестве стандарта в NHS для женщин с кровотечением на ранних сроках беременности и выкидышем в анамнезе после того, как их растущее количество исследований показало, что это экономически эффективно и может увеличить шансы женщин на зачатие.
В первом из новых исследований, опубликованных в Американском журнале акушерства и гинекологии, исследуются результаты двух крупных клинических испытаний — PROMISE и PRISM — под руководством Бирмингемского университета и Национального центра исследований выкидышей Томми.
PROMISE изучило 836 женщин с невынашиваемыми выкидышами по необъяснимым причинам в 45 больницах Великобритании и Нидерландов и обнаружило, что при приеме прогестерона частота живорождений выше на 3%.
PRISM изучила 4153 женщин с кровотечением на ранних сроках в 48 больницах Великобритании и обнаружила, что число детей, родившихся у тех, кому давали прогестерон, у которых ранее был один или несколько выкидышей, увеличилось на 5% по сравнению с теми, кто получал плацебо. .
Преимущество было даже больше для женщин, у которых в прошлом были «повторяющиеся выкидыши» (т. Е. Три или более выкидыша) — с 15% -ным увеличением коэффициента живорождений в группе прогестерона по сравнению с группой плацебо.
Второе из новых исследований, опубликованное в BJOG: международном журнале акушерства и гинекологии, оценивает экономические аспекты исследования PRISM и приходит к выводу, что прогестерон является экономически эффективным и стоит в среднем 204 фунта стерлингов на беременность.
Доктор Пэт О’Брайен, консультант-акушер и вице-президент Королевского колледжа акушеров и гинекологов, сказал: « Выкидыш может стать тяжелой утратой для женщин, их партнеров и семей.Поэтому мы приветствуем результаты этих хорошо изученных испытаний, которые подтверждают использование прогестерона среди женщин с кровотечением на ранних сроках беременности и выкидышами в анамнезе.
«Это лечение увеличивает шансы на успешные роды и, по-видимому, является экономически эффективным для NHS, поэтому мы надеемся, что NICE учтет это важное исследование в своем следующем обновлении руководства.
«Для женщин, не имевших в анамнезе выкидышей, лечение не приносит большой пользы, и женщинам, которые беспокоятся о своей беременности, следует обращаться к своей акушерке или в отделение ранней беременности для получения ухода и поддержки.Обнадеживает то, что у большинства женщин, перенесших выкидыш, в будущем беременность и роды будут успешными ».
Доктор Адам Девалл, старший научный сотрудник по клиническим испытаниям в Университете Бирмингема и менеджер Национального центра исследований выкидышей Томми, сказал: « От 20 до 25% беременностей заканчиваются выкидышем, который имеет серьезные клинические и психологические последствия. влияние на женщин и их семьи.
«Роль добавок прогестерона в первом триместре беременности в лечении беременных с высоким риском выкидыша — это давний исследовательский вопрос, который обсуждается в медицинской литературе более 60 лет.
«До сих пор лица, определяющие политику, не могли дать основанные на фактах рекомендации по использованию добавок прогестерона для улучшения результатов.
«Испытания PRISM и PROMISE обнаружили небольшой, но положительный эффект лечения, зависящий от количества предыдущих выкидышей.
«Мы считаем, что двойные факторы риска кровотечения на ранних сроках беременности и один или несколько предыдущих выкидышей в анамнезе определяют женщин с высоким риском, у которых прогестерон полезен. Вопрос в том, как это должно повлиять на клиническую практику? »
Трейси Робертс, профессор экономики Университета Бирмингема, сказала: : « Выкидыш — это серьезное экономическое бремя, которое обходится NHS Великобритании примерно в 350 миллионов фунтов стерлингов в год на лечение выкидышей и осложнений.
«Учитывая страдания женщин и их семей, связанные с выкидышем, и последующие ресурсы, которые могут быть связаны с консультированием и внимательным дородовым наблюдением при последующих беременностях женщин, перенесших выкидыш, прогестерон, вероятно, будет считаться хорошим соотношением цены и качества для предотвращения выкидыша. . »
Конец
По вопросам СМИ обращайтесь в пресс-службу RCOG по телефону +44 (0) 20 7045 6773 или по электронной почте [email protected]
Для всех, кто пострадал, Ассоциация выкидышей предлагает полезную информацию и поддержку на своем веб-сайте.

 8-159
8-159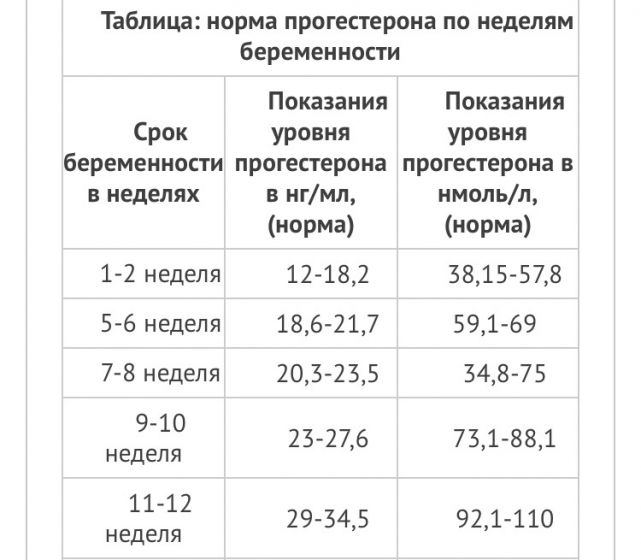 Значение прогестерона больше 25 nmol/L на 7 день после предполагаемой овуляции – признак овуляторного цикла. Для более точной оценки функции желтого тела рекомендуется назначать анализ за 4 -10 дней до начала нового менструального цикла три раза с трехдневными интервалами.
Значение прогестерона больше 25 nmol/L на 7 день после предполагаемой овуляции – признак овуляторного цикла. Для более точной оценки функции желтого тела рекомендуется назначать анализ за 4 -10 дней до начала нового менструального цикла три раза с трехдневными интервалами. 0001
0001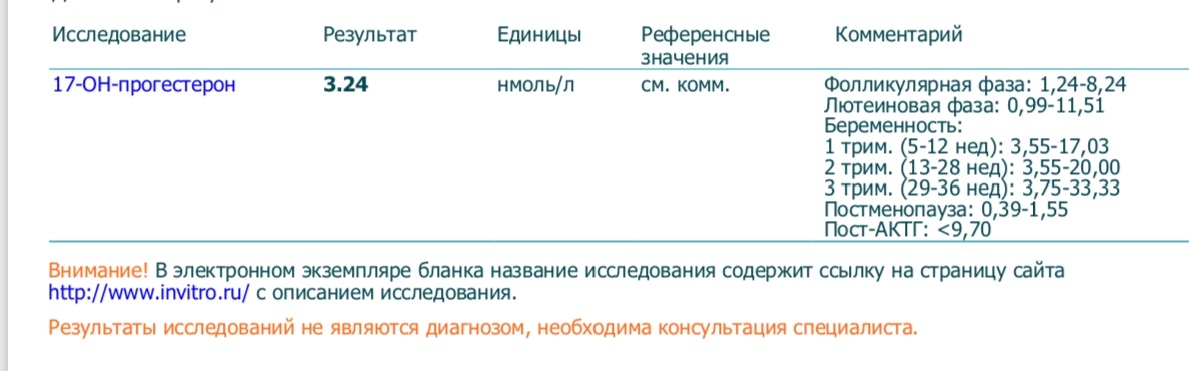 Г., Нибил Дж. Р., Галан Х. Л. (2012) Акушерство: нормальные и проблемные беременности: нормальные и проблемные беременности. Сент-Луис, США: Saunders 17: 592-593.
Г., Нибил Дж. Р., Галан Х. Л. (2012) Акушерство: нормальные и проблемные беременности: нормальные и проблемные беременности. Сент-Луис, США: Saunders 17: 592-593.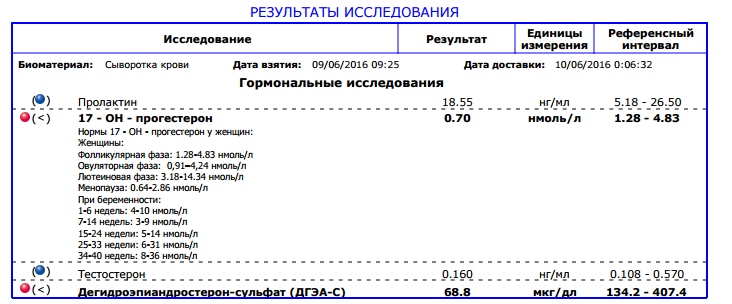 Am J Reprod Immunol 27: 128-129. [Crossref]
Am J Reprod Immunol 27: 128-129. [Crossref] Акушерский гинеколь 101: 959-967.[Crossref]
Акушерский гинеколь 101: 959-967.[Crossref]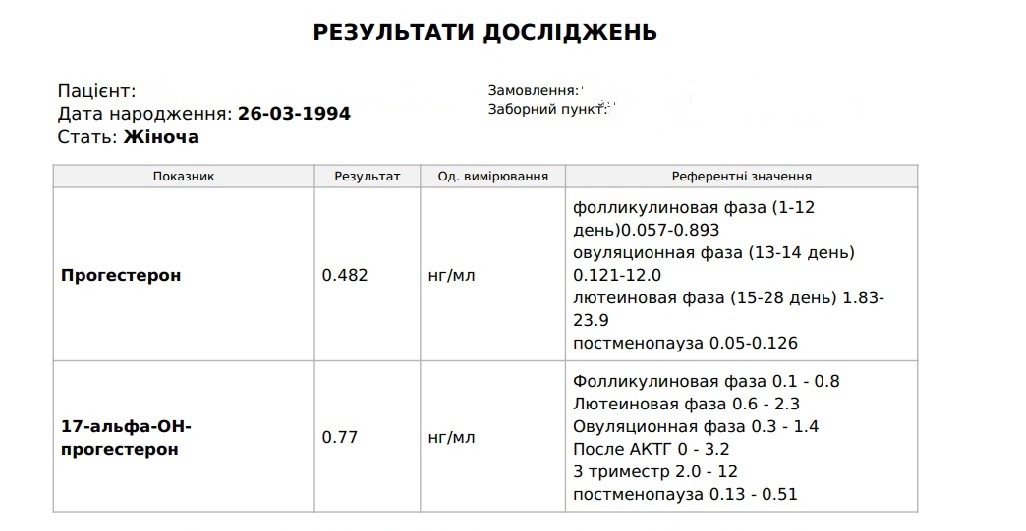 , Остерман М., Дрисколл А., Мэтьюз Т. (2017) Рождение: окончательные данные за 2015 год. Natl Vital Stat Rep .
, Остерман М., Дрисколл А., Мэтьюз Т. (2017) Рождение: окончательные данные за 2015 год. Natl Vital Stat Rep . 3
3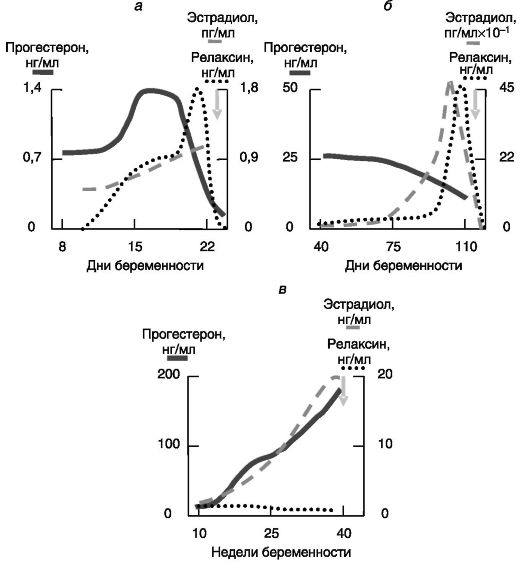 , 1991 [9]
, 1991 [9]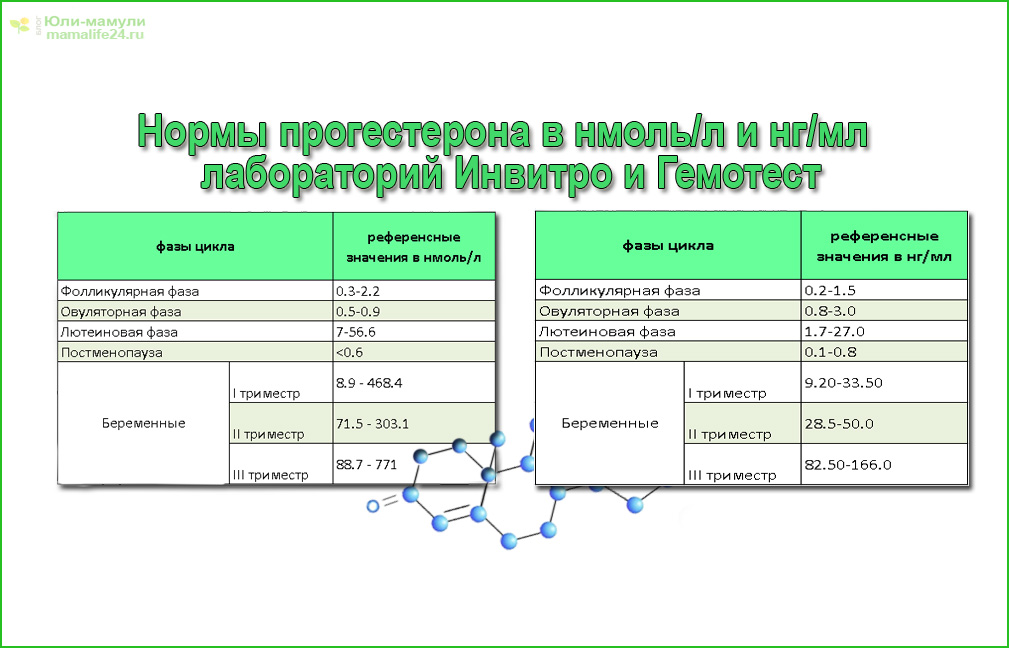 , 1998 [16]
, 1998 [16]