Цитология и гистология. В чем разница?
Цитология
Цитология (греч. κύτος «клетка» и λόγος — «учение», «наука») — раздел биологии, изучающий живые клетки, их органеллы,строение и функционирование, процессы клеточного размножения, старения и смерти.
Цитологические исследования в лаборатории проводят каждый день. Самыми простым примером может служить общий клинический анализ крови. Врач-лаборант ежедневно проводит исследования большого количества мазков крови, подсчитывает популяцию клеток, дифференцирует их и указывает на нарушение строения, в случае если таковые имеются.
То есть цитологическое исследование подразумевает под собой исследование клеток под микроскопом на предмет их строения и изменений.
Когда же еще можно использовать данный метод?
Чаще всего цитологией пользуются дерматологи и онкологи.
Дерматологам данное исследование позволяет оценить тип и интенсивность воспаления, обсеменение микрофлорой или грибами. Чаще всего цитологическое исследование врач проводит прямо на приеме, чтобы назначить корректное лечение вашему питомцу.
А вот в случае подозрения на новообразование у питомца сложнее. Врач на приеме может взять тонкоигольную биопсию. А врач-лаборант окрасит полученный материал специальными красителями для качественного исследования. Цитолог в свою очередь будет тщательно оценивать изменения в клетках, определять наличие или отсутствие воспаления, микрофлоры, грибов.
Так же цитологически исследуют выпоты в брюшную или грудную полости, синовиальную жидкость, ликвор и многое другое.
Преимущества цитологии:
- Быстрый результат (от 1 часа до 3 дней)
- Несложный забор материала у животного
- Постановка предварительного диагноза
- Помощь врачу качественно назначить необходимое лечение
Цитология
Гистология
Гистология (от греч. ἱστός «ткань» + λόγος «знание, слово, наука») — раздел биологии, изучающий строение, жизнедеятельность и развитие тканей живых организмов
ἱστός «ткань» + λόγος «знание, слово, наука») — раздел биологии, изучающий строение, жизнедеятельность и развитие тканей живых организмов
Гистология изучает ткани, которые в свою очередь состоят из клеток. То есть изменения рассматривают в более крупном объеме.
Для проведения гистологического исследования необходимо получить образец ткани (кусочек кожи, кусочек кости и т.п.). Материал специально готовится перед тем, как гистолог будет его исследовать. Этот процесс может занимать от 3 до 10 дней. Далее врач будет оценивать строение и изменения в ткани.
Зачем же гистология:
- Подтвердить или опровергнуть цитологический диагноз
- Дать предварительный диагноз для дальнейшего исследования (например, иммуногистохимии)
- Помощь врачу в выборе тактики и лечения питомца с онкологическими заболеваниями.
Гистология. Фото врача-гистолога Лисицкой К.В.
Таким образом, для корректного лечения вашего питомца важны как цитология, так и гистология.
Здоровья вам и вашим питомцам!
Отделение хирургии МВЦ «ПиК»
Гистология и биопсия это одно и тоже?
Когда пациент сталкивается серьезным заболеванием, он часто слышит от специалиста такие слова как гистология и биопсия – насколько эти термины аналогичны и однозначны и есть ли перед ними отличия?
В частности стоит сразу сказать – это разные термины:
1. Так биопсия представляет собой способ забора биологического материала, который далее передается на исследование.
2. В то время как гистология – способ исследования, наравне с цитологией. Именно гистология и цитология – это дополнительные методы диагностики, которые назначает врач при невозможности получить точный и развернутый ответ в подтверждение или опровержение предварительного диагноза.
Биопсия назначается к проведению при подозрении на онкологию и помогает определить наличие в организме пациента злокачественного ракового очага, отличить его от предракового состояния.
Говоря конкретно о гистологии – это лабораторный метод исследования, позволяющий дать точный и информативный ответ на наличие/отсутствие патологических в организме клеток, злокачественной природы новообразований. Гистологию врач назначает при проведении обследования самых разных органов и с учетом этого выделяют самые разные методики забора биоматериала:
- Мазок – отпечаток.
- Соскоб и тканевой срез.
- Пункция при помощи иглы.
- Посредством проведения аспирации.
После, полученный биологический материал сразу отправляют на микроскопическое исследование для выявления как патологических процессов, так и патологических в образце клеток. С целью проведения гистологического вида исследования – применяют такие оптического типа приборы:
- Классический для исследований световой аппарат.
- Растровый аппарат и люминесцентные спектральные лабораторные аппараты.
- Микроскоп Фрица Цернике.
Помимо этого могут применять и экспресс – методику диагностирования и исследования биологического материала и к нему прибегают в процессе проведения оперативного вмешательства, когда были выявлены подозрительного типа новообразования.
Как видим – гистология и проводимая биопсия не есть синонимами и аналогичными терминами, разница меж ними достаточно существенна и очевидна. Для проведения гистологии и данного вида лабораторного исследования – необходимо провести биопсию. Сама по себе биопсия, без последующего проведения гистологии или же цитологического исследования не несет в себе никакой сути и ценности.
21.11.2017
Цитологический метод в диагностике опухолей и опухолеподобных процессов
Цитопатология, клиническая или диагностическая цитология, изучает клеточный состав патологических процессов. В качестве отдельной медицинской специальности официально признана в 1941 г. после работ Папаниколау Г. и Траута Н. К чести нашей страны разработка цитологического метода диагностики начата в 1938 г. в клинико-диагностической лаборатории Московского научно-исследовательского онкологического института им. П.А. Герцена. В 1941 г. профессор Н.Н. Шиллер-Волкова на сессии института доложила о первых результатах по исследованию выделений из влагалища, мокроты и пунктатов. В развитии цитологии можно выделить три основных этапа: эксфолиативная, в основном гинекологическая цитопатология; аспирационная цитология, бурный расцвет которой начинается с 80-х годов и связан с внедрением ультразвуковой диагностики, и современный этап развития определяется применением иммуноцитохимических и молекулярных методов исследования, а также автоматизированного скрининга в гинекологической цитологии.
и Траута Н. К чести нашей страны разработка цитологического метода диагностики начата в 1938 г. в клинико-диагностической лаборатории Московского научно-исследовательского онкологического института им. П.А. Герцена. В 1941 г. профессор Н.Н. Шиллер-Волкова на сессии института доложила о первых результатах по исследованию выделений из влагалища, мокроты и пунктатов. В развитии цитологии можно выделить три основных этапа: эксфолиативная, в основном гинекологическая цитопатология; аспирационная цитология, бурный расцвет которой начинается с 80-х годов и связан с внедрением ультразвуковой диагностики, и современный этап развития определяется применением иммуноцитохимических и молекулярных методов исследования, а также автоматизированного скрининга в гинекологической цитологии.
Цитологический метод технически прост, быстр, сравнительно дешев, малотравматичен. Однако «легкость» цитологического метода обманчива, так как цитологическое исследование должно заканчиваться формулировкой заключения, основываясь на котором разрабатывается тактика лечения.
Абразивная цитология получает материал из определенного участка внутренних органов, в том числе исследуются субэпителиальные поражения с помощью фиброоптических инструментов. При таком взятии материала клетки хорошо сохраняются, и препараты легко интерпретировать. Материал получают из шейки матки, вагины, эндометрия, респираторного, желудочно-кишечного, мочеполового тракта.
При таком взятии материала клетки хорошо сохраняются, и препараты легко интерпретировать. Материал получают из шейки матки, вагины, эндометрия, респираторного, желудочно-кишечного, мочеполового тракта.
Тонкоигольная биопсия в настоящее время позволяет получить материал практически из любого органа. Метод постоянно совершенствуется и дает оптимальные результаты, что делает его в плане диагностики высокоэффективным и экономичным.
Взятый для цитологического исследования материал помещают на край предметного стекла и другим предметным или покровным стеклом равномерно, сильно не надавливая, тонким слоем распределяют по всей поверхности препарата.
В последние годы помимо рутинных цитологических мазков для получения качественных монослойных цитологических препаратов используется жидкостная система: пунктаты вносятся в специальную среду накопления, после чего центрифугируются в режиме 1000 оборотов в течение 5 минут при среднем ускорении на центрифуге (Суtospin-3, Суtospin-4). Применение методики жидкостной цитологии имеет ряд преимуществ: обеспечивает сохранность клеточных структур, уменьшает фон, клетки сосредотачиваются в одном месте – «окошке», что сокращает время просмотра препарата и значительно экономит дорогие сыворотки при проведении иммуноцитохимического исследова-
Влажная фиксация препарата в спирте сразу после взятия мазков применяется при окраске по Папаниколау. В остальных случаях мазки высушивают на воздухе, а затем фиксируют уже в лаборатории. Наиболее распространенный способ фиксации – в равных объемах спирта и эфира (смесь Никифорова). Для иммуноцитохимического исследования применяют фиксацию ацетоном. При окраске мазков используют панхромную окраску азур-эозином по методу Романовского – Гимза в различных модификациях (Лейшмана, Паппенгейма), а также окраска гематоксилином и эозином, особенно при исследовании гинекологического материала используется окраска по Папаниколау. Возможно при рутинном исследовании или специальной окраске выявление бактериальной флоры, в том числе бацилл Коха, лепры, хеликобактера, трихомонад и т.д.
Возможно при рутинном исследовании или специальной окраске выявление бактериальной флоры, в том числе бацилл Коха, лепры, хеликобактера, трихомонад и т.д.
Цитологическая диагностика основана на следующих принципах:
- Разница клеточного состава в норме и патологии.
- Оценка не одной отдельно взятой клетки, а совокупности клеток, большое значение придается фону препарата.
- Цитолог должен иметь патологоанатомический базис.
- Каждое исследование завершается формулировкой заключения.
Критерии цитологической диагностики злокачественных новообразований составляются из оценки клетки, ядра и ядрышка.
Клетка:
– увеличена в размере, иногда гигантская, редко размер близок к норме, что затрудняет цитологическую диагностику, например, при коллоидном, тубулярном раке, маститоподобном варианте долькового рака молочной железы, фолликулярном раке щитовидной железы, карциноиде, почечноклеточном светлоклеточном раке, высокодифференцированных веретеноклеточных саркомах;
– изменение формы и полиморфизм клеточных элементов;
– нарушение соотношения ядра и цитоплазмы в сторону увеличения доли ядра;
– диссоциация степени зрелости ядра и цитоплазмы, например, молодое ядро в ороговевшей цитоплазме при высокодифференцированном плоскоклеточном раке.
Ядро:
– увеличение размера, полиморфизм, бугристость, неравномерный рисунок хроматина, наиболее постоянный признак – неровность контуров, гиперхромия, фигуры клеточного деления в цитологических препаратах сравнительно редки.
Ядрышко:
– число ядрышек больше, чем в нормальной клетке, ядрышки увеличены в размере, неправильной формы.
Несмотря на присутствие критериев злокачественности у подавляющего большинства клеток, в некоторых клетках рака эти критерии могут отсутствовать или быть выражены в неполном объеме. Необходимо обращать внимание на особенности взаимного расположения клеток, характер межклеточных связей. Заключение формулируют по совокупности признаков при достаточном количестве клеточного материала. Попытка оценить мазок по неадекватно взятому материалу – наиболее частая причина ошибочных заключений.
Необходимо обращать внимание на особенности взаимного расположения клеток, характер межклеточных связей. Заключение формулируют по совокупности признаков при достаточном количестве клеточного материала. Попытка оценить мазок по неадекватно взятому материалу – наиболее частая причина ошибочных заключений.
Основные задачи цитологической диагностики состоят в следующем:
- Формулировка заключения до лечения.
- Интраоперационная срочная диагностика.
- Контроль эффективности лечения.
- Оценка важнейших факторов прогноза течения заболевания.
Цитологическое заключение до лечения включает:
- определение гистогенеза новообразований;
- установление степени дифференцировки опухолевого процесса;
- уточнение степени распространенности опухоли;
- изучение фоновых изменений;
- определение некоторых факторов прогноза;
- возможность исследования бактериальной флоры.
Современное цитологическое заключение не только констатирует наличие рака, но и указывает гистологический тип опухоли и степень дифференцировки согласно общепринятым международным классификациям (МКБ-О и ВОЗ).
Критериями достоверности цитологического метода являются результаты сопоставления с плановым гистологическим исследованием. Наибольший процент совпадений цитологического заключения с окончательным гистологическим заключением наблюдается при исследовании образований кожи, молочной, щитовидной железы, при метастатическом поражении лимфатических узлов. Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Таблица 1. Достоверность цитологических исследований
опухолей различных локализаций.
| Локализация | % совпадения цитологического и гистологического диагноза | % совпадения по данным литературы | % неудавшихся пункций |
|---|---|---|---|
| Легкое | 95,5-97 | 79-98 | 2,9-3,0 |
| Молочная железа | 95,8-97,4 | 90-96 | 2,6-8,3 |
| Лимфатические узлы | 98,4-98,7 | 90 | 1,6-10,7 |
| Кожа | 91,2-92,7 | 90-98 | 2,4-12,5 |
| Мягкие ткани (без указания гистологического типа опухоли) |
90,2-93,8 | 65-93,4 | 5-12,3 |
| Желудочно-кишечный тракт | 92,3-97,5 | 73-93,6 | 2,5-4,4 |
| Щитовидная железа | 85,5-93,2 | 57-94 | 1,6-4,2 |
| Шейка матки | 89,5-93,2 | 65-90 | 3,5-4,5 |
| Эндометрий | 78,9-84,8 | 30-90 | 3,8-15,4 |
| Почка | 86,2-89,3 | 76,4-91,3 | 7,1-11,5 |
| Экссудаты | 95,7-100 | – | 1,2-2,7 |
Уверенное цитологическое заключение о наличии злокачественного новообразования, совпадающее с клиническими симптомами и данными других диагностических исследований, расценивается как морфологическое подтверждение диагноза злокачественной опухоли. Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Гипердиагностика опухолей на нашем материале многие годы не превышает 1%, однако может служить причиной ненужного, а иногда и калечащего лечения. Истинная гипердиагностика, то есть ложное цитологическое заключение о наличии опухоли, объясняется несколькими наиболее типичными причинами.
Выраженная пролиферация клеточных элементов является наиболее частой причиной гипердиагностики рака. Например, пролиферация эпителия протоков и долек молочной железы при фиброаденоме и пролиферирующем аденозе, особенно при укрупнении ядер, наиболее часто приводит к гипердиагностике рака молочной железы. Правильной диагностике помогает анализ ядерных характеристик клеток опухоли: наличие ровных контуров ядра и равномерное распределение хроматина.
Реактивные изменения эпителия служат также нередкой причиной неадекватной цитологической диагностики. Наиболее тяжелые ошибки встречаются при ангиомиолипоме почки, при которой реактивные изменения почечного эпителия с укрупнением и полиморфизмом ядер приводят к ошибочному диагнозу высокодифференцированного почечноклеточного светлоклеточного рака. Диагностике ангиомиолипомы помогает обнаружение сосудистых структур и веретенообразных клеток, экспрессирующих виментин, десмин, НМВ-45.
Хронический аутоиммунный тиреоидит типа Хашимото сопровождается образованием сосочковоподобных структур, к оценке которых необходимо подходить осторожно и помнить, что при этом процессе реактивные изменения эпителия можно ошибочно принять за папиллярный рак щитовидной железы. Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Большую проблему цитологии представляет дифференциальная диагностика различных степеней диспластических изменений эпителия и внутриэпителиального рака. Присутствие при тяжелой дисплазии полиморфных крупных клеток с большими неправильно округлыми ядрами, иногда с увеличенными ядрышками, двуядерных клеток с тяжистым рисунком хроматина может быть неверно расценено как рак. При диспластических изменениях плоского эпителия необходимо учесть, что большинство клеток сходны с клетками глубоких слоев, крупные атипические клетки находятся в тесной связи с клетками без признаков атипии, имеются клетки стромы. Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Нередко причиной гипердиагностики метастатического поражения в лимфатических узлах являются комплексы клеток укрупненного эндотелия и гистиоцитов, образующих эпителиоподобные структуры, а также наличие макрофагов с содержанием бурого пигмента. При затруднениях диагностики помогает иммуноцитохимическое исследование с небольшим набором антител (VIII фактор, цитокератины, ЭМА, НМВ-45), позволяющее подтвердить или отвергнуть наличие метастазов рака или меланомы.
Во избежание ошибок морфологической диагностики большое значение имеет четкое указание на характер проведенного лечения. Например, прием довольно распространенного антибиотика тетрациклина приводит к накоплению в клетках щитовидной железы бурого пигмента и ошибочному диагнозу метастаза меланомы. Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Например, прием довольно распространенного антибиотика тетрациклина приводит к накоплению в клетках щитовидной железы бурого пигмента и ошибочному диагнозу метастаза меланомы. Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Имеются и объективные диагностические проблемы, например, в дифференциальной диагностике между эндометриоидной высокодифференцированной аденокарциномой и атипической гиперплазией эндометрия, себоррейной (базальноклеточной) кератомой и базально-клеточным раком, инфекционным мононуклеозом и болезнью Ходжкина, где достаточно высокий процент ошибочных заключений и требуется дальнейшая разработка цитологических критериев диагностики.
Знание клинической картины, характера проведенного лечения, применение современных методик морфологической диагностики с использованием иммуноцитохимии и морфометрии способствует сведению случаев гипердиагностики к нулю.
Вместе с истинной цитологической гипердиагностикой существует ложная гипердиагностика, когда цитолог дает уверенное заключение о злокачественном процессе, а при гистологическом исследовании опухоли не обнаруживается, то есть фактически имеет место гистологическая гиподиагностика. Пересмотр цитологических препаратов несколькими высококвалифицированными специалистами, повторное взятие биопсии, клиническое течение заболевания в дальнейшем подтверждают результаты цитологического исследования. Больше всего ложной цитологической гипердиагностики относится к исследованию биопсийного материала из бронхов и гортани, а также при исследовании лимфатическиих узлов, когда при цитологическом исследовании выявлялись единичные комплексы анаплазированных клеток, несомненно принадлежащих раку. При приготовлении гистологических препаратов эти комплексы теряются в готовых гистологических препаратах. Реальная потеря немногочисленных опухолевых клеток при приготовлении гистологических препаратов не допускает игнорирования клиницистом данных цитологического исследования и приводит к «золотому» стандарту – совместному цитологическому и гистологическому исследованию биоптата.
При приготовлении гистологических препаратов эти комплексы теряются в готовых гистологических препаратах. Реальная потеря немногочисленных опухолевых клеток при приготовлении гистологических препаратов не допускает игнорирования клиницистом данных цитологического исследования и приводит к «золотому» стандарту – совместному цитологическому и гистологическому исследованию биоптата.
Интраоперационная цитологическая диагностика – одно из основных направлений цитологического метода исследования. Во время операции, используя цитологический метод, уточняется характер патологического процесса, степень распространенности с выявлением метастазов в лимфатические узлы, печень и другие органы, производится контроль радикальности выполненной операции с исследованием краев резекции. Роль цитологии возрастает при разработке показаний к расширенным лимфоаденэктомиям и при определении так называемых «сторожевых», или «сигнальных», лимфатических узлов, которых может быть шесть, и применение гистологического метода невозможно из-за длительности исследования. По данным ведущих клиник, ошибка срочного гистологического исследования «сторожевых» лимфатических узлов составляет 25%, поэтому они рекомендуют использовать интраоперационное цитологическое исследование отпечатков с поверхности разрезанного лимфатического узла. По нашим данным, достоверность срочного цитологического исследования по выявлению метастатического поражения лимфатических узлов составляет 97-99%.
Надо отметить, что к срочному морфологическому исследованию могут быть противопоказания. Срочное интраоперационное морфологическое исследование не рекомендуется выполнять при подозрении на внутриэпителиальный рак с ограниченным очагом поражения из-за того, что не останется материала для планового гистологического исследования. Цитологические критерии внутриэпителиального рака только разрабатываются, и цитолог может дать заключение о раке, не указывая, что это Carcinoma in situ. При внутрипротоковых папилломах небольшого размера срочное гистологическое исследование лучше не выполнять, а цитологическое исследование достоверно поможет установить характер процесса.
При срочной морфологической диагностике существенно помогает макроскопическое исследование операционного материала. Опытный морфолог при визуальном исследовании уже может поставить диагноз, но для подтверждения диагноза необходимо микроскопическое исследование. Например, опухолевый узел классической звездчатой формы может быть при трех совершенно разных процессах: при раке, склерозирующем аденозе с центром Семба и липогранулеме. И только микроскопическое исследование позволяет правильно поставить диагноз.
Цитологический метод позволяет в динамике, не травмируя пациента, изучать лечебный патоморфоз при химиолучевой и фотодинамической терапии.
XX столетие названо в медицинских кругах веком цитопатологии. Оценивая возможности цитологического метода, можно сказать, что есть еще возможности его развития в комбинации с другими дисциплинами и методами.
Иммуноцитохимическое исследование нередко является решающим в дифференциальной диагностике новообразований, когда при рутинном исследовании возникают непреодолимые трудности для установления гистогенеза отдельных опухолей, определения источника метастазирования, трактовки первично-множественных поражений.
За последние годы достигнут огромный прогресс в клиническом использовании различных биологических маркеров. В отличие от сывороточных маркеров, клеточные маркеры определяются непосредственно в опухолевых клетках ИЦХ исследованием, в основе которого лежит реакция антиген-антитело. В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
Специфических маркеров дифференциальной диагностики злокачественных и доброкачественных опухолевых процессов не существует, но на сегодняшний день активно ведутся научные изыскания в решении этой проблемы. Так, равномерное окрашивание герминативных центров лимфоидных фолликулов с использованием антител bcl-2 указывает на фолликулярную лимфосаркому, в то время как негативная реакция свидетельствует о доброкачественном гиперпластическом процессе; реакция с антителами HBME-1 при ИЦХ исследовании опухолей щитовидной железы часто положительная в злокачественных новообразованиях и практически отсутствует при доброкачественных, в дифференциальной диагностике широко применяют галектин-3, экспрессирующийся карциномами щитовидной железы из А-клеток (папиллярный, фолликулярный) с отсутствием экспрессии в фолликулярных аденомах, зобах и нормальной ткани щитовидной железы.
Для установления гистогенеза и дифференциальной диагностики опухолей разработаны и постоянно совершенствуются, схемы C.R.Taylor и R.J. Cote (1994 г.). Разнообразие моноклональных антител, используемых в иммуноцитохимических исследованиях тонкоигольных пунктатов, в каждом конкретном случае позволяет ответить на вопрос, имеет ли данная опухоль эпителиальное происхождение или является саркомой, меланомой, лимфомой. Иммуноцитохимия широко применяется для иммунофенотипирования злокачественных лимфом, без чего, по современным канонам, невозможно начать лечение.
Иммуноцитохимическое исследование помогает в определении источника метастазирования при невыявленном первичном очаге. К сожалению, органоспецифических маркеров не так уж и много. К их числу могут быть отнесены специфический антиген предстательной железы (ПСA), позволяющий идентифицировать метастазы рака простаты более чем в 95% случаев; тиреоглобулин, экспрессирующийся в 92–98% фолликулярного и папиллярного рака щитовидной железы, и кальцитонин, экпрессирующийся в 80% медуллярных раков щитовидной железы В некоторых случаях рак щитовидной железы может экспрессировать и кальцитонин, и тиреоглобулин, что только с помощью иммуноферментной диагностики позволяет диагностировать диморфные А-С-клеточные раки.
Одним из первых показателей, вошедших в практику лечения больных раком молочной железы (РМЖ), и относящихся к категории клеточных маркеров, были рецепторы стероидных гормонов. Рецепторы стероидных гормонов – это белки, специфически и избирательно связывающие соответствующие стероиды после их проникновения в клетку.
По данным ВОЗ (2003 г.), экспрессия рецепторов эстрогенов (РЭ+) и прогестерона (РП+) в инвазивных протоковых раках составляет 70-80%; инвазивный дольковый рак в 70-95% экспрессирует РЭ, в 60-70% -РП, 100% экспрессия РЭ отмечена в инвазивном криброзном, муцинозных опухолях молочной железы. Эдокринная терапия наиболее эффективна у больных с первичными опухолями с высоким уровнем рецепторов стероидов. При метастатических поражениях степень реакции на эндокринную терапию также зависит от наличия РЭ и РП в опухоли: её эффективность составляет около 10–15% при гормонотрицательных опухолях, 27% при опухоли с РЭ+ и РП-, 46% при статусе РЭ- и РП+ и 75% при опухолях, содержащих РЭ+ и РП+. Рецепторположительные опухоли молочной железы имеют более высокую дифференцировку и более благоприятный прогноз.
Необходимо отметить, что рецепторы гормонов в доброкачественных образованиях молочной железы еще мало изучены. Отмечено повышение числа РЭ+ клеток в нормальной ткани молочной железы с увеличением возраста, а также при склерозирующем аденозе, папилломах, фиброаденомах и листовидных опухолях. Коэкспрессия РЭ+/Ki-67+ с разной степенью выраженности и соотношения большей частью выявлялась в патологии, связанной с риском развития РМЖ.
Рецепторы эстрогенов экспрессируются в клетках рака эндометрия, яичников, шейки матки, щитовидной железы, кишечника, нейроэндокринных опухолей, в том числе карциноидов.
Иммуноцитохимическое исследование позволяет на дооперационном этапе установить важнейшие факторы прогноза опухолевого процесса и скоррегировать схемы лечения. Пролиферативная активность многих новообразований оценивается с помощью антител Ki-67 в злокачественных лимфомах, опухолях молочной, предстательной, поджелудочной железы, легких, гипофиза, толстой кишки. Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Гиперэкспрессия онкопротеина C-erbB-2(HER2/neu), являющегося рецептором эпидермального фактора роста 2-го типа, придающего клеткам свойство неограниченного деления, служит фактором риска рецидива заболевания для ряда опухолей: рака молочной железы, толстой кишки, лёгкого и др. Экспрессия онкобелка C-erbB-2 при ИГХ исследовании обнаруживается в 15–40% РМЖ. Выявление онкопротеина C-erbB-2, по мнению некоторых авторов, ассоциируется с высокой степенью злокачественности опухоли, отсутствием РЭ и РП, высокой митотической активностью, устойчивостью к химиотерапии и требует назначение герцептина.
Наличие метастазов в лимфатических узлах при опухолевом поражении является главным дискриминирующим прогностическим признаком. С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
Иммуноцитохимические реакции оцениваются как качественно при уточнении гистогенеза опухоли, наличии метастаза в лимфатическом узле или другом органе, иммунофенотипировании лимфом, так и количественно – при оценке пролиферативной активности, экспрессии рецепторов гормонов в опухоли, онкопротеина С-erbB-2 и т.д. Иммуноцитохимическая реакция может быть ядерной, цитоплазменной и мембранной. Ядерная реакция проявляется интенсивным окрашиванием ядра и бывает при определении РЭ и РП, Ki–67, PCNA, p53 и т.д. Цитоплазменная реакция характеризуется диффузным окрашиванием цитоплазмы или отложением гранул в виде грубых пятен и зерен. Цитоплазменное окрашивание дают хромогранин, синаптофизин, белок S-100, виментин, десмин, тиреоглобулин, кальцитонин, цитокератины, bcl-2 и т. д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
Для количественной оценки экспрессии маркера Мс. Carthy и соавторы разработали систему подсчета Histo score (H.S.). Система подсчета включает интенсивность иммуноцитохимической окраски, оцениваемую по 4-балльной шкале, и долю окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски в баллах: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное, 4 – очень сильное окрашивание. Формула подсчета:
Histochemical score = ∑ P(i)×i (гистосчет),
где i – интенсивность окрашивания, выраженная в баллах от 0 – 4,
Р(i) – процент клеток, окрашенных с разной интенсивностью.
Максимальное количество Histo score соответственно должно быть 400. Подсчет проводится в трех когортах по 100 опухолевых клеток в различных полях зрения (объектив х 40).
В практической работе допустимо использование полуколичественной оценки. Реакция считается отрицательной при полном отсутствии или экспрессии антигена менее 5%–10% опухолевых клеток, слабоположительной – от 5%–10% до 24% клеток, умеренно положительной – в 25%–75%, выраженной – более чем в 75% клеток. При оценке иммуноферментной реакции принимают во внимание интенсивность и полноту окрашивания цитолеммы клеток в центре опухолевого очага. Так, яркая, мембранная, беспрерывная по контуру клетки реакция обозначает выраженную экспрессию белка С-erbB-2 (+++), что в 95% случаев подтверждается амплификацией гена С-erbB-2, выявляемой с помощью FISH (флуоресцентной гибридизацией in situ).
Сопоставляя данные иммуноцитохимических исследований различных опухолей с целью уточнения гистогенетической принадлежности и результатов послеоперационных морфологических заключений, получены следующие результаты: 89% совпадений при анализе опухолей щитовидной железы, 83% при уточнении гистогенеза первичной опухоли и метастазах в лимфатических узлах, 89% – при опухолях мягких тканей и кожи и 100% – при исследовании биологических жидкостей. При определении гормонального статуса РМЖ процент совпадения ИЦХ и ИГХ исследований составляет 88,3%, при исследовании пролиферативной активности – 83%, при определении онкопротеина C-erbB-2 – 93,2%.
При сравнении возможностей ИЦХ исследования при выполнении пункционной биопсии и ИГХ исследования при трепанобиопсии преимущества ИЦХ, на наш взгляд, несомненны. Пункционная биопсия – более простая процедура, не сопровождается такими осложнениями, как воспаление, кровотечение, и позволяет получить полноценный клеточный материал. При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
Использование иммуноцитохимического исследования позволяет расширить возможности морфологических методов и на дооперационном этапе уточнить гистогенез, диагностировать первично-множественные поражения, степень распространения и оценить некоторые показатели прогноза и чувствительность опухоли к химиогормонотерапии.
На современном этапе развития в цитологии используются методы молекулярной и генной диагностики: гибридизация in situ, Southern Blotting, Nothern Blooting, Western Blotting, DNK Microarray и т.д) В научной и практической работе цитологи применяют проточную цитофотометрию.
Одним из путей совершенствования цитологического метода исследования является применение морфометрии, что позволяет получать объективные количественные параметры. Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Развиваются новые методы микроскопии: фазово-контрастная, флюоресцентная, конфокальная и т.д. Создание компьютерных систем обучения, развитие метода телеконсультации также предъявляют новые требования и, несомненно, будут способствовать развитию и совершенствованию цитологического метода диагностики.
Волченко Надежда Николаевна
д.м.н., профессор, руководитель отделения
онкоцитологии МНИОИ им.П.А.Герцена
Гистологическое исследование опухолей| Блог UNIM
Точная постановка диагноза «рак» невозможна без проведения гистологического анализа.
Гистологическое исследование опухолей является одним из самых достоверных и важных диагностических методов. Гистологическое исследование проводят врачи-патоморфологи, оценивая под микроскопом материал после биопсии (непосредственно фрагмент опухоли) или же операционный материал (удаленный орган или его часть). В дальнейшем при необходимости используются дополнительные методы исследования (иммуногистохимия (ИГХ) и молекулярные исследования).
Данное исследование проводится как для выяснения происхождения опухоли, так и для определения стратегии будущего лечения. Вероятность назначения неправильного лечения велика при отсутствии информации о том, что из себя представляет обнаруженная опухоль. Нельзя ориентироваться лишь на клиническую картину, результаты методов визуализации (рентген, КТ, МРТ) или анализов крови. Зачастую онколог не знает, с чем имеет дело, и может лишь высказать свои предположения, поставив диагноз со знаком «?». Тогда и назначается биопсия с последующим морфологическим исследованием.
Зачастую онколог не знает, с чем имеет дело, и может лишь высказать свои предположения, поставив диагноз со знаком «?». Тогда и назначается биопсия с последующим морфологическим исследованием.
Морфологическое исследование является заключительным этапом в диагностическом поиске и позволяет онкологам безошибочно выбирать между тем или иным курсом химиотерапии, или же совсем от нее отказаться в случае получения заключения о доброкачественном процессе.
Кроме 100% точности диагноза, в отдельных случаях гистологическое исследование позволяет расширить, или же наоборот, ограничить объем хирургического вмешательства. Приведем несколько примеров.
Опухоль молочной железы. Первая мысль, которая возникает у женщины – рак! Да, это возможно, но… Существует ряд оговорок. После какого метода исследования был выставлен диагноз? Если это цитологическое исследование (мазки), то есть высокая вероятность ошибочно выставленного диагноза. Это обусловлено тем, что даже «нормальные» клетки эпителия после нанесения на стекло (грубо говоря «размазывания») могут принимать атипичный вид и вводить цитолога в заблуждение. В таком случае просто необходимо гистологическое или иммуногистохимическое(ИГХ) исследование биоптата («кусочка опухоли») врачом-патологоанатомом, который достоверно выставит диагноз. Ведь вероятность того, что опухоль доброкачественная, также есть. В таком случае удалять всю молочную железу и калечить пациентку нет необходимости, а можно ограничиться лишь секторальной резекцией (удалить лишь пораженную часть железы). Или же в случае получения диагноза «лимфома» (такое тоже возможно), вообще не проводить оперативного вмешательства.
Поражение желудка. Опять же, есть вероятность того, что это рак. Но также не исключена и лимфома. В ее случае нет необходимости удалять желудок, а можно ограничиться лишь химиотерапией.
Все зависит, конечно, от качества материала, взятого для исследования и квалификации патоморфолога. Ни один диагноз опухоли, злокачественной или доброкачественной, не выставляется лишь одним врачом. В таких случаях принцип коллегиального просмотра очень важен. Минимум два мнения и четыре глаза. Ведь то, что видит один врач, может пропустить другой или не обратить на это внимания.
В таких случаях принцип коллегиального просмотра очень важен. Минимум два мнения и четыре глаза. Ведь то, что видит один врач, может пропустить другой или не обратить на это внимания.
Подводя резюме под вышесказанным, можно выделить несколько последовательных этапов до момента постановки правильного диагноза:
— обращение пациента к клиническому врачу/онкологу;
— полное и всестороннее обследование с выявлением опухолевого очага;
— биопсия/удаление образования с его доставкой в лабораторию патоморфологии для морфологической диагностики;
— вместе с материалом предоставляются как можно более полные клинические данные и результаты методов обследования.
Как уже было сказано выше, финальной точкой в диагностическом поиске для клинических врачей является заключение патоморфолога.
Заказать звонок
Медицинские вопросы и ответы от UNIM
1) Как берут биопсию?
Биопсия — это диагностическая процедура, при которой из «подозрительного» места, например, опухоли, полипа, длительно незаживающей язвочки, берутся крохотные частицы ткани (биоптат). В зависимости от того, откуда берется биоптат, пользуются разными инструментами. Это может быть толстая игла, эндоскоп (когда исследуют пищевод или желудок), световод (при бронхоскопии), обычный скальпель (во время хирургической операции). При проведении процедуры используется местное обезболивание, либо общий наркоз при операции.
2) Мне сделали гистологию – опасно ли это?
Гистологию назначают, если есть новообразование самой различной локализации (родинка, полип, уплотнение под кожей и т.п.), чтобы определить его природу (из каких клеток оно состоит, и нет ли раковых клеток). Сама процедура биопсии неприятна, но неопасна. Боль может появляться от введения иглы при пункционной биопсии, а также в течение нескольких дней после процедуры.
3) Как подготовиться к биопсии/какие анализы сдать перед биопсией?
Зависит от вида биопсии. В большинстве случаев биопсия проводится амбулаторно и не требует какой-либо специальной подготовки пациента. Хирургическая биопсия может потребовать временного прекращения приема тех или иных препаратов, о чем следует спросить у лечащего врача.
В большинстве случаев биопсия проводится амбулаторно и не требует какой-либо специальной подготовки пациента. Хирургическая биопсия может потребовать временного прекращения приема тех или иных препаратов, о чем следует спросить у лечащего врача.
Обычно за 8 часов до проведения биопсии рекомендуется прекратить прием пищи и жидкостей. Однако применение препаратов внутрь разрешается с небольшим количеством воды. Пациентам, получающим инъекции инсулина по поводу сахарного диабета, следует проконсультироваться с врачом относительно изменения дозы препарата.
Перед проведением биопсии очень важно сообщить врачу обо всех лекарствах, которые принимает пациент, в том числе растительного происхождения, а также о наличии аллергии, особенно на местные анестетики. За три дня до процедуры следует прекратить прием аспирина или других препаратов, которые разжижают кровь.
Также необходимо сообщить врачу о недавно перенесенных заболеваниях или других состояниях.
4) Какие анализы мне надо сдать на рак?
При подозрении на злокачественную опухоль, проводится биопсирование новообразования и близлежащих тканей. Затем полученные образцы доставляют, обрабатывают и получают гистологические блоки, из которых делают гистологические стекла. Эти гистологические стекла изучает под микроскопом врач-патоморфолог и ставит диагноз. Так производится постановка диагноза «рак».
5) Какой анализ крови сдать на рак?
Ни один анализ крови не дает достаточной точности для диагностики рака. Поэтому анализ крови на рак сдавать не нужно.
6) Как обследоваться у Вас на онкологию?
При наличии новообразования необходимо пройти процедуру биопсирования в лечебном учреждении вашего города и затем направить нам полученный материал в 10%-ном формалине, либо готовые гистологические стекла и блоки, которые сделают в этом учреждении. Мы проведем гистологическое исследование, либо пересмотр имеющихся гистологических стекол и поставим или проверим ваш диагноз.
7) Стоит ли доверять анализу, который мне провели?
Качество гистологического анализа во многом зависит от лаборатории, в которой он проводился, и от врача, который, изучая гистологические стекла, ставил диагноз. При перепроверке диагноза, поставленного в региональной лаборатории, в лабораториях экспертного уровня, корректировка диагноза проводится до 40% случаев. Чтобы удостовериться в качестве своего диагноза, нужно отправить гистологические стекла на пересмотр: https://unim.su/service/peresmotr-preparatov/.
8) Что/какие болезни показывает гистология?
На гистологическом исследовании врач-патоморфолог изучает под микроскопом ткани новообразования, и делает вывод, из каких клеток оно состоит — на основании этого ставится диагноз. Гистология показывает не только онкологию, но и широкий спектр неонкологических заболеваний.
9) Могу ли я у Вас сдать анализы на онкомаркеры?
Нет, мы не проводим анализы на онкомаркеры. Мы занимаемся только точной онкологической диагностикой — проводим гистологические, иммуногистохимические и молекулярные исследования.
10) Можно ли у вас сдать анализ крови?
Нет, мы не проводим анализы крови, так как они не являются элементом точной онкологической диагностики.
11) Покажут ли онкомаркеры онкологию?
Нет, с достаточной точностью не покажут. Онкомаркеры в небольшом количестве всегда содержатся в крови человека, причем их количество может повышаться при фоновых заболеваниях (даже при простуде). Кроме того, количество антигенов увеличивается при беременности. Онкомаркеры в качестве скрининга не применяются, и сдавать их без направления врача не имеет смысла. Они применяются при уже существующей опухоли как один из элементов диагностики, а также при в контроле за заболеванием после проведенного лечения.
12) Определяет ли цитология рак?
Цитологическое исследование применяется в скрининге некоторых онкологических заболеваний (например, рака шейки матки), так как оно менее неинвазивно (нетравматично), в отличие от гистологии. Оно помогает выделить среди условно здоровых пациентов тех, у кого есть определенные изменения клеток и кому необходимо дополнительное обследование. Но на основании цитологического исследования диагноз «рак» не ставится, необходимо проведение гистологического исследования.
Оно помогает выделить среди условно здоровых пациентов тех, у кого есть определенные изменения клеток и кому необходимо дополнительное обследование. Но на основании цитологического исследования диагноз «рак» не ставится, необходимо проведение гистологического исследования.
13) Бывает ли СОЭ в норме при раке?
Бывает. СОЭ — показатель быстроты разделения крови в тоненьком капилляре на 2 слоя: плазму и эритроциты. Это неспецифический скрининговый показатель воспаления в теле человека, он может повыситься при насморке или после плотного обеда, при анемии или лейкозе, а может и не повышаться. Также СОЭ может быть выше нормы у полностью здорового человека. Конечно, у многих больных раком высокие показатели СОЭ, но этот показатель повышен не у всех пациентов! Поэтому его не используют в диагностике рака, и только при значительном повышении СОЭ (выше 75 мм/ч) и отсутствии инфекционного или воспалительного заболевания может возникнуть предположение о наличии опухоли.
14) Подозрительные родинки, что делать?
При наличии подозрительных родинок необходимо обратиться к дерматологу или онкологу. Врач изучит их с помощью дерматоскопа и определит, нужно ли удаление. Удаление проводится с обязательным гистологическим исследованием. Именно это исследование показывает, были ли раковые клетки в родинке или нет. От самой процедуры удаления рак не развивается, он может развиться, если родинку с раковыми клетками не трогать и дать онкологическому процессу развиваться, а также если онкологическую родинку удалить без гистологии – врач не будет знать, что у пациента был патологический процесс, и не назначит необходимого лечения.
15) Какой анализ точно показывает рак?
Точно определить, есть рак или нет, можно только по результатам гистологического исследования. Другие методы исследования не дают необходимой точности.
16) Делаете ли Вы анализы на предрасположенность к раку?
Генетическую предрасположенность к раку можно определить после посещения генетика и сдачи определенных анализов. Не все виды рака являются наследственными, большая часть видов рака – спорадические (появляются спонтанно). Некоторые виды наследственного рака хорошо изучены, и существуют анализы, позволяющие определить, есть у Вас мутация, вызывающая этот вид рака или нет. Например, здесь Вы можете сдать анализ на генетическую предрасположенность к раку молочной железы и раку яичников: http://rshmtest.ru/test-brca1-brca2-rak-molochnoy-zhelezyi/.
Не все виды рака являются наследственными, большая часть видов рака – спорадические (появляются спонтанно). Некоторые виды наследственного рака хорошо изучены, и существуют анализы, позволяющие определить, есть у Вас мутация, вызывающая этот вид рака или нет. Например, здесь Вы можете сдать анализ на генетическую предрасположенность к раку молочной железы и раку яичников: http://rshmtest.ru/test-brca1-brca2-rak-molochnoy-zhelezyi/.
17) Какова вероятность рака, если анализ крови хороший?
На ранних стадиях рака анализ крови может быть в норме. Но даже при наличии отклонений показателей от нормы (лейкоциты, СОЭ) по одним лишь показателям общего анализа крови диагностировать рак невозможно.
18) Можно ли самому (без назначения врача) прийти сдать гистологический анализ?
Нет. Гистологический анализ предполагает исследование уже выявленных новообразований. Направление пи наличии новообразования не нужно, но принимать решение о необходимости проведения биопсирования должен онколог. При необходимости Вас может проконсультировать наш онколог.
Или задайте Ваш вопрос по телефону: 88005559267
Отличие расширенной кольпоскопии от жидкостной цитологии
Что такое жидкостная цитология или ПАП-тест?В 1928 году медик из Греции Джордж Папаниколау сам того не подозревая стал изобретателем цитологического мазка. Когда он проводил генетические опыты над морскими свинками и следил за их репродуктивным циклом, он заметил, что в образцах их выделений и вагинальной ткани есть некоторые метаморфозы. Чтобы доказать свою теорию, он взял фрагменты ткани с шейки матки у больных раком женщин и сравнил их с фрагментами тканей полностью здоровых женщин. Далее Папаниколау рассмотрел взятые пробы и тем самым доказал свою гипотезу о раковых клетках.
Благодаря данному открытию удалось разработать простой анализ, спасший много жизней. Метод жидкостной цитологии помог не только расширить знания о раке, но и способах диагностирования этой болезни на ранних стадиях и ее лечении.
Почему же жидкостная цитология стала такой информативной при болезнях рака шейки матки? Дело в том, что данное заболевание может никак не проявлять себя в течении многих лет. Симптомы рака появляются только тогда, когда он глубоко укореняется в теле женщины и начинает стремительно истреблять здоровые клетки. Может даже пройти 5-10 лет, пока рак шейки не выдаст себя.
Таким образом, цитологический мазок стал незаменимым тестом, помогающим обнаруживать болезнь еще на начальной стадии ее появления и сохранять здоровье. И именно поэтому современные гинекологи советуют сдавать жидкостную цитологию (ПАП-тест) хотя бы один раз в год начиная с 16 лет.
Как же проводится ПАП-тест? Этот анализ подразумевает под собой взятие биоматериала с внешней и внутренней стороны шейки матки. Далее взятые клетки исследуются в лаборатории. Однако если мазок дал положительный результат, это еще не диагноз рака. Женщину направляют на дополнительное обследование и назначают расширенную кольпоскопию, о которой пойдет речь ниже. Иногда жидкостная цитология указывает и на то, что у девушки имеется венерическое заболевание.
Расширенная кольпоскопия
Расширенная кольпоскопия — это несложная и лишь слегка болезненная процедура, которая длится от 10 до 20 минут. Она проходит в привычном всем девушкам кресле и является плановой процедурой.
Для диагностики медицинский работник использует кольпоскоп. Это электронный микроскоп большого размера, который способен увеличивать до шестидесяти раз. Его ставят в 30 см от вульвы и осматривают шейку матки, обработав ее разбавленным раствором уксуса. Когда тампон, смоченный в растворе, убирает слизь, патогенные участки ткани окрашиваются в светлый цвет.
Далее гинеколог может обработать подозрительные участки йодным раствором и провести осмотр аномальных участков с помощью цветных светофильтров. Это позволяет увидеть маленькие капилляры. У здоровых пациенток они тонкие и расположены равномерно.
Если врач обнаруживает много патогенных тканей, он берет анализ на биопсию. Эта процедура проводится максимально безболезненно и аккуратно, чтобы не причинить вред девушке. Врач следит за ее реакцией и старается сделать все, чтобы ей было комфортно.
Эта процедура проводится максимально безболезненно и аккуратно, чтобы не причинить вред девушке. Врач следит за ее реакцией и старается сделать все, чтобы ей было комфортно.
Таким образом кольпоскопия является лучшим способом диагностировать рак шейки матки еще на этапе его появления. Ведь благодаря яркому свету электронного микроскопа врач может хорошо рассмотреть шейку матки и выявить имеющиеся отклонения, которых не удается обнаружить при обычном осмотре.
Один раз в полгода врачи акушер-гинекологи EVACLINIC рекомендуют проходить Женский диагностический комплекс «Евалюция», чтобы быть уверенной, что все в порядке! Записаться на комплекс можно прямо на сайте или по короткому номеру 409!
Цитология в Германии — EMEX Medical Gmbh
Цитология в Германии – это метод диагностического исследования, который активно используется в Германии. Все внимание в цитологии направлено на изучение клеток и обнаружение патологических изменений в них. Цитологический анализ может быть использован при профилактическом осмотре, постановке диагноза, контроле над прохождением лечения.
С помощью цитологии можно выявлять разные патологические состояния, но главная задача цитологического исследования – обнаружить злокачественные клетки, если такие имеются, и определить есть ли у пациента рак.
Какие материалы используют для цитологии в Германии?
Для цитологического исследования в Германии могут использоваться: моча, кровь, мокрота, выделения из молочных желез, смывы с разных поверхностей органов, отпечатки язвенных поверхностей, ран, соскоб, спинномозговая жидкость.
Как проводится анализ на цитологию в Германии?
После получения образца, специалист рассматривает его под микроскопом. Диагност обращает внимание на строение клеток, их расположение, размер, особенности реакции на изменения внешней среды и определяет, имеет ли место патология и есть ли атипичные клетки. Чем опытнее и квалифицированнее врач, тем точнее будет поставлен диагноз.
У вас есть возможность сдать анализ на цитологию в одном из самых надежных диагностических центров Европы – Диагностической клинике Мюнхена. Здесь работают врачи, которые зарекомендовали себя лучшими диагностами, а использование новейших технологий позволяет им выявлять патологию с максимальной точностью.
Диагностическая клиника Мюнхена
Цитология рака в Германии
Особую роль цитология в Германии играет в ранней диагностике рака. Этот метод позволяет точно определить, что именно происходит в месте развития патологического процесса, отличить доброкачественное новообразование от злокачественного, выявить разновидность атипичных клеток, которые образуют опухоль, и выбрать наиболее подходящее лечение.
Вы можете сделать цитологическую диагностику в Германии:
- рака желудка;
- рака матки;
- рака мочевого пузыря;
- рака легкого;
- рака ротовой полости;
- других видов рака.
Можно также сделать другие патологические анализы и пройти комплексное обследование в немецких клиниках.
Диагностика в Германии
Стоимость анализа на цитологию в Германии вы можете узнать через специальную форму или связавшись с нами по телефону.
Чтобы сделать цитологию в Германии или пройти другое нужное вам диагностическое обследование в лучших немецких клиниках, отправьте нам запрос на диагностику.
Как пройти диагностику в Германии?Цитология и биопсия: сравнение точности
Эндрю С. Лоар, DVM, DACVIM (онкология и внутренняя медицина)
Опубликовано 2017-09-05 в Клиническая патология
Оценка клинически аномальных тканей, представленных на цитологический анализ, на протяжении десятилетий оставалась простой и недорогой диагностической методикой. В отличие от взятия образцов биопсии, материал, полученный для цитологического исследования, обычно требует меньшего количества осложнений, времени и планирования. Лишь небольшое количество исследований продемонстрировало относительную ценность цитологического диагноза по сравнению с гистологическим (биопсия) у одного и того же пациента.В приведенном ниже обсуждении в качестве первой части многостраничной статьи рассматриваются исследования, проведенные клиническими и анатомическими патологами, чтобы помочь клиницистам, которые должны определить точность результатов, полученных на цитологических образцах.
Лишь небольшое количество исследований продемонстрировало относительную ценность цитологического диагноза по сравнению с гистологическим (биопсия) у одного и того же пациента.В приведенном ниже обсуждении в качестве первой части многостраничной статьи рассматриваются исследования, проведенные клиническими и анатомическими патологами, чтобы помочь клиницистам, которые должны определить точность результатов, полученных на цитологических образцах.
Диагностическая точность — это частота, с которой тест правильно определяет пациента как имеющего или не имеющего интересующее заболевание; тест с высокой диагностической точностью выявляет относительно мало ложноположительных (высокоспецифичный ) и мало ложноотрицательных (высокочувствительный ) результатов.Поскольку индексный тест часто выполняется для выявления более чем одного болезненного процесса, полезно определить диагностическую точность анализа, определив, как часто индексный тест согласуется или коррелирует с эталонным стандартом. Таким образом, во многих исследованиях обсуждается частота совпадения (корреляции) или несогласованности. Другие исследования указывают на долю частичного или полного согласия , что отражает долю случаев, в которых цитологический диагноз совпадает с биопсийным.
Есть несколько неточностей, связанных с производительностью и оценкой цитологических и гистопатологических анализов.Качество обоих тестов и этих сравнительных исследований, очевидно, зависит от опыта клинических и анатомических патологов, читающих слайды. Могут быть значительные различия в диагнозах между разными патологами, оценивающими одни и те же ткани. Действительно, похожие, если не менее существенные различия были выявлены, когда один и тот же человек просматривал одни и те же слайды в разное время. В нескольких гистопатологических исследованиях были рассмотрены вариации между наблюдателями, в основном представляющие различия между первым и вторым мнениями, в диагностике смеси представленных биопсий. Значительные диагностические расхождения наблюдались в 10-20% случаев, при этом клинически значимое частичное (несогласие) отмечалось почти в 50%. Кроме того, изменение типа образца, полученного для биопсии, было связано с противоречивыми результатами; Гистологические образцы иглы или керна обычно показывают меньшую точность, чем материал, полученный с помощью эксцизионной или клиновидной резекции. Эти и другие несоответствия ставят под сомнение термин «золотой стандарт» применительно к гистопатологическому анализу и трудности подтверждения истинно положительных и истинно отрицательных результатов.
Значительные диагностические расхождения наблюдались в 10-20% случаев, при этом клинически значимое частичное (несогласие) отмечалось почти в 50%. Кроме того, изменение типа образца, полученного для биопсии, было связано с противоречивыми результатами; Гистологические образцы иглы или керна обычно показывают меньшую точность, чем материал, полученный с помощью эксцизионной или клиновидной резекции. Эти и другие несоответствия ставят под сомнение термин «золотой стандарт» применительно к гистопатологическому анализу и трудности подтверждения истинно положительных и истинно отрицательных результатов.
Тем не менее, методологии цитологического тестирования могут быть несовместимыми. Каждый цитологический образец должен интерпретироваться с предположением, что представленный материал не может быть репрезентативным для аспирированного поражения. Это очевидно, когда образец бесклеточный или состоит только из элементов периферической крови; однако в большем количестве клеточных образцов клинический патолог может идентифицировать отдельные цитологические результаты, которые являются отрицательными для конкретного заболевания, но не может предположить, что результаты могут быть неубедительными.Это очень важно при сравнении ценности цитологии и биопсии, потому что в большинстве исследований исключение неубедительных цитологических диагнозов заметно улучшает определение диагностической точности. Результаты цитологического исследования, которые не подтверждают опухоль или какой-либо другой окончательный диагноз, не обязательно следует рассматривать как отрицательный результат, если он выполнен на нерепрезентативном образце или идентифицирован как нерепрезентативный.
Другие ограничения при цитологической оценке включают распространение и доступность рассматриваемого поражения.Аспирация очаговых, особенно наружных, образований обычно дает более репрезентативные результаты по сравнению с материалом, полученным из более диффузных поражений или материала, полученного с помощью внутриполостных игл.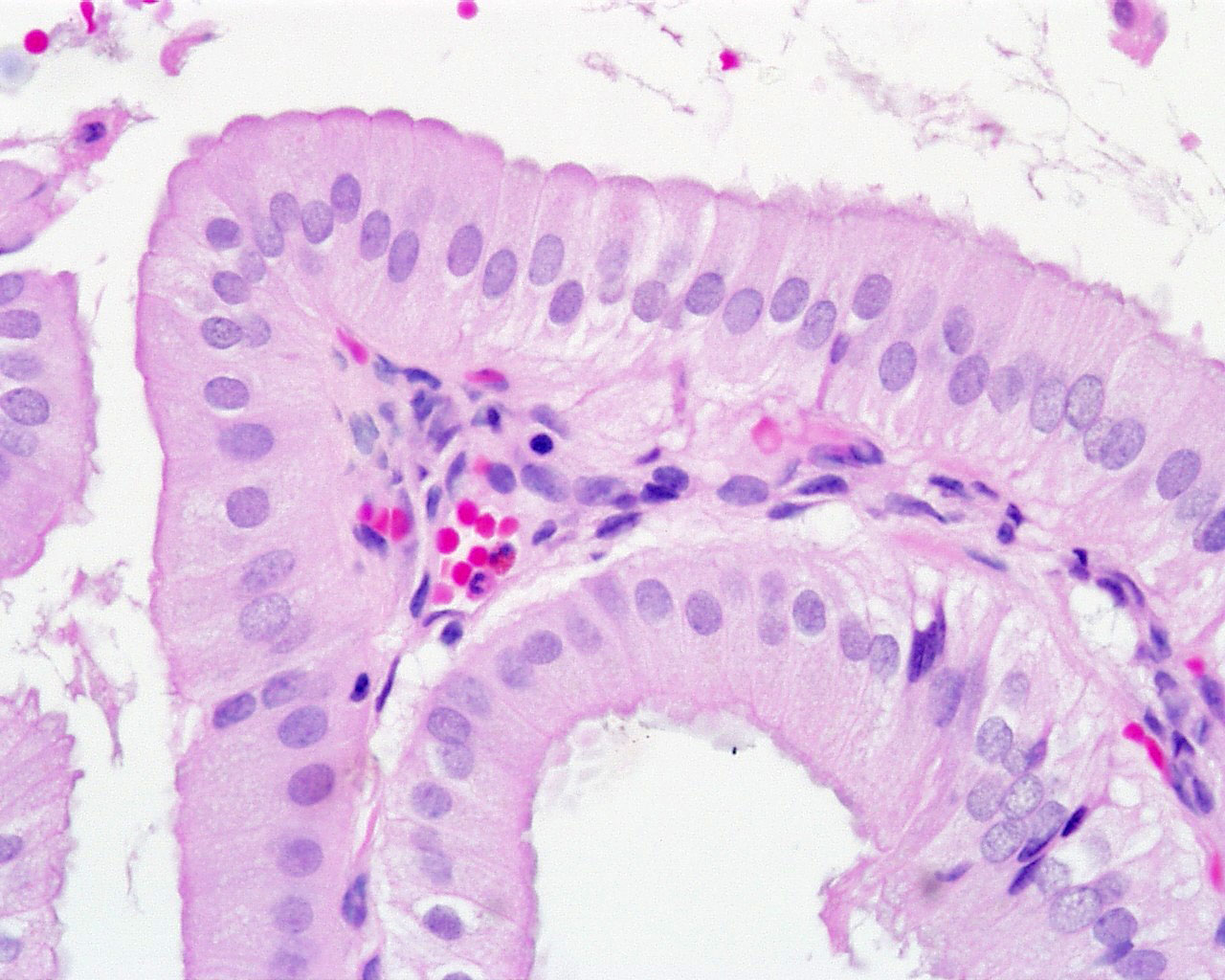 Аналогичным образом доказано, что аспираты под ультразвуковым контролем более точны, чем когда игла направлена в меньшем направлении. Наконец, размер используемой иглы, техника аспирации и количество подготовленных слайдов — все это связано с вариациями в диагностической точности, и читателю рекомендуется ознакомиться со стандартными текстами по цитологии, чтобы разработать подходящие методы отбора образцов.
Аналогичным образом доказано, что аспираты под ультразвуковым контролем более точны, чем когда игла направлена в меньшем направлении. Наконец, размер используемой иглы, техника аспирации и количество подготовленных слайдов — все это связано с вариациями в диагностической точности, и читателю рекомендуется ознакомиться со стандартными текстами по цитологии, чтобы разработать подходящие методы отбора образцов.
Вернитесь на следующей неделе, чтобы увидеть сообщение, в котором обсуждается относительная точность цитологического исследования по сравнению с биопсией на предмет поражений кожи, желудочно-кишечного тракта, дыхательных путей и костной ткани.
Изображение предоставлено: Изменено из фотографии ВМС США Тома Ватанабе. [Общественное достояние], через Wikimedia Commons
Об автореДоктор Эндрю Лоар окончил Университет Джорджии. Он прошел стажировку в Государственном университете Луизианы и резидентуру по онкологии в Медицинском центре для животных в Нью-Йорке.Он работал в клиническом штате в ветеринарных школах Технологического института Вирджинии и Университета Висконсина, а также в Ветеринарном медицинском центре Западного Лос-Анджелеса. Он получил сертификат совета ACVIM (внутренняя медицина и онкология). Он был первым ветеринарным онкологом, практикующим в южной Калифорнии, и руководил онкологической клиникой в Сан-Диего с 1985 по 1995 год. Доктор Лоар прошел дополнительное обучение в области клинической патологии в Государственном университете Оклахомы и работал консультантом по онкологии / внутренней медицине и цитологом в справочной ветеринарной лаборатории, профессиональной лаборатории животных, ныне ANTEC, и лабораториях IDEXX.Вернувшись в Медицинский центр для животных в качестве клинического цитолога, он позже стал соучредителем ALX Laboratory, небольшой амбициозной лаборатории клинической патологии на Манхэттене. |
Сравнение результатов цитологического или гистологического диагноза злокачественной мезотелиомы
Это исследование демонстрирует, что случаи с цитологическим диагнозом эпителиоидной ММ имеют аналогичный результат выживания по сравнению с пациентами с гистологическим диагнозом эпителиоидной ММ.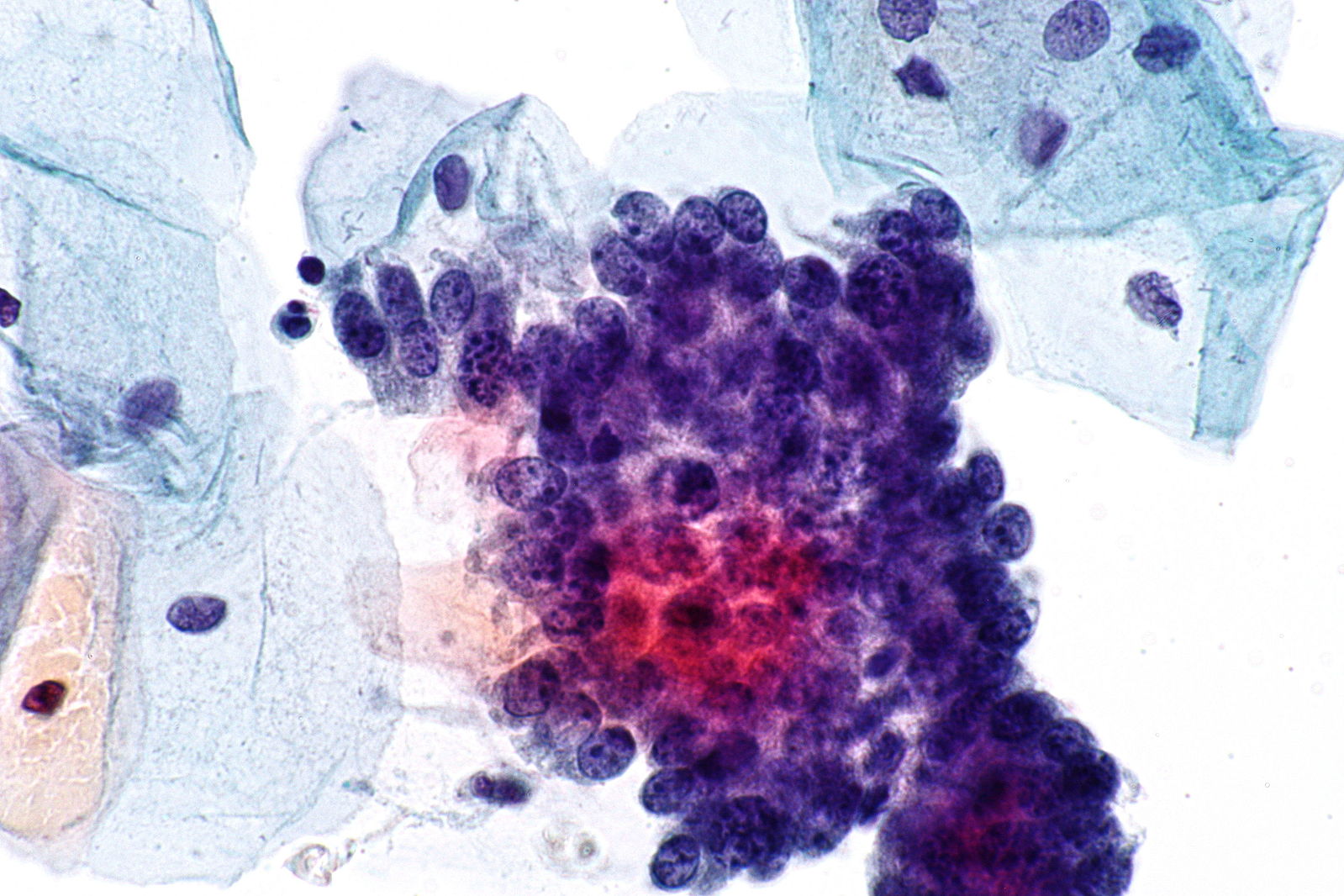 Кроме того, существует последовательное и четкое разделение кривых выживаемости (цитологически или гистологически диагностированных) эпителиоидных ММ от гистологически диагностированных двухфазных ММ, что указывает на то, что в этой популяции, по-видимому, нет клинически значимых различий между цитологически и гистологически диагностированными эпителиоидными ММ.
Кроме того, существует последовательное и четкое разделение кривых выживаемости (цитологически или гистологически диагностированных) эпителиоидных ММ от гистологически диагностированных двухфазных ММ, что указывает на то, что в этой популяции, по-видимому, нет клинически значимых различий между цитологически и гистологически диагностированными эпителиоидными ММ.
Текущие международные руководства ссылаются на исторические проблемы в отношении использования цитологии в качестве средства диагностики ММ, и широко признано, что этот метод бесполезен для диагностики опухолей, содержащих саркоматоиды.Накапливаются доказательства того, что цитологический диагноз ММ, подкрепленный дополнительными методами, такими как иммуногистохимия, столь же надежен, как и гистопатологический диагноз (Rakha et al, 2010). Было высказано опасение, что цитологически установленный диагноз ММ может ошибочно классифицировать двухфазный ММ как эпителиоидный, потому что клетки саркоматоидного компонента не попадают в плевральное пространство, что приводит к ошибочной классификации. Используя выживаемость в качестве суррогата для различной гистологии ММ, текущее исследование не поддерживает эту ошибочную классификацию.Напротив, результаты этого исследования демонстрируют, что случаи с диагнозом эпителиоидного ММ с использованием только цитологии не имеют существенной разницы в общей выживаемости по сравнению со случаями с гистологически диагностированным эпителиоидным ММ, и, что важно, существует статистически значимое разделение результатов выживания, когда по сравнению с двухфазным или саркоматоидным ММ.
После получения соответствующей истории болезни и визуализации диагностическая аспирация в большинстве случаев считается первым инвазивным исследованием необъяснимого плеврального или перитонеального выпота.Во многих случаях это позволяет провести цитологический анализ и диагностировать злокачественный плевральный / перитонеальный выпот. Важность этого текущего исследования заключается в том, что при наличии соответствующего цитопатологического опыта и техники диагноз эпителиоидной ММ может быть поставлен с уверенностью, потенциально без необходимости проведения дальнейших инвазивных биопсий с использованием метода визуализации или торакоскопических методов. Предыдущий аудит практики в нашем учреждении показал, что в среднем отчет цитологии был доступен за 29 дней до последующей тканевой диагностики случаев ММ (Segal et al, 2013).Таким образом, цитологический анализ имеет очевидные преимущества для пациентов и медицинских ресурсов. Клиницисты могут надежно информировать пациентов о диагнозе и прогнозе, зная, что нет клинически значимой разницы между общей выживаемостью при использовании любого из диагностических методов.
Предыдущий аудит практики в нашем учреждении показал, что в среднем отчет цитологии был доступен за 29 дней до последующей тканевой диагностики случаев ММ (Segal et al, 2013).Таким образом, цитологический анализ имеет очевидные преимущества для пациентов и медицинских ресурсов. Клиницисты могут надежно информировать пациентов о диагнозе и прогнозе, зная, что нет клинически значимой разницы между общей выживаемостью при использовании любого из диагностических методов.
Цитология выпота является малоинвазивной и недорогой, что является еще одним важным фактором в этой популяции, учитывая ограниченную продолжительность жизни. Цитологический диагноз ММ должен соответствовать одному из следующих критериев: бесспорные злокачественные клетки по цитоморфологическим критериям, которые демонстрируют мезотелиальный фенотип, подтвержденный дополнительными исследованиями; или цитоморфологические признаки, которые не являются однозначно злокачественными, но с дополнительными методами, подтверждающими злокачественность и мезотелиальный фенотип (Hjerpe et al, 2015).Диагноз мезотелиомы в образцах выпота ставится с использованием комбинации морфологических признаков и иммуногистохимии. Основное изменение, произошедшее за последние 20 лет, — это наличие в настоящее время надежных иммуногистохимических мезотелиальных маркеров, таких как кальретинин, CK5 / 6, D240, мезотелин и WT1, а также более специфических железистых маркеров, например, TTF1 (легкое), PAX8 (гинекологический тракт, почки, щитовидная железа). Эти иммуногистохимические маркеры облегчили различие между аденокарциномой и мезотелиомой, и это привело к резкому сокращению использования ЭМ для подтверждения фенотипа опухоли, тогда как раньше ЭМ была рутинной частью диагностики, теперь она почти никогда не проводится.Дополнительные тесты для различения доброкачественных и злокачественных мезотелиальных клеток, включая иммуногистохимию BAP1 и FISH для p16 (CDKN2A), стали доступны совсем недавно; эти последние тесты не использовались широко во время текущего исследования (Hwang et al, 2016).
Поскольку эпителиоидный подтип ММ является наиболее распространенным, результаты настоящего исследования имеют важное значение для большинства случаев ММ. Важно отметить, что некоторые случаи эпителиоидной ММ не могут быть диагностированы с помощью цитологии и требуют биопсии ткани для диагностики, но также и то, что биопсия ткани сама по себе не всегда может точно определить подтип ММ (Bueno et al, 2004), поэтому обе группы в этом исследование может содержать несколько двухфазных случаев.
Рак — это заболевание, подлежащее регистрации в штате Вашингтон, что подтверждает, что смещение выборки маловероятно, поскольку уведомляются все случаи рака со всего штата. Все диагнозы ММ были подтверждены экспертом-патологом с целью дальнейшего изучения случая с целью дифференциации на подтипы ММ, если это необходимо. Когорта ММ с диагностированным только цитологическим исследованием была старше (средний возраст 67,6 против 70,2 года), что, вероятно, отражает различную клиническую практику для пожилого населения, отдавая предпочтение менее инвазивному подходу. Регрессия Кокса показала, что возраст, мужской пол и перитонеальная ММ имели статистически значимую связь с выживаемостью, но не было значимого эффекта от различных диагностических подходов.Среди заболевших преобладали мужчины, которые подвергались воздействию асбеста на работе, что характерно для этого заболевания во всем мире. Хотя почти четверть заболевших были бывшими рабочими или жителями Виттенума (с сильным воздействием исключительно крокидолита), нет никаких доказательств того, что воздействие различных типов волокон асбеста приводит к различным клиническим исходам (Franklin et al, 2016). Таким образом, эти данные могут быть обобщены на другие группы населения во всем мире, подвергающиеся воздействию асбеста.
При стратификации по десятилетию диагноза средняя выживаемость со временем увеличивалась с тенденцией к значимости (1970–1980 гг. 7.6 месяцев, IQR 2,9–18,9 по сравнению с 2000–2012 гг. 11,8 месяцев, IQR 6,0–20,3; P = 0,083; Фигура 2). Комбинированный системный пеметрексед / цисплатин — единственная терапия, которая, как было доказано, улучшает общую выживаемость при ММ, и она доступна в нашем учреждении с начала 2006 г. (Vogelzang et al, 2003). Следовательно, продемонстрированная тенденция к увеличению медианы выживаемости, вероятно, представляет собой систематическую ошибку заблаговременности из-за улучшения диагностических знаний, подходов и повышения осведомленности врачей о ММ, как описано ранее (Musk et al, 2011).Существует относительно немного исследований, изучающих чувствительность диагностики мезотелиомы с помощью цитологического исследования выпота. Исторически часто указывается чувствительность около 30% (Renshaw et al, 1997a), однако опытные лаборатории в районах с высокой заболеваемостью могут достичь чувствительности более 70% (Segal et al, 2013), а другие более поздние исследования документально подтверждают чувствительность 50–60% (Rakha et al, 2010; Pinelli et al, 2012). Недавнее добавление новых иммуногистохимических красителей (BAP1) и исследований FISH (CDKN2A / p16) дает большие надежды на повышение чувствительности диагностики мезотелиомы в образцах выпота во всех лабораториях (Walts et al, 2016).
11,8 месяцев, IQR 6,0–20,3; P = 0,083; Фигура 2). Комбинированный системный пеметрексед / цисплатин — единственная терапия, которая, как было доказано, улучшает общую выживаемость при ММ, и она доступна в нашем учреждении с начала 2006 г. (Vogelzang et al, 2003). Следовательно, продемонстрированная тенденция к увеличению медианы выживаемости, вероятно, представляет собой систематическую ошибку заблаговременности из-за улучшения диагностических знаний, подходов и повышения осведомленности врачей о ММ, как описано ранее (Musk et al, 2011).Существует относительно немного исследований, изучающих чувствительность диагностики мезотелиомы с помощью цитологического исследования выпота. Исторически часто указывается чувствительность около 30% (Renshaw et al, 1997a), однако опытные лаборатории в районах с высокой заболеваемостью могут достичь чувствительности более 70% (Segal et al, 2013), а другие более поздние исследования документально подтверждают чувствительность 50–60% (Rakha et al, 2010; Pinelli et al, 2012). Недавнее добавление новых иммуногистохимических красителей (BAP1) и исследований FISH (CDKN2A / p16) дает большие надежды на повышение чувствительности диагностики мезотелиомы в образцах выпота во всех лабораториях (Walts et al, 2016).
Есть ряд потенциальных ограничений этого исследования, которые следует учитывать при интерпретации данных. Возможно, что в штате недостаточно представлены все истинные случаи ММ из-за пропущенного диагноза или неправильной классификации как вторичный рак плевры; однако маловероятно, что это пропорционально отражает многие случаи. Поскольку группа цитологического исследования была старше на момент постановки диагноза, возможно, они были более нездоровы и не могли пройти более инвазивные методы диагностики.Также вероятно, что некоторые цитологически диагностированные случаи эпителиоидной ММ были на самом деле двухфазными, однако это в равной степени верно и для образцов гистологической биопсии (Bueno et al, 2004). Из-за дизайна этого исследования нет возможности оценить точность, чувствительность или специфичность любого из средств диагностического подхода; в WAMR нет записи о том, изменился ли подтип случая после экспертной оценки или подтверждения при вскрытии.
Это исследование не демонстрирует, что эпителиоидный ММ, диагностированный только цитологически, биологически совпадает с гистологически диагностированным эпителиоидным ММ.Однако это демонстрирует отсутствие разницы в клинически значимых результатах для пациентов, использующих эти два разных диагностических метода. Хотя нет данных по лечению или стадированию заболевания, эти параметры вряд ли будут сильно влиять на результаты, помимо типа клеток, который широко признан одной из наиболее влиятельных переменных. В настоящее время нет доказательств того, что будет какая-либо разница в ответе на химиотерапию между этими группами.Признано, что в эпоху персонализированной медицины с генетическим или иммунологическим тестированием образцов опухоли бывают случаи, когда может потребоваться более крупный образец (биопсийного) материала. Точно так же, если пациент рассматривается для исследования хирургических подходов, существует также признанная необходимость в множественных биопсиях как гемиторака, так и средостения (Alvarez et al, 2009). Когда диагноз мезотелиомы ставится на основе образца выпота, это почти всегда высококлеточный образец; в случаях, когда значительное количество клеток не попадает в жидкость, обычно требуется биопсия для диагностики.В этих образцах клеточной жидкости собираются клетки, отколовшиеся от больших участков плевры, а не очень ограниченный отбор образцов тонкой сердцевины (с визуализацией) или небольших биоптатов, полученных при плевроскопии. Таким образом, количество клеток, имеющихся в клеточных блоках, приготовленных из образцов жидкости, обычно намного больше, чем в биопсийном материале.
В этой большой когорте это исследование демонстрирует, что характеристики выживаемости только цитологических и гистологически диагностированных эпителиоидных ММ не различаются.В опытной лаборатории цитологический диагноз эпителиоидной ММ является клинически приемлемым и не связан с клинически значимым другим исходом по сравнению с гистологически диагностированными случаями. Следовательно, диагноз ММ цитологическим исследованием выпота может быть достаточным для клинического ведения без необходимости дальнейшего инвазивного тестирования.
Следовательно, диагноз ММ цитологическим исследованием выпота может быть достаточным для клинического ведения без необходимости дальнейшего инвазивного тестирования.
Типы цитологических тестов, используемых для выявления рака
Диагностика заболеваний по отдельным клеткам и небольшим кластерам клеток называется цитология или цитопатология .Это важная часть диагностики некоторых видов рака.
По сравнению с биопсией ткани, цитологический образец обычно:
- Проще получить
- Доставляет меньше дискомфорта пациенту
- Меньше вероятность серьезных осложнений
- Стоимость меньше
Недостатком является то, что в некоторых случаях результат биопсии ткани более точен, но во многих случаях цитологический раствор может быть таким же точным.
Цитологические тесты могут быть использованы для диагностики или скрининга:
- Диагностический тест используется только для людей, у которых есть признаки, симптомы или другие причины подозревать, что у них может быть определенное заболевание (например, рак).Диагностический тест определяет наличие болезни и, если да, то точно и точно классифицирует болезнь.
- Скрининговый тест используется для выявления людей, у которых может быть определенное заболевание, еще до того, как у них появятся симптомы. Ожидается, что скрининговый тест найдет почти всех людей, которые могут болеть этим заболеванием, но скрининговый тест не всегда доказывает наличие болезни.
Часто диагностический тест используется, если результат скринингового теста положительный (т. Е. Если в скрининговом тесте что-то обнаружено).Некоторые цитологические тесты, такие как Пап-тест, в основном используются для скрининга, в то время как другие могут точно идентифицировать рак (см. «Цитология соскоба или щетки» ниже). Когда результаты цитологического исследования показывают рак, часто перед началом лечения также делают биопсию, чтобы убедиться в этом.
Аспирация тонкой иглой
Тонкоигольная аспирация (FNA) иногда считается цитологическим тестом, а иногда — биопсией. Это обсуждается в разделе «Типы биопсии, используемые для выявления рака».
Цитологические тесты биологических жидкостей
Жидкости, взятые из полостей (пространств) в организме, можно тестировать на наличие раковых клеток.Некоторые из жидкостей полости тела, протестированных таким образом, включают:
- Моча
- Мокрота (мокрота)
- Спинномозговая жидкость, также известная как спинномозговая жидкость или CSF (из пространства, окружающего головной и спинной мозг)
- Плевральная жидкость (из пространства вокруг легких)
- Перикардиальная жидкость (из мешочка, окружающего сердце)
- Асцитная жидкость, также называемая асцит или перитонеальная жидкость (из брюшной полости)
Цитология соскоба или кисточки
Другой метод цитологии состоит в том, чтобы аккуратно соскоблить или очистить некоторые клетки исследуемого органа или ткани.Самым известным цитологическим тестом, который позволяет брать образцы клеток таким образом, является Пап-тест. Небольшой шпатель и / или щеточка используются для удаления клеток из шейки матки (нижняя часть матки или матки) для мазка Папаниколау. Другие области, которые можно чистить щеткой или царапать, включают пищевод (трубку для глотания), желудок, бронхи (дыхательные трубки, ведущие в легкие) и рот.
Рынок гистологии и цитологии к 2026 году достигнет 30 543,4 миллиона долларов США
Нью-Йорк, 14 ноября 2019 г. (GLOBE NEWSWIRE) — Растущая распространенность рака, растущая стандартизация патологических лабораторий, технологические достижения в диагностических и молекулярных методах гистологии и цитологических процедур, а также благоприятная компенсация за скрининг рака и лабораторные тесты. основные факторы, способствующие высокому среднегодовым темпам роста рынка гистологии и цитологии в течение прогнозируемого периода.
Согласно недавнему анализу отчетов и данных, мировой рынок гистологии и цитологии был оценен в 11 057,7 млн долларов США в 2018 году и, как ожидается, достигнет 30 543,4 млн долларов США к 2026 году, демонстрируя среднегодовой темп роста 13,6%. Процедуры гистологии и цитологии связаны с диагностикой заболеваний и других состояний. Гистология — это исследование тканей человека, которое включает в себя структуру и функцию, тогда как цитология — это исследование человеческих клеток. Рынок гистологии и цитологии пережил огромный рост в отношении отраслей здравоохранения, поскольку с помощью этих клинических исследований можно диагностировать несколько смертельных заболеваний.
В настоящее время использование молекулярных методов является широко распространенным методом в гистологии и цитологии как средство морфологии для диагностики и прогнозирования. Более того, изучение маркеров терапевтического ответа оказалось полезным при некоторых типах новообразований для диагностики рака. Использование цитологического материала для проведения молекулярных исследований дает множество преимуществ: простота получения свежего образца, возможность проверки качества образца сразу после отбора и лучшая сохранность ДНК и РНК.
Запросите бесплатный образец этого отчета об исследовании по телефону: https://www.reportsanddata.com/sample-enquiry-form/2194
Возможность использования геномных и протеомных исследований в небольших количествах полученных образцов с помощью тонкоигольной аспирации (ENA) можно свести к минимуму инвазивные процедуры и обеспечить мониторинг рака, тем самым увеличивая потребность в гистологических и цитологических процедурах. ПЦР, микрочипы, протеомные и другие методы секвенирования в настоящее время проверяются на цитологических образцах.Правильная обработка образцов имеет первостепенное значение для сохранения морфологии и целостности нуклеиновых кислот. При сборе и отборе клеток роль цитопатолога обязательна. Гистопатологическая оценка в основном сравнивает больные или экспериментально измененные ткани с подходящим образцом от здоровых или контрольных аналогов. Поэтому очень важно строго стандартизировать каждый гистологический процесс (т. Е. Отбор образцов, обрезку, заливку, срезы и окрашивание). Цитология позволяет идентифицировать злокачественные новообразования по небольшому количеству клеток.
При сборе и отборе клеток роль цитопатолога обязательна. Гистопатологическая оценка в основном сравнивает больные или экспериментально измененные ткани с подходящим образцом от здоровых или контрольных аналогов. Поэтому очень важно строго стандартизировать каждый гистологический процесс (т. Е. Отбор образцов, обрезку, заливку, срезы и окрашивание). Цитология позволяет идентифицировать злокачественные новообразования по небольшому количеству клеток.
Мазки по Папаниколау шейки матки являются наиболее широко распространенным примером такого рода исследований и значительно снизили заболеваемость раком шейки матки. Цитология предоставляет пациентам минимальные или неинвазивные средства получения образцов и позволяет анализировать такие образцы, как отслоившиеся клетки в мокроте и моче, а также жидкости плевры, перикарда и кисты. Аспирация тонкой иглой позволяет получить образцы клеток из небольших очагов поражения и под визуальным контролем из недоступных участков, таких как легкое, головка поджелудочной железы и парааортальные лимфатические узлы.Образцы часто бывают очень маленькими, и для получения максимальной полезности процесс должен выполняться обученными специалистами и с использованием надлежащего и высококачественного цитологического и гистологического оборудования. Растущая осведомленность о скрининге рака и технологических достижениях в исследованиях клеток и тканей, вероятно, увеличит спрос в течение прогнозируемого периода.
Увеличение числа хорошо оборудованных клинических лабораторий в развивающихся странах и благоприятная компенсация за скрининг рака и лабораторные тесты, вероятно, будут стимулировать рост рынка.Достижения в области цитологии и гистологии экономят время патологов, делая услуги более рентабельными. Низкая стоимость, высокая чувствительность и адекватная специфичность, связанные с процедурой цитологического исследования, будут способствовать дальнейшему росту рынка гистологии и цитологии. Эффективное тестирование образцов может привести к экономии средств и более быстрым результатам для пациентов, а также к повышению осведомленности людей о своем здоровье. Жесткое регулирование — один из ключевых факторов, сдерживающих рост рынка гистологии и цитологии.
Жесткое регулирование — один из ключевых факторов, сдерживающих рост рынка гистологии и цитологии.
Использование гистологии и цитологии в диагностике инфекционных заболеваний хорошо зарекомендовало себя. Микроскопическая идентификация вируса или бактерий по их морфологическим признакам при окрашивании продолжает оставаться общепринятым методом диагностической гистологии; но недавние разработки в области иммуногистохимии и молекулярной диагностики определенно будут более быстрыми и специфичными. Однако рутинная гистологическая идентификация патогенов не может заменить традиционные методы микробиологического культивирования.
Для успешной характеристики патологии инфекционного заболевания требуется надлежащая характеристика воспалительной реакции, знание ассоциированных патогенов, использование специальных красителей на основе гистологии и цитологии и, в некоторых случаях, использование высокоспецифичных молекулярных технологий. Если микробиологи, патологи, клиницисты и производители оборудования работают вместе, своевременная и зачастую правильная диагностика многих трудно диагностируемых заболеваний может быть выполнена эффективно. Перед культивированием все биопсии должны быть исследованы на наличие патогена или признаков, вызывающих инфекцию.Важная информация часто упускается, если не проводится тщательная микроскопическая визуализация образца ткани, поэтому существует острая необходимость в эффективных методах гистологии и цитологии для диагностики хронических заболеваний.
Дальнейшие ключевые выводы из отчета показывают, что
- Рынок гистологии и цитологии испытал огромный рост в отрасли здравоохранения, поскольку с помощью этих клинических исследований можно диагностировать несколько смертельных заболеваний.
- Компания Рош выпустила сканер слайдов VENTANA DP 200 который представляет собой высокоскоростной сканер слайдов для цифровой патологии в марте 2018 года.
 Это уменьшает количество ошибок рабочего процесса и улучшает качество изображения. Ожидается, что запуск таких продуктов будет стимулировать рынок гистологии и цитологии.
Это уменьшает количество ошибок рабочего процесса и улучшает качество изображения. Ожидается, что запуск таких продуктов будет стимулировать рынок гистологии и цитологии. - Цитологические исследования, связанные с большой распространенностью заболевания и принятием теста для скрининга шейки матки. Сегмент может сохранить свои лидирующие позиции в течение прогнозируемого периода благодаря недавнему введению различных тестов и преимуществ перед гистологией, таких как более быстрый анализ и экономическая эффективность.
- Подсегмент проточной цитометрии, как ожидалось, покажет максимальный CAGR в течение прогнозируемого периода в пределах тест-тип сегментации гистологии и цитологии.Этот сегмент используется для обнаружения и измерения характеристик клеток, которые в основном используются в лабораториях, которые способствуют росту рынка этого сегмента продукта.
- Рынок гистологии и цитологии окажется в значительной степени выгодным для Азиатско-Тихоокеанского региона. В течение прогнозируемого периода CAGR был самым высоким среди всех регионов. Основным фактором, способствующим росту этого рынка, является огромная плотность населения в таких странах, как Индия и Китай, и повышение осведомленности об этих тестах
- В сентябре 2018 года Phillips запустила программное обеспечение для вычислительной патологии. , Tissue Mark, для автоматического обнаружения опухолей яичников и простаты, который предоставляет врачам и лаборантам эффективный инструмент для гистологической и цитологической диагностики.
- Некоторые из ключевых игроков на рынке гистологии и цитологии — Abbott Laboratories; Бектон Дикинсон и компания; BrandTech Scientific, Hoffmann-La Roche Ltd.; Hologic, Inc .; Корпорация Life Technologies; Sysmex Corporation; Thermo Fisher Scientific, Inc.; Southwest Precision Instruments и Trivitron Healthcare
Чтобы определить ключевые тенденции в отрасли, щелкните ссылку ниже: https://www.reportsanddata. com/report-detail/histology-and-cytology-market
com/report-detail/histology-and-cytology-market
Сегментов, охваченных в отчете:
Для этого отчета отчеты и данные сегментировали рынок гистологии и цитологии на основе типа, типа заболевания, типа лечения, типа теста, конечного использования и региона:
Тип Исследование на рынке гистологии и цитологии (выручка, млн долларов США; 2016–2026)
- Цитология
- Рак шейки матки
- Рак молочной железы
- Другие виды рака
- Гистология
Тип теста на рынке гистологии и цитологии ( Выручка, млн долларов США; 2016–2026)
- Методы микроскопии
- Цитохимия и гистохимия
- Иммуногисток гемология и иммунофлуоресценция
- Проточная цитометрия
- Молекулярно-генетические методы
- Цитогенные тесты
- кариотипирование
- флуоресцентная гибридизация in situ (FISH)
- Полимеразная цепная реакция
- Другое
- Цитогенные тесты
- Больницы / клиники
- Биофармацевтические компании
- Academia
- Другие конечные пользователи
Заказать сейчас: https: // www.reportsanddata.com/checkout-form/2194
Региональный прогноз (доход в миллионах долларов США; 2016–2026)
- Северная Америка
- Европа
- Азиатско-Тихоокеанский регион
- Латинская Америка
- Ближний Восток и Африка
Просмотрите другие похожие отчеты в категории Диагностика по отчетам и данным
Photomedicine Market — https://www. reportsanddata.com/report-detail/photomedicine-market
reportsanddata.com/report-detail/photomedicine-market
In-Vitro Diagnostics (IVD) Рынок контроля качества — https: // www.reportsanddata.com/report-detail/in-vitro-diagnostics-ivd-quality-control-market
Рынок диагностики Point of Care (PoC) — https://www.reportsanddata.com/report-detail/ point-of-care-poc-diagnostics-market
Об отчетах и данных
Reports and Data — это маркетинговая и консалтинговая компания, которая предоставляет синдицированные отчеты об исследованиях, индивидуальные отчеты об исследованиях и консалтинговые услуги. Наши решения ориентированы исключительно на вашу цель — определять, определять и анализировать изменения в поведении потребителей по демографическим характеристикам и отраслям, а также помогать клиентам принимать более разумные бизнес-решения.Мы предлагаем исследования рынка, обеспечивающие актуальные и основанные на фактах исследования в различных отраслях, включая здравоохранение, технологии, химическую промышленность, энергетику и энергетику. Мы постоянно обновляем наши предложения по исследованиям, чтобы наши клиенты были в курсе последних тенденций, существующих на рынке. В отчетах и данных собрана сильная база опытных аналитиков из различных областей знаний.
Как использовать правила кодирования гистологии
Мы рассмотрели большую часть содержания информации о правилах кодирования гистологии 2007 г. ранее в этом учебном модуле.Ознакомиться с этими руководящими принципами в том виде, в каком они напечатаны в Общих инструкциях MPH 2007 года.
Сейчас:
- Вы ознакомились с Общими инструкциями MPH.
- Вы определили, что является основным сайтом, и просмотрели Эквивалентные термины и определения для этого сайта или основной системы. Определения могут дать вам важную информацию о конкретных типах клеток или взаимосвязях между различными гистологиями.

- Вы использовали модули правил Multiple Primaries для этого сайта, чтобы определить, сколько рефератов нужно подготовить.
- Вы готовы присвоить гистологический код первому реферату. (Позже вы повторите этот процесс, чтобы присвоить гистологический код последующим выпискам для случая.)
Где получить информацию о гистологии
В Общих инструкциях в конце правил гистологического кодирования есть примечание, которое определяет порядок приоритета для документов, которые могут содержать гистологический диагноз.
Лучшими документами для получения гистологической информации являются отчет о патологии, цитологический отчет и другая клиническая документация в медицинской карте в указанном порядке.
Отчет о патологии
Отчет о патологии — самый важный документ, к которому у вас есть доступ. Следует запомнить два важных понятия:
- Возьмите гистологическую информацию о наиболее репрезентативном исследованном образце опухоли. Определение «наиболее репрезентативный образец» — это патологический образец хирургической процедуры, в ходе которой было удалено наибольшее количество опухолевой ткани. Другими словами, если пациенту была сделана пункционная биопсия поражения молочной железы с последующей лампэктомией, лампэктомия будет иметь наиболее репрезентативный образец, поскольку она удаляла больше опухолевой ткани, чем пункционная биопсия.Напротив, если у пациента была лампэктомия с последующей мастэктомией, и мастэктомия показала только микроскопический остаток, лампэктомия была бы наиболее репрезентативной, потому что, опять же, она дала больше всего опухолевой ткани.
Обратите внимание, что это правило кодирования гистологии значительно отличается от правил лечения, которые говорят о кодировании наиболее обширной процедуры. Не путайте и не смешивайте правила кодирования нескольких основных цветов и гистологии с правилами кодирования других частей реферата.
- Взять гистологическую информацию из окончательного диагноза и связанных приложений и комментариев.
 Это новое правило является большим изменением для опытных регистраторов, которым в прошлом предлагалось кодировать наиболее конкретную гистологию и внимательно читать микроскопическое описание (если оно доступно), чтобы собрать лакомые кусочки данных, которые можно было бы использовать для правильного присвоения гистологического кода. или неправильно.
Это новое правило является большим изменением для опытных регистраторов, которым в прошлом предлагалось кодировать наиболее конкретную гистологию и внимательно читать микроскопическое описание (если оно доступно), чтобы собрать лакомые кусочки данных, которые можно было бы использовать для правильного присвоения гистологического кода. или неправильно.
Причина этого нового правила заключается в том, что в процессе разработки правил патологи из целевой группы заявили, что, документируя микроскопическое описание, они говорят о том, что они видят от слайда к слайду.Когда они просмотрели все слайды, они собрали собранную информацию и использовали свои знания и опыт, чтобы поставить окончательный диагноз. Их комментарий заключался в том, что в микроскопическом описании может быть более конкретный диагноз, но это могла быть небольшая часть образца, видимая только на одном слайде. Из-за этого они решили не включать его в окончательный диагноз, потому что он не был репрезентативным для всего образца; они никогда бы не поставили окончательный диагноз на такой маленькой территории.
Обычно гистологический диагноз является окончательным диагнозом, как написано. Есть несколько исключений:
- В некоторых случаях в окончательном диагнозе может быть указано «см. Комментарий», и в этом случае информация в комментарии или примечании может использоваться для кодирования гистологии.
- Дополнения к окончательному диагнозу, такие как дополнительная информация из отсроченного лабораторного отчета, также могут использоваться для кодирования гистологии.
- Пересмотренный или измененный диагноз заменяет исходный окончательный диагноз, а гистология должна быть закодирована на основе пересмотренного или измененного диагноза.Пересмотренный или измененный диагноз обычно ставится патологоанатомом, который первоначально выписал случай. Если есть заключение патологоанатома, в котором содержится другой диагноз, но первоначальный патолог не исправляет и не пересматривает свой окончательный диагноз, следует закодировать исходный окончательный диагноз.

- Будет несколько случаев, когда информация из микроскопического описания может быть использована для определения гистологического кода. Такие случаи будут четко указаны в правилах для конкретных сайтов.Например, для толстой кишки важно знать, что рак развился из уже существующего полипа. Информация о полипе может отсутствовать в окончательном диагнозе, но может быть представлена в виде макроскопического или микроскопического описания.
Прочие документы
- Вторым по важности медицинским документом для кодирования гистологии является отчет цитологического исследования. Если отчета о патологии нет, введите код из отчета цитологического исследования. Цитология во многих случаях менее специфична, чем патология, потому что цитолог смотрит на отдельные клетки, а не на массу опухоли, но, тем не менее, это надежный источник гистологической информации.
- Если нет ни отчета о патологии, ни отчета цитологии, введите код из медицинской документации, который ссылается либо на патологию, либо на цитологию. Другими словами, если вы видите запись в медицинской карте, в которой говорится, что пациенту была сделана биопсия в офисе до поступления и что биопсия показала аденокарциному, врач ссылается на патологию.
- Самый низкий приоритет — это упоминание в медицинской карте вида рака. Например, это может быть анамнез и физикальное обследование, где есть сведения о том, что у пациента имеется аденокарцинома левого легкого.В медицинской карте упоминается тип или гистология рака, но не указывается конкретная ссылка на отчет о патологии или цитологический отчет.
Модули кодирования гистологии
Помня об этих общих правилах о том, где получить гистологическую информацию в медицинской карте, перейдите к разделу «Правила кодирования гистологии» в правильном наборе правил для сайта, который вы рефератируете. Вы заметите, что, подобно модулям в разделе «Правила множественных первичных», есть два отдельных модуля правил кодирования гистологии (за исключением меланомы кожи).
- Одиночная опухоль (один первичный очаг)
- Множественные опухоли выделены как единый первичный сайт
Каждый модуль представляет собой независимый полный набор правил. Правила пронумерованы последовательно, чтобы избежать путаницы, но каждый модуль стоит отдельно.
- Модуль «Одна опухоль» используется, когда у вас есть одно поражение, гистологию которого необходимо закодировать. Единственная опухоль может перекрывать смежные участки, или она может иметь смесь типов клеток, или это может быть смесь инвазивного рака и рака in situ.Все эти вопросы решаются в приоритетах модуля правил «единой опухоли».
- Модуль «Множественные опухоли, абстрагированные как одна первичная» используется, когда правила множественных первичных указали, что множественные опухоли рассматривались как единое целое и должен быть подготовлен только один реферат. (Если в правилах нескольких основных вариантов указано, что вы должны подготовить более одного реферата для случая, с этого момента работайте только с одним рефератом за раз.) Например, правила нескольких основных вариантов говорят, что пациент с множественными злокачественными полипами и В анамнезе семейный полипоз кишечной палочки (наследственное заболевание) является единичным первичным.Чтобы определить гистологический код для этого случая, используйте модуль «Множественные опухоли, выделенные как одна первичная».
Правила кодирования приоритета гистологии
- Как только вы войдете в соответствующий модуль, начните чтение с первого правила в этом модуле.
- Продолжайте читать, пока не найдете правило, применимое к вашему случаю.
- Используйте первое применимое правило и остановитесь. Не пропускайте остальные правила, чтобы узнать, применимо ли другое правило.
Почти всегда первые два правила кодирования гистологии одинаковы в каждом модуле. Правило h2 в модуле «Одна опухоль» и соответствующее первое правило в модуле «Множественные опухоли» подтверждают приоритет гистологической информации, когда нет патологии или цитологического образца (без резекции или биопсии) или когда нет отчета о патологии или цитологии. доступны (биопсия или резекция, выполненные в другом месте): укажите гистологию, задокументированную врачом. Документация может быть в медицинской карте в виде заявления, относящегося к патологическим или цитологическим находкам, в качестве ссылки врача на конкретный тип рака или даже в отчете о КТ, МРТ или ПЭТ.Если в любом из этих источников упоминается конкретная гистология, закодируйте ее так. Если не задокументировано ничего более специфичного, чем «рак» или «карцинома», введите код 8000 Злокачественное новообразование, БДУ или 8010 Карцинома, БДУ, в зависимости от ситуации.
доступны (биопсия или резекция, выполненные в другом месте): укажите гистологию, задокументированную врачом. Документация может быть в медицинской карте в виде заявления, относящегося к патологическим или цитологическим находкам, в качестве ссылки врача на конкретный тип рака или даже в отчете о КТ, МРТ или ПЭТ.Если в любом из этих источников упоминается конкретная гистология, закодируйте ее так. Если не задокументировано ничего более специфичного, чем «рак» или «карцинома», введите код 8000 Злокачественное новообразование, БДУ или 8010 Карцинома, БДУ, в зависимости от ситуации.
Правило h3 в модуле «Одна опухоль» и соответствующее второе правило в модуле «Множественные опухоли» устанавливают, что допустимо кодировать гистологию из метастатического участка, когда нет патологии или цитологического образца из первичного участка.
Однако почти во всех случаях будет микроскопическое подтверждение опухоли в виде ткани (патология) или жидкостей и клеток (цитология).Реально зависящие от сайта приоритеты имеют приоритет после первых двух базовых правил.
Теория, стоящая за приоритетом правил гистологического кодирования, заключается в том, чтобы в первую очередь иметь дело с наиболее распространенными ситуациями. По мере того как правила идут дальше по списку, они применяются к все меньшему количеству случаев. Например, при раке головы и шеи во многих случаях идентифицируется только одна гистология (плоскоклеточная карцинома), независимо от того, охватывает ли реферат одну опухоль или несколько опухолей, выделенных как одну первичную.В таком случае вам нужно только прочитать пару правил, прежде чем вы найдете подходящее («Закодируйте гистологию, когда идентифицирован только один гистологический тип»), и все готово. Если идентифицировано более одного гистологического типа, последующие правила говорят, какой код использовать, когда присутствует как инвазивный, так и in situ рак, когда одна опухоль более инвазивна, чем другая, когда один из типов является более конкретным термином, чем другой, и и так далее в порядке убывания приоритета.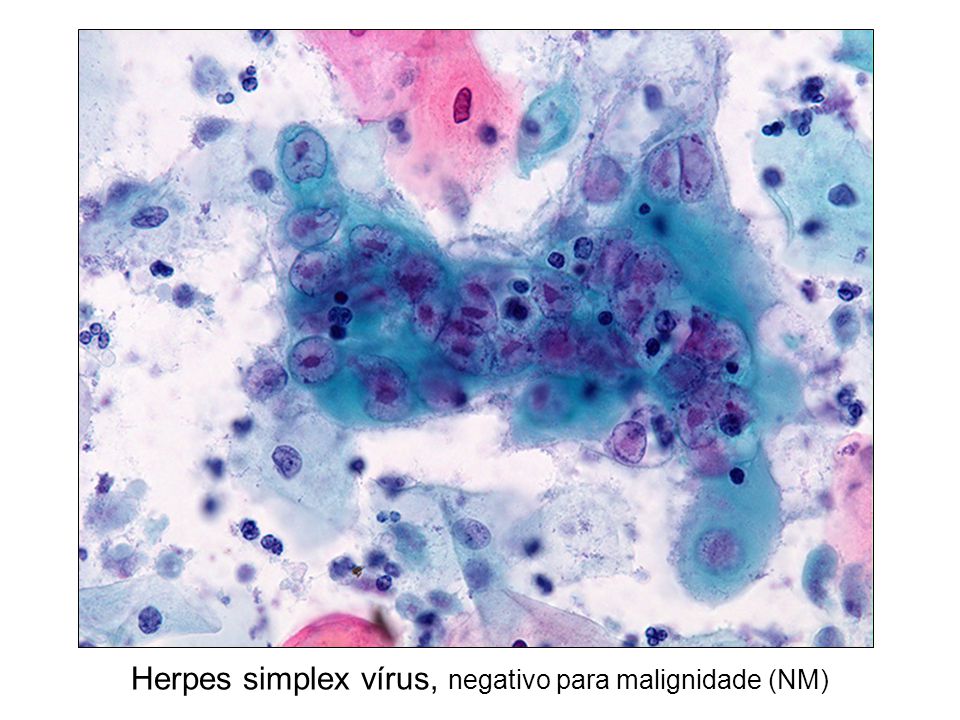
В общем, правил гистологического кодирования намного больше, чем правил множественных основных, потому что для большинства сайтов существует широкий диапазон гистологических кодов на выбор.Многие правила относятся к одному или нескольким конкретным гистологическим кодам. Эти конкретные гистологические коды расположены в соответствии с типами клеток, которые являются наиболее важными с точки зрения прогноза. Например, при карциноме молочной железы in situ неинфильтрирующая комедокарцинома имеет худший прогноз, чем другие типы карциномы in situ, поэтому одним из наиболее приоритетных правил является кодирование случая со смесью внутрипротоковой карциномы и неинфильтрирующей комедокарциномы до 8501. / 2 Неинфильтрирующая комедокарцинома. Таким образом, гистологический код реферата может частично отражать прогноз пациента.
В других наборах правил есть конкретные инструкции, когда и когда не использовать определенные гистологические коды. У патологов есть особые критерии для определения муцинозной опухоли или аденокарциномы из перстневых клеток толстой кишки, аденокарциномы в сравнении с крупноклеточной карциномой в легких или регрессирующей меланомы кожи. Аденокарцинома кишечного типа — это диагноз, который не следует использовать при раке толстой кишки. Правила MPH 2007 года были тщательно разработаны и протестированы, чтобы дать должный приоритет многим гистологиям, которые могут развиваться на данном первичном участке.
В каждом модуле правил кодирования гистологии самое последнее правило «Закодируйте гистологию с более высоким числовым кодом МКБ-О-3» предназначено для охвата любой ситуации, не описанной в правилах с более высоким приоритетом. Это последнее универсальное правило будет применяться очень редко; это также правило «последней инстанции» в МКБ-О-3.
Корреляция между цитологией тонкоигольной аспирации и гистологией пальпируемых образований молочной железы в нигерийском третичном учреждении здравоохранения
Предпосылки . В условиях нехватки ресурсов лечение уплотнений в груди может оказаться сложной задачей. Тонкоигольная аспирационная цитология (FNAC), особенно при использовании с клеточным блоком, может помочь улучшить доступность для пациентов. Цель . Определить диагностическую точность FNAC пальпируемых поражений груди в течение 5 лет. Методы . Полученные с помощью FNAC данные о пальпируемых уплотнениях молочной железы, которые наблюдались в клинике FNAC нашего отделения с января 2007 г. по декабрь 2011 г., были получены и сопоставлены с данными гистологии эксцизионных биопсий. Результатов . В общей сложности 1790 пациентов имели FNAC опухолей груди в течение 5-летнего периода; 436 из них впоследствии сделали биопсию. Наши результаты выгодно отличаются от показателей эффективности тестов Программы скрининга груди UK NHS, показанных в скобках: абсолютная чувствительность 95,4% (> 70%), полная чувствительность 99,2% (> 90%), полная специфичность 88,9% (> 65%). , прогностическая ценность положительного результата 99,6% (> 99%), частота ложноотрицательных результатов 0,8% (<4%), частота ложноположительных результатов 0,4% (<0,5%), неадекватная частота 3.2% (<15%) и подозрительный показатель 10,2% (<15%). Заключение . FNAC груди очень хорошо сопоставимы с гистологией эксцизионных биопсий и в опытных руках чрезвычайно полезны при лечении опухолей груди. Рекомендуются дальнейшие исследования для оценки диагностической точности FNAC и клеточных блоков в наших условиях.
В условиях нехватки ресурсов лечение уплотнений в груди может оказаться сложной задачей. Тонкоигольная аспирационная цитология (FNAC), особенно при использовании с клеточным блоком, может помочь улучшить доступность для пациентов. Цель . Определить диагностическую точность FNAC пальпируемых поражений груди в течение 5 лет. Методы . Полученные с помощью FNAC данные о пальпируемых уплотнениях молочной железы, которые наблюдались в клинике FNAC нашего отделения с января 2007 г. по декабрь 2011 г., были получены и сопоставлены с данными гистологии эксцизионных биопсий. Результатов . В общей сложности 1790 пациентов имели FNAC опухолей груди в течение 5-летнего периода; 436 из них впоследствии сделали биопсию. Наши результаты выгодно отличаются от показателей эффективности тестов Программы скрининга груди UK NHS, показанных в скобках: абсолютная чувствительность 95,4% (> 70%), полная чувствительность 99,2% (> 90%), полная специфичность 88,9% (> 65%). , прогностическая ценность положительного результата 99,6% (> 99%), частота ложноотрицательных результатов 0,8% (<4%), частота ложноположительных результатов 0,4% (<0,5%), неадекватная частота 3.2% (<15%) и подозрительный показатель 10,2% (<15%). Заключение . FNAC груди очень хорошо сопоставимы с гистологией эксцизионных биопсий и в опытных руках чрезвычайно полезны при лечении опухолей груди. Рекомендуются дальнейшие исследования для оценки диагностической точности FNAC и клеточных блоков в наших условиях.
1. Введение
Рак груди является наиболее распространенным злокачественным новообразованием у женщин во всем мире, и предоперационная оценка уплотнений груди является важной частью лечения поражений груди [1, 2].Использование стержневой игольной биопсии для лечения пальпируемых уплотнений груди в последнее время увеличивается [3, 4]. Это связано с тем, что биопсия стержневой иглой менее инвазивна, чем открытая биопсия, и были разработаны устройства для вакуумной биопсии для получения большего размера образца для анализа [4]. Однако биопсия стержневой иглы не лишена недостатков. К ним относятся высокая стоимость (по сравнению с FNAC), длительное время обработки ткани, дискомфорт пациента, такой как боль и гематома, и риск посева опухоли вдоль следа иглы [2, 5].Тройной тест, который включает в себя клиническую, радиологическую и патологическую оценку, тем не менее, остается отличным инструментом при оценке пальпируемых уплотнений в груди. Его диагностическая точность превышает 99% при согласовании всех трех модальностей [2, 6, 7].
Однако биопсия стержневой иглы не лишена недостатков. К ним относятся высокая стоимость (по сравнению с FNAC), длительное время обработки ткани, дискомфорт пациента, такой как боль и гематома, и риск посева опухоли вдоль следа иглы [2, 5].Тройной тест, который включает в себя клиническую, радиологическую и патологическую оценку, тем не менее, остается отличным инструментом при оценке пальпируемых уплотнений в груди. Его диагностическая точность превышает 99% при согласовании всех трех модальностей [2, 6, 7].
В настоящее время большинство стран приняло этот тройной подход к оценке (клинической, радиологической и патологической) для диагностики груди, при этом FNAC является патологическим исследованием первой линии как в скрининговых, так и в симптоматических популяциях, за исключением случаев, когда присутствуют микрокальцификации [8 ].Однако на практике существуют некоторые вариации. Когда все три оценки совпадают, окончательное лечение злокачественных новообразований (мастэктомия, химиотерапия и / или лучевая терапия) может продолжаться на основе FNAC без биопсии ткани; некоторые другие настаивают на биопсии стержневой иглы для всех поражений индекса [8]. В большинстве нигерийских больниц биопсию ткани запрашивают перед мастэктомией, даже если поражение является злокачественным на FNAC, что увеличивает потребность в скудных денежных ресурсах. В условиях ограниченных ресурсов, таких как наша, можно было бы перейти к мастэктомии без запроса биопсии ткани, особенно если FNAC сочетается с препаратами клеточного блока, чтобы еще больше повысить диагностическую точность и универсальность.Мазки и клеточные блоки могут быть проверены на ER и PR с помощью иммуноцитохимии, в то время как тестирование HER2 может быть выполнено только FISH, поскольку иммуноцитохимия HER2 ненадежна даже в лучших центрах.
FNAC, особенно в руках опытных цитопатологов, имеют высокую диагностическую точность, достигающую 98,9% в некоторых сериях [9, 10]. Диагностическая точность FNAC дополнительно повышается, когда подготовка клеточного блока приближается к 100% в конкретном исследовании [11], что делает FNAC наиболее надежным элементом тройного теста в случаях, когда три метода несовместимы [6].
Помимо высокой диагностической точности, FNAC предлагает такие преимущества, как минимальная инвазивность, минимальный дискомфорт, экономическая эффективность и быстрота результатов по сравнению с биопсией стержневой иглой [5, 12, 13]. Таким образом, FNAC является чрезвычайно важным инструментом при оценке пальпируемых уплотнений в груди в условиях ограниченных ресурсов.
Целью данного исследования является определение диагностической точности FNAC при оценке пальпируемых образований молочной железы при LUTH.
2. Материалы и методы
Записи результатов FNAC пальпируемых уплотнений груди, обнаруженных в клинике FNAC отделения анатомической и молекулярной патологии Учебной больницы Лагосского университета (LUTH) с 2007 по 2011 год, были взяты из базы данных.FNAC проводился для всех случаев с использованием иглы 23 G, прикрепленной к одноразовым пластиковым шприцам объемом 20 мл, размазанным по стандартным предметным стеклам микроскопа, зафиксированным спиртом и окрашенным гематоксилином и эозином (H&E), модифицированными красителями Гимза и Папаниколау (Пап). Об этих случаях сообщалось с использованием 5-уровневой системы: C1 — неадекватный; C2 — доброкачественный; C3 — подозрительный, вероятно доброкачественный; C4 — подозрительный, возможно злокачественный; и C5 при злокачественных поражениях груди.
Записи последующих эксцизионных биопсий или мастэктомий также были извлечены из базы данных патологий и сравнены с результатами цитологического исследования для корреляции (рис. 1).Статистические параметры обеспечения качества рассчитывались в соответствии с рекомендациями программы NHS Breast Screening Program (NHSBSP) [2].
Случаи с отсутствующими данными были исключены из исследования.
3. Результаты
FNAC запросили в общей сложности 1790 опухолей груди за период исследования. Из них 1301 были доброкачественными, 250 — злокачественными, 181 — сомнительными и 58 — неадекватными (рис. 2). В четырехстах тридцати шести (436) из 1790 случаев впоследствии была сделана биопсия, показатель биопсии — 24. 4% (рисунок 3).
4% (рисунок 3).
Корреляция цитологического и гистологического диагнозов показана в таблице 1. Более 90% случаев из FNAC (96,3%) были подтверждены гистологически как злокачественные, а 99,5% были подтверждены как доброкачественные. 82,8% подозрительных, но, возможно, доброкачественных на FNAC случаев были признаны доброкачественными при гистологическом исследовании, и 60% случаев с подозрением на злокачественные новообразования оказались злокачественными.
| ||||||||||||||||||||||||||||||||||||||||||||||||
Статистические данные по обеспечению качества были рассчитаны в соответствии с руководящими принципами и значениями UK NHSBSP приведены в таблице 2.Абсолютная чувствительность, количество карцином, диагностированных как таковые при цитологическом исследовании, выраженное в процентах от общего количества взятых образцов карцином, составила 95,4%. Полная чувствительность, которая представляет собой количество карцином, которые не были однозначно отрицательными или недостаточными по FNAC, выраженная в процентах от общего количества карцином, составила 99,2%. Полная специфичность, то есть количество правильно идентифицированных доброкачественных образований, выраженное в процентах от общего количества доброкачественных образований, составила 88,9%. Прогнозирующая ценность положительного результата, определяемая как количество правильно идентифицированных раковых заболеваний, выраженное в процентах от общего количества положительных результатов, составила 99.6%.
Полная чувствительность, которая представляет собой количество карцином, которые не были однозначно отрицательными или недостаточными по FNAC, выраженная в процентах от общего количества карцином, составила 99,2%. Полная специфичность, то есть количество правильно идентифицированных доброкачественных образований, выраженное в процентах от общего количества доброкачественных образований, составила 88,9%. Прогнозирующая ценность положительного результата, определяемая как количество правильно идентифицированных раковых заболеваний, выраженное в процентах от общего количества положительных результатов, составила 99.6%.
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Корреляции конкретных диагнозов, поставленных на цитологическом и гистологическом исследованиях, показаны в таблице 3. Из 8 случаев с подозрением на воспалительный процесс на FNAC, 4 были подтверждены гистологически как воспалительные, 1 был фиброаденома, другая — фиброзно-кистозные изменения, 1 — гидроцистома и 1 — инвазивная дольчатая карцинома. Один случай, подозреваемый в липоме при цитологическом исследовании, был подтвержден как липома при гистологическом исследовании. Другой случай, как выяснилось, состоял только из нормальной ткани груди.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4.
 Обсуждение
ОбсуждениеFNAC — полезный инструмент для предоперационной оценки уплотнений груди [2]. Точная предоперационная оценка важна, поскольку она позволяет быстро направить злокачественные больные на лечение и выписать доброкачественные больные из клиники и вернуть их к рутинному наблюдению [2]. FNAC также может использоваться для наблюдения за этими доброкачественными случаями, если не указано иное. FNAC точен, дешев, прост в выполнении и менее инвазивен, чем биопсия стержневой иглой [5].
Статистика обеспечения качества, рассчитанная для этого исследования (таблица 2), выгодно отличается от пороговых значений эффективности NHSBSP Великобритании и демонстрирует высокую точность FNAC при оценке уплотнений в груди.Исследования других нигерийских центров также подтверждают этот вывод. В исследовании, проведенном в клинической больнице университета Амину Кано (AKTH), абсолютная чувствительность составила 81%, специфичность — 99%, а прогностическая ценность положительного результата — 97,7% [14]. Другое исследование, проведенное в Бенине, показало абсолютную чувствительность 84,6%, полную чувствительность 97,4%, полную специфичность 64% и положительную прогностическую ценность 100% [15]. Эти исследования показывают адекватность FNAC при оценке пальпируемых уплотнений в груди в условиях ограниченных ресурсов.
Наше исследование показало низкую частоту получения образцов, не отвечающих требованиям NHSBSP. Это связано с тем, что патологоанатомы оценивают образцы тонкоигольной аспирации на месте с использованием метода быстрого окрашивания (модифицированный метод Гимзы). Оценка аспиратов на месте оказалась точной и рентабельной [13]. Это также снижает вероятность повторного вызова FNAC и, следовательно, уменьшает задержку в получении результатов [2].
Известно, что отсутствие поражения при взятии пробы во время аспирации является наиболее частой причиной ложноотрицательного цитологического диагноза [2].Некоторые карциномы, в том числе дольчатая карцинома (ответственный за один из ложноотрицательных результатов в этом исследовании, таблица 3), могут давать такой результат [2]. Действительно, FNAC инвазивной лобулярной карциномы ассоциируется с заведомо высоким уровнем ложноотрицательных и сомнительных диагнозов [16]. Это связано с тем, что классическая инвазивная дольчатая карцинома с большей вероятностью дает малоклеточный мазок с тонкой атипией и редкими единичными интактными эпителиальными клетками [16].
Действительно, FNAC инвазивной лобулярной карциномы ассоциируется с заведомо высоким уровнем ложноотрицательных и сомнительных диагнозов [16]. Это связано с тем, что классическая инвазивная дольчатая карцинома с большей вероятностью дает малоклеточный мазок с тонкой атипией и редкими единичными интактными эпителиальными клетками [16].
Ложноположительным случаем в этом исследовании была фиброаденома с очагами пролиферативных изменений.Фиброаденомы являются наиболее частой причиной ложноположительного диагноза при FNAC. Это связано с частым присутствием случайных изолированных интактных клеток с диссоциацией, эпителиальной ядерной атипией и высокой клеточностью [17]. Дополнительными ловушками являются апокринная метаплазия, многоядерность и малоклеточность гиалинизированных фиброаденом [17].
В этом исследовании 181 из 1790 случаев FNAC были сомнительными, что составляет 10,1% подозрительных случаев. Хотя это значение находится в пределах предпочтительных пороговых значений производительности, это число может быть дополнительно уменьшено за счет использования препаратов клеточного блока, которые в этих случаях не проводились.Было показано, что клеточные блоки, приготовленные из остаточной тканевой жидкости, помогают в дальнейшем установлении более окончательного цитопатологического диагноза [18]. В одном исследовании было подтверждено, что 3 случая с подозрением на злокачественные новообразования на FNAC были инвазивной карциномой протоков с клеточным блоком [19]. Другие ограничения FNAC молочной железы, которые можно легко преодолеть с помощью клеточных блоков, — это сложность демонстрации инвазии и классификации пролиферативных поражений [20]. Тестирование рецепторов ER и PR может быть надежно выполнено как на мазках, так и на клеточных блоках, полученных из FNA, с использованием иммуноцитохимии [8].Результаты выражаются как процент опухолевых клеток, показывающих ядерное окрашивание, в то время как HER2 может быть надежно протестирован только с использованием флуоресцентной гибридизации in situ (FISH).
5. Заключение
FNAC груди очень хорошо сравниваются с гистологией эксцизионных биопсий, и в опытных руках они чрезвычайно полезны при оценке уплотнений груди. Дальнейшие исследования по оценке диагностической точности препаратов FNAC и клеточного блока в нашем учреждении продолжаются.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Точность гистопатологических и цитопатологических методов идентификации возбудителей микетомы
Реферат
Мицетома — это ужасающее забытое тропическое заболевание, вызываемое различными грибковыми и бактериальными патогенами. Правильный диагноз до видового уровня является обязательным для правильного лечения. В эндемичных регионах для достижения этой цели используются различные диагностические тесты и методы, в том числе посев зерна, хирургическая биопсия, гистопатологическое исследование, тонкоигольная аспирационная цитологическая экспертиза (FNAC) и в некоторых центрах молекулярная диагностика, такая как ПЦР.В этом ретроспективном исследовании были определены чувствительность, специфичность и диагностическая точность зерновой культуры, гистопатологического исследования хирургической биопсии и FNAC для выявления возбудителей мицетомы. Гистопатологическое исследование показало лучшую чувствительность и специфичность. Результаты гистологического исследования оказались верными у 714 (97,5%) из 750 пациентов, инфицированных Madurella mycetomatis , у 133 (93,6%) из 142 пациентов, инфицированных Streptomyces somaliensis , у 53 (74.6%) из 71 пациента, инфицированного Actinomadura madurae , и у 12 (75%) из 16 пациентов, инфицированных Actinomadura pelletierii . Результаты FNAC были правильными у 604 (80,5%) из 750 пациентов с эумицетомой Madurella mycetomatis , у 50 (37,5%) из 133 пациентов с Streptomyces somaliensis, пациентов, у 43 (60,5%) из 71 пациентов с Actinomadura madurae, пациентов и 11 (68,7%) из 16 Actinomadura pelletierii . Среднее время, необходимое для получения результата FNAC, составляло один день, а для результатов гистопатологического исследования — 3.5 дней, а по зерну в среднем 16 дней. В заключение, гистопатологическое исследование и FNAC являются более практичными методами для быстрой идентификации видов, чем зерновые культуры во многих эндемичных регионах.
Среднее время, необходимое для получения результата FNAC, составляло один день, а для результатов гистопатологического исследования — 3.5 дней, а по зерну в среднем 16 дней. В заключение, гистопатологическое исследование и FNAC являются более практичными методами для быстрой идентификации видов, чем зерновые культуры во многих эндемичных регионах.
Информация об авторе
В регионах, эндемичных по мицетоме, медицинские и медицинские условия обычно неоптимальны, и доступно лишь несколько диагностических тестов и методов. Это сильно повлияло на правильную диагностику и ведение пациентов и, как следствие, на позднее обращение пациентов с запущенной болезнью.В этом ретроспективном исследовании представлен опыт MRC по распространенным диагностическим тестам в период с 1991 по 2018 год. В этом исследовании были определены чувствительность, специфичность и диагностическая точность зерновой культуры, гистопатологического исследования хирургической биопсии и FNAC для выявления возбудителей мицетомы. Гистопатологическое исследование показало лучшую чувствительность и специфичность. Кроме того, идентификация зерновых культур требует большого опыта, это утомительная процедура, и перекрестное заражение является обычным явлением, поэтому часто бывает ошибочный диагноз.Можно сделать вывод, что гистопатологическое исследование и FNAC являются более практичными методами для быстрой идентификации видов, чем зерновые культуры во многих эндемичных регионах с плохой диагностической установкой.
Образец цитирования: Siddig EE, Mhmoud NA, Bakhiet SM, Abdallah OB, Mekki SO, El Dawi NI, et al. (2019) Точность гистопатологических и цитопатологических методов идентификации возбудителей микетомы. PLoS Negl Trop Dis 13 (8): e0007056. https: // doi.org / 10.1371 / journal.pntd.0007056
Редактор: Тодд Б. Рейнольдс, Университет Теннесси, США
Поступила: 1 декабря 2018 г . ; Принята к печати: 28 июня 2019 г .; Опубликовано: 29 августа 2019 г.
; Принята к печати: 28 июня 2019 г .; Опубликовано: 29 августа 2019 г.
Авторские права: © 2019 Siddig et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Авторы не получали специального финансирования на эту работу.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Мицетома — хроническая гранулематозная подкожная воспалительная инфекция, эндемичная в субтропических и тропических регионах, но сообщается во всем мире [1, 2].Для него характерны безболезненная подкожная припухлость, образование множественных пазух и выделения, содержащие зерна [3, 4]. Клиническая картина может дать ключ к диагнозу, но без дальнейшего диагностического тестирования это приведет к ошибочному диагнозу и неточному лечению [5]. Мицетома может быть вызвана различными бактериями (актиномицетома) или грибами (эумицетома) [6, 7]. Сообщается, что более 70 различных микроорганизмов вызывают эту инфекцию, и, следовательно, очень важно идентифицировать возбудителей болезни до самого высокого уровня разрешения, что, в свою очередь, будет способствовать выбору соответствующего лечения [8, 9].В эндемичных регионах наиболее часто используемыми инструментами являются культивирование зерен, хирургическая биопсия с последующим гистопатологическим исследованием и цитологическое исследование тонкой иглой аспирации (FNAC) [10, 11].
В настоящее время культивирование зерновых культур по-прежнему считается золотым стандартом для видовой идентификации во многих центрах [12, 13]. Однако этот метод утомителен, требует много времени из-за низкой скорости роста и требует от опытных микробиологов определения возбудителей болезни на основе макроскопического вида изолятов.Кроме того, обычное явление — заражение. Пациенты, получающие лечение, могут иметь нежизнеспособные результаты, и, следовательно, трудно идентифицировать возбудитель болезни [14, 15].
Однако этот метод утомителен, требует много времени из-за низкой скорости роста и требует от опытных микробиологов определения возбудителей болезни на основе макроскопического вида изолятов.Кроме того, обычное явление — заражение. Пациенты, получающие лечение, могут иметь нежизнеспособные результаты, и, следовательно, трудно идентифицировать возбудитель болезни [14, 15].
Чтобы преодолеть эти трудности, гистологическое исследование часто используется в дополнение к культуре. При гистопатологическом исследовании легко отличить грибковых и бактериальных возбудителей [16, 17]. Однако идентификация на уровне видов является более сложной задачей и считается далеко не надежной [18, 19].В Исследовательском центре мицетомы (MRC) Хартумского университета, Хартум, Судан, FNAC является обычным инструментом для идентификации возбудителей. Он менее инвазивен и требует много времени по сравнению с гистопатологическими и культуральными методами [20, 21]. Однако, насколько нам известно, не проводилось исследования, в котором сравнивались бы чувствительность и специфичность двух методов идентификации возбудителей мицетомы. Исходя из этого, это исследование было проведено в Исследовательском центре мицетомы, где были осмотрены и пролечены 8500 подтвержденных пациентов с мицетомой.В этом ретроспективном исследовании были проанализированы записи этих пациентов и включены пациенты, прошедшие три диагностических теста.
Материалы и методы
Заявление об этике
После одобрения этическим советом Институционального наблюдательного совета Исследовательского центра мицетомы были рассмотрены все гистопатологические, цитологические и микробиологические отчеты пациентов, обследованных в Исследовательском центре мицетомы за 27-летний период (с января 1991 г. по январь 2018 г.).
Когорта исследования
Данные были собраны в предварительно разработанном листе сбора данных.Были собраны демографические характеристики пациентов, результаты трех методик.
В это исследование были включены только пациенты, у которых возбудители были идентифицированы посевом и подверглись тонкоигольной аспирации для цитологического исследования и глубокой эксцизионной биопсии для гистопатологического исследования. (Рисунок 1).
Рис. 1. Идентификация возбудителей: все отчеты о культуральных, гистопатологических и цитологических идентификациях пациентов, осматривавшихся в период с января 1991 г. по январь 2018 г. в Исследовательском центре мицетомы, были взяты из нашей электронной базы данных.
Из этих пациентов в 2202 случаях микробиологический отчет не был доступен, из 1853 случаев не был доступен гистопатологический отчет и в 2894 случаях отсутствовал цитологический отчет, оставив 991 случай мицетомы, которые соответствовали нашим критериям включения. Идентификация культуры считалась золотым стандартом. Из них 750 случаев были вызваны M . mycetomatis , 142 случая по S . somaliensis , 71 были вызваны A . madurae и 12 по A . Пеллетиери . В этих случаях гистологические и цитологические отчеты сравнивали с результатами посева. Гистологический или цитологический отчет были либо идентичны идентификации культуры, либо отрицательны. Показаны результаты как для гистологического, так и для цитологического отчетов.
https://doi.org/10.1371/journal.pntd.0007056.g001
Количество истинно-положительных (TP), ложноположительных (FP), истинно-отрицательных (TN) и ложно-отрицательных (FN) Результаты тестов были рассчитаны для каждого метода и сравнивались с культурой, которая считается нашим методом золотого стандарта.В соответствии с этими результатами для каждого теста были рассчитаны чувствительность, специфичность, положительная прогностическая ценность, отрицательная прогностическая ценность и точность. Точность рассчитывалась как доля истинных результатов (как истинно положительных, так и истинно отрицательных) среди общего числа случаев.
Изоляция зерен
Зерна были получены с помощью хирургической биопсии и / или FNAC. Для последнего в очаг поражения вводили иглу 25-го калибра и брали аспират. Урожайность зерен оценивали визуально по количеству и размеру полученных зерен.Если выход был низким, проводили вторую аспирацию иглой 23-го размера. Когда наблюдалось обильное кровотечение из поражений, использовалась игла 27-го размера. Полученный образец обычно разбивается на две части; одна была немедленно отправлена в отделение микробиологии для посева, другая часть была отправлена в отделение гистологии для гистопатологического и цитологического исследования.
Культура
Зерна мицетомы трижды промывали стерильным физиологическим раствором. Когда предполагалось наличие грибка на основании клинических данных, сопровождающих форму запроса, а также цвета и консистенции зерен (зерна грибов, как правило, твердые и имеют белый, желтый и черный цвет в зависимости от возбудителя), зерна культивировали на Сабуро декстрозный агар с гентамицина сульфатом (400 мкг / мл) для грибковых зерен при 37 ° C.Если в соответствии с клиническими данными и отчетом УЗИ ожидается появление актиномицетов, а также по цвету и консистенции зерна (зерна актиномицетомы обычно мягкие и гладкие), зерна культивировали на кровяном агаре, колумбийском агаре, агаре с дрожжевым экстрактом глюкозы, инфузии мозга и сердца. , Агар Левенштейна — Йенсена и модифицированный агар Сабуро с добавлением 0,5% дрожжевого экстракта. После этого планшеты инкубировали при 37 ° C в течение 7-14 дней.
Выявление возбудителя эумицетомы посевом
Когда гриб выращивали на пластине Сабуро, его идентифицировали на основании его макроскопической и микроскопической морфологии.Таблица 1 демонстрирует характеристики различных возбудителей эумицетомы для макроскопической и микроскопической идентификации.
Макроскопически внешний вид M . Колонии mycetomatis весьма изменчивы.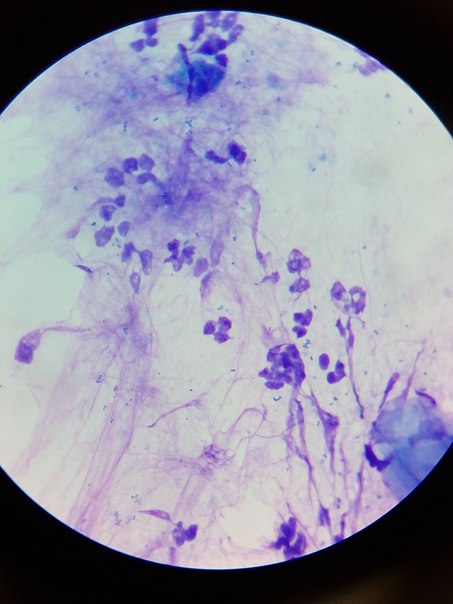 Вначале колонии имеют тенденцию быть белыми, а по мере созревания становятся желтыми или коричневыми. Некоторые штаммы M . mycetomatis способны продуцировать коричневый пигмент в культуре. Текстура бывает гладкой, плоской или ворсистой. Madurella mycetomatis отличается от T . grisea своей способностью расти при температурах до 40 ° C и неспособностью усваивать сахарозу (Таблица 2).
Вначале колонии имеют тенденцию быть белыми, а по мере созревания становятся желтыми или коричневыми. Некоторые штаммы M . mycetomatis способны продуцировать коричневый пигмент в культуре. Текстура бывает гладкой, плоской или ворсистой. Madurella mycetomatis отличается от T . grisea своей способностью расти при температурах до 40 ° C и неспособностью усваивать сахарозу (Таблица 2).
Выявление возбудителя актиномицетомы посевом
При получении колоний предполагаемая видовая идентификация основана на макроскопическом и микроскопическом внешнем виде вида. Типичные колонии Nocardia spp и Streptomyces spp имеют консистенцию от сухой до меловой, обычно складчатой.Цвет будет от желтого до серо-белого. А . madurae и A . pelletieri Штаммы продуцируют кремовый и красный пигментный мицелий соответственно и не имеют воздушных филаментов при первоначальном выделении. Окрашивание по Цилю-Нильсену используется для определения кислотостойкости изолята. Nocardia spp окрашивает положительно, а Actinomadura spp отрицательно окрашивает.
Будут выполнены различные биохимические тесты для определения возбудителя на уровне вида.К ним относятся разложение аденина, казеина и гипоксантина; рост на адоните; гидролиз эскулина; глицерин; гликоген; D-раффиноза; L-рамноза; D-тураноза; D-ксилоза; и L-аспарагиновая кислота (таблицы 3 и 4).
Цитологическое исследование
Аспирату давали высохнуть на воздухе и окрашивали красителем Diff-Quick. Окрашенные аспираты были исследованы опытным гистопатологом на наличие следующих цитоморфологических признаков: клеточность мазков, воспалительная реакция ткани хозяина, наличие и типы зерен возбудителей.Идентификация видов проводилась на основе видоспецифических критериев. В общем М . mycetomatis зерна могут быть маленькими или крупными, от светло- до темно-коричневого цвета и иметь неправильные очертания и артефакты дробления при окрашивании гематоксилином и эозином (H&E) (рис.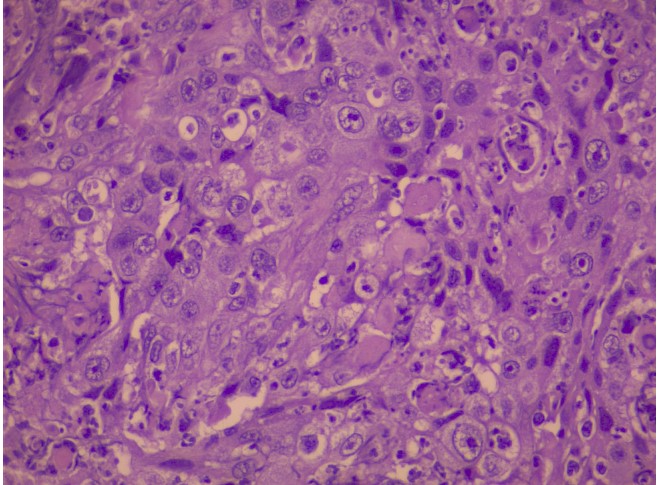 2A).
2A).
Рис. 2. Цитология возбудителей мицетомы.
( A ): цитологический вид M . mycetomatis , ( B ): A . pelletierii , ( C ): S . somaliensis в тонкоигольных аспиратах, окрашенных HE (увеличение в 10 раз).
https://doi.org/10.1371/journal.pntd.0007056.g002
S . somaliensis зерна трудно увидеть на срезах, окрашенных H&E, они окрашиваются от ярко-розового до мутно-розового цвета, часто имеют овальную или неправильную форму и могут быть агрегатами (рис. 2С).
А . madurae зёрна имеют небольшую овальную форму, окрашены в розовый или красный цвет в H&E и, как правило, представляют собой единую массу без каких-либо трещин. А . pelletierii зерна имеют мелкую округлую или овальную форму, они окрашены в темно-синий цвет на срезах, окрашенных H&E, и имеют тенденцию к трещинам.
Гистопатологическое исследование
Всем пациентам была проведена хирургическая биопсия под наркозом, которая была зафиксирована в 10% формалине и переработана в парафиновые блоки. Были получены срезы размером 3-5 мкм и окрашены H&E. В нашей гистопатологической лаборатории гистопатолог составил отчет с названием вида в соответствии со следующими критериями: i.е. видоспецифические критерии, которые использовались всеми ими. М . mycetomatis , как правило, крупные, от светло- до темно-коричневого цвета с неправильными очертаниями. Они имеют тенденцию к разрушению при разрезании секций. М . mycetomatis имеет два разных типа зерен: нитчатые и везикулярные. Нитчатый тип является наиболее распространенным типом и состоит из коричневых разделенных и разветвленных гиф, которые могут быть немного более вздутыми к краям (Рис. 3D).
Рис. 3. Патогистологический вид возбудителей мицетомы.
Гистопатологический вид A . madurae (А), S . somaliensis (В), А . pelletierii (C) и M . mycetomatis (D) на срезах, окрашенных HE (увеличение 10x).
somaliensis (В), А . pelletierii (C) и M . mycetomatis (D) на срезах, окрашенных HE (увеличение 10x).
https://doi.org/10.1371/journal.pntd.0007056.g003
S . somaliensis зёрна имеют округлую или овальную форму с однородным внешним видом на срезах тканей.На неокрашенных срезах они кажутся бледно-желтыми, а зерна плохо окрашиваются H&E. Более того, в результате разрезания на них могут появиться продольные трещины, волокна мелкие (диаметр 0,5–2 мкм), плотно упакованы и внедрены в цементную матрицу (рис. 3В).
А . pelletierii зерна мелкие, округлой или овальной формы, также наблюдаются полукруглые и серповидные формы. Нитевидные структуры обнаружить довольно сложно.Однако внимательное и тщательное изучение периферии зерен может выявить некоторые из них. А . pelletierii зерен окрашивают H&E в темно-фиолетовый, что очень характерно и позволяет поставить окончательный диагноз без необходимости использования методов культивирования (рис. 3C).
А . мадур зерен — от желтого до белого. Поэтому отличить их от окружающего жира может быть сложно. Гистологически размер зерна варьируется от мелкого до крупного.Крупные зерна имеют характерный пестрый рисунок. Периферия зерна непрозрачная, однородная и темно-фиолетовая при окрашивании H&E окрашиванием, в то время как центр окрашивается менее плотно. Кроме того, на периферии зерен виден эозинофильный материал (рис. 3А). Более мелкие зерна более однородны и их трудно отличить от A . pelletierii . Однако даже мелкие зерна A . madurae имеют более глубокую пурпурную кайму, которой нет у A . pelletierii .
Результаты
В этом исследовании 991 пациент из 7940 соответствовал критериям отбора и был включен в анализ. Их возраст колебался от 5 до 75 лет. Большинство из них составляли 737 мужчин (74,3%), большинство из них составляли 327 студентов (32,9%) и 167 фермеров (16,8%). У большинства пациентов (837 из 991) в анамнезе были выделения, содержащие зерна, большинство из которых были черными (565; 57%)), за которыми следовали желтые (104; 10,5%), белые (60; 6). .1%) и красных зерен (14; 1,4%). В этой когорте большинство пациентов (72,6%) не имели в анамнезе местных травм, только 191 (19,3%) пациент вспомнил о местной травме, а остальные 73 (7,4%) пациента не были уверены.
У большинства пациентов (837 из 991) в анамнезе были выделения, содержащие зерна, большинство из которых были черными (565; 57%)), за которыми следовали желтые (104; 10,5%), белые (60; 6). .1%) и красных зерен (14; 1,4%). В этой когорте большинство пациентов (72,6%) не имели в анамнезе местных травм, только 191 (19,3%) пациент вспомнил о местной травме, а остальные 73 (7,4%) пациента не были уверены.
На основании отчетов о культуре зерен у 750/991 (75,6%) пациентов мицетома была вызвана M . mycetomatis , в 142/991 г. (14,4%) он был вызван S . somaliensis , в 71/991 г. (7,16%) он был вызван A . madurae , а в 16/991 (1,6%) он был вызван A . Пеллетиери . У 11 пациентов не было зарегистрировано роста зерен, полученных во время сбора образцов. Время роста варьировалось от 5 до 28 дней.
В этом исследовании из 991 случая мицетомы правильная видовая идентификация была получена для 912 случаев с помощью гистопатологического исследования. С помощью FNAC правильный диагноз был поставлен в 708 случаях. Гистопатологическое исследование подтвердило диагноз M . mycetomatis в 714 из 750 случаев с чувствительностью 95,2%, специфичностью 95,4% и диагностической точностью 95,3%. Для FNAC только 604 из 750 M . mycetomatis Было идентифицировано случаев, что привело к чувствительности 80,5%, специфичности 88,4% и диагностической точности 82,4%.
Из 142 S . somaliensis случаев, 133 также были идентифицированы при гистопатологическом исследовании с чувствительностью 93,7%, специфичностью 98,9% и диагностической точностью 98.2%. С FNAC только 50 из 133 S . somaliensis Было выявлено случаев, что привело к чувствительности 35,2%, специфичности 99,3% и диагностической точности 90,1%.
53 из 71 корпуса с A . madurae Идентификация была идентифицирована гистопатологическим исследованием с чувствительностью 74,7%, специфичностью 99,5% и диагностической точностью 97,7%. FNAC выявил 43 из 71 случая с чувствительностью 60,6%, специфичностью 94.4% и диагностическая точность 91,9%.
FNAC выявил 43 из 71 случая с чувствительностью 60,6%, специфичностью 94.4% и диагностическая точность 91,9%.
Для A . пеллетиерии, из 16 ящиков; 12 были также идентифицированы при гистологическом исследовании с чувствительностью 75,0%, специфичностью 100% и диагностической точностью 99,6%. Для FNAC были получены чувствительность 68,8%, специфичность 99,7% и диагностическая точность 99,2%.
При гистопатологическом исследовании ложноотрицательный результат был зарегистрирован в 36/750 M . mycetomatis случаев, 9/142 S . somaliensis случаев, 18/71 A . madurae ящиков и 4/16 A . pelletieri ящиков. Чтобы определить причины ложноотрицательных результатов, гистопатологические препараты были повторно исследованы. Существовали различные причины ложноотрицательного результата, в том числе отсутствие гистопатологической архитектуры мицетомы, что привело к пропуску возбудителя (рис. 4).
Рис. 4. Гистопатологический разрез пациента с диагнозом M . mycetomatis по результатам культивирования; Гистопатологический отчет был отрицательным на грибок, и когда мы извлекли слайд, мы увидели прилипание гистиоцитов в центре с небольшим количеством зерен (H и E, X 10).
https://doi.org/10.1371/journal.pntd.0007056.g004
Кроме того, в некоторых блоках зерна отсутствовали; либо потому, что ткань не была гомогенно инфицирована возбудителем и что часть, взятая для гистологии, либо срез не содержал зерен.Это последнее можно преодолеть, исследуя несколько срезов на разной глубине гистологических блоков, особенно когда отмечаются воспаление и некроз.
Ложноположительные результаты получены в 28 случаях. Это было , приписываемое наличию многочисленных структур, которые могут имитировать внешний вид M . mycetomatis , включая овощи, синтетические волокна и водоросли, которые могут напоминать гифы и кальцинозы грибов (рис. 5).
5).
Рис 5.Ложноположительные определения в цитологии.
Показаны цитологические мазки (A) M . mycetomatis гифы окрашены по Гимзе, (B) Синтетические волокна окрашены по Райт-Гимза. (Пятно Гимзы, X40). (C) Мазок, показывающий гифы M . mycetomatis . (D) Мазок, показывающий удлиненные структуры отряда Oedogoniales. Хлоропласты образуют цепочку, прерванную четкими зонами (X40). (E) Мазок, показывающий M . mycetomatis зерен после раздавливания на мазке.(F) мазок с обильным кальцинированным мусором без интактных клеток, взятый у пациента с опухолевым кальцинозом (Diff Quick, X10).
https://doi.org/10.1371/journal.pntd.0007056.g005
В целом, с помощью гистологии в большинстве случаев была получена правильная видовая идентификация. Среднее время идентификации культуральных изолятов составляло 16 дней (от 5 до 28 дней), для гистологии — 3,5 дня (от 2 до 5 дней), а для цитологии — один день (от 1 до 2 дней). Это продемонстрировало, что надежная идентификация видов с использованием гистологии была получена в 92 году.0% случаев при среднем сокращении времени на 13,5 дней, для цитологии это было 71,4% случаев при сокращении времени на 15 дней, что указывает на то, что добавление гистологии или цитологии к диагностическим методам, используемым для идентификации видов, привело к более раннему началу лечения.
Обсуждение
Точная идентификация возбудителей мицетомы считается краеугольным камнем для начала соответствующей терапии. Следовательно, быстрый и точный диагностический инструмент для окончательной идентификации видов считается критически важной частью лечения и ведения пациентов [21–23].Используются различные лабораторные методы идентификации видов, включая культивирование, гистопатологию [7, 25], FNAC [8, 24], серологические анализы и визуализацию [26–29], а также различные инструменты молекулярной диагностики [30–35]. Однако не все эти анализы доступны в эндемичных регионах. В Исследовательском центре мицетомы обычно выполняются культивирование зерен, гистопатология и FNAC, которые использовались в течение последних 27 лет. В этом сообщении мы использовали данные, собранные за последние 27 лет, для оценки чувствительности, специфичности и диагностической точности гистопатологии и цитологии при идентификации возбудителей мицетомы по сравнению с текущим золотым стандартом: культивированием.
В Исследовательском центре мицетомы обычно выполняются культивирование зерен, гистопатология и FNAC, которые использовались в течение последних 27 лет. В этом сообщении мы использовали данные, собранные за последние 27 лет, для оценки чувствительности, специфичности и диагностической точности гистопатологии и цитологии при идентификации возбудителей мицетомы по сравнению с текущим золотым стандартом: культивированием.
Это исследование показало, что гистопатология была более точной для FNAC с точки зрения идентификации видов. Наши результаты согласуются с результатами, полученными ранее Юсифом и его коллегами [36]. Они сообщили о 90,9% -ном согласии при сравнении гистопатологии с FNAC для диагностики M . mycetomatis (90,9%), тогда как для возбудителей актиномицетомы — только 60%. Более низкая диагностическая достоверность возбудителей актиномицетомы могла быть вызвана морфологическим сходством этих микроорганизмов.Кроме того, оба метода зависят от оператора и требуют интенсивного обучения и опыта, которые могут повлиять на точность.
Мицетома может быть вызвана более чем 70 различными возбудителями [37], но распространение этих видов не везде одинаково, что может вызвать различия в диагностической точности в разных регионах. В некоторых эндемичных для мицетомы регионах мицетома вызывается близкородственными видами. Морфологически эти организмы могут выглядеть одинаково, что может затруднить идентификацию этих организмов.В Мексике наиболее распространенными возбудителями являются Nocardia brasiliensis и Nocardia asteroides [37], два близкородственных вида, которые трудно отличить друг от друга на основании гистопатологии [38, 39]. В Сенегале наиболее распространенными возбудителями эумицетомы являются M . mycetomatis и Falciformispora senegalensis , которые оба могут вызывать мицетому черного зерна [37, 40]. В черных зернах F . senegalensis , центр не пигментирован, цемент отсутствует, а на периферии зерна темного цвета и присутствует коричневый цемент. Однако это также наблюдается в черных зернах Trematosphaeria grisea и некоторых зернах M . mycetomatis . Следовательно, необходим опытный патолог, чтобы различать эти организмы [41].
Однако это также наблюдается в черных зернах Trematosphaeria grisea и некоторых зернах M . mycetomatis . Следовательно, необходим опытный патолог, чтобы различать эти организмы [41].
Проведенное здесь исследование было ретроспективным исследованием, основанным на записях Исследовательского центра мицетомы за последние 27 лет. В то время молекулярная идентификация возбудителей болезни не проводилась, и культура считалась золотым стандартом.Недавно в исследовании, проведенном Борманом и его коллегами, было продемонстрировано, что при использовании морфологической идентификации во многих случаях происходит ошибочная идентификация [42]. Из 28 ранее идентифицированных изолятов Trematosphaeria grisea 22 были другими видами грибов [42]. Для возбудителей актиномицетомы также были описаны ошибочные определения. В 2008 году Quintana и партнеры продемонстрировали эту половину модели S . Изоляты somaliensis , полученные из Судана, оказались Streptomyces sudanensis [43].Кроме того, рядом с A . madurae и A . pelletieri описан также Actinomadura latina [44]. Поэтому текущее продолжающееся исследование включает молекулярную диагностику для определения истинной этиологии и прогностической ценности посева, FNAC и гистологии. С внедрением в нашем центре молекулярной диагностики мы уже сделали первый шаг в этом направлении.
В этом исследовании чувствительность гистопатологического метода была выше, чем у FNAC для всех протестированных видов.В этом исследовании они изучили эффективность FNAC по сравнению с гистологией у 19 различных пациентов с мицетомой. Из этих 19 пациентов пять пациентов были исключены из-за недостаточного количества аспирированных материалов. Из 14 оставшихся пациентов 10 были диагностированы как M . mycetomatis с гистопатологией и 4 были актиномицетомами. С таким ограниченным числом пациентов они могли сделать вывод, что FNAC может идентифицировать возбудителя у 9 из 10 M . mycetomatis пациентов.Один пациент, идентифицированный с помощью гистологии, не мог быть идентифицирован с помощью цитологии, что еще раз подтверждает, что гистология превосходит FNAC в отношении идентификации видов [15]. Результат подтвержден в нашем текущем исследовании, так как в нашем исследовании 146 пациентов с M . mycetomatis mycetoma были пропущены с помощью FNAC. Однако из трех различных используемых методов идентификации FNAC был самым быстрым и привел к идентификации видов в течение 1 дня вместо 3,5 дней для гистологии или 16 дней для культивирования.FNAC — это простой и быстрый метод диагностики, который можно использовать в клинике комплексной диагностики, а также в эпидемиологических и полевых исследованиях. Однако у него много ограничений: это зависит от оператора, может быть болезненным и привести к глубоко укоренившимся бактериальным инфекциям. FNAC менее инвазивен, чем глубокая биопсия, так как получается только небольшое отверстие для прокола. С помощью глубокой биопсии удаляется большая площадь поражения, тем самым подвергая большую часть поражения вторичным бактериальным инфекциям и создавая больший риск распространения инфекции.В настоящее время глубокая биопсия выполняется только для получения диагностического образца, а не для уменьшения бремени инфекции в месте поражения. Это связано с тем, что поражение может быть обширным, даже если снаружи видно только небольшое поражение. В настоящее время аспират тонкой иглой часто берут вслепую без контроля ультразвуковой визуализации, что создает риск того, что оператор может пропустить карманы, содержащие зерна. При использовании аспирации под контролем ультразвука диагностическая ценность метода улучшится, что, в свою очередь, может увеличить количество случаев, в которых может быть получена положительная идентификация видов.
mycetomatis пациентов.Один пациент, идентифицированный с помощью гистологии, не мог быть идентифицирован с помощью цитологии, что еще раз подтверждает, что гистология превосходит FNAC в отношении идентификации видов [15]. Результат подтвержден в нашем текущем исследовании, так как в нашем исследовании 146 пациентов с M . mycetomatis mycetoma были пропущены с помощью FNAC. Однако из трех различных используемых методов идентификации FNAC был самым быстрым и привел к идентификации видов в течение 1 дня вместо 3,5 дней для гистологии или 16 дней для культивирования.FNAC — это простой и быстрый метод диагностики, который можно использовать в клинике комплексной диагностики, а также в эпидемиологических и полевых исследованиях. Однако у него много ограничений: это зависит от оператора, может быть болезненным и привести к глубоко укоренившимся бактериальным инфекциям. FNAC менее инвазивен, чем глубокая биопсия, так как получается только небольшое отверстие для прокола. С помощью глубокой биопсии удаляется большая площадь поражения, тем самым подвергая большую часть поражения вторичным бактериальным инфекциям и создавая больший риск распространения инфекции.В настоящее время глубокая биопсия выполняется только для получения диагностического образца, а не для уменьшения бремени инфекции в месте поражения. Это связано с тем, что поражение может быть обширным, даже если снаружи видно только небольшое поражение. В настоящее время аспират тонкой иглой часто берут вслепую без контроля ультразвуковой визуализации, что создает риск того, что оператор может пропустить карманы, содержащие зерна. При использовании аспирации под контролем ультразвука диагностическая ценность метода улучшится, что, в свою очередь, может увеличить количество случаев, в которых может быть получена положительная идентификация видов.
Зерновая культура остается во многих центрах краеугольным камнем диагностики мицетомы. кроме того, морфологическая идентификация возбудителя мицетомы иногда может быть затруднена из-за наложения и сходства, встречающихся между разными видами, как показано в Таблице 1. Однако культивирование — это длительная процедура, и для идентификации микроорганизмов необходим опытный микробиолог. до видового уровня [45]. Перекрестное заражение — распространенная проблема.
Однако культивирование — это длительная процедура, и для идентификации микроорганизмов необходим опытный микробиолог. до видового уровня [45]. Перекрестное заражение — распространенная проблема.
Недавно была опубликована схема идентификации возбудителей эумицетомы, основанная на физиологических свойствах возбудителя, что указывает на возможность использования физиологических свойств для более надежной идентификации возбудителей эумицетомы [1]. К ним относятся культивирование при 37 ° C и рост на актидионе, L-сорбозе, глицетоле, 2-кетоглюконате калия, метил-D-глюкопиранозиде, инозитоле и D-сорбите. Однако эти тесты отнимают больше времени и задерживают идентификацию возбудителя, что потенциально может привести к отсрочке лечения пациента.Однако путем дополнения культивирования гистологией или FNAC предварительная идентификация может быть получена раньше. Тем более, что лечение мицетомных инфекций зависит от возбудителя. Актиномицетома лечится иначе, чем эумицетома. [22].
Правильная идентификация на уровне вида повлияет на принятие клинического решения. Первое необходимое диагностическое различение — это различие между возбудителями актиномицетомы и возбудителями эумицетомы, поскольку это будет включать либо антибактериальное лечение, либо лечение, основанное на хирургическом вмешательстве и противогрибковом лечении.В этой ситуации было обнаружено, что цитологическое исследование тонкоигольной аспиарации и гистопатологическое исследование очень чувствительно при различении актиномицетомы и эумицетомы на основании морфологических характеристик; поэтому, основываясь на нашем опыте, мы рекомендовали использовать FNAC в центрах с ограниченными ресурсами, например, в сельских центрах, где нет лабораторий гистопатологии.
Что касается возбудителей актиномицетомы, то в настоящее время неизвестно, зависит ли выбор антибактериального средства от возбудителей, и необходимы исследования, чтобы оценить, нужны ли разные схемы лечения для каждого из различных бактериальных возбудителей.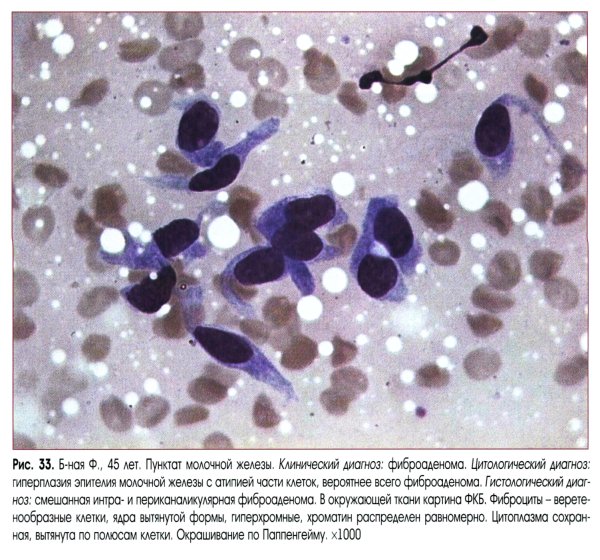 Когда это оказывается так, идентификация на уровне видов становится важной. Для возбудителей эумицетомы хирургическое вмешательство всегда сочетается с итраконазолом. Однако Medicopsis romeroi и Madurella fahalii не были чувствительны к итраконазолу in vitro . Это будет означать, что дискриминация между этими видами и восприимчивыми видами будет обязательной и потенциально может повлиять на клиническое ведение. Необходима клиническая оценка таких случаев и влияние на показатели терапевтического успеха.Однако перед проведением такого исследования необходимо провести надлежащую идентификацию видов.
Когда это оказывается так, идентификация на уровне видов становится важной. Для возбудителей эумицетомы хирургическое вмешательство всегда сочетается с итраконазолом. Однако Medicopsis romeroi и Madurella fahalii не были чувствительны к итраконазолу in vitro . Это будет означать, что дискриминация между этими видами и восприимчивыми видами будет обязательной и потенциально может повлиять на клиническое ведение. Необходима клиническая оценка таких случаев и влияние на показатели терапевтического успеха.Однако перед проведением такого исследования необходимо провести надлежащую идентификацию видов.
Таким образом, цитопатолог / гистопатолог должен знать о многих имитаторах, которые могут выглядеть как возбудитель мицетомы, и мы настоятельно рекомендуем, чтобы патологи после постановки диагноза рекомендовали корреляцию с микробиологией или предоставляли предостережение, чтобы посоветовать клиницистам ограничения идентификации организмов с помощью гистопатологического / цитопатологического исследования.
Список литературы
- 1. Reis CMS, Reis-Filho EGM. Мицетомы: эпидемиологический, этиологический, клинический, лабораторный и терапевтический обзор. Бюстгальтеры Dermatol. 2018; 93 (1): 8–18. pmid: 29641691
- 2. Fahal AH. Мицетома: глобальная медицинская и социально-экономическая дилемма. PLoS Negl Trop Dis. 2017; 11 (4): e0005509. pmid: 28426654
- 3. Zijlstra EE, van de Sande WWJ, Fahal AH. Мицетома: долгий путь от пренебрежения. PLoS Negl Trop Dis.2016; 10 (1): e0004244. pmid: 26797103
- 4. Сулейман С.Х., Вадаэлла Е.С., Фахал А.Х. Хирургическое лечение мицетомы. PLoS Negl Trop Dis. 2016; 10 (6): e0004690. pmid: 27336736
- 5.
ван де Санде Венди, Фахал Ахмед, Ахмед Сара Абдалла, Серрано Хулиан Альберто, Бонифас Александро, Зильстра Эд от имени рабочей группы по эвмицетоме; Устранение пробелов в знаниях о мицетоме, Медицинская микология , 2018; 56 (Supp 1): 153–164.

- 6. Фахал А., Махгуб Е.С., Хассан АМЕ, Абдель-Рахман М.Э.Мицетома в Судане: новости Центра исследования мицетомы Хартумского университета, Судан. PLoS Negl Trop Dis. 2015; 9 (3): e0003679. pmid: 25816316
- 7. Сиддиг Э. Э., Фахал А. Х. Гистопатологический подход в диагностике возбудителей мицетомы: мини-обзор. J Cytol Histol. 2017; 8: 466.
- 8. Сиддиг Е.Е., Юсиф Б.М., Эдрис А.М., Фахал А.Х. Цитология Touch Imprint: простой метод диагностики возбудителей мицетомы. Хартумский медицинский журнал.2016; 9 (1): 1211–1216.
- 9. Ахмед А.А., ван де Санде В., Фахал А.А. Лабораторная диагностика мицетомы: Обзорная статья. PLoS Negl Trop Dis. 2017; 11 (8): e0005638. pmid: 28837657
- 10. Verghese A, Klokke AH. Гистологическая диагностика грибка, вызывающего мицетому. Индийский J Med Res. 1966; 54: 524–530. pmid: 5947017
- 11. Алам К., Махешвари В., Бхаргава С., Джайн А., Фатима У, Хак Э. Гистологический диагноз стопы Мадура (микетома): обязательное условие для окончательного лечения.Журнал мировых инфекционных болезней. 2009; 1 (1), 64–67. pmid: 20300390
- 12. Чуфал СС, Таплиял NC, Гупта МК. Подход к гистологической диагностике и лечению стопы Мадура. J Infect Dev Ctries. 2012; 6 (9): 684–8. pmid: 23000870
- 13. Ибрагим А.И., Эль-Хассан А.М., Фахал А., ван де Санде В.В. Гистопатологическое исследование зерна Madurella mycetomatis. PLoS One. 2013; 8 (3): e57774. pmid: 23483927
- 14. Эфаред Б., Тахири Л., Бубакар М.С., Ацам-Эбанг Дж., Хаммас Н., Хинде Э.Ф. и др.Мицетома в неэндемичной зоне: диагностическая проблема. Клиническая патология BMC. 2017; 17, 1. pmid: 28167862
- 15. Эль-Хаг И.А., Фахал А.Х., Халил ЕАГ. Тонкоигольная аспирационная цитология мицетомы. Acta Cytologica. 1996; 40 (3): 461–46. pmid: 8669179
- 16. Fahal AH. Мицетомный шип на плоти Обзорная статья. Trans R Soc Trop Med Hyg. 2004; 98 (1): 3–11. Обзор.
- 17. Zein HAM, Fahal AH, Mahgoub ES, EL Hassan T, Abdel Rahman ME. Предикторы излечения, ампутации и последующего прекращения у пациентов с мицетомой, полученные в Исследовательском центре мицетомы при Хартумском университете.Trans R Soc Trop Med Hyg. 2012; 106 (11): 639– pmid: 22854685
- 18. ван де Санде WWJ, Магхуб Э.С., Фахал А.Х., Гудфеллоу М., Уэлш О., Зийлстра Э. Пробел в знаниях о микетоме: определение приоритетов исследований. PLoS Negl Trop Dis. 2014; 8 (3): e2667. pmid: 24675533
- 19. Mitjà O, Marks M, Bertran L, Kollie K, Argaw D, Fahal AH и др. Комплексный контроль и лечение запущенных тропических кожных заболеваний. PLoS Negl Trop Dis. 2017; 11 (1): e0005136. pmid: 28103250
- 20.ван де Санде WWJ, Фахал А.Х., Гудфеллоу М., Махгуб Е.С., Валлийский О., Зийлстра Э. Достоинства и недостатки используемых в настоящее время диагностических инструментов при мицетоме. PLoS Negl Trop Dis. 2014; 8 (7): e2918. pmid: 24992636
- 21. Hay RJ, Fahal AH. Мицетома: старое тропическое заболевание, которому до сих пор не уделяется должного внимания. Trans R Soc Trop Med Hyg. 2015; 109 (3): 169–70. pmid: 25667234
- 22. Валлийский O, Аль-Абдели HM, Salinas-Carmona MC, Fahal AH. Лечебная терапия мицетомы. PLoS Negl Trop Dis.2014; 8 (10): e3218. pmid: 25330342
- 23. ван де Санде WWJ, Магхуб Э.С., Фахал А.Х., Гудфеллоу М., Уэлш О., Зийлстра Э. Пробел в знаниях о микетоме: определение приоритетов исследований. PLoS Negl Trop Dis. 2014; 8 (3): e2667. pmid: 24675533
- 24. ЭЛ Хаг И.А., Фахал А.Х., Гасим Э.Т. Тонкоигольная аспирационная цитология мицетомы. Acta Cytol. 1996; 40 (3): 461–4. pmid: 8669179
- 25. Ибрагим А.И., Эль-Хассан А.М., Фахал А., ван де Санде В.В. Гистопатологическое исследование зерна Madurella mycetomatis .PLoS ONE. 2013; 8 (3): e57774. pmid: 23483927
- 26. Fahal AH. Мицетома, Клинико-патологическая монография. Хартум: Издательство Хартумского университета, 2006.
- 27. Абд Баги М.Э., Фахал А.Х., Шейх Х.Э., Абдул Вахаб О., Тайфур М.К. и др. Патологические переломы при мицетоме. Trans R Soc Trop Med Hyg. 2003; 97: 582–584. pmid: 15307432
- 28. Фахал А.Х., Шейх Х.Э., Хомейда М.М., Араби Ю.Е., Махгуб Е.С. Ультрасонографическая визуализация мицетомы. Br J Surg. 1997; 84: 1120–1122.pmid: 9278658
- 29. Эль Шами М.Э., Фахал А.Х., Шакир М.Ю., Хомейда М.М. Новая система оценки МРТ для диагностики и лечения мицетомы. Trans R Soc Trop Med Hyg. 2012; 106: 738–742. pmid: 22981317
- 30. Ахмед А.О., Мухтар М.М., Кулс-Саймонс М., Фахал А.Х., де Хуг С., ван ден Энде Б.Г. и др. Разработка видоспецифической процедуры анализа полиморфизма длины рестрикционного фрагмента с помощью ПЦР для идентификации Madurella mycetomatis. J Clin Microbiol. 1999; 37: 3175–3178.pmid: 10488173
- 31. Ahmed A, van de Sande W., Verbrugh H, Fahal A, van Belkum A. Штаммы Madurella mycetomatis из поражений мицетомы у суданских пациентов являются клональными. J Clin Microbiol. 2003; 41 (10): 4537–41. pmid: 14532179
- 32. Desnos-Ollivier M, Bretagne S, Dromer F, Lortholary O, Dannaoui E. (2006) Молекулярная идентификация агентов мицетомы черного зерна. J Clin Microbiol. 44 (10): 3517–23. pmid: 17021076
- 33. Ахмед С.А., ван ден Энде BHGG, Фахал А.Х., ван де Санде WWJ, де Хуг Г.С.Быстрая идентификация возбудителей эумицетомы черного зерна с помощью амплификации по кругу. PLoS Negl Trop Dis. 2014; 8 (12): e3368. pmid: 25474355
- 34. Ахмед С.А., ван де Санде В.В., Деснос-Оливье М., Фахал А.Х., Махмуд Н.А., де Хуг Г.С. Применение методов изотермической амплификации для идентификации Madurella mycetomatis, основного возбудителя мицетомы человека. J Clin Microbiol. 2015; 53 (10): 3280–5. pmid: 26246484
- 35. ван де Санде WW, Горкинк Р., Саймонс Г., Отт А., Ахмед А.О., Вербру Х. и др.(2005) Генотипирование Madurella mycetomatis путем селективной амплификации рестрикционных фрагментов (полиморфизм длины амплифицированного фрагмента) и корреляция подтипа с географическим происхождением и размером поражения. J Clin Microbiol. 43 (9): 4349–56. pmid: 16145076.
- 36. Юсиф Б.М., Фахал А.Х., Шакир М.Ю. Новый метод диагностики мицетомы с использованием фиксированных блоков аспирированного материала. Trans R Soc Trop Med Hyg. 2010; 104 (1): 6–9. pmid: 19700179
- 37. ван де Санде WWJ.Глобальное бремя мицетомы человека: систематический обзор и метаанализ. PLoS Negl Trop Dis. 2013; 7 (11): e2550. pmid: 24244780
- 38. Дестомбес П., Мариат Ф., Розати Л., Сегретин Г. [Мицетома в Сомали — результаты обследования, проведенного с 1959 по 1964 год]. Acta Trop. 1977; 34: 355–373. pmid: 23657
- 39. Дестомбес П. Гистологическое строение мицетом. Ann Soc Belges Med Trop Parasitol Mycol. 1964; 44: 897–908. pmid: 14309459
- 40. Ndiaye B, Develoux M, Dieng MT, Kane A, Ndir O, Raphenon G и др.Текущий отчет о мицетоме в Сенегале: отчет о 109 случаях. Journal de Mycologie Médicale 2000; 10 (3): 140–144.
- 41. Verghese A, Klokke AH. Гистологическая диагностика грибка, вызывающего мицетому. Индийский J Med Res. 1966. 54 (6): 524–30. pmid: 5947017
- 42. Фрейзер М., Борман А.М., Джонсон Э.М. Быстрая и надежная идентификация возбудителей микетомы черного зерна с помощью матричной лазерной десорбционной ионизации – времяпролетной масс-спектрометрии. Diekema DJ, изд.Журнал клинической микробиологии. 2017; 55 (8): 2521–2528.
- 43. Quintana ET, Wierzbicka K, Mackiewicz P, Osman A, Fahal AH, Hamid ME, et al. Streptomyces sudanensis sp. nov., новый возбудитель, выделенный от больных актиномицетомой.

 Это уменьшает количество ошибок рабочего процесса и улучшает качество изображения. Ожидается, что запуск таких продуктов будет стимулировать рынок гистологии и цитологии.
Это уменьшает количество ошибок рабочего процесса и улучшает качество изображения. Ожидается, что запуск таких продуктов будет стимулировать рынок гистологии и цитологии.
 Это новое правило является большим изменением для опытных регистраторов, которым в прошлом предлагалось кодировать наиболее конкретную гистологию и внимательно читать микроскопическое описание (если оно доступно), чтобы собрать лакомые кусочки данных, которые можно было бы использовать для правильного присвоения гистологического кода. или неправильно.
Это новое правило является большим изменением для опытных регистраторов, которым в прошлом предлагалось кодировать наиболее конкретную гистологию и внимательно читать микроскопическое описание (если оно доступно), чтобы собрать лакомые кусочки данных, которые можно было бы использовать для правильного присвоения гистологического кода. или неправильно.
 1%
1%