❗❓Наука для детей — Молекулы и атомы | Смешарики Пинкод
Подписывайся на канал TVSmeshariki: youtube.com/c/smeshariki и не забудь НАЖАТЬ НА КОЛОКОЛЬЧИК 🔔 Каждую ПЯТНИЦУ на нашем канале TVSmeshariki премьерные серии НОВОГО сезона мультсериала Смешарики Пин-код и Смешарики Спорт! Не пропустите!#Смешарикивернулись
ПИНКОД (сезон гуманитарных технологий) — Все серии: goo.gl/vahwfD
Пин-код. Смешарики | Познавательные мультики для детей — 1 сезон: goo.gl/nzj76y
Пин-код. Смешарики | Познавательные мультики для детей — 2 сезон: goo.gl/FTTAFS
Пин-код (2017 год) + Смешарики Спорт: goo.gl/RJKJVf
Плейлист для выходных: goo.gl/qFucmE
Смешарики 2D. Все серии подряд | HD: goo.gl/6Q62F2
Смешарики Новые приключения : goo.gl/54Bvc9
Смешарики 2009 года : goo.gl/3WC17H
Смешарики. Сборники : goo.gl/6osQFm
Лучшие мультфильмы: goo.gl/sf7FqY
Смотрите также:
Смешарики — Азбука здоровья youtu.be/pMfeKQgfwTo
Смешарики — Умный дом youtu.be/jvtWyKYckI0
Смешарики 2D — Чистый спорт youtu.be/oWfOqQkM5JM
Смешарики — Шуша youtu.be/T2tNCm7yPRE
Смотрите также свои любимые серии про:
Лосяша : goo.gl/RwUjtc
Копатыча : goo.gl/8Jz5GA
Карыча : goo.gl/fnvKNV
Пина : goo.gl/eMYexH
Ёжика : goo.gl/NRsTLe
Бараша : goo.gl/D7Q3Vv
Нюшу : goo.gl/ULC6fi
Кроша : goo.gl/dGGLJ8
Совунью : goo.gl/EXyEgQ
В преддверии наступления Нового года Бараш ищет чуда. С помощью Шаролета он уменьшается до размеров молекул и атомов и изучает их изнутри, чтобы найти то, куда ученые еще не смогли добраться. Найдет ли Бараш чудо для себя внутри молекул и атомов?
Наука для детей — Смешарики Пин-Код — интересные факты о растениях, о технике, передаче информации, о человеке, о Земле, физических и химических явлениях. Наука для школьников может показаться скучной, но с эпизодами Пин-Кода от Смешариков учиться легко и интересно. Эпизоды из серий подойдут также и для маленьких детей. Ведь все научные факты сопровождаются занимательным анимационным видеорядом. Физика для детей от Смешариков — это весело и познавательно!
Физика для детей от Смешариков — это весело и познавательно!
Ссылка на серию: youtube.com/watch?v=L8EKfH_7rI…
Мы в социальных сетях!
Группа Вконтакте: vk.com/smeshariki
Мы в Инстаграм instagram.com/smeshariki_offic…
Мы на Фейсбуке: facebook.com/TVSmeshariki/?ref…
Мы в Одноклассниках: ok.ru/smeshariki
Следи за нами в Твиттере twitter.com/TVSmeshariki
Все мультклипы подряд goo.gl/ZCJv2v
Смотреть Смешарики онлайн все серии подряд на русском языке вы можете в хорошем качестве совершенно бесплатно без регистрации. Приятного просмотра!
Сказка про молекулу: физика для детей
Начать объяснять ребенку, как устроен мир можно с самого детства. Почему бы не знакомить кроху с физикой еще до школы? Поможет в этом сказка про молекулу. Вы можете выдумать ее самостоятельно, к примеру, за ужином рассказать ребенку о том, чем вода отличается ото льда и пара. Интересно то, что в некоторых школах детям дают творческие задания – придумать интересные приключения молекулы в сказочной форме. Таким образом, воспринимать физику становится намного интереснее. Что ж, давайте сегодня на ночь вместо обычных волшебных героев, познакомим своего ребенка с молекулой воды, которая живет в стакане или бутылке воды.
Сказка про молекулу: физика ближе к ребенку
Привет, меня зовут Синди. Вам может показаться, что все молекулы воды одинаковы и имена нам ни к чему. Если посмотреть на людей с космоса, они также могут казаться совершенно одинаковыми, на самом же деле каждый индивидуален и прекрасен по-своему. Так и мы – молекулы, хоть и очень похожи, но все же у каждого есть свое имя, а если нас поставить на огонь кто-то из нас превратиться в пар первым и улетит высоко, кто-то же до последнего будет метаться по кастрюле, как кипяток.
 Мы прижимались друг к другу, не могли ходить, даже говорить было трудно. Но мы быстро адаптируемся к любим условиям, да и ждать долго не пришлось. Вскоре нас принесли в одну семью, которая состояла из двух человек. Мы сразу поняли, раз людей, которые будут пользоваться нами, мало, мы еще долго пробудем в этой десятилитровой банке.
Мы прижимались друг к другу, не могли ходить, даже говорить было трудно. Но мы быстро адаптируемся к любим условиям, да и ждать долго не пришлось. Вскоре нас принесли в одну семью, которая состояла из двух человек. Мы сразу поняли, раз людей, которые будут пользоваться нами, мало, мы еще долго пробудем в этой десятилитровой банке. Мною залили овсяную крупу. И вот я уже на огне. И вот начинается моя новая жизнь, новые приключения.
Мною залили овсяную крупу. И вот я уже на огне. И вот начинается моя новая жизнь, новые приключения.Автор — Маргарита Сурженко
Ми створили більше 300 безкоштовних казок на сайті Dobranich. Прагнемо перетворити звичайне вкладання спати у родинний ритуал, сповнений турботи та тепла.
ПІДТРИМАТИ
простые научные опыты с использованием мыла
Мыло – это не только средство для поддержания чистоты тела, это еще и любопытный объект для юных исследователей. Играя с мылом, дети могут узнать много нового и интересного, познакомиться с некоторыми законами природы.
Жидкое мыло: опыт с поверхностным натяжением
Жидкое мыло продемонстрирует способность этого вещества уменьшать поверхностное натяжение воды. Наполните тазик водой, вырежьте из картона небольшой треугольник – нашу лодочку. Положите лодочку на воду с краю тазика, острым углом по направлению к центру. Попросите ребенка обмакнуть палец в жидкое мыло и опустить в воду за лодочкой. В результате лодочка сразу начинает двигаться к противоположному краю тазика. Результаты этих опытов объясняются действием мыла на воду: оно уменьшает натяжение воды.
Твердое мыло: опыт с притяжением между молекулами
А на примере твердого мыла можно изучить взаимное притяжение между молекулами. Если взять, например, тарелку, немного смочить ее водой и положить сверху кусок мыла, прижать его и несколько раз прокрутить. Через 3-5 минут можно попробовать поднять мыло. Мы увидим, что тарелка при этом поднимется вместе с мылом.
Это происходит из-за того, что когда мыло намокло, между тарелкой и мылом образовалась мыльная пена, молекулы которой настолько сблизились с молекулами тарелки, что между ними возникло взаимное притяжение. Поэтому после высыхания мыло и тарелка «склеились», стали одним целым.
Мыльные пузыри: взаимодействие материалов и «физика низких температур»
Мы уже писали о том, как можно сделать в домашних условиях мыльные пузыри, а сейчас предлагаем вам несколько вариантов веселых игр с мыльными пузырями. Можно устроить настоящее соревнование из нескольких этапов – кто сделает самый большой мыльный пузырь и кто сделает больше всего пузырей. Мыльные пузыри можно не только выдувать, их можно потом лопать! Дети гоняются за мыльными пузырями, пытаясь как можно больше их «поймать».
А можно и в самом деле ловить мыльные пузыри и стараться как можно дольше их сохранить. Для этого лучше обернуть руку шерстяным шарфом или надеть варежки. Поверхность пузыря достаточно упруга. Пузырь будет опираться на шерстяные ворсинки шарфа и как бы парить в воздухе. Это отличный пример взаимодействия разных материалов и поверхностей.
Мыльные пузыри можно делать с помощью специальных рамочек, а можно и буквально собственными руками. Обмакните руки в мыльный раствор и надувайте пузыри с помощью указательного и большого пальца. Радужные шарики будут у вас прямо в руках.
Налив в баночку или стакан немного мыльного раствора, опустите в него коктейльную трубочку и начинайте сильно в нее дуть. Очень быстро получится очень много пены, которая заполнит всю посуду и начнет весело переваливаться через край.
Очень интересно играть с мыльными пузырями зимой на улице. Когда на улице где-то 6 -10 градусов мороза, шарики начинают быстро замерзать. Если дать возможность мыльному замерзшему пузырю упасть на землю, он не разобьется, как стеклянный шарик. Пленка оказывается не хрупкой, какой, казалось бы, должна быть тонкая корочка льда. На нем появятся вмятины, а отдельные обломки закрутятся в трубочки Зрелище просто незабываемое!
А еще можно сделать мыльную матрешку из пузырей. Возьмите любую плоскую тарелку и налейте немного нашего раствора. С помощью трубочки надуйте большой шарик.
Мыльными пузырями можно даже рисовать. Жидкость для мыльных пузырей надо разлить по стаканчикам и добавить в них акварельные краски. А потом цветные пузыри пускать на белый лист бумаги. В результате такой игры получится неповторимая абстрактная картинка, созданная своими руками.
Рисунки мылом
Рисовать можно не только мыльными пузырями, но и твердым мылом. Лучше всего мыльные рисунки получаются, если взять мыльный обмылок и плотную ткань контрастного цвета. Мыло оставляет на ткани четкий след, а если вдруг надо исправить ошибку, это легко сделать, протерев неправильность влажной салфеткой. Этим свойством мыла часто пользуются швеи и рукодельницы, чтобы перенести на ткань выкройку.
«Повелитель молекул. Константин Северинов». Документальный фильм
30 октября 2020 г. 13:36
Герой фильма — ведущий российский микробиолог, ученый с мировым именем, доктор биологических наук Константин Северинов. Он популярно объяснит, что такое человек с точки зрения молекулярного биолога, и расскажет, как современная наука в недалеком будущем кардинально изменит жизнь человечества.
По мнению Константина Северинова, наступает золотое время для генной инженерии. Ученый сравнивает информацию, записанную в ДНК, с огромной книгой (объемом с «Войну и мир») и объясняет, как в нашем генетическом тексте появляются «опечатки» — дефекты ДНК, которые приводят к наследственным болезням. Новейшие научные разработки уже позволяют исправить этот «брак». Северинов расскажет, от каких генетических болезней можно будет избавиться уже в ближайшем будущем. Поможет в этом «генетический редактор», который ученые будут включать на стадии эмбрионального развития, чтобы устранить ген, отвечающий за поломку ДНК.
А можно ли будет не просто избавиться от заболевания, но и усилить умственные или физические способности будущего ребенка, чтобы он стал выдающимся спортсменом или ученым? Ответ на этот вопрос тоже есть, как и на многие другие: что записано в ДНК человека и как расшифровать эти записи с пользой для здоровья? За что отвечают гены, а в чем наследственность не виновата? Как стресс может менять генетику человека и почему потомки тех, кому пришлось голодать, живут дольше? Что могут показать популярные сейчас генетические тесты, и имеет ли смысл их делать? Можно ли выделить генотип целой нации? Почему против японцев можно изобрести генетическое оружие, а против русских — не получится?
Константин Северинов работает и преподает в двух странах: в России — в научном центре Сколково, в Америке — в Ратгертском университете, поэтому он в курсе ведущих мировых тенденций и может авторитетно говорить и о клонировании. Возможно ли клонировать человека и каким будет его генетическая копия? Можно ли использовать клонирование для трансплантации? Почему клонировать отдельный орган сложнее?
Сейчас основное направление работ лабораторий Северинова — исследование микроцинов и бактериофагов. Разработки группы Северинова помогут создать антибиотики нового поколения. Почему на наш организм перестают действовать существующие антибиотики? И что произойдет с человечеством, если в ближайшее время не появятся новые антибиотики?
Самый неожиданный поворот в разговоре — рассказ про микробиом — мир бактерий, обитающий в каждом человеке. От чего зависят индивидуальные особенности нашего микробиома, как мы уживаемся с таким количеством бактерий, с какими бактериями надо бороться, а какие нужно культивировать? Только микробиолог может объяснить, почему самый эффективный способ борьбы с лишним весом — это борьба с помощью бактерий.
Источник: 1tv.ru
Урок 32. состав – структура – свойства — Естествознание — 10 класс
Естествознание, 10 класс
Урок 32. Состав – структура — свойства
Состав – структура — свойства
Перечень вопросов, рассматриваемых в теме:
- Какова структура вещества? Все ли вещества имеют молекулярную структуру?
- В чем причина многообразия веществ? Как структура молекул влияет на свойства веществ?
- Можно ли прогнозировать свойства вещества, зная его структуру (строение)?
Глоссарий по теме:
Генезис (греч. — genesis) — происхождение, становление и развитие, результатом которого является определенное состояние изучаемого объекта. Генезис природных и социальных явлений интересовал и интересует философию и науку с античности до наших дней (философский словарь).
Структу́ра (от лат. Structūra — «строение»), или строе́ние — внутреннее устройство чего-либо / Ожегов С.И. и Шведова Н.Ю. Толковый словарь русского языка. / Российская академия наук. Институт русского языка им. В.В.Виноградова. — М.:Азбуковник, 1999/.
Качественный состав – это перечень всех образующих вещество химических элементов.
Количественный состав – это число атомов каждого химического элемента в составе мельчайшей частицы вещества – его молекулы.
Запись, выражающая качественный и количественный состав вещества с помощью хими-ческих знаков, называется химической формулой.
Закон постоянства состава: Многие вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
Химическая связь – это совокупность сил, связывающих и удерживающих атомы или другие частицы в устойчивых структурах (молекулах и др.).
Гибридизация атомных орбиталей – это их перемешивание в пространстве с целью выравнивания и обеспечения наиболее полного перекрывания.
Аллотропия – это явление, при котором один и тот же химический элемент образует несколько простых веществ. Простые вещества, образованные одним элементом – это аллотропные модификации (видоизменения) этого элемента.
Изомерия – это явление, при котором существуют вещества, имеющие одинаковый состав, но разное химическое строение, а потому и свойства. Вещества, имеющие одинаковый состав, но разное химическое строение, а потому и разные свойства, называются изомерами.
Основная и дополнительная литература по теме урока:
Основные источники:
- Еремин В.В. Теоретическая и математическая химия для школьников. – М.: МЦНМО, 2007.
- Миттова И.Я., Самойлов А.М. История химии с древнейших времен до конца XX века: учебное пособие в 2-х томах. Т. 1. – Долгопрудный: ИД «Интеллект», 2009.
- Папулов Ю.Г, Левин В.П., Виноградова М.Г. Строение вещества в естественнонаучной картине мира: Молекулярные аспекты. Учебное пособие, 2-ое издание. Тверь: ТвГУ, 2005 — 208 с.
Дополнительные источники:
- Травень В. Ф. «Органическая химия», в 2-х томах. Москва, ИКЦ «Академкнига», 2004.
- Химия. Школьная энциклопедия. Гл. ред. Ю.А.Золотов. М.: Большая российская энциклопедия, 2003.
- Энциклопедия для детей. Том 17. Химия. Гл. ред. В.А.Володин. — М.: Аванта+, 2000.
Теоретический материал для самостоятельного изучения
Учение о молекуле лежит в основе всех
других обобщений, так что современную химию
можно по праву назвать молекулярной химией.
А. М. Бутлеров, (1828-1886), русский химик, создатель теории химического строения органических веществ, учёный-пчеловод и лепидоптеролог, общественный деятель
Установление взаимосвязи между свойствами веществ и строением молекул составляет фундаментальную научную проблему химии. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении порядка расположения атомов (связей) в исходных соединениях и характера изменений при образовании из них других соединений.
Мы знаем, что молекула представляет собой микрочастицу, образованную из атомов и способную к самостоятельному существованию, обладающую его главными химическими свойствами.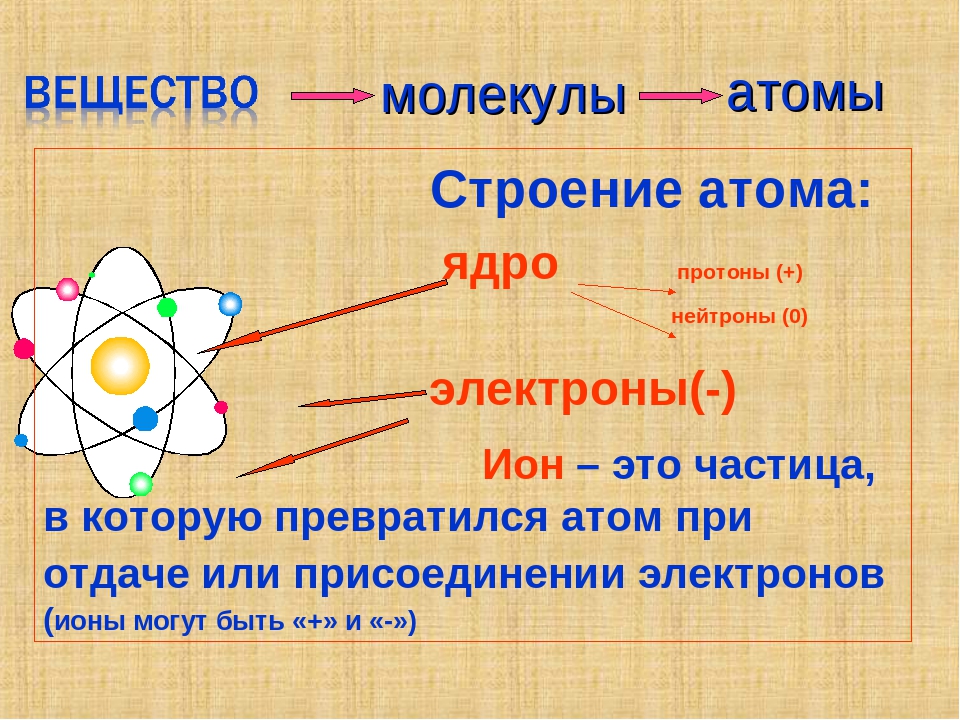 Она имеет постоянный состав входящих в нее атомных ядер и фиксированное число электронов и обладает совокупностью свойств, позволяющих отличать молекулы одного вида от молекул другого. Число атомов в молекуле может быть различным: от двух до сотен тысяч. Молекулы простых веществ состоят из одинаковых атомов, сложных – из разных атомов. Существует большое количество соединений, молекулы которых состоят из многих тысяч атомов — макромолекулы.
Она имеет постоянный состав входящих в нее атомных ядер и фиксированное число электронов и обладает совокупностью свойств, позволяющих отличать молекулы одного вида от молекул другого. Число атомов в молекуле может быть различным: от двух до сотен тысяч. Молекулы простых веществ состоят из одинаковых атомов, сложных – из разных атомов. Существует большое количество соединений, молекулы которых состоят из многих тысяч атомов — макромолекулы.
Первые представления о структуре молекул основывались на химическом анализе. Со времен М.В. Ломоносова (1741), который высказал мысль, что свойства вещества зависят от рода, числа и расположения «элементов» (атомов), составляющих его «корпускулу» (молекулу), представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволило определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле, составленной на основе качественного и количественного анализа, а также закона постоянства состава (Ж.Пруст). В дальнейшем А.М. Бутлеров (1861) ввел понятие химического строения (как порядка связи атомов в молекуле) и показал, что свойства вещества определяются его составом и химическим строением. Стереохимическая гипотеза Я. Вант-Гоффа и Ле Беля (1874) расширила понятие строения. Оказалось, что свойства вещества зависят как от химического (в топологическом плане), так и пространственного строения молекул. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. В таблице 1 отражена зависимость пространственного строения веществ от типа гибридизации.
Межатомные связи должны также соответствовать пространственному расположению атомов. В таблице 1 отражена зависимость пространственного строения веществ от типа гибридизации.
«Пространственное строение частиц в зависимости от типа гибридизации». Приведите свои примеры веществ.
Тип гибриди-зации центрального атома | Пространственное строение частицы | Условное изображение | Примеры |
sp | Линейное | ВеС12, ZnCl2, С2Н2 | |
sp2 | Плоскостно-тригональное | BCl3, N03—,CO32-, C2H4, C6H6 | |
sp3 | Тетраэдр | CH4, NH4+, SO42-, CC14 | |
sp3 | Тригональная пирамида | NH3, H30+ | |
sp3 | Угловое | Н20 |
Чем различаются понятия «свойства молекулы» и «свойства вещества»?
Подсказка. Допустим, вы открыли химический справочник и в статье «Азот» прочитали: «N2 – газ без цвета и запаха, tкип = –196 °С, tпл = –210 °С, энергия химической связи 940 кДж/моль». Какие из этих характеристик относятся к свойствам молекулы азота, а какие к свойствам простого вещества?
В состав молекулы может входить различное число атомов. Так, молекулы благородных газов одноатомны, молекулы таких веществ, как водород, азот, — двухатомны, воды — трехатомны и т.д. Молекулы наиболее сложных веществ — высших белков и нуклеиновых кислот — построены их такого количества атомов, которое измеряется сотнями тысяч. При этом атомы могут соединяться друг с другом не только в различных соотношениях, но и различным образом. Поэтому при сравнительно небольшом числе химических элементов число различных веществ очень велико.
При этом атомы могут соединяться друг с другом не только в различных соотношениях, но и различным образом. Поэтому при сравнительно небольшом числе химических элементов число различных веществ очень велико.
Все ли вещества состоят из молекул?
Подсказка. Для ответа на этот вопрос обратитесь к строению таких веществ как металлы, алмаз, графит, хлорид натрия.
Не во всех случаях частицы, образующие вещество, представляют собой молекулы.
Многие вещества в твердом и жидком состоянии, например, большинство солей, имеют не молекулярную, а ионную структуру. Некоторые вещества имеют атомное строение. В веществах, имеющих ионное или атомное строение, носителем химических свойств являются не молекулы, а те комбинации ионов или атомов, которые образуют данное вещество.
Вспомните, какие типы связей и кристаллических решеток существуют? Чем определяются свойства веществ?
В зависимости от природы частиц, образующих кристалл, различают атомные, молекулярные, ионные и металлические кристаллические решетки
Таблица 2 «Зависимость свойств веществ от типа связи и кристаллических решеток»
Тип кристаллической решетки | Характерный вид химической связи | Частицы, располагающиеся в узлах решетки | Примеры веществ и их характерные свойства |
Атомная | Ковалентная неполярная | Атомы | Некоторые неметаллы, оксиды и др. Чаще твердые вещества, обладающие высокой прочностью. Тугоплавки. Полупроводники и диэлектрики. |
Молекулярная | Ковалентная неполярная и полярная | Молекулы | Неметаллы, оксиды, кислоты и др. Разнообразны по агрегатному состоянию и другим свойствам. Легко переходят из одного агрегатного состояния в другое. Летучи, легкоплавки. |
Ионная | Ионная | Ионы | Соли, щелочи и др. |
Металлическая | Металлическая | Атомы и катионы металла | Металлы. Твердые вещества (кроме ртути) с металлическим блеском. Ковки, пластичны. Обладают тепловой и электрической проводимостью. |
В настоящее время известен не один десяток миллионов разнообразных веществ. При этом все они образованы значительно меньшим числом химических элементов (современной науке достоверно известно 112 химических элементов).
Как объяснить такое разнообразие веществ?
Что такое аллотропия?
Приведите примеры аллотропных модификаций известных вам химических элементов. Дайте сравнительную характеристику их свойств.
Явление аллотропии характерно для большинства неметаллов и многих металлов. При этом образуемые ими аллотропные модификации могут различаться по составу, строению и типу кристаллических решеток.
Между аллотропными модификациями одного элементы возможны взаимные переходы. При этом все они имеют разную устойчивость. Как правило, при одних и тех же условиях более стабильна лишь одна из модификаций, обладающая минимальным запасом энергии. Остальные модификации при этих же условиях будут неустойчивы и рано или поздно перейдут в более устойчивую форму.
Что такое изомерия?
Изомерия – это явление, при котором существуют вещества, имеющие одинаковый состав, но разное химическое строение, а потому и свойства. Вещества, имеющие одинаковый состав, но разное химическое строение, а потому и разные свойства, называются изомерами.
Приведите примеры известных вам изомеров. Укажите, в чем заключаются различия их строения и свойств.
Явление изомерии характерно и для неорганических, и для органических веществ. Однако особенно ярко оно проявляется среди органических соединений, являясь важнейшей причиной их многообразия.
Таблица Изомерия органических соединений
Виды изомерии органических соединений | |||||
Структурная изомерия | |||||
Углеродного скелета | Положения функциональных групп | Положения кратных связей | Межклассовая | ||
Пространственная изомерия | |||||
Конформационная | Геометрическая | Оптическая | |||
Проиллюстрируйте указанные в таблице виды изомерии примерами.
Выводы:
- Молекулы — это очередной после атомов качественный уровень строения и эволюции вещества.
- Вещества имеют разный состав и строение.
- Свойства веществ определяются их строением: характером связей, типом кристаллической решетки, пространственным расположением, порядком соединения атомов.
- Зная строение вещества можно прогнозировать его свойства.
Примеры и разбор решения заданий тренировочного модуля:
Задание 1. Вещество, в узлах кристаллической решетки которого находятся ионы, это…
Тип вариантов ответов: (Текстовые, Графические, Комбинированные).
а) CaС12;
б) NH3;
в) I2;
г) C (графит).
Правильный вариант/варианты (или правильные комбинации вариантов): а
Подсказка: В узлах ионных решеток располагаются, чередуясь, положительно и отрицательно заряженные ионы. К соединениям с ионной связью, образующим ионные решетки, относится большинство солей и небольшое число оксидов.
Задание 2. Соедините попарно прямоугольники с овалами так, чтобы каждому типу гибридизации атомных орбиталей углерода соответствовал пример молекулы. |
Правильный вариант: Подсказка: Тип гибридизации атомных орбиталей углерода определяется числом заместителей при этом атоме углерода:
|
«Дофамин: самый нужный гормон. Как молекула управляет человеком» Либерман Дениэл — описание книги | Научпоп для всех
Алтайский край
Альметьевск
Амурская область
Ангарск
Астрахань
Белгород
Братск
Брянск
Владимирская область
Волгоград
Волгоградская область
Воронеж
Екатеринбург
Ивановская область
Иркутск
Кабардино-Балкарская Республика
Калужская
Кемерово
Кемеровская область
Киров
Кострома
Краснодарский край
Красноярск
Красноярский край
Курганская
Курск
Липецк
Москва
Московская область
Нижний Новгород
Нижний Тагил
Новосибирск
Омск
Оренбург
Оренбургская область
Орловская область
Пенза
Пермь
Приморский край
Республика Адыгея
Республика Башкортостан
Республика Крым
Республика Северная Осетия — Алания
Республика Татарстан
Республика Тыва
Республика Хакасия
Ростов-на-Дону
Ростовская область
Самара
Саратов
Саратовская область
Севастополь
Смоленск
Ставрополь
Ставропольский край
Тамбов
Томск
Тула
Тюмень
Ульяновск
Хабаровск
Ханты-Мансийский автономный округ
Челябинск
Челябинская область
Чувашская Республика
Ярославль
Ярославская область
Весёлые эксперименты и опыты для детей
Ничто так не помогает насытить неуемную любознательность ребенка, как веселые опыты: для детей с их постоянными «почему», «как» и «зачем» нет ничего более важного, чем новое понимание — особенно если это понимание одного из химических или физических процессов окружающего мира.
Спешим вас обрадовать: для того, чтобы провести наглядные, поучительные и очень интересные опыты для детей, не нужны ни специальная подготовка, ни оборудование, ни редкие или дорогие материалы. С нашей помощью вы сможете устроить волшебную лабораторию просто у себя на кухне, а многие эксперименты под вашим присмотром ребята смогут сделать и сами.
Простые и веселые эксперименты на вашей кухне
Сегодня мы поговорим о самых простых опытах, демонстрирующих законы физики и химии, а главное— неизменно радующих маленьких зрителей. Вот какие чудеса вы можете сделать своими руками и без особых усилий.
- Фейерверк в молоке
- Картофель-«подводная лодка»
- Лимон-аккумулятор
- Волшебный стакан
Что может быть веселее, чем волшебные превращения чего-то бесконечно привычного — например, молока.
Берем: цельное (не обезжиренное) молоко, разноцветные пищевые красители, средство для мытья посуды, тарелка и палочка.
Опыт проводится так: молоко выливаем в тарелку, аккуратно добавляем красители (по 2-3 капли каждого), смачиваем палочку моющим средством и опускаем ее в центр молока.
Эффект: цвета начинают перемешиваться, создавая настоящий калейдоскоп.
Объяснение: входящие в молоко молекулы реагируют с молекулами моющего средства, запуская сразу несколько химических процессов, основной из которых — реакция с участием молекул жира, которые приходят в движение; поверхностное натяжение снижается, красители начинают перемещаться по поверхности молока, смешиваясь и создавая настоящий взрыв цвета.
Вы научили ребенка чистить картошку и полагаете, что этим корнеплодом его уже не удивить? А вот и нет!
Берем: банку емкостью 1 л, соль, картофельный клубень.
Опыт проводится так: заполняем банку до половины водой и наблюдаем, как картофелина тонет в воде; добавляем в воду соль — картошка в насыщенном растворе всплывает, разводим раствор водой — снова тонет. Вот так «подводная лодка»!
Объяснение: картошка тяжелее воды, но легче насыщенного соляного раствора.
Хорошо, если ставя веселые эксперименты для детей, вы объясняете им нюансы — вот почему этот опыт лучше проводить с папой, который расскажет, откуда здесь берется электричество.
Берем: вымытый и хорошо высушенный после мытья лимон, скрепку для бумаги, иголку, изолированную медную проволоку (20 см длины, до 0,5 мм в диаметре), лампочку из фонарика
Опыт проводится так: разрезаем проволоку на 2 части, зачищаем концы; в лимоне делаем иглой два прокола на расстоянии 1-1,5 см, в один вставляем скрепку с прикрученной к ней проволочкой, в другой — вторую проволочку; свободные концы медных проволочек прикладываем к контактам лампы — о, чудо! лампочка горит!
Хотите простейшую идею, как отвлечь ребенка, если он вам не дает сосредоточиться на важном деле — вот она!
Берем: тонкостенный стеклянный стакан, чистую воду.
Опыт проводится так: заполняем стакан доверху, берем его в руку и смотрим сквозь воду на пальцы другой руки.
Эффект: пальцы выглядят длинными и тонкими, как макароны, кисти не видно вообще; поворачиваем пальцы вверх — и они превращаются в толстые коротенькие сардельки, а если отодвинуть стакан подальше он глаз, то кисть превратится в ручку лилипута. Ну, и просто посмотрите друг на друга — стакан смеха, да и только!
атомов и молекул — Новости для детей
Атом — это основная единица, из которой все сделано. Есть много разных видов атомов с разными названиями, размерами и весом *.
Атомы очень маленькие. Самый большой из них будет примерно в 200 000 раз меньше ширины человеческого волоса. Поскольку они такие маленькие, атомы невозможно увидеть без специальных инструментов.
На данный момент ученым известно около 118 различных видов атомов. Такие атомы называются элементами.Вы, наверное, уже знаете о некоторых из них. Например, гелий, неон и золото состоят из атомов одного вида. Это элементы.
Различные виды атомов, называемые «элементами», расположены в таблице.
Это называется «Периодическая таблица элементов».
(Источник: OpenStax University Physics, Wikimedia Commons.)
Molecules
Молекулы образуются при соединении атомов. Например, вы могли слышать, как кто-то назвал воду «h3O».Это потому, что два атома водорода (H) и один атом кислорода (O) объединяются в молекулу воды.
Молекула воды состоит из двух атомов водорода и одного атома кислорода (h3O).(Источник: Wikimedia Commons.)
Молекула — это наименьшее количество чего-то, что вы можете получить, не разбивая его на что-то другое. Например, если вы взяли одну молекулу воды и разбили ее, у вас больше не было бы воды. У вас есть водород и кислород.
Что составляет атом?
В центре атомов есть протоны и нейтроны.Электроны движутся снаружи.На схеме показаны части атома лития. На самом деле атом так не выглядит.
(Источник: AG Caesar, Wikimedia Commons.)
Каждый атом состоит из трех видов меньших частей: протонов, (которые заряжены положительно), нейтронов, (не имеют заряда) и электронов, (которые заряжены отрицательно). Протоны и нейтроны тяжелее и остаются в середине атома. Их называют ядром.Они окружены облаком движущихся электронов, которые очень легкие и притягиваются к положительному заряду ядра.
У разных атомов разное количество протонов, нейтронов и электронов. Их подсчет покажет вам, из какого элемента находится атом. Например, у атома лития 3 протона, 3 или 4 нейтрона и 3 электрона.
* Ученые обычно предпочитают говорить «масса» вместо «вес».
действительно ли все состоит из молекул?
Любопытные дети — это серия для детей всех возрастов, в которой «Разговор» просит экспертов ответить на вопросы детей.Приветствуются все вопросы: узнайте, как войти, внизу этой статьи.
Люди говорят, что все состоит из молекул. Чувства состоят из молекул? Звук состоит из молекул? — Клэр, шесть лет, Бристоль, Великобритания
Спасибо за вопрос, Клэр. Перво-наперво: когда люди говорят «все», они часто имеют в виду то, что ученые называют «материей». Материя — это то, к чему можно прикоснуться. Но чувства не имеют значения, и это тоже не звук.
Перво-наперво: когда люди говорят «все», они часто имеют в виду то, что ученые называют «материей». Материя — это то, к чему можно прикоснуться. Но чувства не имеют значения, и это тоже не звук.
Материя включает звезды, воздух, воду, столы, стулья, деревья, ваше тело, ваш мозг и почти все, что вы видите вокруг себя.
Все эти вещи состоят из молекул, но молекулы — не самые маленькие частицы материи, потому что каждая молекула состоит из еще более мелких частей, называемых атомами.
А сами атомы состоят из еще более мелких частей. Один из самых крохотных частиц, из которых состоит материя, называется электроном.
Электроны и эмоции
Вещи, не имеющие значения, включают чувства, мысли и свет. Свет позволяет нам видеть все, что нас окружает, но он отличается от материи. Главное отличие в том, что он ничего не весит. Даже воздух имеет вес, а свет — нет.
Чувства и мысли тоже не имеют веса и не имеют значения. Но и они не легкие. Чувства и мысли живут в нашем мозгу.
То, как действует материя в нашем мозгу, влияет на наши чувства и мысли, а наши чувства и мысли могут влиять на то, как действует материя в нашем мозгу.
Чувства не имеют значения, важен ваш мозг. Shutterstock.Ученые еще не знают точно, как возникают мысли, но они знают, что это имеет какое-то отношение к тому, как эти мельчайшие частицы материи — электроны — перемещаются, создавая электрический сигнал, подобный сигналам, которые посылаются от выключатель света, чтобы включить свет.
Например, ученые выяснили, что ваш мозг хранит воспоминания, удерживая электроны в определенных местах.
Есть разные чувства. Есть чувства, о которых вам говорит ваше тело, например, когда вы обжигаете палец свечой или когда чувствуете голод. А есть чувства, которые мы называем эмоциями, например, когда вы грустите или взволнованы.
Оба типа чувств создаются в вашем мозгу, и оба они снова связаны с этими электронами, с тем, как они движутся и где они находятся в вашем мозгу.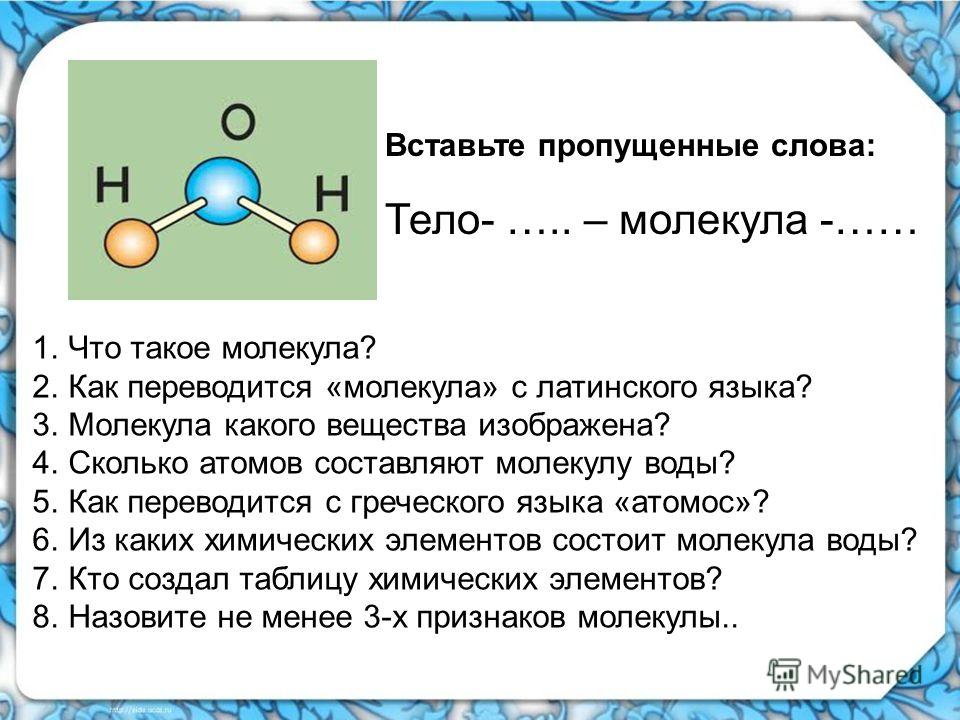
Восприятие звука
Звук снова другое дело. Звук состоит из волн, но не совсем как волны в океане.Звуковые волны создаются, когда молекулы вокруг нас движутся определенным образом.
Представьте, что вы включаете громкую музыку через динамик. Если вы дотронетесь до передней части динамика во время воспроизведения музыки, вы должны почувствовать, как он покачивается.
Колебание динамика заставляет молекулы в воздухе вокруг него колебаться и сталкиваться друг с другом.
Это небольшое покачивание заставляет другие молекулы поблизости колебаться, и колебания переходят от одной группы молекул воздуха к другой, пока, наконец, не достигают молекул воздуха рядом с барабанной перепонкой.
Ваша барабанная перепонка очень чувствительна и может распознавать колебания молекул воздуха, поэтому посылает в ваш мозг особое сообщение. Ваш мозг получает сообщение и говорит: «Это музыка!» — и вот как вы слышите песню.
Итак, ни чувства, ни звук не состоят из молекул так, как материя. Но оба они имеют прямое отношение к тому, как движутся молекулы — и их меньшие части, атомы и электроны.
Здравствуйте, любопытные ребята! У вас есть вопрос, на который вы хотите получить ответ от эксперта? Попросите кого-нибудь из взрослых прислать нам свой вопрос.Вы можете:
* Отправьте свой вопрос по адресу [email protected]
* Сообщите нам в Twitter, пометив @ConversationUK хэштегом #curiouskids или
* Напишите нам на Facebook.
Сообщите, пожалуйста, свое имя, возраст и город, в котором вы живете. Если хотите, вы также можете отправить аудиозапись своего вопроса. Отправляйте сколько угодно вопросов! Мы не сможем ответить на все вопросы, но сделаем все, что в наших силах.
Другие статьи «Любопытные дети», написанные академическими экспертами:
Урок по науке об атомах и молекулах для детей
Урок науки: атомы
«Из чего на самом деле все сделано?» Подобные вопросы задавались веками, и ученые постоянно пытаются найти ответ. Когда-то ученые считали, что самым маленьким «строительным блоком» материи был атом , название происходит от греческого слова, означающего «неспособный разрезать».Позже было обнаружено, что, хотя атом является самой маленькой единицей, обладающей химическими свойствами элемента , даже атомы состоят из более мелких частиц. Элементы — это простейшие вещества, встречающиеся в природе, и их невозможно расщепить обычными химическими средствами. На сегодняшний день обнаружено по меньшей мере 92 встречающихся в природе элемента. Элементы организованы в периодическую таблицу в зависимости от их различных свойств.
Чтобы продемонстрировать идею атома как наименьшей единицы элемента, возьмите стопку скрепок и разделите ее на две стопки, а затем снова разделите их пополам.Продолжайте делить, пока у вас не сложится одна скрепка. Первоначальная стопка представляла собой материю, и вы только что разделили ее до ее мельчайших единиц, которые все еще функционируют — одна скрепка все еще скрепляет отдельные листы. Разрежьте скрепку пополам. Он по-прежнему выполняет ту же работу, что и целая скрепка? Нет. Таким же образом атом — это наименьшая часть элемента, который все еще функционирует как элемент.
Плотная центральная часть атома, называемая ядром , состоит из протонов и нейтронов .Протоны — это маленькие частицы с положительным электрическим зарядом. Число протонов в атоме, называемое атомным номером , определяет «идентичность» атома или его элемент. Например, все атомы меди состоят из 29 протонов. (Если вы посмотрите на таблицу Менделеева, вы увидите, что элементы упорядочены по атомным номерам. ) Нейтроны , как следует из их названия, не имеют электрического заряда, но они значительно увеличивают массу тела человека. атом. Фактически, приблизительно атомных масс атома — это сумма масс протонов и нейтронов, сложенных вместе.(Атомная масса указана прямо под символом элемента в периодической таблице.) Хотя все атомы определенного элемента всегда будут иметь одинаковое количество протонов, иногда атомы этого элемента могут иметь разное количество нейтронов. В данном случае эти атомы называются изотопами.
) Нейтроны , как следует из их названия, не имеют электрического заряда, но они значительно увеличивают массу тела человека. атом. Фактически, приблизительно атомных масс атома — это сумма масс протонов и нейтронов, сложенных вместе.(Атомная масса указана прямо под символом элемента в периодической таблице.) Хотя все атомы определенного элемента всегда будут иметь одинаковое количество протонов, иногда атомы этого элемента могут иметь разное количество нейтронов. В данном случае эти атомы называются изотопами.
Атом также содержит другие частицы, называемые электронами, , которые вращаются вокруг ядра . Они имеют настолько маленькую массу, что их игнорируют при вычислении атомной массы.Электроны имеют отрицательный электрический заряд, который уравновешивается положительным зарядом протона, образуя нейтральный атом. Однако при наличии достаточной энергии электроны могут иногда отскакивать от атома, нарушая электрический баланс и давая атому положительный заряд. Точно так же иногда атом может получить дополнительный электрон, придав ему отрицательный заряд. Атомы с несбалансированными электрическими зарядами, положительными или отрицательными, называются ионами . Положительные ионы — атомы, потерявшие электроны — немного меньше исходного атома, а отрицательные ионы, получившие электроны, немного больше.
Урок науки: связывание и молекулы
Вся материя состоит из крошечных атомов, так как же нам получить более крупную субстанцию, такую как вода, сахар или железо? Эти очень маленькие атомы могут соединяться в более крупные соединения: ионов или молекул .
Существуют разные типы облигаций, основанные на различных отношениях между элементами. Когда металлы и неметаллы соединяются, тип связи — , ионный, . Электрон от одного элемента на переходит на на внешний электронный уровень или на валентность другого элемента.Образованные таким образом соединения являются ионами, а не молекулами, потому что связанные атомы изменяют количество своих электронов и, таким образом, становятся электрически несбалансированными.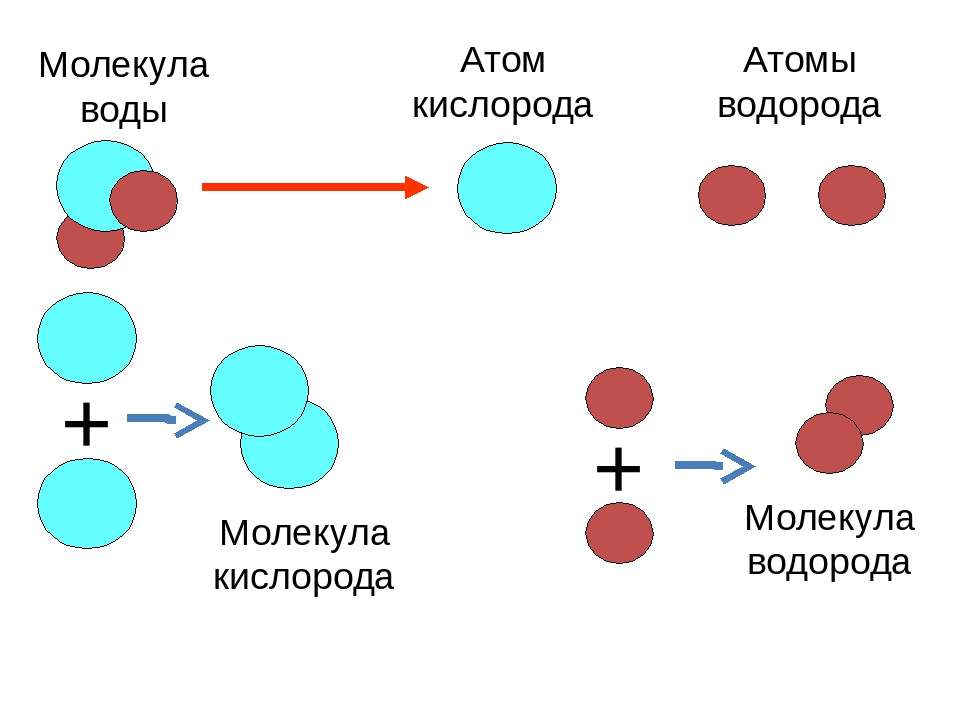
Молекулы, состоящие из неметаллов, соединены ковалентными связями ; их электроны разделяются на парами атомов, а не переносятся, поэтому связь между ними имеет тенденцию быть очень прочной.
В молекулах, состоящих из металлов, тип связи называется металлический . Название, которое ученые используют для объяснения электронных взаимоотношений в этих молекулах, называется теория «электрон-море» .Как и в молекулах с ковалентными связями, электроны разделены; но они являются общими для всех атомов вместе, а не между отдельными людьми. Валентные электроны (те, что находятся на внешнем электронном уровне) становятся «свободными» и мобильными в середине соединения, ограниченными положительными зарядами протонов соединенных атомов.
Молекулы имеют разные формы в зависимости от типов атомов, связанных вместе. Теория отталкивания электронных пар валентной оболочки (VSEPR) объясняет эту взаимосвязь тем, что молекул будут формировать любую форму, которая будет удерживать валентные электроны в центральном атоме как можно дальше друг от друга .
Соединения атомов могут существовать в трех различных состояниях. Твердые тела состоят из медленно движущихся молекул. Жидкости состоят из более быстро движущихся молекул; силы притяжения между атомами частично преодолеваются движением. В газах молекулы движутся очень быстро, и силы притяжения полностью преодолеваются. Тепло заставляет молекулы двигаться быстрее, поэтому твердый лед при нагревании тает в воду, жидкость. Если кипятить воду на плите, она испарится, когда нагреется, превратившись в газ.Обычно жидкости, состоящие из молекул с высоким атомным весом, кипятят дольше, потому что молекулам требуется больше времени, чтобы начать движение.
Чтобы помочь вам визуализировать, как атомы соединяются в молекулы, поэкспериментируйте с нашим набором молекулярных моделей.
Урок науки: модели атома
Древние думали, что все состоит из четырех элементов: земли, огня, воды и воздуха. Позже ученые пришли к выводу, что вся материя состоит из крошечных невидимых частиц. Они назвали эти частицы атомами , от греческого слова, означающего «неспособный разрезать».Но как узнать о том, чего не видно? Перед учеными долгое время стояла трудная задача понять структуру атомов путем сбора косвенных свидетельств о них, поскольку они не могут видеть сами атомы. Теории, которые они выдвинули, называются атомными моделями.
Позже ученые пришли к выводу, что вся материя состоит из крошечных невидимых частиц. Они назвали эти частицы атомами , от греческого слова, означающего «неспособный разрезать».Но как узнать о том, чего не видно? Перед учеными долгое время стояла трудная задача понять структуру атомов путем сбора косвенных свидетельств о них, поскольку они не могут видеть сами атомы. Теории, которые они выдвинули, называются атомными моделями.
Основы современных атомных моделей были заложены Джоном Далтоном в начале 1800-х годов. Его модель объясняет, что элементы состоят из мельчайших частиц, называемых атомами, что атомы разных элементов имеют разные размеры и свойства, что атомы одного элемента не могут быть преобразованы в атомы другого элемента и что атомы образуют соединения, соединяясь друг с другом.Имея очень мало информации, Дальтон начал пытаться определить массы атомов различных элементов.
Далтон и другие долгое время считали атом неделимым, но в конце XIX века такие ученые, как Дж. Дж. Томпсон, экспериментируя с электричеством, обнаружил существование в атоме отрицательно заряженных частиц — электронов. Поскольку модель Дальтона не могла объяснить электроны, Томпсон создал новую модель атома. Он утверждал, что электроны существуют в положительно заряженном материале, который их окружает и уравновешивает заряды, делая атом нейтральным.При определенных обстоятельствах, предположил Томпсон, электроны могут быть удалены из атома. Эту атомную модель иногда называют моделью «сливового пудинга», поскольку изображение электронов в положительно заряженном материале скорее похоже на сливы в пудинге.
Модель Томпсона вскоре перестала соответствовать свидетельствам, обнаруженным в 1911 году Эрнестом Резерфордом, который работал с радиоактивными элементами и положительно заряженными ионами, называемыми «альфа-частицами» (состоящими из двух протонов и двух нейтронов), которые испускались этими элементами.Резерфорд экспериментировал с нацеливанием альфа-частиц на золотую фольгу. Большая часть альфа-частиц прошла прямо через фольгу, как и следовало ожидать от атомной модели Томпсона. Однако некоторые частицы отражались. Резерфорд пришел к выводу, что атомы должны иметь некоторую плотную центральную часть, которая была бы достаточно сильной, чтобы отражать направленные на них альфа-частицы. Он назвал это ядром , и определил, что в нем есть положительно заряженные частицы, называемые протонами , , которые уравновешивают отрицательные заряды электронов.
Большая часть альфа-частиц прошла прямо через фольгу, как и следовало ожидать от атомной модели Томпсона. Однако некоторые частицы отражались. Резерфорд пришел к выводу, что атомы должны иметь некоторую плотную центральную часть, которая была бы достаточно сильной, чтобы отражать направленные на них альфа-частицы. Он назвал это ядром , и определил, что в нем есть положительно заряженные частицы, называемые протонами , , которые уравновешивают отрицательные заряды электронов.
Однако электроны и протоны не могли объяснить всю массу атома, и в 1932 году Джеймс Чедвик идентифицировал нейтральные частицы, которые находятся в ядре: нейтроны. Таким образом, основываясь на открытиях других ученых, ученые пришли к выводу, что «неделимые» атомы на самом деле состоят из более мелких частиц.
Более поздние атомные модели, такие как модель Бора и квантовая модель, принимают присутствие электронов, протонов и нейтронов как факт. Эти модели фокусируются на размещении и поведении электронов, и они пытаются определить, как электроны движутся на разных уровнях атома.
Активность атомов и молекул — Playdough To Plato
Активность для детей от 7 лет и старше.
Ищете забавный способ рассказать детям об атомах и молекулах ?! Мы вас прикрыли! Наш пакет мероприятий по атомам и молекулам включает в себя увлекательные практические занятия, которые знакомят с частями атома (ядро, протоны, электроны и нейтроны), а затем показывают, как несколько атомов группируются вместе, образуя молекулы.
Возьмите свой пакет действий с атомами и молекулами в нашем магазине или на сайте Teachers Pay Teachers!
Этот пост содержит партнерские ссылки Amazon.
Атомы бумажной тарелки
Для начала я взял бумажную тарелку, маркер, клей и три разных набора из 7 помпонов, чтобы Большой Брат (6,5 лет) смог сделать модель атома.
Мы говорили о ядре, которое содержит положительно заряженные протоны и нейтрально заряженные нейтроны.
Затем, поскольку на этот раз мы делали атом азота, он приклеил семь оранжевых протонов в центре пластины вместе с семью голубыми нейтронами.Этот сгусток протонов и нейтронов образовал его ядро.
Затем пришло время добавить наши отрицательно заряженные электроны, поэтому я показал Большому Брату, как электроны быстро вращаются вокруг ядра.
В атоме азота, подобном тому, который мы строили, есть два основных пути — внутренняя орбита с двумя электронами и внешняя орбита с пятью.
Он взял свой маркер и начертил круги по обеим орбитам. Мы использовали бумажные тарелки марки Chinet, на которых уже были вырезаны кольца для облегчения отслеживания — незапланированный, но ценный бонус.😉
Большой Брат склеил два электрона по внутренней орбите и пять по внешней.
Альт! Наш атом бумажной тарелки был готов.
Молекулы мармеладных капель
Сыграв в забавную игру «Загадочный элемент» с Периодической таблицей (входит в комплект упражнений), мы начали изучать, как атомы соединяются вместе, образуя такие молекулы, как вода и углекислый газ.
Взяв по одной карточке, я помог Старшему Брату прочитать общее название (например, вода) и название молекулы (h3O).Затем он вскочил и начал строить структурную формулу (рисунок) из зубочисток и леденцов.
Эти занятия сделали изучение атомов и молекул таким увлекательным и увлекательным! Их можно было бы использовать в в качестве научных центров, программ STEM или Makerpaces.
Возьми свой набор
Тоже готовы играть ?! Получите свой пакет действий с атомами и молекулами в нашем магазине или на сайте Teachers Pay Teachers!
Что такое молекула? — Определение от WhatIs.com
К Молекула — это самая маленькая частица химического элемента или соединения, обладающая химическими свойствами этого элемента или соединения. Молекулы состоят из атомов, скрепленных химическими связями. Эти связи образуются в результате разделения или обмена электронами между атомами. Атомы одних элементов легко связываются с другими атомами, образуя молекулы. Примеры таких элементов — кислород и хлор. Атомы некоторых элементов не легко связываются с другими атомами.Примеры — неон и аргон.
Эти связи образуются в результате разделения или обмена электронами между атомами. Атомы одних элементов легко связываются с другими атомами, образуя молекулы. Примеры таких элементов — кислород и хлор. Атомы некоторых элементов не легко связываются с другими атомами.Примеры — неон и аргон.
Молекулы могут сильно различаться по размеру и сложности. Элемент гелий представляет собой одноатомную молекулу. Некоторые молекулы состоят из двух атомов одного элемента. Например, O 2 — это молекула кислорода, наиболее часто встречающаяся в атмосфере Земли; в нем два атома кислорода. Однако при определенных обстоятельствах атомы кислорода объединяются в триплеты (O 3 ), образуя молекулу, известную как озон. Другие известные молекулы включают воду, состоящую из двух атомов водорода и одного атома кислорода (H 2 O), диоксид углерода, состоящий из одного атома углерода, связанного с двумя атомами кислорода (CO 2 ), и серную кислоту, состоящую из двух атомы водорода, один атом серы и четыре атома кислорода (H 2 SO 4 ).
Некоторые молекулы, особенно некоторые белки, содержат сотни или даже тысячи атомов, которые соединяются в цепочки, которые могут достигать значительной длины. Жидкости, содержащие такие молекулы, иногда ведут себя странно. Например, жидкость может продолжать вытекать из колбы, из которой она была вылита, даже после того, как колбу вернули в вертикальное положение.
Молекулы всегда в движении. В твердых телах и жидкостях они плотно упакованы. В твердом теле движение молекул можно сравнить с быстрой вибрацией.В жидкости молекулы могут свободно перемещаться между собой, что-то вроде скольжения. В газе плотность молекул обычно меньше, чем в жидкости или твердом теле того же химического соединения, и они движутся даже более свободно, чем в жидкости. Для определенного соединения в данном состоянии (твердое, жидкое или газообразное) скорость движения молекул увеличивается с увеличением абсолютной температуры.
Последнее обновление: декабрь 2016 г.
Продолжить чтение о молекулеChem4Kids.com: Атомы: Соединения
Начнем с молекул. Молекула — это общий термин, используемый для описания любых атомов, связанных химическими связями. Каждая комбинация атомов — это молекула. Соединение — это молекула, состоящая из атомов разных элементов. Все соединения являются молекулами, но не все молекулы являются соединениями. Газообразный водород (H 2 ) представляет собой молекулу, но не соединение, поскольку состоит только из одного элемента. Воду (H 2 O) можно назвать молекулой или соединением, потому что она состоит из атомов водорода (H) и кислорода (O).
Существует два основных типа химических связей, которые удерживают атомы вместе: ковалентные и ионные / электровалентные связи. Атомы, которые разделяют электроны в химической связи, имеют ковалентные связи. Молекула кислорода (O 2 ) является хорошим примером молекулы с ковалентной связью. Ионные связи возникают, когда электроны передаются от одного атома другому. Поваренная соль (NaCl) — распространенный пример соединения с ионной связью.
Вы также можете узнать о третьем типе облигаций. Между атомами металлов возникают металлические связи.Мы собираемся сосредоточиться на ионных и ковалентных связях.
Когда мы обсуждаем фазовые изменения в материи, мы смотрим на физических изменений. Одни только физические силы (если вы не находитесь внутри Солнца или чего-то экстремального) редко разрушают соединения полностью. Вы можете нагреть, чтобы растопить кубик льда, но молекулы воды не изменятся. Вы также можете налить чашку воды в емкость и уменьшить давление. Вода в конечном итоге закипит, но молекулы не изменятся.Химические изменения в соединениях происходят, когда химические связи создаются или разрушаются. Силы действуют на связи между атомами, изменяя молекулярную структуру вещества. Вы можете налить жидкую кислоту на твердое вещество и наблюдать, как твердое вещество растворяется в . Этот процесс является химическим изменением, потому что создаются и разрушаются молекулярные связи. Геологи поливают камни кислотами, чтобы проверить наличие определенных соединений.
Вокруг вас миллионы различных соединений. Вероятно, все, что вы видите, — это тот или иной тип соединения.Когда элементы соединяются и становятся составными, они теряют многие из своих индивидуальных черт. Один только натрий (Na) очень реакционноспособен . Но когда натрий и хлор (Cl) объединяются, они образуют нереактивное вещество , называемое хлоридом натрия (поваренная соль, NaCl). Новые соединения имеют мало или совсем не обладают физическими или химическими характеристиками исходных элементов. У них есть собственная новая жизнь.
Если вы посмотрите на хлорид натрия, он скреплен одной ионной / электровалентной связью. А как насчет хлорида магния (MgCl 2 )? Он содержит один атом магния (Mg) и два атома хлора (Cl).Есть две ионные связи. Метан (CH 4 ) состоит из одного углерода, (C) и четырех атомов водорода (H). Есть четыре связи, и все они ковалентны.У этих примеров очень простые химические связи. Однако большинство соединений имеют комбинации ионных и ковалентных связей. Давайте посмотрим на гидроксид натрия (Na-OH) …
Вы можете увидеть часть натрия (Na) слева и часть гидроксид (-OH) справа. Связь, которая связывает водород (H) с кислородом (O), является ковалентной.Натрий связан с гидроксидной частью соединения ионной связью. Это хороший пример того, как в одном соединении могут быть разные типы связей.
Диссектор молекул — масс-спектрометр (видео NASA / GSFC)
забавных фактов для детей о молекулах воды
Факты о молекулах воды
Вода — самое важное и обычное явление для существования жизни на Земле.Он состоит из двух элементов, водорода и кислорода, а химическая формула — H 2 O. Это означает, что две молекулы водорода связаны с одной молекулой кислорода. Вода имеет три состояния: в жидком состоянии она называется водой, в газообразном состоянии — паром, а в твердом состоянии — льдом.
Краткие сведения: —
- Около 70% нашего тела также состоит из воды. А на момент нашего рождения эта цифра составляла 80%.
- Вода — хороший растворитель. Легко растворяется с солью, сахаром и другими кислотами.Но некоторые другие вещества, такие как жир, масла и т. Д., Не смешиваются с водой.
- Чистая вода не имеет цвета, запаха или вкуса, так как имеет pH около 7.
- В нормальных условиях вода кипит при 100 ° C и замерзает при 0 ° C.
- Замороженная вода означает, что лед занимает больше места, чем жидкая форма. Это причина того, что зимой лопаются многие водопроводные трубы.
- В полярных ледяных шапках Марса вода находится в форме льда.
- Температура вашего окружения определяет количество воды, которое вам требуется каждый день.
- Текущая вода может генерировать электричество. Весь этот процесс происходит на гидроэлектростанциях.
- Более 70% поверхности нашей планеты покрыто водой с приблизительным объемом в 325 миллионов кубических миль.
- 8% воды в мире имеет форму льда и не может быть использована.
- Человек может прожить 30 дней без еды, но не может прожить более 7 дней без воды.
- Более 90% пресной воды в мире находится в Антарктиде и не может быть использована.
Закрыть
Цитировать эту страницуВы можете вырезать и вставить приведенные ниже примеры цитирования MLA и APA:
MLA Style Citation
Declan, Tobin.

 Твердые вещества с высокими температурами плавления. Малолетучи. Хорошо растворяются в полярных растворителях.
Твердые вещества с высокими температурами плавления. Малолетучи. Хорошо растворяются в полярных растворителях.