Ортопедические последствия у детей, перенесших острый гематогенный остеомиелит Текст научной статьи по специальности «Клиническая медицина»
УДК 616.71—018.46—002.1—053.36/.37—08-089.8
ОРТОПЕДИЧЕСКИЕ ПОСЛЕДСТВИЯ У ДЕТЕЙ, ПЕРЕНЕСШИХ ОСТРЫЙ ГЕМАТОГЕННЫЙ ОСТЕОМИЕЛИТ
Ильдар Фуатович Ахтямов1, Марат Рашатович Гильмутдинов 3, Алексей Петрович Скворцов 3, Алмаз Асхатович Ахунзянов 2
1 Кафедра травматологии, ортопедии и экстремальных состояний (зав. — проф.И.Ф. Ахтямов), 2 кафедра детской хирургии с курсом ФПК и ППС (зав. — доц. Л.М. Миролюбов) Казанского государственного медицинского университета, 3 кафедра травматологии и ортопедии (зав. — чл.-корр АН РТ, проф. Х.З. Гафаров) Казанской государственной медицинской академии последипломного образования, е-таИ: [email protected]
Реферат
С целью оценки эффективности лечения острого гематогенного остеомиелита и определения основных видов ортопедических осложнений у детей младшего возраста проведен анализ лечения этого заболевания у 36 детей в возрасте от 11 дней до 2,1 года. В 22 (61,1%) случаях установлено полное выздоровление пациента, а в 10 (27,8%) — нарушение роста. Тяжелые ортопедические последствия развились у 4 из 5 детей, поступивших в периоде новорожденности, которым понадобилось оперативное лечение.
Ключевые слова: острый гематогенный остеомиелит, ортопедические осложнения, оперативное лечение.
До сих пор гематогенный остеомиелит является распространенным и крайне тяжелым гнойно-воспалительным заболеванием детского возраста [1]. Успехи в лечении острого гематогенного остеомиелита (ОГО) выразились в снижении летальности детей с 45 до 8,4%, однако число рецидивов и его осложнений достигает 68% [3].
Цель исследования: оценить эффективность лечения ОГО и определить основные виды ортопедических осложнений у детей младшего возраста.
Проведен анализ результатов лечения острого метаэпифизарного остеомиелита у 36 детей в возрасте от 11 дней до 2,1 года и у одной больной 6 лет, находившихся в Детской республиканской клинической больнице МЗ РТ с 1994 по 2004 г. Среди них было 19 (52,8%) мальчиков и 17 (47,2%) девочек. Распределение больных по возрасту и полу было следующим: 32
мальчиков, поступивших в периоде ново-рождённости, было 5, в возрасте до одного года — 9, от одного года до 2 лет — 5, старше 2 лет — 0, девочек — соответственно 5,
В первые три дня от начала заболевания были госпитализированы 14 (38,8%) детей, на 4—7-е — 19 (52,8%) и позднее 7 суток — 3 (8,3%). Высокая частота (61,1%) позднего обращения к детскому хирургу связана с первичным обращением к врачам других специальностей (травматолог, педиатр, невропатолог).
В ходе анализа историй болезни обследованных детей было выявлено, что ОГО привел к поражению нижних конечностей в области проксимального эпимета-физа бедренной кости в 8 (22,2%) случаях, дистального эпиметафиза бедренной кости — в 12 (33,3%), проксимального эпиметафиза большеберцовой кости — в 6 (16,7%), дистального эпиметафиза больше-берцовой кости — в 4 (11,1%). Поражение верхней конечности локализовалось в 9 (25%) случаях в проксимальном эпимета-физе плечевой кости, в 1 (2,8%) — в дис-тальном эпиметафизе плечевой кости, а в 4 (11,1%) — в костях предплечья.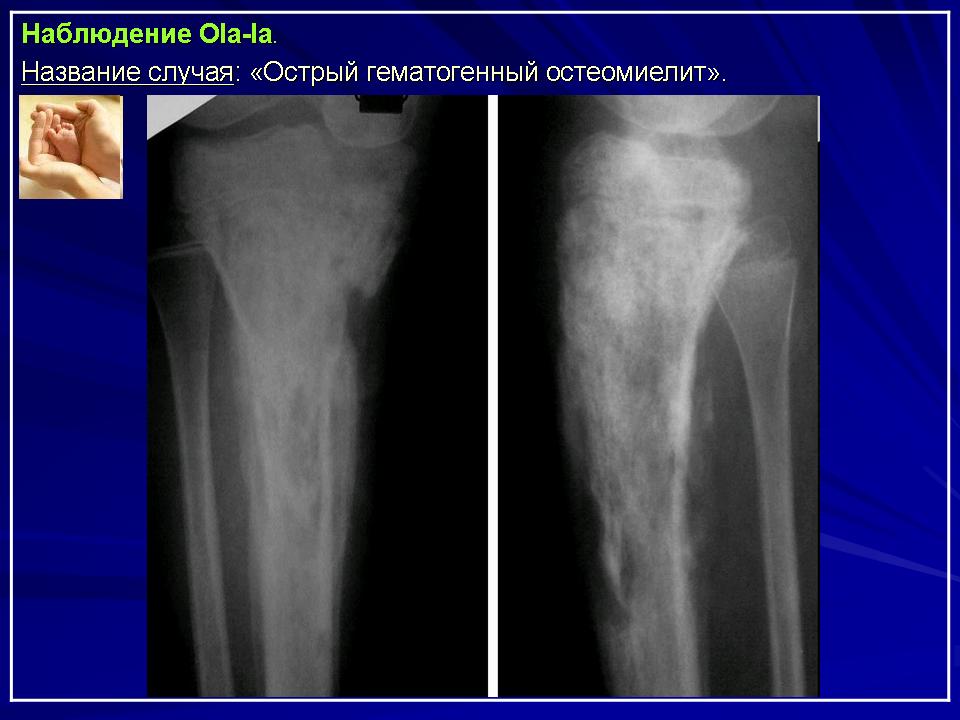
Таким образом, сочетанное поражение двух сегментов было констатировано у 8 детей.
Лечение детей с ОГО в ДРКБ МЗ РТ проводится комплексно: медикаментозную терапию сочетают с профилактикой ортопедических осложнений, а при необходимости производят хирургическое вмешательство.
Анализ историй болезни показал, что консервативное лечение получили 19 (52,8%), пациентов. Оно заключалось в антибиотико- и дезинтоксикационной
А
Рис. 1. Рентгенограммы левой нижней конечности больной Л.: А — деструкция проксимального метаэпифиза левого бедра при поступлении; Б — в возрасте 45 дней; В — укорочение левого бедра в возрасте одного года, Г — raxa vara с уменьшением шеечно-диафизарного угла.
терапии, наложении мазевых повязок, физиотерапевтических процедурах (электрофорез антибиотиков, УВЧ), иммобилизации конечности. Хирургические вмешательства производились 17 (47,2%) детям. В 8 случаях осуществлялась остеоперфо-рация метафиза костей конечностей, в 8 (22,2%) — вскрытие и дренирование флегмоны. 2 (5,5%) детям пунктирован сустав, причем в одном случае со вскрытием и дренированием флегмоны. 3 пациентам на фоне комплексной интенсивной терапии проводили сеансы гипербарической оксигенации (ГБО), которые выполнялись в зависимости от возраста и тяжести
© 3. «Казанский мед. ж.», № 1.
заболевания в режиме 1,3—1,7 атм. с экспозицией 40—60 минут.
 В 41,1% случаев высеивался золотистый стафилококк, в 17,6% — эпидермальный стрептококк, в 5,9% — E. coli, в 5,9% — эн-теробактер клоаце, в 5,9% — сапрофитный стафилококк. В 23,5% случаев роста не
В 41,1% случаев высеивался золотистый стафилококк, в 17,6% — эпидермальный стрептококк, в 5,9% — E. coli, в 5,9% — эн-теробактер клоаце, в 5,9% — сапрофитный стафилококк. В 23,5% случаев роста не33
Острый процесс осложнился вторичной деструкцией легких (11,1%), перикардитом (8,3%), реактивным гепатитом (8,3%).
Отдаленные результаты лечения детей с ОГО удалось отследить и проанализировать на на сроках от 3 до 13 лет (средний срок наблюдений — 7,5 года). В ходе контрольного осмотра каждому пациенту проводилось клинико-рентгенологичес-кое обследование, по результатам которого в 22 (61,1%) случаях установлено полное выздоровление пациента без остаточных дефектов развития опорно-двигательного аппарата.
Л. в возрасте 25 дней поступила в ДРКБ МЗ РТ 15.04.02 г. Заболела остро 13.04.02 г.: на фоне повышения температуры тела до 38°С появилась болезненная припухлость, перешедшая в отек области верхней трети бедра. При поступлении в стационар верхняя треть левого бедра увеличена в объеме, движения в левом тазобедренном суставе резко ограничены, болезненны. На рентгенограмме левой бедренной кости от 15.04.02 г. — деструкция проксимального метаэпифиза левого бедра (рис.1 А). 15.04.02 г. произведена остеопер-форация проксимального метафиза левого бедра. Назначена интенсивная антибактериальная и инфузионная терапия, наложена гипсовая лонгета. Кортикальный слой разрушен.
При поступлении в стационар верхняя треть левого бедра увеличена в объеме, движения в левом тазобедренном суставе резко ограничены, болезненны. На рентгенограмме левой бедренной кости от 15.04.02 г. — деструкция проксимального метаэпифиза левого бедра (рис.1 А). 15.04.02 г. произведена остеопер-форация проксимального метафиза левого бедра. Назначена интенсивная антибактериальная и инфузионная терапия, наложена гипсовая лонгета. Кортикальный слой разрушен.
Ребёнок был выписан на 30-й день под наблюдение хирурга по месту жительства. На конт-34
рольном осмотре в возрасте одного года выявлено укорочение левой нижней конечности на 1,0 см с ограничением объема движений в левом тазобедренном суставе. На сравнительной рентгенограмме нижних конечностей от 9.04.03 г. определяются укорочение левого бедра за счет деформации и умеренного изгиба в проксимальном метафизе (рис. 1 В), патологический подвывих в левом тазобедренном суставе. Проксимальный мета-физ левого бедра утолщен, деформирован. При осмотре девочки в пятилетнем возрасте укорочение составляло уже 2,5 см за счет варусной деформации шейки бедренной кости, что привело к ограничению объема ротационных движений в левом тазобедренном суставе. На контрольной рентгенограмме тазобедренных суставов с захватом бедренных костей (рис. 1 Г) определялась еоха-уага с уменьшением шеечно-диафизарного угла до 92°.
Тяжелые ортопедические последствия развились у 4 детей. Пациенту с патологическим вывихом бедра после ОГО произведены открытое вправление вывиха и реконструктивная операция на элементах тазобедренного сустава в возрасте 7 лет. В дальнейшем деструктивный процесс перерос в коксартроз и в возрасте 18 лет больному было выполнено эндопротезиро-вание тазобедренного сустава. У пациента с деструкцией диафиза большеберцовой кости произошёл патологический перелом с развитием ложного сустава. ит, укорочение нижней конечности на 3 см.
ит, укорочение нижней конечности на 3 см.
М. в возрасте 1,5 месяца поступила в гнойное отделение ДРКБ МЗ РТ 6.05.2003 г . Заболела 1.05.2003 г.: на фоне резкого повышения температуры тела более 39°С появились болезненность в левом коленном суставе, отек, ограничение движений. 3.05.2003 г. была госпитализирована
Рис. 2. Рентгенограммы пациентки М.: А — в возрасте одного года определяется деформация дистального отдела левой бедренной кости; Б — genu-valgum в возрасте 3 лет 7 месяцев; В — укорочение левой нижней конечности в возрасте 3 лет 7 месяцев.
в ЦРБ: произведена остеоперфорация н/з левой бедренной кости. Получала лечение: антибактериальная терапия, УВЧ, иммобилизация гипсовой лонгетой. Была выписана домой с рекомендацией носить гипсовую лонгету и явиться на прием к хирургу через один месяц. Получала плановое консервативное лечение (электрофорез СаС12, парафин, ЛФК, массаж) в 4 месяца и в один год. На рентгенограмме левой бедренной кости с захватом левого коленного сустава от 11.11.2004 г. видно укорочение левой нижней конечности за счет деструкции дистального метаэпифиза бедренной кости. Эпифиз фраг-ментирован. Суставная щель расширена (рис.2). На контрольной рентгенограмме левого коленного сустава от 18.04.05 г. визуализируется деформация дистального отдела левой бедренной кости (рис 2): метафиз расширен, эпифиз деформирован, склероз кости. При осмотре в возрасте 3 года 7 месяцев выявлены укорочение левой нижней конечности на 3,0 см, деформация левого коленного сустава в виде genu-va1gum (рис. 2 В).
При очном анкетировании установлено, что большая часть детей у ортопеда не наблюдается и профилактического консервативного лечения не получает.
Проведена сравнительная оценка результатов лечения пациентов, перенесших ОГО с поражением костей конечностей, в зависимости от метода. При консервативном лечении ортопедические осложнения возникли у 4, отсутствовали у 14, при остеоперфорации — соответственно у 5 и 3, вскрытии и дренировании — у 4 и 4, пункции суставов — у 1 и 1. 5 (35,7%) из детей с ортопедическими последствиями поступили в периоде новорожденности. Таким образом, по нашим данным, у 38,9% детей с острым метаэпифизарным остео-
При консервативном лечении ортопедические осложнения возникли у 4, отсутствовали у 14, при остеоперфорации — соответственно у 5 и 3, вскрытии и дренировании — у 4 и 4, пункции суставов — у 1 и 1. 5 (35,7%) из детей с ортопедическими последствиями поступили в периоде новорожденности. Таким образом, по нашим данным, у 38,9% детей с острым метаэпифизарным остео-
миелитом длинных трубчатых костей развиваются ортопедические осложнения.
ЛИТЕРАТУРА
1. Акжигитов Г.Н., Галлеев М.Н., Сахаутдинов В.Г., Юдин Я.Б. Остеомиелит. — М.: Медицина,1986.
2. Бондаренко Н.М., Коваль И.И., Орел И.Д. Клиника, диагностика и лечение хронического остеомиелита // Хирургия. — 1985. — № 11. — С.90—92.
3. Гайко Г.В. Нарушение роста и формирования длинных костей после гематогенного остеомиелита у детей и подростков // Ортоп. травматол. и протез. — 1988. — № 4. —С. 28—32.
4. Даниелян ОА., Янакова О.М., Заславская А.М. Основные задачи клинического и инструментальных методов исследования у больных с последствиями гематогенного остеомиелита // Мат. Всероссийск. научно-практ. конф. — Казань, 1996. — С.212.
Поступила 13.04.09.
ORTHOPEDIC CONSEQUENCES OF TREATMENT OF CHILDREN WHO SUFFERED ACUTE HEMATOGENOUS OSTEOMYELITIS
I.F. Akhtyamov, M.R. Gil’mutdinov, A.P. Skvortsov, A.A.. Akhunzyanov
Summary
In order to assess the effectiveness of the treatment of acute hematogenous osteomyelitis and to identify the main types of orthopedic complications in young children, analyzed was the treatment of this disease in 36 children aged 11 days to 2. 1 years. In 22 (61.1%) cases established was complete recovery of the patient, and in 10 (27.8%) -abnormalities of growth. Heavy orthopedic consequences developed in 4 out of 5 children who were admitted to hospital in the neonatal period and who needed surgical treatment.
1 years. In 22 (61.1%) cases established was complete recovery of the patient, and in 10 (27.8%) -abnormalities of growth. Heavy orthopedic consequences developed in 4 out of 5 children who were admitted to hospital in the neonatal period and who needed surgical treatment.
Key words: acute hematogenous osteomyelitis, orthopedic complications, surgical treatment.
Заболевания
Ортопедические последствия острого гематогенного остеомиелита – явление нередкое. Частота встречаемости разнится в зависимости от региона проживания.
Основные проявления
- Деформации и укорочения одного или нескольких сегментов конечностей. Причем часто в процесс вовлечены, как нижние конечности, так и верхние. Например, многоплоскостная деформация и укорочение плечевой кости является одной из самых распространенных проявлений болезни;
- Вывихи или подвывихи в тазобедренном суставе.
Какова причина ортопедических проявлений болезни?
Причиной деформации и укорочения конечности (ей) является повреждение зон(ы) роста с последующим полным нарушением ее функции (в таком случае нарушается только продольный рост кости) или частичным (в таком случае возникает деформация).
Возможно ли избежать деформации и укорочения, если ребенок перенес гематогенный остеомиелит?
При своевременной диагностике и санации очага (ов) остеомиелита, грамотной работе хирурга на этапе санации, ортопедических последствий остеомиелита возможно избежать. Однако, важным фактором для прогноза является не только мастерство и квалификация хирурга, но и вид микроба, состояние иммунитета.
Наиболее тяжелыми являются ортопедические последствия менингококковой инфекции. Зачастую больные обращаются с множественными деформациями скелета, ампутированными дистальными отделами конечностей.
Надо ли оперировать детей с последствиями острого гематогенного остеомиелита?
В большинстве случаев показаны неоднократные хирургические вмешательства.
Их цели:
- устранить вывихи и подвывихи в суставах;
- устранить деформации и укорочения костей;
Почему детям с последствиями острого гематогенного остеомиелита показаны многократные вмешательства?
Поврежденная зона роста – самый главный враг ортопеда и ребенка! Устранить деформацию и удлинить кость – задача, решаемая для современного ортопеда, владеющего чрескостным и погружным остеосинтезом. Заставить нормально работать поврежденную зону роста – задача практически не решаемая, за исключением случаев ее «малых», непротяженных повреждений. Следовательно, у большинства детей по мере роста происходит рецидив деформации. В ряде случаев мы специально «замыкаем» функционирующую порцию зоны роста, чтобы избежать рецидива деформации, но в таких случаях кость не растет продольно, и мы в дальнейшем должны ее удлинять. Окончательно избавить ребенка от деформаций и укорочения возможно к возрасту его костной зрелости.
Зачем многократно оперировать ребенка, если вероятен рецидив деформации? Почему не выполнить операцию к моменту костной зрелости ребенка?
Если не оперировать ребенка, деформация будет прогрессировать. Суставы, длительно работающие под «неправильной» нагрузкой, начинают разрушаться, что приводит к не купируемому болевому синдрому и необходимости замены суставов на искусственные.
Какие методы лечения используются?
- Гемиэпифизиодез восьмиобразными пластинами и винтами (управляемый рост). Самый малотравматичный метод. В случаях ПОГО применим у маленьких детей при условии сохранения работы зоны роста, хотя в большинстве случаев метод- неэффективен, так как повреждение зоны роста носит необратимый характер.
- Остеотомии (пересечение кости) в сочетании с чрескостным остеосинтезом и постепенным удлинением кости(ей) коррекцией деформации. Наиболее часто используемый и эффективный метод. Позволяет как устранить деформацию, так и удлинить кость.

- Остеотомии таза и бедренной кости в сочетании с внутренней фиксацией и гипсовой иммобилизацией применяются у детей с вывихом и подвывихом бедра.
Более подробно о применяемых методах лечения см. в разделе «Методы лечения».
В каждом случае решение о выборе метода оперативного лечения, его необходимости, принимается хирургом индивидуально.
Первично-хронический остеомиелит, симулировавший саркому кости
В последние десятилетия наблюдается рост частоты подострого и первично-хронического остеомиелита в детском возрасте, а также атипичных форм, порой трудно отличимых от необластического процесса. По-видимому, «эра антибиотиков» привела к существенному изменению микробной флоры и реактивности организма, в результате чего появились такие формы остеомиелита, в том числе у детей [1–5]. Диагностика данной патологии нередко представляет трудности в связи с маловыраженным клиническим течением и сходством рентгенологической картины с изменениями, наблюдающимися при новообразованиях и дистрофических процессах [1, 4, 5]. Использование спиральной компьютерной томографии (СКТ), магнитно-резонансной томографии, сцинтиграфии не всегда позволяет поставить правильный диагноз, и решающее значение в таких случаях имеет гистологическое исследование [1, 4].
В клинике детской хирургии имени профессора Н.Л. Куща за последние 15 лет мы наблюдали 2 детей с первично-хроническим остеомиелитом, симулировавшим саркому кости. Приводим одно из наших наблюдений.
Больной Ш., 17 лет (история болезни № 4384), поступил в клинику детской хирургии 20.04.2011 с жалобами на припухлость и боли в области левой бедренной кости, лихорадку. Болен с 20.03.2011 года, когда после игры в футбол появились боли в области левого бедра. Лечился у травматолога по месту жительства по поводу предполагаемого ушиба, без особого эффекта. Состояние оставалось удовлетворительным, лихорадки не отмечалось. Через 3,5 недели стала определяться припухлость по передней поверхности левого бедра, появились боли в ночное время. 17.04.2011 г. пациент был госпитализирован в детское хирургическое отделение г. Макеевки. 17.04 была произведена рентгенография левой бедренной кости, заподозрена опухоль кости, первично-хронический остеомиелит (рис. 1). Больной направлен в клинику.
17.04.2011 г. пациент был госпитализирован в детское хирургическое отделение г. Макеевки. 17.04 была произведена рентгенография левой бедренной кости, заподозрена опухоль кости, первично-хронический остеомиелит (рис. 1). Больной направлен в клинику.
При поступлении общее состояние тяжелое. Кожные покровы чистые, бледные. Субфебрильно лихорадит. Со стороны легких и сердца — без особенностей. Живот при пальпации мягкий, безболезненный. Место болезни: левое бедро увеличено в объеме (больше правого на 5 см в окружности), в основном в верхней и средней трети. Гиперемии кожи нет, но в глубине определяется флюктуация, имеется незначительный болевой синдром. Локальная температура не повышена.
Заподозрена саркома Юинга, первично-хронический остеомиелит (опухолеподобная форма) с поражением левой бедренной кости. Проведено обследование. Ультразвуковое исследование: вокруг бедренной кости визуализируется овоидной формы опухолевидное жидкостное образование с густым эхогенным содержимым, размерами 22 х 6,9 х 5 см. Эхо-признаки абсцесса бедра. СКТ (рис. 2): в верхнем и среднем отделах левого бедра, преимущественно в переднемедиальных отделах, определяется образование овальной формы, пониженной плотности, размерами 15 х 7,5 х 6,6 см, оттесняющее магистральные сосуды и тесно прилегающее к бедренной кости. Бедренная кость утолщена до 3,8 см в верхнем и среднем отделах на протяжении до 13 см, структура несколько неоднородная, с участком пониженной плотности до 1,2 см, наружные контуры достаточно четкие, костный канал неравномерно сужен на этом уровне, максимально до 0,5 см. В легких, брюшной полости и забрюшинном пространстве без патологии. Заключение: новообразование левого бедра. В анализе крови: Нb — 128 г/л, эр. — 4,0 х 1012/л, лейк. — 15,9 х 109/л, СОЭ — 56 мм/ч, тромбоциты — 264 х 109/л. Биохимические анализы крови в пределах возрастной нормы.
26.04.2011 произведено оперативное лечение (хирург — к.м.н. В.К. Литовка). Операционное поле обработано по Филончикову. Произведен продольный разрез кожи по передней поверхности левого бедра длиной до 12 см (на уровне средней и верхней трети) в зоне припухлости. Гемостаз. Рассечены поверхностная и широкая фасции, они не изменены. Мышцы обычного цвета и консистенции. Тупо разведены глубокие мышцы, прилегающие к бедренной кости, они отечны, как бы выбухают. При этом выделилось до 160–170 мл жидкого гноя со сгустками фибрина и темной крови. Ревизия пальцем — полость располагается вокруг бедренной кости, размером 11 х 3,5 х 2,5 см. Бедренная кость на границе верхней и средней трети оголена, шероховата. Биопсия остатков надкостницы: она утолщена, инъецирована, с налетом фибрина. Остеотрепанация на участке 3,5–4 мм, лишенном надкостницы. Из костномозгового канала получено скудное количество крови и серозно-гнойное отделяемое. Туалет. Гемостаз. Резиновые выпускники по переднему краю бедра, поставленные в глубь раны (один — кверху, второй — книзу) через две контрапертуры (по медиальной и задней поверхности) длиной 2,5–3 см, поставлены резиново-марлевые турунды к бедренной кости. Раны послойно ушиты до дренажей. Туалет. Асептическая повязка. Иммобилизация. Макропрепараты: участок утолщенной надкостницы с нитями фибрина, кусочки кости обычного цвета с гноевидным содержимым. Диагноз после операции: первично-хронический остеомиелит левой бедренной кости с формированием субмускулярного абсцесса.
Произведен продольный разрез кожи по передней поверхности левого бедра длиной до 12 см (на уровне средней и верхней трети) в зоне припухлости. Гемостаз. Рассечены поверхностная и широкая фасции, они не изменены. Мышцы обычного цвета и консистенции. Тупо разведены глубокие мышцы, прилегающие к бедренной кости, они отечны, как бы выбухают. При этом выделилось до 160–170 мл жидкого гноя со сгустками фибрина и темной крови. Ревизия пальцем — полость располагается вокруг бедренной кости, размером 11 х 3,5 х 2,5 см. Бедренная кость на границе верхней и средней трети оголена, шероховата. Биопсия остатков надкостницы: она утолщена, инъецирована, с налетом фибрина. Остеотрепанация на участке 3,5–4 мм, лишенном надкостницы. Из костномозгового канала получено скудное количество крови и серозно-гнойное отделяемое. Туалет. Гемостаз. Резиновые выпускники по переднему краю бедра, поставленные в глубь раны (один — кверху, второй — книзу) через две контрапертуры (по медиальной и задней поверхности) длиной 2,5–3 см, поставлены резиново-марлевые турунды к бедренной кости. Раны послойно ушиты до дренажей. Туалет. Асептическая повязка. Иммобилизация. Макропрепараты: участок утолщенной надкостницы с нитями фибрина, кусочки кости обычного цвета с гноевидным содержимым. Диагноз после операции: первично-хронический остеомиелит левой бедренной кости с формированием субмускулярного абсцесса.
Послеоперационный период протекал гладко. Ребенок получил инфузионную терапию, два курса антибактериальной терапии, общеукрепляющее лечение, лазеротерапию, электрофорез с димексидом. Швы сняты, раны зажили вторичным натяжением. Гистологическое заключение (№ 4117-30): в кусочках костной ткани явления дистрофии и некроза. В участке скелетной мускулатуры очаги выраженного гнойного воспаления. Перед выпиской произведена контрольная рентгенография левой бедренной кости (рис. 3): на границе верхней и средней трети диафиза на протяжении 6 см в медиально-заднем отделе определяется деструкция костной ткани с участками разрушенного периоста.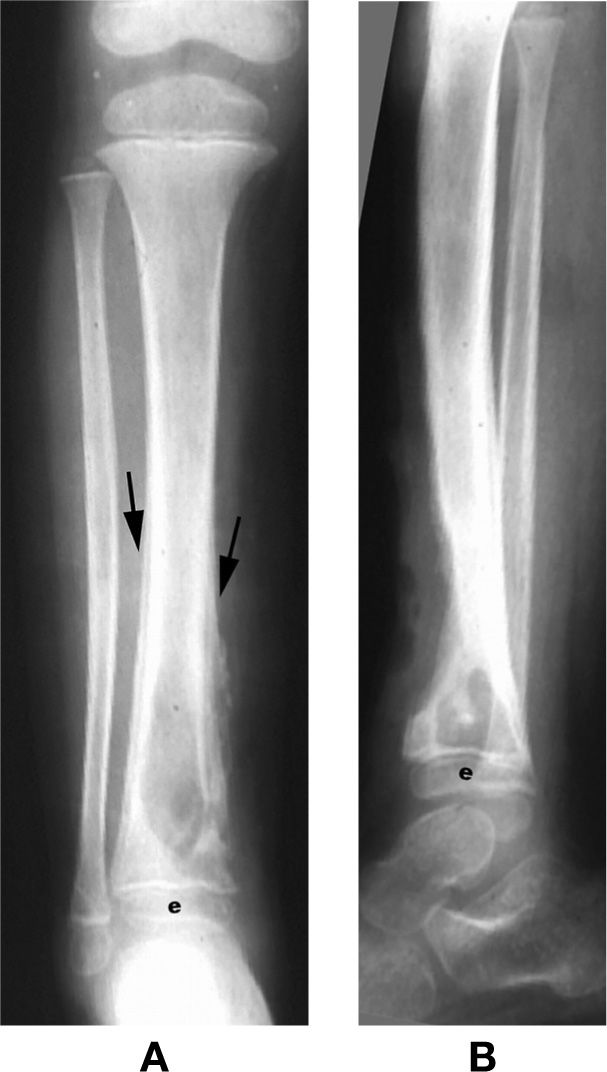 На этом уровне и дистальнее — отслоенный периостит, увеличение кости в объеме. Больной 18.05 выписан на амбулаторное лечение. Пациент осмотрен через 3 месяца. Жалоб нет. Ходит не хромая. Рентгенография левой бедренной кости без патологии. Здоров.
На этом уровне и дистальнее — отслоенный периостит, увеличение кости в объеме. Больной 18.05 выписан на амбулаторное лечение. Пациент осмотрен через 3 месяца. Жалоб нет. Ходит не хромая. Рентгенография левой бедренной кости без патологии. Здоров.
Абаев Ю.К., Швед И.А., Клецкий С.К. Подострый и первично-хронический остеомиелит в детском возрасте // Вестник хирургии. — 2005. — № 4. — С. 54-57.
Грона В.Н., Литовка В.К., Журило И.П., Латышов К.В. Опухоли и опухолеподобные образования у детей. — Донецк: Норд Пресс, 2010. — 364 с.
Литовка В.К., Журило И.П. Конденсирующий остеит у детей // Клінічна хірургія. — 1992. — № 6. — С. 74-75.
Ezza E., Wientroub Sh. Primary subacute haematogenous osteomyelitis: are biopsy and surgery always indicated? // J. Pediatr. Ortop. — 1996. — Vol. 16, № 4. — Р. 220-223.
Rasool M.N. Primary subacute haematogenous osteomyelitis in children // J. Boner. Joint. Surg. — 2001. — Vol. 83, № 1. — Р. 93-98.
Лучевая диагностика остеомиелита у детей
Остеомиелит у детей в возрасте до одного года вызывается Streptococcus группы B, Staphylococcus aureus (70-90% случаев), Haemophilus influenza (5-50%), и Escherichia coli. Старше года возбудителем является S aureus, E coli, H influenza, Serratia marcescens, и Pseudomonas aeruginosa, изредка Salmonella, грамм-положительные кокки и анаэробы. До одного года частота остеомиелита составляет около 1 случая на 1000, старше года – 1 на 5000. Бактерия попадает в метафизы через питающие сосуды, там развивается воспалительный процесс, который дальше распространяется в субпериостальные пространства и, при прорыве абсцесса, на окружающие мягкие ткани. Остеомиелит у детей чаще поражает дистальный и проксимальный метафизы бедренной и большой берцовой кости, дистальный метафиз плечевой кости и дистальный метафиз малой берцовой кости. Выделяют острый, подострый и хронический остеомиелит. При остром остеомиелите имеются клинические проявления в виде локальных болей, отёка и повышения температуры. Ранний воспалительный период длится 2-3 дня, после которого начинает формироваться абсцесс, а через 7 дней образуются секвестры. Особой формой остеомиелита является абсцесс Броди – локальный процесс в подострой стадии без предшествовавших симптомов острого остеомиелита. Дальнейший развитие процесса зависит от эффективности антибиотикотерапии и хирургического лечения. Осложнениями острого остеомиелита являются переход в хроническую форму (5-25%), метастатическая инфекция, септический артрит, нарушение зоны роста с угловой деформацией кости, патологические переломы, сепсис, воспаление мягких тканей и образование свищей.
При остром остеомиелите имеются клинические проявления в виде локальных болей, отёка и повышения температуры. Ранний воспалительный период длится 2-3 дня, после которого начинает формироваться абсцесс, а через 7 дней образуются секвестры. Особой формой остеомиелита является абсцесс Броди – локальный процесс в подострой стадии без предшествовавших симптомов острого остеомиелита. Дальнейший развитие процесса зависит от эффективности антибиотикотерапии и хирургического лечения. Осложнениями острого остеомиелита являются переход в хроническую форму (5-25%), метастатическая инфекция, септический артрит, нарушение зоны роста с угловой деформацией кости, патологические переломы, сепсис, воспаление мягких тканей и образование свищей.
Выявление остеомиелита в острой фазе осуществляется с помощью радионуклидной диагностики, чувствительность которой превышает 90%. Отёк костного мозга и субпериостальные абсцессы обнаруживаются методом МРТ, чувствительность которой для ранней диагностики остеомиелита составляет около 85%. Несколько меньшей чувствительностью обладает ультразвуковая диагностика. Первые изменения на рентгенограммах появляются не ранее 7-10 дня и только на 10-14 день становятся отчётливыми. В этот период отмечается и наибольшая чувствительность КТ. Развитый воспалительный процесс характеризуется большим спектром симптомов в том или ином сочетании: деструктивный очаг, разнообразной величины и формы, склеротическая реакция окружающей кости, каналы-выпускники гноя, открывающиеся в мягкие ткани, секвестры в очаге или в каналах, периостальная реакция (линейная, бахромчатая, без спикул), гиперостоз различной степени выраженности, сужение костномозгового канала, отек мягких тканей при отсутствии мягкотканого компонента .
При хроническом остеомиелите КТ служит методом выбора: выявляются четкие очаги деструкции кости, часто содержащие секвестры, контуры очагов неровные, нечеткие . В перифокально расположенных участках костной ткани отмечается очаговый остеопороз с явлениями реактивного костеообразования (очаговый остеосклероз). Отчетливо видны секвестры , могут образовываться секвестральные свищи. Вдоль коркового слоя кости образуется плоска отслоенного периоста. В дальнейшем периостальные наслоения ассимилируются, поперечник кости увеличивается, контуры становятся бугристыми.
Отчетливо видны секвестры , могут образовываться секвестральные свищи. Вдоль коркового слоя кости образуется плоска отслоенного периоста. В дальнейшем периостальные наслоения ассимилируются, поперечник кости увеличивается, контуры становятся бугристыми.
Хронический остеомиелит грудинного конца ключицы. Определяется очаг деструкции грудинного конца правой ключицы с наличием мелких секвестров внутри и отеком окружающих тканей.
МРТ Т2-взвешенного типа. Остеомиелит большеберцовой кости. Яркий сигнал соответствует костной деструкции и распространению по костному мозгу.
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
567891011
12131415161718
19202122232425
2627282930
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Клиника детской хирургии и ортопедии
Адрес:
194064, СПб, ул. Политехническая, д. 32
Политехническая, д. 32
Основные направления работы клиники
Клиника оказывает хирургическую помощь детям при широком спектре врожденной и преобретенной патологии опорно-двигательного аппарата.
Диагностика и лечение заболеваний опорно-двигательного аппарата, в т.ч. у детей первого года жизни:
Позвоночник, позвоночный канал, спинной мозг |
|
Примеры лечения
Врожденная комбинированная аномалия позвоночника и грудной клетки
Удаление опухоли позвонка, осложненной сдавлением спинного мозга
Закрытая чрескожная селективная пункционная вертебропластика при симптоматической гемангиоме тела L2 у ребенка (полное купирование болевого синдрома).
Реконструкция позвоночника при переломах позвоночника и их последствиях
Ребенок 9 лет, диагноз: остеогенная саркома шейки правой бедренной кости. Операция: расширенная резекция проксимального отдела бедренной кости, энжопротезирование растущим протезом.
Кости и суставы |
|
Больная 13 лет, диагноз: Хронический посттравматический остеомиелит н/3 голени. Оперирована: иссечение свища, резекция, костная аутопластика дефекта дистального метафиза большеберцовой кости, пластика дефекта мягких тканей островковым лоскутом с осевым кровотоком.
Оперирована: иссечение свища, резекция, костная аутопластика дефекта дистального метафиза большеберцовой кости, пластика дефекта мягких тканей островковым лоскутом с осевым кровотоком.
Ребенок 6 лет, укорочение правой нижней конечности 6 см, дистракционный остеосинтез правого бедра спицестержневым аппаратом Илизарова.
Грудная клетка |
|
Опухоль ребра у ребенка 1 года
Клиника является одним из немногих учреждением в Российской Федерации, выполняющим полный комплекс диагностических и лечебных мероприятий у детей с деструктивными инфекционными и опухолевыми поражениями любых отделов скелета (позвоночник, крупные суставы, кости), в т.ч. с использованием малоинвазивных чрескожных биопсий с гистологической и бактериологической верификацией “небактериальных” остеомиелитов.
Клиника остается единственным учреждением Российской Федерации, оказывающим хирургическую помощь детям с поражениями позвоночника, костей и суставов при туберкулезе.
Спектр выполняемых операций – от диагностических малоинвазивных биопсий до обширных многоуровневых реконструкций позвоночника 360° с инструментальной фиксацией.
Вмешательства выполняются с использованием технологий MIS (минимально-инвазивной хирургии), аппаратов внешней фиксации, имплантационных фиксирующих спинальных и AO-систем, современных биологических и небиологических костнопластических материалов.
Лечение включает как одномоментные, так и этапные реконструктивно-пластические вмешательства на всех отделах и структурах опорно-двигательного аппарата, учитывающие возрастные особенности растущего ребенка: различные виды костной пластики с сохранением ростковых зон, пластики дефектов мягких тканей, в том числе кровоснабжаемым комплексом тканей, металлоостеосинтез, эндопротезирование.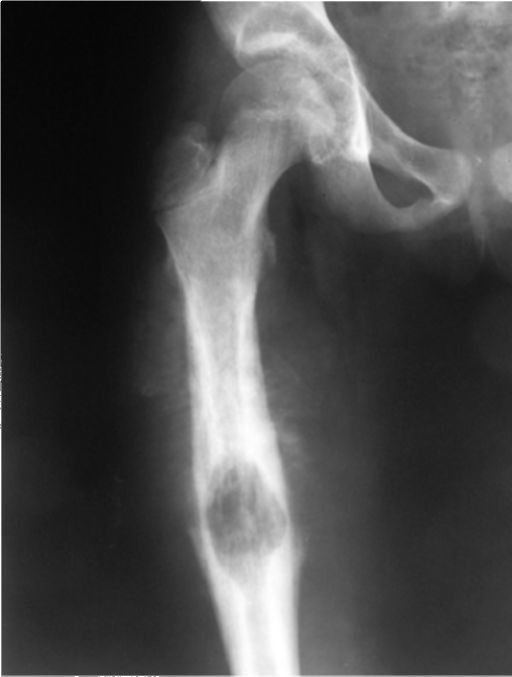
При операциях используется современное техническое обеспечение — силовой инструментарий, ультразвуковые костные скальпели и деструкторы, хирургическая навигация, нейромониторинг.
Восстановительное лечение неврологических осложнений травм и заболеваний позвоночника с применением методов накожной и инвазивной электростимуляции спинного мозга, аппаратной двигательной реабилитации, тренажеров и т.д.
Врачи отделения
Главный научный сотрудник (Координатор направления «Внелегочный туберкулез»), врач травматолог-ортопед, д.м.н., профессор
Заведующий отделением , к.м.н., врач травматолог-ортопед
Врач травматолог-ортопед
Врач детский-хирург высшей квалификационной категории
Врач-детский хирург
Научный сотрудник, д.м.н. врач травматолог-ортопед
Врач-нейрохирург высшей квалификационной категории
Врач-педиатр
Врач-анестезиолог-реаниматолог
Врач-анестезиолог-реаниматолог высшей квалификационной категории
Врач-анестезиолог-реаниматолог высшей квалификационной категории
Основные направления научной работы клиники:
Среди проводимых в клинике научных исследований, посвященных хирургии деструктивных поражений скелета и их последствий у детей, врожденным порокам развития позвоночника, уникальными являются реконструктивные операции на позвоночнике у детей первого года жизни с контролем их роста и развития, операции на кранио-веребральной зоне, использование ультразвукового инструментария (костный скальпель, деструктор) при операциях на костях, комбинированные вмешательства при опухолях позвоночника ( эндоваскулярный и радикально-реконструктивный этапы)
Сотрудниками клиники опубликованы 6 монографий, более 400 публикаций в научных медицинских журналах.
В апреле 2017 года
Клиника в составе института получила статус “Центра AOSpine”
Клиника детской хирургии и ортопедии — самостоятельное подразделение ФГБУ СПбНИИФ, с декабря 2012 года располагающееся в новом 5-этажном здании.
Современно оборудованные палаты
Госпитализация в Клинику осуществляется после очной или заочной (по документам) консультации в соответствии с установленным действующим законодательством порядком в рамках государственных гарантий за счет федерального бюджета и ОМС, включая высокотехнологичную медицинскую помощь, а также на коммерческой основе.
Запись на очные консультации:
тел. 8-812-775-75-55
Консультации по электронной почте: [email protected]
Адрес клиники: 194064, Санкт-Петербург, ул. Политехническая, д.32
Что такое остеомиелит, и чем он опасен
Чем вызван остеомиелит, какие осложнения возможны при этом заболевании?Иван Дмитриевич, Барановичи
Остеомиелит — воспалительное заболевание кости. Раньше эту болезнь называли костоеда. Преимущественно остеомиелит встречается у детей и подростков, но им могут болеть и взрослые, особенно пожилые люди — на их долю приходится до 20% случаев.
При остеомиелите в основном поражаются длинные трубчатые кости — кости бедра, голени, плеча, предплечья. Чаще всего заболевание вызывает золотистый стафилококк, реже — пневмококк и другие микроорганизмы. Но возбудитель не может просто так добраться до костной ткани. Различают посттравматический и гематогенный остеомиелит. При гематогенном остеомиелите микроорганизм проникает в костную ткань из любого очага инфекции. Это могут быть гнойные воспаления кожи и подкожной клетчатки (абсцессы, флегмоны), пневмонии, инфекции мочевыводящих путей и т. д. Заболевание нередко начинается и при травматическом повреждении кости.
Клиническая картина весьма изменчива, но основным симптомом являются боли в очаге поражения. Боль четко локализуется в поврежденном участке, она усиливается при малейшем движении или надавливании. Быстро возникает нарушение функции конечности, больной не только не может пользоваться ею — даже пассивные движения становятся невозможны. В области поражения появляются покраснение и отек. Однако это более характерно для острого остеомиелита, при хроническом симптомы не так выражены.
В области поражения появляются покраснение и отек. Однако это более характерно для острого остеомиелита, при хроническом симптомы не так выражены.
У детей заболевание протекает с высокой температурой, у взрослых температура может быть повышена не так сильно. Но важным диагностическим критерием являются патологические изменения крови. Рентгенологические изменения появляются только через три недели. Ранним методом диагностики могут быть компьютерная или магниторезонансная томография кости. Острый процесс часто переходит в хронический, для которого характерно рецидивирующее течение. При этом возможно образование свищей, из которых выделяются гной и костные секвестры (омертвевшие кусочки костной ткани). Больной страдает от общей слабости, утомляемости, интоксикации. Температура при этом либо субфебрильная, либо вообще отсутствует. Периоды ремиссии могут продолжаться от нескольких недель до нескольких лет. Только при отсутствии рецидивов в течение 3—4 лет можно говорить об излечении от данного заболевания.
Осложнением процесса может быть поражение близлежащих суставов с развитием гнойного артрита. У детей поражаются зоны роста кости, что в итоге приводит к укорочению конечности даже при успешно проведенном лечении. Самым тяжелым осложнением, которое может закончиться и летальным исходом, является сепсис. Исход заболевания во многом зависит от своевременно начатого лечения. В его основе лежит антибиотикотерапия, причем не одним, а чаще всего несколькими препаратами (их выбор основывается на определении чувствительности к ним возбудителя заболевания). Лечение проводится в стационаре, поскольку антибиотик очень часто вводят внутривенно. При хроническом гнойном остеомиелите необходимо оперативное вмешательство.
Юрий Кузьменков, врач РНПЦ “Кардиология”
Сфера интересов доктора — терапия, кардиология, эндокринология.
Ждем ваших вопросов, друзья!
 Частичное цитирование разрешено при наличии гиперссылки.
Частичное цитирование разрешено при наличии гиперссылки.Заметили ошибку? Пожалуйста, выделите её и нажмите Ctrl+Enter
Ведение острого гематогенного остеомиелита у детей
Expert Rev Anti Infect Ther. Авторская рукопись; доступно в PMC 2010 1 декабря 2010 г.
Опубликован в окончательной редакции как:
PMCID: PMC2836799
NIHMSID: NIHMS180283
Nada S Harik
Кафедра педиатрии и кафедра микробиологии и иммунологии Университета медицины Арканзас Science and the Arkansas Children’s Hospital, Little Rock, AR 72205, USA, тел.: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah
Марк С. Смелцер
Кафедра микробиологии и иммунологии и кафедра ортопедической хирургии, Университет медицинских наук Арканзаса, Литл-Рок, Арканзас 72205 , США
Нада С. Харик, Департамент педиатрии и Департамент микробиологии и иммунологии, Университет медицинских наук Арканзаса и Детская больница Арканзаса, Литл-Рок, AR 72205, США, тел .: +1 501 364 1416, факс: +1 501 364 3551, уд.smau @ adankirah; † Автор заочного отделения педиатрии и отделения микробиологии и иммунологии Медицинского университета Арканзаса и детской больницы Арканзаса, Литл-Рок, AR 72205, США, тел .: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Остеомиелит у детей преимущественно гематогенного происхождения и острый по своей природе. Основной причиной остеомиелита у детей является золотистого стафилококка , а эпидемиология и патогенез S.aureus , включая остеомиелит, изменились за последние годы в связи с появлением устойчивых к метициллину S. aureus , ассоциированных с сообществами. В этом обзоре рассматриваются достижения в диагностике и общем лечении острого гематогенного остеомиелита у детей с учетом этих изменений.
Ключевые слова: острый гематогенный остеомиелит, AHO, антибактериальная терапия, CA-MRSA, дети, внебольничная метициллин-резистентная Staphylococcus aureus , диагностическая визуализация, остеомиелит, Staphylococcus aureus
строго определена как любая форма 9000 воспаления, затрагивающего кости и / или костный мозг, но почти всегда это результат инфекции.Это сложная инфекция, которая принимает различные формы, особенно с точки зрения наиболее подходящего терапевтического подхода к использованию, и по этой причине для описания остеомиелита использовалось несколько схем классификации. Один из них фокусируется на источнике инфекции и различает инфекции, возникающие в результате гематогенного посева из эндостального кровоснабжения, и инфекции, возникающие в результате вышележащей инфекции мягких тканей (остеомиелит, вторичный по отношению к смежному очагу инфекции) и / или сосудистой недостаточности. [1].Вторая схема, которая применяется независимо от основного источника бактерии-нарушителя, различает острую, подострую и хроническую инфекцию в зависимости от времени между появлением симптомов и диагнозом [1]. Острый остеомиелит определяется как инфекция, диагностированная в течение 2 недель после появления симптомов [1,2]. Подострый остеомиелит диагностируется через 2 недели после появления симптомов, а хронический остеомиелит — через несколько месяцев после появления симптомов [2]. Хотя нам известно об отсутствии исследований, конкретно посвященных этой проблеме, мы считаем, что эти временные рамки должны зависеть, по крайней мере, до некоторой степени, от свойств вирулентности инфекционного штамма. Staphylococcus aureus является преобладающим патогеном, вызывающим остеомиелит у детей (см. Ниже), и возможно, что временные рамки инфекции могут измениться у детей, инфицированных метициллин-резистентным S. aureus (CA-MRSA). , многие штаммы которых являются гипервирулентными по причинам, которые еще предстоит полностью объяснить [3]. В таком случае возникнет острая необходимость в разработке диагностических методов, способных обнаруживать инфекцию на ранних стадиях.
В таком случае возникнет острая необходимость в разработке диагностических методов, способных обнаруживать инфекцию на ранних стадиях.
Обе схемы классификации, процитированные ранее, имеют отношение к этому обсуждению, поскольку, в отличие от инфекции у взрослых, остеомиелит у детей обычно имеет гематогенное происхождение и чаще всего протекает остро [1,2,4]. Основным фактором, способствующим распространению гематогенного пути заражения, является характер эндостального кровоснабжения растущих костей детей [1,2,4].
Ни одно из этих различий не является абсолютным в том смысле, что остеомиелит у детей может быть вызван локальным распространением инфекции смежных мягких тканей или, что реже, прямой инокуляцией патогенного микроорганизма в кость.Хронические инфекции действительно возникают у детей, как правило, в результате неудачной антимикробной терапии или наличия ортопедического имплантата. Хроническая инфекция дополнительно определяется образованием секвестра мертвой кости, и для успешного лечения таких инфекций обычно требуется хирургическая обработка раны и длительное лечение антимикробными препаратами, последнее иногда принимает форму как системной, так и местной доставки антибиотиков [1]. Хотя в этом обзоре рассматриваются оба эти вопроса, учитывая его преобладание среди детей, основное внимание уделяется диагностике и лечению острого гематогенного остеомиелита (ОГД) у педиатрических пациентов.
Микробная этиология острого гематогенного остеомиелита
Острый гематогенный остеомиелит обычно возникает в метафизе длинных трубчатых костей, причем примерно две трети всех случаев затрагивают бедренную, большеберцовую или плечевую кости [1,2,4]. Хотя могут быть задействованы различные бактериальные патогены, наиболее распространенным патогеном является S. aureus , который вызывает 70–90% инфекций AHO у детей [2,4]. Другие этиологические агенты, в произвольном порядке, включают Streptococcus pyogenes , Streptococcus pneumoniae , стрептококки группы B (у младенцев), коагулазонегативные стафилококки (особенно при инфекциях, связанных с имплантатами), Kingella kingae , кишечные грамотрицательные бациллы (особенно Salmonella spp.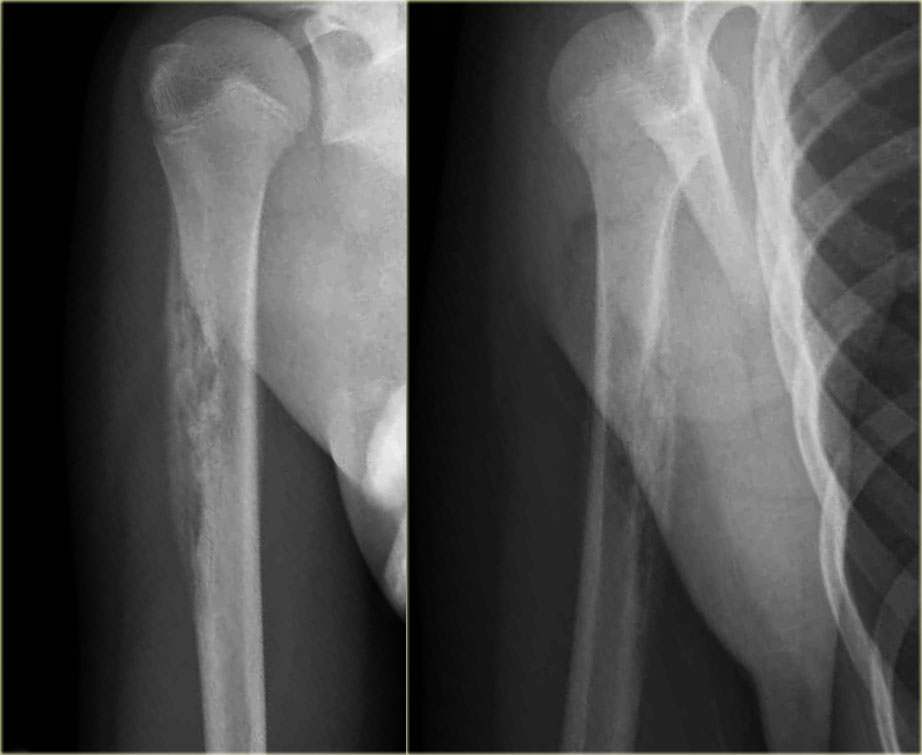 у лиц с серповидно-клеточной анемией) и анаэробными бактериями. Haemophilus influenzae тип b (Hib) был частой причиной детского остеомиелита, но его распространенность снизилась за счет введения конъюгированной вакцины Hib [2,4]. Такие организмы, как Mycobacterium , Bartonella , грибы ( Histoplasma , Cryptococcus и Blastomyces ), Candida и Coxiella , обычно являются необычными причинами риска развития остеомиелита, обычно наблюдаемыми у пациентов с остеомиелитом. путешествовать или проживать в географических регионах, в которых патогенные микроорганизмы являются эндемичными и / или имеют иммунодепрессивный характер [4].Также важно отметить, что, несмотря на все более широкое использование более чувствительных диагностических методов, которые в меньшей степени зависят от культуры бактерии-нарушителя, особенно ПЦР, этиология AHO у детей остается неизвестной в значительном количестве случаев [5].
у лиц с серповидно-клеточной анемией) и анаэробными бактериями. Haemophilus influenzae тип b (Hib) был частой причиной детского остеомиелита, но его распространенность снизилась за счет введения конъюгированной вакцины Hib [2,4]. Такие организмы, как Mycobacterium , Bartonella , грибы ( Histoplasma , Cryptococcus и Blastomyces ), Candida и Coxiella , обычно являются необычными причинами риска развития остеомиелита, обычно наблюдаемыми у пациентов с остеомиелитом. путешествовать или проживать в географических регионах, в которых патогенные микроорганизмы являются эндемичными и / или имеют иммунодепрессивный характер [4].Также важно отметить, что, несмотря на все более широкое использование более чувствительных диагностических методов, которые в меньшей степени зависят от культуры бактерии-нарушителя, особенно ПЦР, этиология AHO у детей остается неизвестной в значительном количестве случаев [5].
В качестве примера недавний отчет показал, что K. kingae было наиболее частой причиной костно-суставных инфекций у французских детей младше 3 лет [6]. Однако приблизительно 70% этих случаев ограничивались септическим артритом, и только приблизительно 18% демонстрировали клинические признаки остеомиелита [6].Это согласуется с обзором педиатрических случаев в Северной Америке, который показал, что, помимо грамположительных кокков, K. kingae были основной причиной костно-суставных инфекций у детей младше 5 лет [4]. Это также согласуется с нашим опытом в Детской больнице Арканзаса (Арканзас, США), где мы обнаружили, что K. kingae является наиболее частой причиной септического артрита у детей в возрасте до 2 лет [Juretschko S, Arkansas Children’s Hospital, Чел.Comm.]. K. kingae — это привередливый организм, который трудно культивировать, и его очевидное увеличение распространенности в качестве возбудителя костно-суставных инфекций вряд ли связано с изменением общей эпидемиологии заболевания, а скорее с увеличением использования большего количества других веществ. чувствительные диагностические методы, такие как ПЦР, для прямой идентификации патогенов, присутствующих в суставной жидкости и образцах костей. Такие исследования подчеркивают необходимость в альтернативных диагностических методах, которые можно использовать для проведения окончательной антимикробной терапии.Однако они не меняют вывода о том, что грамположительные кокки в целом и Staphylococcus aureus в частности, на сегодняшний день являются единственной наиболее распространенной причиной всех типов костно-суставных инфекций у детей всех возрастных групп [2,4].
чувствительные диагностические методы, такие как ПЦР, для прямой идентификации патогенов, присутствующих в суставной жидкости и образцах костей. Такие исследования подчеркивают необходимость в альтернативных диагностических методах, которые можно использовать для проведения окончательной антимикробной терапии.Однако они не меняют вывода о том, что грамположительные кокки в целом и Staphylococcus aureus в частности, на сегодняшний день являются единственной наиболее распространенной причиной всех типов костно-суставных инфекций у детей всех возрастных групп [2,4].
Как и в случае всех форм инфекции S. aureus , продолжающееся появление метициллин-устойчивых штаммов вызывает все большую озабоченность. Обзор данных из 33 различных детских больниц, представляющих 17 из 20 крупных мегаполисов США, показал, что распространенность остеомиелита, вызванного метициллин-резистентным S.aureus (MRSA) увеличилась с 0,3 до 1,4 на 1000 госпитализаций в период с 2002 по 2007 год, в то время как частота метициллин-чувствительного остеомиелита S. aureus (MSSA) оставалась стабильной [7]. В целом 51% пациентов, поступивших с инфекцией S. aureus , были инфицированы MRSA [7]. Это согласуется с нашим опытом в Детской больнице Арканзаса, где мы обнаружили, что приблизительно 65% наших стационарных случаев инфицирования S. aureus вызваны MRSA [Juretschko S, Arkansas Children’s Hospital, Pers.Comm.]. Важно отметить, что в исследовании всех детей, госпитализированных в Детский медицинский центр Далласа (Техас, США) с острым остеомиелитом в период с 1999 по 2003 год, частота осложнений вторичной инфекции MRSA была значительно выше, чем у пациентов, инфицированных MSSA, и у пациентов, страдающих от острого остеомиелита, вызванного возбудителями, отличными от S. aureus [8]. Осложнения включали миозит, абсцесс кости, патологический перелом, тромбоз глубоких вен и диссеминированное заболевание [8].Следует отметить, что в этом исследовании дети, которые получали соответствующую терапию MRSA в течение 2 дней, имели такую же частоту осложнений, как и дети, у которых была задержка на 2 дня или более в начале соответствующей антибактериальной терапии для острого остеомиелита MRSA [8]. Это означает, что использования только соответствующих противомикробных препаратов может быть недостаточно для лечения остеомиелита, связанного с MRSA. Это особенно верно в отношении инфекций, вызванных CA-MRSA, поскольку у этих пациентов часто наблюдаются более серьезные клинические проявления, которые включают усиленный воспалительный ответ, мультифокальное заболевание и более частые костные абсцессы, требующие хирургического дренирования [8,9,10].В этом отношении важно отметить, что временные рамки исследования в Далласе [8] соответствуют времени, когда возникновение инфекций CA-MRSA началось, но еще не достигло (или, возможно, даже сейчас) своего зенита.
Это означает, что использования только соответствующих противомикробных препаратов может быть недостаточно для лечения остеомиелита, связанного с MRSA. Это особенно верно в отношении инфекций, вызванных CA-MRSA, поскольку у этих пациентов часто наблюдаются более серьезные клинические проявления, которые включают усиленный воспалительный ответ, мультифокальное заболевание и более частые костные абсцессы, требующие хирургического дренирования [8,9,10].В этом отношении важно отметить, что временные рамки исследования в Далласе [8] соответствуют времени, когда возникновение инфекций CA-MRSA началось, но еще не достигло (или, возможно, даже сейчас) своего зенита.
Клинические проявления и диагностика острого гематогенного остеомиелита
Большинство детей и подростков с AHO имеют в анамнезе боли в костях в течение нескольких дней [2,4]. Отличительной чертой боли AHO является ее постоянный характер с постепенным увеличением уровня боли [2,4].У маленьких детей часто бывает трудно определить локализацию боли, в то время как у детей старшего возраста она обычно более локализована [2,4]. Боль обычно приводит к ограничению использования пораженной конечности [2,4]. Поскольку чаще всего поражаются длинные кости нижних конечностей, дети часто хромают [2,11]. Во всех случаях локальная боль в костях и лихорадка должны вызывать клиническое подозрение на AHO. Повышенная неподвижность сустава и отсутствие точечной болезненности над метафизом указывают на септический артрит, а не на остеомиелит (или в дополнение к нему).Классические признаки воспаления (покраснение, тепло и припухлость) не появляются, если инфекция не продвинулась через метафизарный кору в поднадкостничное пространство [2]. Такое прогрессирование чаще встречается у младенцев и детей раннего возраста, у которых кора костей более тонкая.
Повышенная скорость оседания эритроцитов (СОЭ), повышенный уровень С-реактивного белка (СРБ) и лейкоцитоз часто наблюдаются при AHO, причем повышенный уровень СРБ является наиболее чувствительным лабораторным параметром [12]. Однако это также зависит от агента-нарушителя.Например, недавнее исследование показало, что заметно повышенный уровень CRP (> 4 мг / дл) наблюдался у 86% детей с AHO, вызванным MRSA, но только у 58% детей с острым MSSA-остеомиелитом [8].
Однако это также зависит от агента-нарушителя.Например, недавнее исследование показало, что заметно повышенный уровень CRP (> 4 мг / дл) наблюдался у 86% детей с AHO, вызванным MRSA, но только у 58% детей с острым MSSA-остеомиелитом [8].
Поскольку физикальное обследование и лабораторные тесты предполагают, а не окончательные, для облегчения диагностики остеомиелита использовались различные методы визуализации. К ним относятся простые рентгенограммы, сцинтиграфия скелета, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ).
Обычные рентгенограммы необходимы для исключения других диагнозов, таких как перелом. Хотя глубокий отек мягких тканей можно увидеть рентгенологически в течение первых нескольких дней от начала, остеопения или остеолитические поражения в результате разрушения кости обычно не видны до 2–3 недель после появления симптомов [13]. По этой причине диагностическая ценность простых рентгенограмм для диагностики остеомиелита ограничена пациентами с длительными симптомами, и, как отмечалось ранее, это обычно не относится к детям.В результате для диагностики детской ОГО чаще используются другие методы визуализации [13]. Сцинтиграфия скелета с использованием дифосфоната технеция-99m позволяет проводить обследование всего тела, что полезно для пациентов с плохо локализованными симптомами или если вызывает беспокойство мультифокальный остеомиелит, и это имеет чувствительность более 90% [14]. Однако это требует воздействия ионизирующего излучения, а чувствительность новорожденных ниже, что делает сцинтиграфию скелета менее полезной в этой возрастной группе.Также может быть сложно дифференцировать остеомиелит от инфаркта, связанного с серповидно-клеточной анемией, и других заболеваний, не связанных с инфекцией, включая новообразования и переломы [14]. Кроме того, сцинтиграфия скелета может иметь ограниченное применение при диагностике внебольничного остеомиелита S. aureus . Недавнее исследование показало, что сцинтиграфия скелета диагностирует остеомиелит только у 53% детей с внебольничным остеомиелитом S. aureus [15].
aureus [15].
Одним из преимуществ компьютерной томографии является то, что она предоставляет конкретную анатомическую информацию о статусе инфекции [13].КТ может обнаруживать секвестры (свидетельствующие о хроническом остеомиелите) и внутрикостные газы, а также определять поднадкостничные абсцессы, все из которых являются важными факторами при разработке общего терапевтического подхода [13]. Однако КТ также требует воздействия радиации. Есть исследования, предполагающие, что позитронно-эмиссионная томография с фтордезоксиглюкозой (ФДГ-ПЭТ) может быть полезной альтернативой для диагностики у взрослых, особенно в сочетании с КТ [16,17]. Однако этот вопрос не был должным образом изучен в конкретном контексте педиатрического пациента.МРТ может использоваться для выявления внутрикостных, поднадкостничных и мягкотканных абсцессов, что позволяет раннее дренировать абсцесс без воздействия радиации [13,18]. Отеки и экссудаты в костномозговом пространстве являются частыми проявлениями острого остеомиелита и могут быть визуализированы с помощью МРТ [13,18]. Однако эти результаты также можно увидеть при других состояниях, таких как перелом и инфаркт [13,18]. Миозит также легко выявляется с помощью МРТ [18]. МРТ дает лучшую анатомическую информацию, предоставляя анатомический атлас для ортопедов, если будет показано хирургическое вмешательство.По этим причинам МРТ становится методом выбора для диагностики AHO у детей [2,13–15,18]. Чувствительность и специфичность МРТ для диагностики остеомиелита колеблются между 82–100% и 75–96% соответственно [13]. Стоимость, доступность и необходимость седации — важные ограничения для использования МРТ.
Хотя представление пациента, лабораторные исследования и диагностическая визуализация важны, ни один из них не является окончательным в отношении диагноза AHO и, что более важно, ни один не дает информации о статусе устойчивости к антибиотикам организма-нарушителя.По этой причине изоляция возбудителя болезни остается золотым стандартом диагностики и в настоящее время является единственным способом установить окончательный микробиологический диагноз [1,2]. В значительном числе случаев невозможно установить окончательную бактериальную этиологию либо потому, что возбудители болезни трудно культивировать, либо потому, что эмпирическая антимикробная терапия не позволила провести микробиологический анализ [2,5]. Когда этиологический агент может быть идентифицирован, эмпирическую противомикробную терапию следует скорректировать на основе профиля специфической чувствительности бактериального штамма-нарушителя.Культивированные образцы должны включать образцы костей, которые имеют более высокую диагностическую ценность по сравнению с культурами крови [2]. Тем не менее, посев крови также должен быть получен, поскольку организм восстанавливается примерно в 50% всех инфекций AHO [2]. Аспирация пораженной кости иглой может выполняться с использованием относительно неинвазивных процедур у новорожденных и маленьких детей, в то время как детям старшего возраста и подросткам часто требуются более инвазивные хирургические методы, такие как сверление или разрезание кости.Прямой посев культурального материала в бутыль для культуры крови увеличивает вероятность выздоровления такого привередливого организма, как K. kingae . Использование ПЦР для выявления патогенов в образцах костей также становится все более распространенным. В Детскую больницу Арканзаса все образцы костей отправляются на ПЦР-анализ с акцентом на S. aureus, S. pneumoniae , а у детей до 8 лет — K. kingae . Также должны быть получены окраски и посевы грибков и микобактерий, особенно в случаях со специфическими факторами риска и в случаях AHO с отрицательными посевами, которые не поддаются эмпирической терапии.Также следует отправить образцы тканей на гистологическое исследование для подтверждения диагноза остеомиелита. Сбор посевов на ранних стадиях AHO полезен, потому что длительная эмпирическая антимикробная терапия снижает вероятность восстановления возбудителя. Действительно, у стабильного пациента, если имеется план быстрого получения культур тканей, мы считаем, что эмпирическую антибиотикотерапию следует отложить до получения культур тканей.
В значительном числе случаев невозможно установить окончательную бактериальную этиологию либо потому, что возбудители болезни трудно культивировать, либо потому, что эмпирическая антимикробная терапия не позволила провести микробиологический анализ [2,5]. Когда этиологический агент может быть идентифицирован, эмпирическую противомикробную терапию следует скорректировать на основе профиля специфической чувствительности бактериального штамма-нарушителя.Культивированные образцы должны включать образцы костей, которые имеют более высокую диагностическую ценность по сравнению с культурами крови [2]. Тем не менее, посев крови также должен быть получен, поскольку организм восстанавливается примерно в 50% всех инфекций AHO [2]. Аспирация пораженной кости иглой может выполняться с использованием относительно неинвазивных процедур у новорожденных и маленьких детей, в то время как детям старшего возраста и подросткам часто требуются более инвазивные хирургические методы, такие как сверление или разрезание кости.Прямой посев культурального материала в бутыль для культуры крови увеличивает вероятность выздоровления такого привередливого организма, как K. kingae . Использование ПЦР для выявления патогенов в образцах костей также становится все более распространенным. В Детскую больницу Арканзаса все образцы костей отправляются на ПЦР-анализ с акцентом на S. aureus, S. pneumoniae , а у детей до 8 лет — K. kingae . Также должны быть получены окраски и посевы грибков и микобактерий, особенно в случаях со специфическими факторами риска и в случаях AHO с отрицательными посевами, которые не поддаются эмпирической терапии.Также следует отправить образцы тканей на гистологическое исследование для подтверждения диагноза остеомиелита. Сбор посевов на ранних стадиях AHO полезен, потому что длительная эмпирическая антимикробная терапия снижает вероятность восстановления возбудителя. Действительно, у стабильного пациента, если имеется план быстрого получения культур тканей, мы считаем, что эмпирическую антибиотикотерапию следует отложить до получения культур тканей.
Лечение острого гематогенного остеомиелита
Лечение AHO требует соответствующей антимикробной терапии во всех случаях и может потребовать хирургического разреза и дренирования.По причинам, обсуждавшимся ранее, соответствующий дренаж стал особенно важным в последние годы из-за продолжающегося появления CA-MRSA. Разрез и дренирование следует выполнять при наличии абсцесса (внутрикостного, поднадкостничного и / или мягкотканного) [2]. Следует провести хирургическое удаление омертвевшей кости и очистку пораженных мягких тканей [1,2]. Наш опыт показывает, что у детей и подростков с остеомиелитом, вызванным CA-MRSA, часто необходимы множественные разрезы и дренажные процедуры, даже при соответствующей антибактериальной терапии.Хирургический дренаж также следует рассмотреть, если ребенок не реагирует на эмпирическую антибактериальную терапию. В этом случае хирургическое вмешательство может улучшить лечение. Кроме того, хирургическое вмешательство позволяет собрать ткань, которую можно микробиологически оценить на предмет необычной этиологии остеомиелита и гистологически исследовать для подтверждения диагноза.
Независимо от того, требуется ли хирургическое вмешательство, для успешного лечения всех форм остеомиелита необходима соответствующая антибактериальная терапия [1,2,4].Антибиотики, которые доказали свою эффективность против инфекций костей и суставов S. aureus , включают нафциллин, клиндамицин, цефалоспорины первого поколения и ванкомицин [1,2]. Если MRSA не вызывает беспокойства (сообщества с ≤10% CA-MRSA, определенным местной антибиотикограммой), то, по нашему мнению, эмпирическая терапия для детей (детей в возрасте 3 месяцев и старше) должна представлять собой антистафилококковый пенициллин (нафциллин). и оксациллин) или цефалоспорин первого поколения (цефазолин). Эти агенты эффективны не только против MSSA, но и против других причин AHO, включая S.pyogenes и K. kingae . К сожалению, стойкое появление MRSA среди изолятов, ассоциированных с сообществом, ограничивает возможности лечения, поскольку все β-лактамные антибиотики исключены из рассмотрения.
В общинах с 10% или более CA-MRSA, ванкомицин или клиндамицин (если местные показатели устойчивости к клиндамицину ≤25%), по нашему мнению, должны использоваться для эмпирического лечения детей. Однако следует отметить, что ни ванкомицин, ни клиндамицин не проявляют активности в отношении К.kingae . Если клиндамицин рассматривается для лечения, фенотип устойчивости к индуцибельным макролидам, линкозамиду и стрептограмину B (MLS B ) должен быть исключен с помощью D-теста (тест индукции эритромицина, который показывает притупление зоны ингибирования клиндамицина на стороне соседний эритромициновый диск при наличии фенотипа устойчивости к MLS B ), поскольку этот фенотип был связан с неудачей лечения [19,20]. По нашему мнению, ванкомицин является основным препаратом выбора для терапии при резистентности, индуцируемой клиндамицином, и в сообществах с уровнем резистентности к клиндамицину более 25%.Если K. kingae вызывает особую озабоченность в области со значительным MRSA, следует рассмотреть возможность терапии цефазолином в дополнение к соответствующей эмпирической терапии MRSA. Следует также еще раз подчеркнуть, что если посевы дают окончательный диагноз, лечение антимикробными препаратами должно быть немедленно скорректировано в зависимости от профиля восприимчивости организма-нарушителя. представляет собой алгоритм предлагаемой начальной антибактериальной терапии AHO у детей от 3 месяцев и старше.
Алгоритм предлагаемой начальной антибактериальной терапии острого гематогенного остеомиелита у детей в возрасте 3 месяцев и старшеЕсли посевы выявляют микроорганизмы, антимикробную терапию следует немедленно скорректировать (при необходимости).
* Если Kingella kingae вызывает особую озабоченность, добавьте терапию цефазолином.
‡ Если клиндамицин рассматривается для лечения, фенотип устойчивости к индуцибельным макролидам, линкозамиду и стрептограмину B должен быть исключен с помощью D-теста, поскольку этот фенотип связан с неэффективностью лечения.
AHO: Острый гематогенный остеомиелит; CA-MRSA: внебольничный метициллин-устойчивый Staphylococcus aureus .
Триметоприм-сульфаметоксазол (TMP-SMX) успешно применялся для лечения инфекций кожи и мягких тканей (SSTI), вызванных CA-MRSA. Однако эффективность TMP – SMX в лечении остеомиелита MRSA у детей недостаточно изучена. Точно так же доксициклин может быть эффективным вариантом для лечения чувствительных к MRSA SSTI у детей старше 8 лет, но его использование для лечения MRSA-остеомиелита у детей остается неизученным.В последние годы стали доступны новые противомикробные препараты для лечения инфекций, вызванных MRSA. К ним относятся линезолид (оксазолидиноновый антибиотик) и даптомицин (липопептидный антибиотик). Пока что клинический опыт применения этих препаратов в конкретном контексте инфекции костей у детей ограничен, хотя в одном исследовании с участием 13 детей, получавших линезолид в качестве альтернативной терапии костно-суставных инфекций, у 11 из 13 детей были хорошие результаты [21]. ]. Средняя продолжительность терапии составляла 20 дней, и в ходе лечения у двоих детей развилась анемия [21].Миелосупрессия — известный побочный эффект длительной терапии линезолидом, так же как и оптические и периферические нейропатии. По этой причине не рекомендуется курс лечения более 21 дня. Это ограничивает использование линезолида при лечении AHO у детей, что требует длительной антимикробной терапии. Педиатрические исследования эффективности даптомицина отсутствуют. Использование даптомицина для лечения AHO у детей ограничено, поскольку MRSA AHO, осложненный пневмонией, представляет собой растущую проблему, а даптомицин инактивируется сурфактантами легких и не может использоваться для лечения таких сложных инфекций.Также известно, что даптомицин вызывает повышение уровня креатининфосфокиназы. При использовании даптомицина следует внимательно следить за уровнем креатининфосфокиназы, поскольку может возникнуть опасный рабдомиолиз. Недавние исследования показали, что даптомицин особенно эффективен в специфическом контексте биопленки [22] и при лечении связанных с биопленками инфекций, в том числе вызванных MRSA [23-25]. Это может быть особенно важно, особенно в контексте хронического остеомиелита.
Это может быть особенно важно, особенно в контексте хронического остеомиелита.
Продолжительность стандартной терапии AHO составляет от 4 до 6 недель.Доказательные данные о способе и продолжительности введения антибиотиков для лечения AHO ограничены, а критерии, устанавливающие, когда следует переходить от парентерального к пероральному лечению, не определены [26]. Продолжительное лечение антибиотиками может потребоваться при отсроченной или неполной хирургической эвакуации или при наличии отдаленных очагов инфекции (например, эндокардита). Интервенционная радиологическая установка постоянных венозных катетеров в периферическую вену легко доступна, но затраты на установку катетера, внутривенное введение антибиотиков в домашних условиях и уход на дому значительно выше, чем затраты, необходимые для пероральной терапии.Кроме того, важны осложнения, связанные с размещением центрального венозного катетера, такие как бактериемия, возникающая из-за постоянного устройства и неисправности линии. В обзоре, сравнивающем результаты короткого (<7 дней) и длительного (> 7 дней) курса внутривенного лечения AHO, вызванного главным образом MSSA, у детей от 3 месяцев до 16 лет, 12 проспективных исследований показали общий уровень излечения. 95,2% (95% ДИ: 90,4–97,7) для короткого курса по сравнению с 98,8% (95% ДИ: 93.6–99,8) для более длительного курса в 6 месяцев [26], что является незначительной разницей в свете возможных осложнений и затрат, указанных выше. Кроме того, не было значительной разницы в терапевтических результатах, основанных на продолжительности пероральной терапии, между двумя группами [26].
Наш опыт показывает, что детей можно эффективно лечить с помощью последовательной парентеральной / пероральной терапии при соблюдении нескольких условий. Парентерально антибиотики следует назначать до тех пор, пока у ребенка не станет лихорадка и пока не будет продемонстрировано улучшение как при физикальном обследовании, так и при лабораторных анализах.Мы рекомендуем 7–14 дней парентеральной терапии для пациентов с бактериемией; Для детей без бактериемии приемлем более короткий курс внутривенной терапии. В начале лечения следует еженедельно контролировать уровень СРБ и СОЭ, чтобы оценить реакцию на терапию. CRP обычно возвращается к исходному уровню в течение недели после эффективной терапии и используется многими как маркер перехода от парентеральной терапии к пероральной [2]. Еженедельно следует проводить полный анализ крови, чтобы оценить реакцию на терапию и контролировать нейтропению, потенциальное последствие антибактериальной терапии.Общая продолжительность терапии должна основываться на разрешении симптомов и нормализации СОЭ, что обычно занимает 4–6 недель. Должны присутствовать надежные опекуны и организовываться регулярное плановое амбулаторное наблюдение. Пероральный антибиотик должен демонстрировать отличное проникновение в кости, иметь такую же степень антибактериального покрытия, что и парентеральный препарат, и ребенок должен иметь возможность принимать пероральные препараты. Однако в связи с увеличением числа CA-MRSA, который также устойчив к клиндамицину, и отсутствием исследований, касающихся использования других пероральных антибиотиков у детей, соответствие этим критериям может вскоре оказаться затруднительным в США.
В начале лечения следует еженедельно контролировать уровень СРБ и СОЭ, чтобы оценить реакцию на терапию. CRP обычно возвращается к исходному уровню в течение недели после эффективной терапии и используется многими как маркер перехода от парентеральной терапии к пероральной [2]. Еженедельно следует проводить полный анализ крови, чтобы оценить реакцию на терапию и контролировать нейтропению, потенциальное последствие антибактериальной терапии.Общая продолжительность терапии должна основываться на разрешении симптомов и нормализации СОЭ, что обычно занимает 4–6 недель. Должны присутствовать надежные опекуны и организовываться регулярное плановое амбулаторное наблюдение. Пероральный антибиотик должен демонстрировать отличное проникновение в кости, иметь такую же степень антибактериального покрытия, что и парентеральный препарат, и ребенок должен иметь возможность принимать пероральные препараты. Однако в связи с увеличением числа CA-MRSA, который также устойчив к клиндамицину, и отсутствием исследований, касающихся использования других пероральных антибиотиков у детей, соответствие этим критериям может вскоре оказаться затруднительным в США.
Комментарий экспертов и пятилетний обзор
До появления антибиотиков AHO было серьезным заболеванием с высокой заболеваемостью и смертностью [2]. Благодаря усовершенствованным методам диагностики и лечения смертность от этого заболевания в развитых странах в настоящее время незначительна [4]. Однако вариабельный клинический курс у детей с AHO затрудняет рекомендации по стандартизации терапии. Лечение всегда должно быть индивидуальным с использованием командного подхода, включающего участие педиатрических инфекционистов и ортопедов.
Эпидемиология AHO у детей также изменилась с появлением CA-MRSA в качестве основного патогена. Прошлые исследования клинического течения, диагностики и лечения AHO могут быть неприменимы к CA-MRSA, и по этой причине срочно необходимы дальнейшие исследования всех вопросов, обсуждаемых в этом обзоре.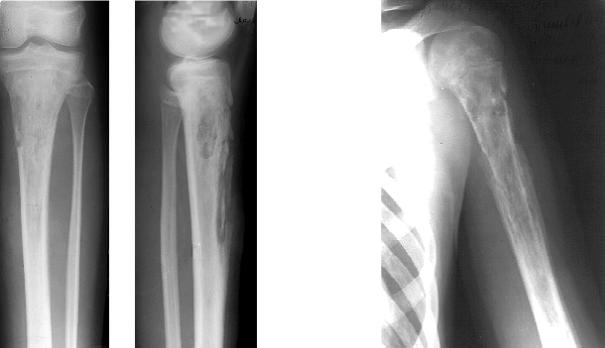 Крайне важно, чтобы эти исследования включали оценку новых противомикробных агентов, которые эффективны против штаммов стафилококков, устойчивых к современным β-лактамным, линкозамидным и гликопептидным антибиотикам.К ним относятся липогликопептиды (бактерицидные агенты с длительным периодом полураспада) телаванцин, оритаванцин и далбаванцин, все из которых являются производными существующих гликопептидных антибиотиков и некоторые из них эффективны против устойчивых к ванкомицину штаммов [27]. Другие антибиотики включают иклаприм, ингибитор дигидрофолатредуктазы, потенциально пригодный для перорального применения, и новые цефалоспорины цефтобипрол и цефтаролин [27]. Важно, чтобы эффективность всех этих новых антибиотиков оценивалась в конкретном контексте детей и в более конкретном контексте детского остеомиелита.
Крайне важно, чтобы эти исследования включали оценку новых противомикробных агентов, которые эффективны против штаммов стафилококков, устойчивых к современным β-лактамным, линкозамидным и гликопептидным антибиотикам.К ним относятся липогликопептиды (бактерицидные агенты с длительным периодом полураспада) телаванцин, оритаванцин и далбаванцин, все из которых являются производными существующих гликопептидных антибиотиков и некоторые из них эффективны против устойчивых к ванкомицину штаммов [27]. Другие антибиотики включают иклаприм, ингибитор дигидрофолатредуктазы, потенциально пригодный для перорального применения, и новые цефалоспорины цефтобипрол и цефтаролин [27]. Важно, чтобы эффективность всех этих новых антибиотиков оценивалась в конкретном контексте детей и в более конкретном контексте детского остеомиелита.
Независимо от наличия каких-либо новых противомикробных препаратов, главной терапевтической проблемой при всех формах остеомиелита является возможность как можно быстрее начать наиболее подходящую терапию. В этом отношении важны два соображения: первое — это сложность, связанная с своевременным подтверждением наличия инфекции, а второе — способность идентифицировать возбудителя болезни и оценить его профиль устойчивости к антибиотикам. Поскольку обычные методы физического и лабораторного анализа имеют ограниченную специфичность, решение первого из них потребует разработки конкретных методов визуализации, способных отличить инфекцию от других форм воспаления и, что не менее важно, определить стадию инфекции как необходимое предварительное условие для разработка эффективного подхода к лечению.Одной из возможностей в этом отношении является FDG-PET, хотя еще раз диагностическая ценность этого метода визуализации не была должным образом оценена, особенно в конкретном контексте детского остеомиелита. Своевременное выявление этиологических агентов AHO в образцах костей и крови, вероятно, будет улучшено за счет более широкого использования методов молекулярной диагностики, включая ПЦР.
Наконец, хотя AHO в настоящее время является наиболее распространенной формой остеомиелита у детей, ситуация может измениться в свете появления инфекций CA-MRSA.Штаммы CA-MRSA, особенно штаммы клональной линии USA300 [3], проявляют повышенную вирулентность, которая приводит к осложнениям как в контексте самого остеомиелита, так и возникновения диссеминированных инфекций у педиатрических пациентов. По этой причине кажется вероятным, что для эффективного лечения детского остеомиелита все чаще требуются терапевтические подходы, более часто связанные с хронической инфекцией, включая хирургическую обработку раны и локальную доставку антибиотиков. Локальная доставка антибиотиков дает несколько преимуществ, наиболее важным из которых является способность достигать высоких уровней антибиотиков в очаге инфекции без риска системной токсичности.Исходя из этого, мы считаем, что исследования должны быть сосредоточены на разработке и оценке как стабильных, так и биоабсорбируемых матриц для локальной доставки антибиотиков. Наиболее часто используемой матрицей доставки, особенно в тех случаях, когда обработка раны приводит к структурно-нестабильному дефекту, требующему последующей реконструкции, является полиметилметакрилат (ПММА). Гранулы из ПММА, пропитанные антибиотиками, коммерчески доступны в некоторых странах, в то время как в других хирурги должны производить свои собственные гранулы из ПММА.Альтернативный подход — имплантация биоабсорбируемой матрицы доставки, которая подходит пациентам, у которых хирургическая обработка раны не создает структурно нестабильного дефекта. Действительно, в таких случаях использование биорассасывающейся матрицы для доставки предпочтительнее ПММА, поскольку не требует удаления гранул по завершении терапии [28,29].
Независимо от матрицы доставки наиболее часто используемыми антибиотиками являются гентамицин, тобрамицин и ванкомицин, при этом имеется относительно мало экспериментальных данных в отношении других противомикробных агентов. Недавно было продемонстрировано, что даптомицин может быть включен как в ПММА, так и в другие матрицы доставки (например, сульфат кальция) без потери активности и что он сохраняет эту активность, поскольку он элюируется из гранул с течением времени [30–32]. Клинический опыт применения гранул, пропитанных антибиотиками, в контексте инфекции костей, особенно в отношении этих новых антибиотиков, ограничен у взрослых, но тем более у детей. Как отмечалось выше, важно, чтобы все формы терапии с использованием любого из доступных антибиотиков оценивались на основе как эффективности, так и фармакологических соображений в конкретном контексте детской инфекции.Исходя из этого, крайне важно, чтобы в будущих исследованиях было изучено использование как существующих, так и новых антибиотиков в конкретном контексте локальной доставки антибиотиков при лечении остеомиелита у детей.
Недавно было продемонстрировано, что даптомицин может быть включен как в ПММА, так и в другие матрицы доставки (например, сульфат кальция) без потери активности и что он сохраняет эту активность, поскольку он элюируется из гранул с течением времени [30–32]. Клинический опыт применения гранул, пропитанных антибиотиками, в контексте инфекции костей, особенно в отношении этих новых антибиотиков, ограничен у взрослых, но тем более у детей. Как отмечалось выше, важно, чтобы все формы терапии с использованием любого из доступных антибиотиков оценивались на основе как эффективности, так и фармакологических соображений в конкретном контексте детской инфекции.Исходя из этого, крайне важно, чтобы в будущих исследованиях было изучено использование как существующих, так и новых антибиотиков в конкретном контексте локальной доставки антибиотиков при лечении остеомиелита у детей.
Ключевые проблемы
У детей остеомиелит в основном гематогенный и острый.
Золотистый стафилококк является преобладающим возбудителем остеомиелита.
Метициллин-устойчивый S.aureus (MRSA) увеличилась во всем мире, что изменило эпидемиологию остеомиелита.
Инфекции, вызванные внебольничным MRSA (CA-MRSA), имеют более серьезные проявления, чем метициллин-чувствительный S. aureus острый гематогенный остеомиелит.
МРТ — предпочтительный метод визуализации при остром гематогенном остеомиелите у детей, но с учетом текущих ограничений всех методов визуализации разработка и оптимизация альтернативных методов визуализации является важной клинической целью.
Если выявлен этиологический агент остеомиелита, необходимо назначить специфическое противомикробное лечение, основанное на профиле восприимчивости организма. Чтобы облегчить это, по возможности должны быть получены соответствующие культуры, включая биопсию кости, и альтернативные методы диагностики, способные обнаруживать патогены независимо от их характеристик роста (например, ПЦР).

В сообществах с более чем 10% CA-MRSA ванкомицин или клиндамицин следует использовать для эмпирического лечения острого гематогенного остеомиелита.Ванкомицин является основным препаратом выбора для терапии CA-MRSA в сообществах с уровнем резистентности к клиндамицину более 25% и в условиях резистентности, индуцируемой клиндамицином.
Стандартная антимикробная терапия острого гематогенного остеомиелита длится от 4 до 6 недель. Доказательные исследования относительно пути и продолжительности лечения антибиотиками острого гематогенного остеомиелита ограничены, а руководящие принципы, когда следует перейти с парентеральной терапии на пероральную, отсутствуют.
Различное клиническое течение у детей с острым гематогенным остеомиелитом затрудняет рекомендации по стандартизированной терапии. Лечение всегда должно быть индивидуальным с использованием командного подхода, включающего участие специалистов как в области детских инфекционных заболеваний, так и в области ортопедии.
Сноски
Раскрытие информации о финансовых и конкурирующих интересах
Авторы получают финансирование от NIH (RO1 — {«type»: «entrez-nucleotide», «attrs»: {«text»: «AI043356», «term_id»: «3286613», «term_text»: «AI043356»}} AI043356, RO1 — {«type»: «entrez-нуклеотид», «attrs»: {«text»: «AI069087», «term_id»: » 3392062 «,» term_text «:» AI069087 «}} AI069087 и RO1 — {» type «:» entrez-нуклеотид «,» attrs «: {» text «:» AI074007 «,» term_id «:» 3400651 «,» term_text «:» AI074007 «}} AI074007) и от Cubist Pharmaceuticals.Авторы не имеют других соответствующих аффилированных или финансовых отношений с какой-либо организацией или юридическим лицом, имеющим финансовый интерес или финансовый конфликт с предметом или материалами, обсуждаемыми в рукописи, кроме тех, которые раскрыты.
При создании этой рукописи не использовались письменные переводчики.
Информация для авторов
Нада С. Харик, Отделение педиатрии и Отделение микробиологии и иммунологии, Университет медицинских наук Арканзаса и Детская больница Арканзаса, Литл-Рок, AR 72205, США, тел.: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah.
Харик, Отделение педиатрии и Отделение микробиологии и иммунологии, Университет медицинских наук Арканзаса и Детская больница Арканзаса, Литл-Рок, AR 72205, США, тел.: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah.
Марк С. Смелцер, Отделение микробиологии и иммунологии и Отделение ортопедической хирургии, Медицинский университет Арканзаса, Литл-Рок, AR 72205, США.
Список литературы
2. Крогстад П. Остеомиелит. В: Фейгин Р.Д., Черри Д.Д., Деммлер-Харрисон Г.Д., Каплан С.Л., редакторы. Учебник детских инфекционных болезней. 6-е издание. Пенсильвания, США: Сондерс Эльзевьер; 2009. С. 725–742. [Google Scholar] 3. Ли М., Ан Дьеп Б., Вильяруз А.Е. и др.Эволюция вирулентности у устойчивых к метициллину эпидемических сообществ Staphylococcus aureus . Proc. Natl Acad. Sci. США. 2009. 106 (14): 5883–5888. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Гутьеррес К. Инфекции костей и суставов у детей. Педиатр. Clin. N. Am. 2005. 52 (3): 779–794. [PubMed] [Google Scholar] 5. Floyed RL, Стил RW. Остеомиелит без посева. Педиатр. Заразить. Дис. J. 2003. 22 (8): 731–736. [PubMed] [Google Scholar] 6. Чометон С., Бенито Ю., Чакер М. и др.Специфическая полимеразная цепная реакция в реальном времени определяет Kingella kingae как наиболее частую причину костно-суставных инфекций у детей раннего возраста. Педиатр. Заразить. Дис. J. 2007; 26 (5): 377–381. [PubMed] [Google Scholar] 7. Gerber JS, Coffin SE, Smathers SA, Zaoutis TE. Тенденции заболеваемости метициллин-устойчивой инфекцией Staphylococcus aureus в детских больницах США. Clin. Заразить. Дис. 2009. 49 (1): 65–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Сааведра-Лозано Дж., Мехиас А., Ахмад Н. и др.Изменение тенденций развития острого остеомиелита у детей: влияние метициллин-резистентных инфекций Staphylococcus aureus . J. Pediatr. Ортоп. 2008. 28 (5): 569–575. [PubMed] [Google Scholar] 9. Мартинес-Агилар Г.А., Авалос-Мишаан А., Халтен К. и др. Внебольничная, метициллин-резистентный и метициллин-чувствительных стафилококк скелетно-мышечные заболевания у детей. Педиатр. Заразить. Дис. J. 2004; 23 (8): 701–706. [PubMed] [Google Scholar] 10. Bocchini CE, Hulten KG, Mason EO Jr и др.Гены лейкоцидина Пантона-Валентайна связаны с усилением воспалительной реакции и локальным заболеванием при остром гематогенном остеомиелите Staphylococcus aureus у детей. Педиатрия. 2006. 117 (2): 433–440. [PubMed] [Google Scholar] 11. Сойер Дж. Р., Капур М. Хромый ребенок: системный подход к диагностике. Являюсь. Fam. Врач. 2009. 79 (3): 215–224. [PubMed] [Google Scholar] 12. Unkila-Kallio L, Kallio MJ, Peltola H, Eskola J. Сывороточный С-реактивный белок, скорость оседания эритроцитов и количество лейкоцитов при остром гематогенном остеомиелите у детей.Педиатрия. 1994. 93 (1): 59–62. [PubMed] [Google Scholar] 13. Пинеда С., Варгас А., Родригес А.В. Визуализация остеомиелита: современные концепции. Заразить. Дис. Clin. N. Am. 2006. 20 (4): 789–825. [PubMed] [Google Scholar] 14. Коннолли LP, Коннолли С.А., Друбах Л.А., Джарамилло Д., Тревес ST. Острый гематогенный остеомиелит у детей: оценка диагностики на основе скелетной сцинтиграфии в эпоху МРТ. J. Nucl. Med. 2002. 43 (10): 1310–1316. [PubMed] [Google Scholar] 15. Браун Л.П., Мейсон Е.О., Каплан С.Л., Кэссиди С.И., Кришнамурти Р., Гиллерман Р.П.Оптимальная стратегия визуализации для внебольничных стафилококка костно-мышечных инфекций у детей. Педиатр. Радиол. 2008. 38 (8): 841–847. [PubMed] [Google Scholar] 16. Basu S, Chryssikos T, Moghadem-Kia S, Zhuang H, Torigian DA, Alavi A. Позитронно-эмиссонная томография как диагностический инструмент при инфекции: настоящая роль и будущие возможности. Семин. Nucl. Med. 2009. 39 (1): 36–51. [PubMed] [Google Scholar] 17. Strobel K, Stumpe KD. ПЭТ / КТ в костно-мышечной инфекции. Семин. Musculoskelet.Радиол. 2007. 11 (4): 353–364. [PubMed] [Google Scholar] 18. Чанг Т. Магнитно-резонансная томография при остром остеомиелите у детей.
и др. Внебольничная, метициллин-резистентный и метициллин-чувствительных стафилококк скелетно-мышечные заболевания у детей. Педиатр. Заразить. Дис. J. 2004; 23 (8): 701–706. [PubMed] [Google Scholar] 10. Bocchini CE, Hulten KG, Mason EO Jr и др.Гены лейкоцидина Пантона-Валентайна связаны с усилением воспалительной реакции и локальным заболеванием при остром гематогенном остеомиелите Staphylococcus aureus у детей. Педиатрия. 2006. 117 (2): 433–440. [PubMed] [Google Scholar] 11. Сойер Дж. Р., Капур М. Хромый ребенок: системный подход к диагностике. Являюсь. Fam. Врач. 2009. 79 (3): 215–224. [PubMed] [Google Scholar] 12. Unkila-Kallio L, Kallio MJ, Peltola H, Eskola J. Сывороточный С-реактивный белок, скорость оседания эритроцитов и количество лейкоцитов при остром гематогенном остеомиелите у детей.Педиатрия. 1994. 93 (1): 59–62. [PubMed] [Google Scholar] 13. Пинеда С., Варгас А., Родригес А.В. Визуализация остеомиелита: современные концепции. Заразить. Дис. Clin. N. Am. 2006. 20 (4): 789–825. [PubMed] [Google Scholar] 14. Коннолли LP, Коннолли С.А., Друбах Л.А., Джарамилло Д., Тревес ST. Острый гематогенный остеомиелит у детей: оценка диагностики на основе скелетной сцинтиграфии в эпоху МРТ. J. Nucl. Med. 2002. 43 (10): 1310–1316. [PubMed] [Google Scholar] 15. Браун Л.П., Мейсон Е.О., Каплан С.Л., Кэссиди С.И., Кришнамурти Р., Гиллерман Р.П.Оптимальная стратегия визуализации для внебольничных стафилококка костно-мышечных инфекций у детей. Педиатр. Радиол. 2008. 38 (8): 841–847. [PubMed] [Google Scholar] 16. Basu S, Chryssikos T, Moghadem-Kia S, Zhuang H, Torigian DA, Alavi A. Позитронно-эмиссонная томография как диагностический инструмент при инфекции: настоящая роль и будущие возможности. Семин. Nucl. Med. 2009. 39 (1): 36–51. [PubMed] [Google Scholar] 17. Strobel K, Stumpe KD. ПЭТ / КТ в костно-мышечной инфекции. Семин. Musculoskelet.Радиол. 2007. 11 (4): 353–364. [PubMed] [Google Scholar] 18. Чанг Т. Магнитно-резонансная томография при остром остеомиелите у детей. Педиатр. Заразить. Дис. J. 2002; 21 (9): 869–870. [PubMed] [Google Scholar] 19. Франк А.Л., Марчинак Дж. Ф., Мангат Д. и др. Лечение клиндамицином метициллин-устойчивых Staphylococcus aureus инфекций у детей. Педиатр. Заразить. Дис. J. 2002; 21 (6): 530–534. [PubMed] [Google Scholar] 20. Сибри Г.К., Текле Т., Кэрролл К., Дик Дж. Неудача лечения клиндамицином метициллин-устойчивого Staphylococcus aureus , экспрессирующего индуцибельную устойчивость к клиндамицину in vitro .Clin. Заразить. Дис. 2003. 37 (9): 1257–1260. [PubMed] [Google Scholar] 21. Chen CJ, Chiu CH, Lin TY, Lee ZL, Yang WE, Huang YC. Опыт применения линезолида у детей с костно-суставными инфекциями. Педиатр. Заразить. Дис. J. 2008; 26 (11): 985–988. [PubMed] [Google Scholar] 22. Weiss EC, Spencer HJ, Daily SJ, Weiss BD, Smeltzer MS. Влияние sarA на чувствительность к антибиотикам Staphylococcus aureus в катетер-ассоциированной модели образования биопленок in vitro . Противомикробный.Агенты Chemother. 2009. 53 (6): 2475–2482. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Weiss ED, Zielinska A, Beenken KE, Spencer HJ, Daily SJ, Smeltzer MS. Влияние sarA на чувствительность к даптомицину Staphylococcus aureus биопленок in vivo . Противомикробный. Агенты Chemother. 2009. 53 (10): 4096–4102. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Miro JM, Garcia-de-la-Maria C, Armero Y, et al. Добавление гентамицина или рифампицина не увеличивает эффективность даптомицина при лечении экспериментального эндокардита, вызванного устойчивостью к метициллину Staphylococcus aureus .Противомикробный. Агенты Chemother. 2009. 53 (10): 4172–4177. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Мурильо О., Гарригос С., Пачон М.Э. и др. Эффективность высоких доз даптомицина по сравнению с альтернативными методами лечения экспериментальной инфекции инородного тела метициллин-резистентным Staphylococcus aureus . Противомикробный.
Педиатр. Заразить. Дис. J. 2002; 21 (9): 869–870. [PubMed] [Google Scholar] 19. Франк А.Л., Марчинак Дж. Ф., Мангат Д. и др. Лечение клиндамицином метициллин-устойчивых Staphylococcus aureus инфекций у детей. Педиатр. Заразить. Дис. J. 2002; 21 (6): 530–534. [PubMed] [Google Scholar] 20. Сибри Г.К., Текле Т., Кэрролл К., Дик Дж. Неудача лечения клиндамицином метициллин-устойчивого Staphylococcus aureus , экспрессирующего индуцибельную устойчивость к клиндамицину in vitro .Clin. Заразить. Дис. 2003. 37 (9): 1257–1260. [PubMed] [Google Scholar] 21. Chen CJ, Chiu CH, Lin TY, Lee ZL, Yang WE, Huang YC. Опыт применения линезолида у детей с костно-суставными инфекциями. Педиатр. Заразить. Дис. J. 2008; 26 (11): 985–988. [PubMed] [Google Scholar] 22. Weiss EC, Spencer HJ, Daily SJ, Weiss BD, Smeltzer MS. Влияние sarA на чувствительность к антибиотикам Staphylococcus aureus в катетер-ассоциированной модели образования биопленок in vitro . Противомикробный.Агенты Chemother. 2009. 53 (6): 2475–2482. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Weiss ED, Zielinska A, Beenken KE, Spencer HJ, Daily SJ, Smeltzer MS. Влияние sarA на чувствительность к даптомицину Staphylococcus aureus биопленок in vivo . Противомикробный. Агенты Chemother. 2009. 53 (10): 4096–4102. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Miro JM, Garcia-de-la-Maria C, Armero Y, et al. Добавление гентамицина или рифампицина не увеличивает эффективность даптомицина при лечении экспериментального эндокардита, вызванного устойчивостью к метициллину Staphylococcus aureus .Противомикробный. Агенты Chemother. 2009. 53 (10): 4172–4177. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Мурильо О., Гарригос С., Пачон М.Э. и др. Эффективность высоких доз даптомицина по сравнению с альтернативными методами лечения экспериментальной инфекции инородного тела метициллин-резистентным Staphylococcus aureus . Противомикробный. Агенты Chemother. 2009. 53 (10): 4252–4257. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Le Saux N, Howard A, Barrowman NJ, Gaboury, Sampson M, Moher D. Более короткие курсы парентеральной антибактериальной терапии, по-видимому, не влияют на частоту ответа у детей с острым гематогенным остеомиелитом: систематический обзор.BMC Infect. Дис. 2002; 2: 16–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Стрыевский М.Э., Кори Г.Р. Новые методы лечения метициллин-резистентного Staphylococcus aureus . Curr. Opin. Крит. Уход. 2009. 15 (5): 403–412. [PubMed] [Google Scholar] 28. Томас М.В., Пулео Д.А. Сульфат кальция: свойства и клиническое применение. J. Biomed. Матер. Res. Б. Прил. Биоматер. 2009. 88 (2): 597–610. [PubMed] [Google Scholar] 29. Залаврас К.Г., Пацакис М.Дж., Холтом П. Местная антибактериальная терапия при лечении открытых переломов и остеомиелита.Clin. Ортоп. Relat. Res. 2004; 427: 86–93. [PubMed] [Google Scholar] 30. Уэбб Н.Д., Макканлесс Д.Д., Кортни Х.С., Бумгарднер Д.Д., Хаггард В.О. Даптомицин, элюированный из сульфата кальция, оказывается эффективным против Staphylococcus . Clin. Ортоп. Relat. Res. 2008. 466 (6): 1383–1387. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Weiss BD, Weiss EC, Haggard WO, Evans RP, McLaren SG, Smeltzer MS. Оптимизированное элюирование даптомицина из гранул полиметилметакрилата. Противомикробный. Агенты Chemother. 2008. 53 (1): 264–266.[Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Канеллакопулу К., Панагопулос П., Джаннитсиоти Э. и др. In vitro элюция даптомицина синтетической кристаллической полугидратной формой сульфата кальция, стимуланом. Противомикробный. Агенты Chemother. 2009. 53 (7): 3106–3107. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Агенты Chemother. 2009. 53 (10): 4252–4257. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Le Saux N, Howard A, Barrowman NJ, Gaboury, Sampson M, Moher D. Более короткие курсы парентеральной антибактериальной терапии, по-видимому, не влияют на частоту ответа у детей с острым гематогенным остеомиелитом: систематический обзор.BMC Infect. Дис. 2002; 2: 16–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Стрыевский М.Э., Кори Г.Р. Новые методы лечения метициллин-резистентного Staphylococcus aureus . Curr. Opin. Крит. Уход. 2009. 15 (5): 403–412. [PubMed] [Google Scholar] 28. Томас М.В., Пулео Д.А. Сульфат кальция: свойства и клиническое применение. J. Biomed. Матер. Res. Б. Прил. Биоматер. 2009. 88 (2): 597–610. [PubMed] [Google Scholar] 29. Залаврас К.Г., Пацакис М.Дж., Холтом П. Местная антибактериальная терапия при лечении открытых переломов и остеомиелита.Clin. Ортоп. Relat. Res. 2004; 427: 86–93. [PubMed] [Google Scholar] 30. Уэбб Н.Д., Макканлесс Д.Д., Кортни Х.С., Бумгарднер Д.Д., Хаггард В.О. Даптомицин, элюированный из сульфата кальция, оказывается эффективным против Staphylococcus . Clin. Ортоп. Relat. Res. 2008. 466 (6): 1383–1387. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Weiss BD, Weiss EC, Haggard WO, Evans RP, McLaren SG, Smeltzer MS. Оптимизированное элюирование даптомицина из гранул полиметилметакрилата. Противомикробный. Агенты Chemother. 2008. 53 (1): 264–266.[Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Канеллакопулу К., Панагопулос П., Джаннитсиоти Э. и др. In vitro элюция даптомицина синтетической кристаллической полугидратной формой сульфата кальция, стимуланом. Противомикробный. Агенты Chemother. 2009. 53 (7): 3106–3107. [Бесплатная статья PMC] [PubMed] [Google Scholar]Ведение острого гематогенного остеомиелита у детей
Expert Rev Anti Infect Ther. Авторская рукопись; доступно в PMC 2010 1 декабря 2010 г.
Опубликован в окончательной редакции как:
PMCID: PMC2836799
NIHMSID: NIHMS180283
Nada S Harik
Кафедра педиатрии и кафедра микробиологии и иммунологии Университета медицины Арканзас Science and the Arkansas Children’s Hospital, Little Rock, AR 72205, USA, тел. : +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah
: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah
Марк С. Смелцер
Кафедра микробиологии и иммунологии и кафедра ортопедической хирургии, Университет медицинских наук Арканзаса, Литл-Рок, Арканзас 72205 , США
Нада С. Харик, Департамент педиатрии и Департамент микробиологии и иммунологии, Университет медицинских наук Арканзаса и Детская больница Арканзаса, Литл-Рок, AR 72205, США, тел .: +1 501 364 1416, факс: +1 501 364 3551, уд.smau @ adankirah; † Автор заочного отделения педиатрии и отделения микробиологии и иммунологии Медицинского университета Арканзаса и детской больницы Арканзаса, Литл-Рок, AR 72205, США, тел .: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Остеомиелит у детей преимущественно гематогенного происхождения и острый по своей природе. Основной причиной остеомиелита у детей является золотистого стафилококка , а эпидемиология и патогенез S.aureus , включая остеомиелит, изменились за последние годы в связи с появлением устойчивых к метициллину S. aureus , ассоциированных с сообществами. В этом обзоре рассматриваются достижения в диагностике и общем лечении острого гематогенного остеомиелита у детей с учетом этих изменений.
Ключевые слова: острый гематогенный остеомиелит, AHO, антибактериальная терапия, CA-MRSA, дети, внебольничная метициллин-резистентная Staphylococcus aureus , диагностическая визуализация, остеомиелит, Staphylococcus aureus
строго определена как любая форма 9000 воспаления, затрагивающего кости и / или костный мозг, но почти всегда это результат инфекции.Это сложная инфекция, которая принимает различные формы, особенно с точки зрения наиболее подходящего терапевтического подхода к использованию, и по этой причине для описания остеомиелита использовалось несколько схем классификации. Один из них фокусируется на источнике инфекции и различает инфекции, возникающие в результате гематогенного посева из эндостального кровоснабжения, и инфекции, возникающие в результате вышележащей инфекции мягких тканей (остеомиелит, вторичный по отношению к смежному очагу инфекции) и / или сосудистой недостаточности. [1].Вторая схема, которая применяется независимо от основного источника бактерии-нарушителя, различает острую, подострую и хроническую инфекцию в зависимости от времени между появлением симптомов и диагнозом [1].
[1].Вторая схема, которая применяется независимо от основного источника бактерии-нарушителя, различает острую, подострую и хроническую инфекцию в зависимости от времени между появлением симптомов и диагнозом [1].Острый остеомиелит определяется как инфекция, диагностированная в течение 2 недель после появления симптомов [1,2]. Подострый остеомиелит диагностируется через 2 недели после появления симптомов, а хронический остеомиелит — через несколько месяцев после появления симптомов [2]. Хотя нам известно об отсутствии исследований, конкретно посвященных этой проблеме, мы считаем, что эти временные рамки должны зависеть, по крайней мере, до некоторой степени, от свойств вирулентности инфекционного штамма. Staphylococcus aureus является преобладающим патогеном, вызывающим остеомиелит у детей (см. Ниже), и возможно, что временные рамки инфекции могут измениться у детей, инфицированных метициллин-резистентным S. aureus (CA-MRSA). , многие штаммы которых являются гипервирулентными по причинам, которые еще предстоит полностью объяснить [3]. В таком случае возникнет острая необходимость в разработке диагностических методов, способных обнаруживать инфекцию на ранних стадиях.
Обе схемы классификации, процитированные ранее, имеют отношение к этому обсуждению, поскольку, в отличие от инфекции у взрослых, остеомиелит у детей обычно имеет гематогенное происхождение и чаще всего протекает остро [1,2,4]. Основным фактором, способствующим распространению гематогенного пути заражения, является характер эндостального кровоснабжения растущих костей детей [1,2,4].
Ни одно из этих различий не является абсолютным в том смысле, что остеомиелит у детей может быть вызван локальным распространением инфекции смежных мягких тканей или, что реже, прямой инокуляцией патогенного микроорганизма в кость.Хронические инфекции действительно возникают у детей, как правило, в результате неудачной антимикробной терапии или наличия ортопедического имплантата. Хроническая инфекция дополнительно определяется образованием секвестра мертвой кости, и для успешного лечения таких инфекций обычно требуется хирургическая обработка раны и длительное лечение антимикробными препаратами, последнее иногда принимает форму как системной, так и местной доставки антибиотиков [1]. Хотя в этом обзоре рассматриваются оба эти вопроса, учитывая его преобладание среди детей, основное внимание уделяется диагностике и лечению острого гематогенного остеомиелита (ОГД) у педиатрических пациентов.
Хроническая инфекция дополнительно определяется образованием секвестра мертвой кости, и для успешного лечения таких инфекций обычно требуется хирургическая обработка раны и длительное лечение антимикробными препаратами, последнее иногда принимает форму как системной, так и местной доставки антибиотиков [1]. Хотя в этом обзоре рассматриваются оба эти вопроса, учитывая его преобладание среди детей, основное внимание уделяется диагностике и лечению острого гематогенного остеомиелита (ОГД) у педиатрических пациентов.
Микробная этиология острого гематогенного остеомиелита
Острый гематогенный остеомиелит обычно возникает в метафизе длинных трубчатых костей, причем примерно две трети всех случаев затрагивают бедренную, большеберцовую или плечевую кости [1,2,4]. Хотя могут быть задействованы различные бактериальные патогены, наиболее распространенным патогеном является S. aureus , который вызывает 70–90% инфекций AHO у детей [2,4]. Другие этиологические агенты, в произвольном порядке, включают Streptococcus pyogenes , Streptococcus pneumoniae , стрептококки группы B (у младенцев), коагулазонегативные стафилококки (особенно при инфекциях, связанных с имплантатами), Kingella kingae , кишечные грамотрицательные бациллы (особенно Salmonella spp.у лиц с серповидно-клеточной анемией) и анаэробными бактериями. Haemophilus influenzae тип b (Hib) был частой причиной детского остеомиелита, но его распространенность снизилась за счет введения конъюгированной вакцины Hib [2,4]. Такие организмы, как Mycobacterium , Bartonella , грибы ( Histoplasma , Cryptococcus и Blastomyces ), Candida и Coxiella , обычно являются необычными причинами риска развития остеомиелита, обычно наблюдаемыми у пациентов с остеомиелитом. путешествовать или проживать в географических регионах, в которых патогенные микроорганизмы являются эндемичными и / или имеют иммунодепрессивный характер [4].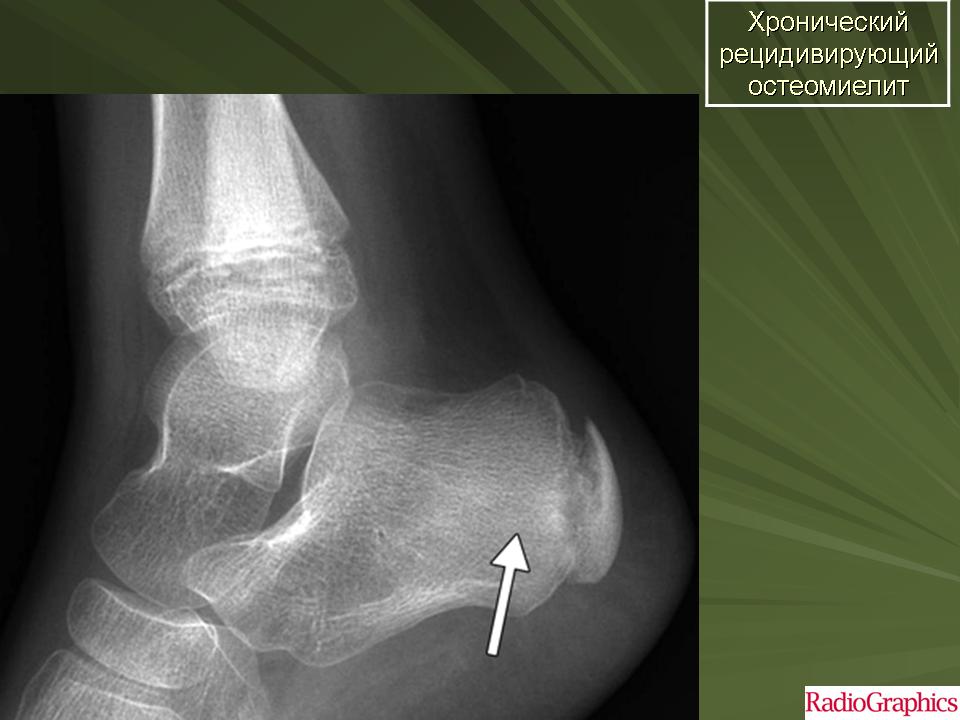 Также важно отметить, что, несмотря на все более широкое использование более чувствительных диагностических методов, которые в меньшей степени зависят от культуры бактерии-нарушителя, особенно ПЦР, этиология AHO у детей остается неизвестной в значительном количестве случаев [5].
Также важно отметить, что, несмотря на все более широкое использование более чувствительных диагностических методов, которые в меньшей степени зависят от культуры бактерии-нарушителя, особенно ПЦР, этиология AHO у детей остается неизвестной в значительном количестве случаев [5].
В качестве примера недавний отчет показал, что K. kingae было наиболее частой причиной костно-суставных инфекций у французских детей младше 3 лет [6]. Однако приблизительно 70% этих случаев ограничивались септическим артритом, и только приблизительно 18% демонстрировали клинические признаки остеомиелита [6].Это согласуется с обзором педиатрических случаев в Северной Америке, который показал, что, помимо грамположительных кокков, K. kingae были основной причиной костно-суставных инфекций у детей младше 5 лет [4]. Это также согласуется с нашим опытом в Детской больнице Арканзаса (Арканзас, США), где мы обнаружили, что K. kingae является наиболее частой причиной септического артрита у детей в возрасте до 2 лет [Juretschko S, Arkansas Children’s Hospital, Чел.Comm.]. K. kingae — это привередливый организм, который трудно культивировать, и его очевидное увеличение распространенности в качестве возбудителя костно-суставных инфекций вряд ли связано с изменением общей эпидемиологии заболевания, а скорее с увеличением использования большего количества других веществ. чувствительные диагностические методы, такие как ПЦР, для прямой идентификации патогенов, присутствующих в суставной жидкости и образцах костей. Такие исследования подчеркивают необходимость в альтернативных диагностических методах, которые можно использовать для проведения окончательной антимикробной терапии.Однако они не меняют вывода о том, что грамположительные кокки в целом и Staphylococcus aureus в частности, на сегодняшний день являются единственной наиболее распространенной причиной всех типов костно-суставных инфекций у детей всех возрастных групп [2,4].
Как и в случае всех форм инфекции S. aureus , продолжающееся появление метициллин-устойчивых штаммов вызывает все большую озабоченность. Обзор данных из 33 различных детских больниц, представляющих 17 из 20 крупных мегаполисов США, показал, что распространенность остеомиелита, вызванного метициллин-резистентным S.aureus (MRSA) увеличилась с 0,3 до 1,4 на 1000 госпитализаций в период с 2002 по 2007 год, в то время как частота метициллин-чувствительного остеомиелита S. aureus (MSSA) оставалась стабильной [7]. В целом 51% пациентов, поступивших с инфекцией S. aureus , были инфицированы MRSA [7]. Это согласуется с нашим опытом в Детской больнице Арканзаса, где мы обнаружили, что приблизительно 65% наших стационарных случаев инфицирования S. aureus вызваны MRSA [Juretschko S, Arkansas Children’s Hospital, Pers.Comm.]. Важно отметить, что в исследовании всех детей, госпитализированных в Детский медицинский центр Далласа (Техас, США) с острым остеомиелитом в период с 1999 по 2003 год, частота осложнений вторичной инфекции MRSA была значительно выше, чем у пациентов, инфицированных MSSA, и у пациентов, страдающих от острого остеомиелита, вызванного возбудителями, отличными от S. aureus [8]. Осложнения включали миозит, абсцесс кости, патологический перелом, тромбоз глубоких вен и диссеминированное заболевание [8].Следует отметить, что в этом исследовании дети, которые получали соответствующую терапию MRSA в течение 2 дней, имели такую же частоту осложнений, как и дети, у которых была задержка на 2 дня или более в начале соответствующей антибактериальной терапии для острого остеомиелита MRSA [8]. Это означает, что использования только соответствующих противомикробных препаратов может быть недостаточно для лечения остеомиелита, связанного с MRSA. Это особенно верно в отношении инфекций, вызванных CA-MRSA, поскольку у этих пациентов часто наблюдаются более серьезные клинические проявления, которые включают усиленный воспалительный ответ, мультифокальное заболевание и более частые костные абсцессы, требующие хирургического дренирования [8,9,10].
aureus , продолжающееся появление метициллин-устойчивых штаммов вызывает все большую озабоченность. Обзор данных из 33 различных детских больниц, представляющих 17 из 20 крупных мегаполисов США, показал, что распространенность остеомиелита, вызванного метициллин-резистентным S.aureus (MRSA) увеличилась с 0,3 до 1,4 на 1000 госпитализаций в период с 2002 по 2007 год, в то время как частота метициллин-чувствительного остеомиелита S. aureus (MSSA) оставалась стабильной [7]. В целом 51% пациентов, поступивших с инфекцией S. aureus , были инфицированы MRSA [7]. Это согласуется с нашим опытом в Детской больнице Арканзаса, где мы обнаружили, что приблизительно 65% наших стационарных случаев инфицирования S. aureus вызваны MRSA [Juretschko S, Arkansas Children’s Hospital, Pers.Comm.]. Важно отметить, что в исследовании всех детей, госпитализированных в Детский медицинский центр Далласа (Техас, США) с острым остеомиелитом в период с 1999 по 2003 год, частота осложнений вторичной инфекции MRSA была значительно выше, чем у пациентов, инфицированных MSSA, и у пациентов, страдающих от острого остеомиелита, вызванного возбудителями, отличными от S. aureus [8]. Осложнения включали миозит, абсцесс кости, патологический перелом, тромбоз глубоких вен и диссеминированное заболевание [8].Следует отметить, что в этом исследовании дети, которые получали соответствующую терапию MRSA в течение 2 дней, имели такую же частоту осложнений, как и дети, у которых была задержка на 2 дня или более в начале соответствующей антибактериальной терапии для острого остеомиелита MRSA [8]. Это означает, что использования только соответствующих противомикробных препаратов может быть недостаточно для лечения остеомиелита, связанного с MRSA. Это особенно верно в отношении инфекций, вызванных CA-MRSA, поскольку у этих пациентов часто наблюдаются более серьезные клинические проявления, которые включают усиленный воспалительный ответ, мультифокальное заболевание и более частые костные абсцессы, требующие хирургического дренирования [8,9,10]. В этом отношении важно отметить, что временные рамки исследования в Далласе [8] соответствуют времени, когда возникновение инфекций CA-MRSA началось, но еще не достигло (или, возможно, даже сейчас) своего зенита.
В этом отношении важно отметить, что временные рамки исследования в Далласе [8] соответствуют времени, когда возникновение инфекций CA-MRSA началось, но еще не достигло (или, возможно, даже сейчас) своего зенита.
Клинические проявления и диагностика острого гематогенного остеомиелита
Большинство детей и подростков с AHO имеют в анамнезе боли в костях в течение нескольких дней [2,4]. Отличительной чертой боли AHO является ее постоянный характер с постепенным увеличением уровня боли [2,4].У маленьких детей часто бывает трудно определить локализацию боли, в то время как у детей старшего возраста она обычно более локализована [2,4]. Боль обычно приводит к ограничению использования пораженной конечности [2,4]. Поскольку чаще всего поражаются длинные кости нижних конечностей, дети часто хромают [2,11]. Во всех случаях локальная боль в костях и лихорадка должны вызывать клиническое подозрение на AHO. Повышенная неподвижность сустава и отсутствие точечной болезненности над метафизом указывают на септический артрит, а не на остеомиелит (или в дополнение к нему).Классические признаки воспаления (покраснение, тепло и припухлость) не появляются, если инфекция не продвинулась через метафизарный кору в поднадкостничное пространство [2]. Такое прогрессирование чаще встречается у младенцев и детей раннего возраста, у которых кора костей более тонкая.
Повышенная скорость оседания эритроцитов (СОЭ), повышенный уровень С-реактивного белка (СРБ) и лейкоцитоз часто наблюдаются при AHO, причем повышенный уровень СРБ является наиболее чувствительным лабораторным параметром [12]. Однако это также зависит от агента-нарушителя.Например, недавнее исследование показало, что заметно повышенный уровень CRP (> 4 мг / дл) наблюдался у 86% детей с AHO, вызванным MRSA, но только у 58% детей с острым MSSA-остеомиелитом [8].
Поскольку физикальное обследование и лабораторные тесты предполагают, а не окончательные, для облегчения диагностики остеомиелита использовались различные методы визуализации.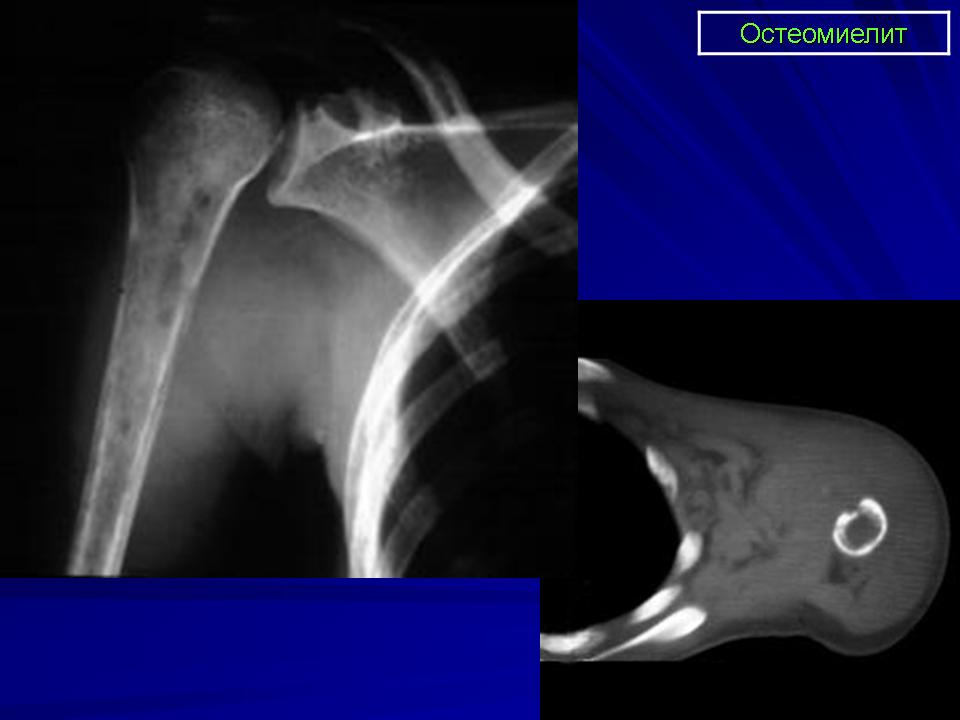 К ним относятся простые рентгенограммы, сцинтиграфия скелета, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ).
К ним относятся простые рентгенограммы, сцинтиграфия скелета, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ).
Обычные рентгенограммы необходимы для исключения других диагнозов, таких как перелом. Хотя глубокий отек мягких тканей можно увидеть рентгенологически в течение первых нескольких дней от начала, остеопения или остеолитические поражения в результате разрушения кости обычно не видны до 2–3 недель после появления симптомов [13]. По этой причине диагностическая ценность простых рентгенограмм для диагностики остеомиелита ограничена пациентами с длительными симптомами, и, как отмечалось ранее, это обычно не относится к детям.В результате для диагностики детской ОГО чаще используются другие методы визуализации [13]. Сцинтиграфия скелета с использованием дифосфоната технеция-99m позволяет проводить обследование всего тела, что полезно для пациентов с плохо локализованными симптомами или если вызывает беспокойство мультифокальный остеомиелит, и это имеет чувствительность более 90% [14]. Однако это требует воздействия ионизирующего излучения, а чувствительность новорожденных ниже, что делает сцинтиграфию скелета менее полезной в этой возрастной группе.Также может быть сложно дифференцировать остеомиелит от инфаркта, связанного с серповидно-клеточной анемией, и других заболеваний, не связанных с инфекцией, включая новообразования и переломы [14]. Кроме того, сцинтиграфия скелета может иметь ограниченное применение при диагностике внебольничного остеомиелита S. aureus . Недавнее исследование показало, что сцинтиграфия скелета диагностирует остеомиелит только у 53% детей с внебольничным остеомиелитом S. aureus [15].
Одним из преимуществ компьютерной томографии является то, что она предоставляет конкретную анатомическую информацию о статусе инфекции [13].КТ может обнаруживать секвестры (свидетельствующие о хроническом остеомиелите) и внутрикостные газы, а также определять поднадкостничные абсцессы, все из которых являются важными факторами при разработке общего терапевтического подхода [13].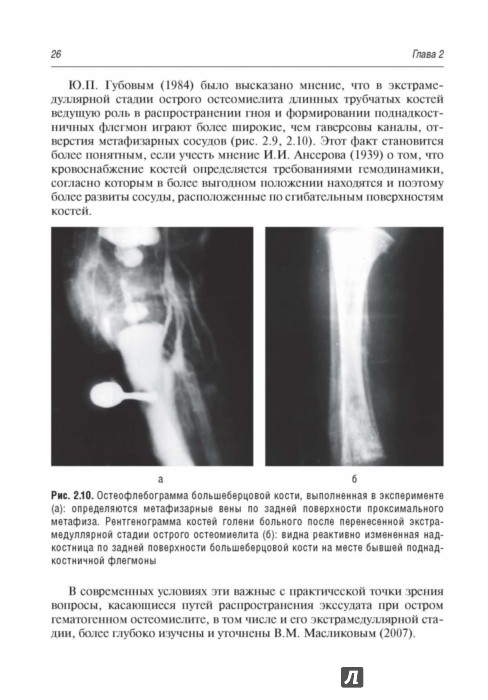 Однако КТ также требует воздействия радиации. Есть исследования, предполагающие, что позитронно-эмиссионная томография с фтордезоксиглюкозой (ФДГ-ПЭТ) может быть полезной альтернативой для диагностики у взрослых, особенно в сочетании с КТ [16,17]. Однако этот вопрос не был должным образом изучен в конкретном контексте педиатрического пациента.МРТ может использоваться для выявления внутрикостных, поднадкостничных и мягкотканных абсцессов, что позволяет раннее дренировать абсцесс без воздействия радиации [13,18]. Отеки и экссудаты в костномозговом пространстве являются частыми проявлениями острого остеомиелита и могут быть визуализированы с помощью МРТ [13,18]. Однако эти результаты также можно увидеть при других состояниях, таких как перелом и инфаркт [13,18]. Миозит также легко выявляется с помощью МРТ [18]. МРТ дает лучшую анатомическую информацию, предоставляя анатомический атлас для ортопедов, если будет показано хирургическое вмешательство.По этим причинам МРТ становится методом выбора для диагностики AHO у детей [2,13–15,18]. Чувствительность и специфичность МРТ для диагностики остеомиелита колеблются между 82–100% и 75–96% соответственно [13]. Стоимость, доступность и необходимость седации — важные ограничения для использования МРТ.
Однако КТ также требует воздействия радиации. Есть исследования, предполагающие, что позитронно-эмиссионная томография с фтордезоксиглюкозой (ФДГ-ПЭТ) может быть полезной альтернативой для диагностики у взрослых, особенно в сочетании с КТ [16,17]. Однако этот вопрос не был должным образом изучен в конкретном контексте педиатрического пациента.МРТ может использоваться для выявления внутрикостных, поднадкостничных и мягкотканных абсцессов, что позволяет раннее дренировать абсцесс без воздействия радиации [13,18]. Отеки и экссудаты в костномозговом пространстве являются частыми проявлениями острого остеомиелита и могут быть визуализированы с помощью МРТ [13,18]. Однако эти результаты также можно увидеть при других состояниях, таких как перелом и инфаркт [13,18]. Миозит также легко выявляется с помощью МРТ [18]. МРТ дает лучшую анатомическую информацию, предоставляя анатомический атлас для ортопедов, если будет показано хирургическое вмешательство.По этим причинам МРТ становится методом выбора для диагностики AHO у детей [2,13–15,18]. Чувствительность и специфичность МРТ для диагностики остеомиелита колеблются между 82–100% и 75–96% соответственно [13]. Стоимость, доступность и необходимость седации — важные ограничения для использования МРТ.
Хотя представление пациента, лабораторные исследования и диагностическая визуализация важны, ни один из них не является окончательным в отношении диагноза AHO и, что более важно, ни один не дает информации о статусе устойчивости к антибиотикам организма-нарушителя.По этой причине изоляция возбудителя болезни остается золотым стандартом диагностики и в настоящее время является единственным способом установить окончательный микробиологический диагноз [1,2]. В значительном числе случаев невозможно установить окончательную бактериальную этиологию либо потому, что возбудители болезни трудно культивировать, либо потому, что эмпирическая антимикробная терапия не позволила провести микробиологический анализ [2,5]. Когда этиологический агент может быть идентифицирован, эмпирическую противомикробную терапию следует скорректировать на основе профиля специфической чувствительности бактериального штамма-нарушителя. Культивированные образцы должны включать образцы костей, которые имеют более высокую диагностическую ценность по сравнению с культурами крови [2]. Тем не менее, посев крови также должен быть получен, поскольку организм восстанавливается примерно в 50% всех инфекций AHO [2]. Аспирация пораженной кости иглой может выполняться с использованием относительно неинвазивных процедур у новорожденных и маленьких детей, в то время как детям старшего возраста и подросткам часто требуются более инвазивные хирургические методы, такие как сверление или разрезание кости.Прямой посев культурального материала в бутыль для культуры крови увеличивает вероятность выздоровления такого привередливого организма, как K. kingae . Использование ПЦР для выявления патогенов в образцах костей также становится все более распространенным. В Детскую больницу Арканзаса все образцы костей отправляются на ПЦР-анализ с акцентом на S. aureus, S. pneumoniae , а у детей до 8 лет — K. kingae . Также должны быть получены окраски и посевы грибков и микобактерий, особенно в случаях со специфическими факторами риска и в случаях AHO с отрицательными посевами, которые не поддаются эмпирической терапии.Также следует отправить образцы тканей на гистологическое исследование для подтверждения диагноза остеомиелита. Сбор посевов на ранних стадиях AHO полезен, потому что длительная эмпирическая антимикробная терапия снижает вероятность восстановления возбудителя. Действительно, у стабильного пациента, если имеется план быстрого получения культур тканей, мы считаем, что эмпирическую антибиотикотерапию следует отложить до получения культур тканей.
Культивированные образцы должны включать образцы костей, которые имеют более высокую диагностическую ценность по сравнению с культурами крови [2]. Тем не менее, посев крови также должен быть получен, поскольку организм восстанавливается примерно в 50% всех инфекций AHO [2]. Аспирация пораженной кости иглой может выполняться с использованием относительно неинвазивных процедур у новорожденных и маленьких детей, в то время как детям старшего возраста и подросткам часто требуются более инвазивные хирургические методы, такие как сверление или разрезание кости.Прямой посев культурального материала в бутыль для культуры крови увеличивает вероятность выздоровления такого привередливого организма, как K. kingae . Использование ПЦР для выявления патогенов в образцах костей также становится все более распространенным. В Детскую больницу Арканзаса все образцы костей отправляются на ПЦР-анализ с акцентом на S. aureus, S. pneumoniae , а у детей до 8 лет — K. kingae . Также должны быть получены окраски и посевы грибков и микобактерий, особенно в случаях со специфическими факторами риска и в случаях AHO с отрицательными посевами, которые не поддаются эмпирической терапии.Также следует отправить образцы тканей на гистологическое исследование для подтверждения диагноза остеомиелита. Сбор посевов на ранних стадиях AHO полезен, потому что длительная эмпирическая антимикробная терапия снижает вероятность восстановления возбудителя. Действительно, у стабильного пациента, если имеется план быстрого получения культур тканей, мы считаем, что эмпирическую антибиотикотерапию следует отложить до получения культур тканей.
Лечение острого гематогенного остеомиелита
Лечение AHO требует соответствующей антимикробной терапии во всех случаях и может потребовать хирургического разреза и дренирования.По причинам, обсуждавшимся ранее, соответствующий дренаж стал особенно важным в последние годы из-за продолжающегося появления CA-MRSA. Разрез и дренирование следует выполнять при наличии абсцесса (внутрикостного, поднадкостничного и / или мягкотканного) [2]. Следует провести хирургическое удаление омертвевшей кости и очистку пораженных мягких тканей [1,2]. Наш опыт показывает, что у детей и подростков с остеомиелитом, вызванным CA-MRSA, часто необходимы множественные разрезы и дренажные процедуры, даже при соответствующей антибактериальной терапии.Хирургический дренаж также следует рассмотреть, если ребенок не реагирует на эмпирическую антибактериальную терапию. В этом случае хирургическое вмешательство может улучшить лечение. Кроме того, хирургическое вмешательство позволяет собрать ткань, которую можно микробиологически оценить на предмет необычной этиологии остеомиелита и гистологически исследовать для подтверждения диагноза.
Следует провести хирургическое удаление омертвевшей кости и очистку пораженных мягких тканей [1,2]. Наш опыт показывает, что у детей и подростков с остеомиелитом, вызванным CA-MRSA, часто необходимы множественные разрезы и дренажные процедуры, даже при соответствующей антибактериальной терапии.Хирургический дренаж также следует рассмотреть, если ребенок не реагирует на эмпирическую антибактериальную терапию. В этом случае хирургическое вмешательство может улучшить лечение. Кроме того, хирургическое вмешательство позволяет собрать ткань, которую можно микробиологически оценить на предмет необычной этиологии остеомиелита и гистологически исследовать для подтверждения диагноза.
Независимо от того, требуется ли хирургическое вмешательство, для успешного лечения всех форм остеомиелита необходима соответствующая антибактериальная терапия [1,2,4].Антибиотики, которые доказали свою эффективность против инфекций костей и суставов S. aureus , включают нафциллин, клиндамицин, цефалоспорины первого поколения и ванкомицин [1,2]. Если MRSA не вызывает беспокойства (сообщества с ≤10% CA-MRSA, определенным местной антибиотикограммой), то, по нашему мнению, эмпирическая терапия для детей (детей в возрасте 3 месяцев и старше) должна представлять собой антистафилококковый пенициллин (нафциллин). и оксациллин) или цефалоспорин первого поколения (цефазолин). Эти агенты эффективны не только против MSSA, но и против других причин AHO, включая S.pyogenes и K. kingae . К сожалению, стойкое появление MRSA среди изолятов, ассоциированных с сообществом, ограничивает возможности лечения, поскольку все β-лактамные антибиотики исключены из рассмотрения.
В общинах с 10% или более CA-MRSA, ванкомицин или клиндамицин (если местные показатели устойчивости к клиндамицину ≤25%), по нашему мнению, должны использоваться для эмпирического лечения детей. Однако следует отметить, что ни ванкомицин, ни клиндамицин не проявляют активности в отношении К.kingae . Если клиндамицин рассматривается для лечения, фенотип устойчивости к индуцибельным макролидам, линкозамиду и стрептограмину B (MLS B ) должен быть исключен с помощью D-теста (тест индукции эритромицина, который показывает притупление зоны ингибирования клиндамицина на стороне соседний эритромициновый диск при наличии фенотипа устойчивости к MLS B ), поскольку этот фенотип был связан с неудачей лечения [19,20]. По нашему мнению, ванкомицин является основным препаратом выбора для терапии при резистентности, индуцируемой клиндамицином, и в сообществах с уровнем резистентности к клиндамицину более 25%.Если K. kingae вызывает особую озабоченность в области со значительным MRSA, следует рассмотреть возможность терапии цефазолином в дополнение к соответствующей эмпирической терапии MRSA. Следует также еще раз подчеркнуть, что если посевы дают окончательный диагноз, лечение антимикробными препаратами должно быть немедленно скорректировано в зависимости от профиля восприимчивости организма-нарушителя. представляет собой алгоритм предлагаемой начальной антибактериальной терапии AHO у детей от 3 месяцев и старше.
Если клиндамицин рассматривается для лечения, фенотип устойчивости к индуцибельным макролидам, линкозамиду и стрептограмину B (MLS B ) должен быть исключен с помощью D-теста (тест индукции эритромицина, который показывает притупление зоны ингибирования клиндамицина на стороне соседний эритромициновый диск при наличии фенотипа устойчивости к MLS B ), поскольку этот фенотип был связан с неудачей лечения [19,20]. По нашему мнению, ванкомицин является основным препаратом выбора для терапии при резистентности, индуцируемой клиндамицином, и в сообществах с уровнем резистентности к клиндамицину более 25%.Если K. kingae вызывает особую озабоченность в области со значительным MRSA, следует рассмотреть возможность терапии цефазолином в дополнение к соответствующей эмпирической терапии MRSA. Следует также еще раз подчеркнуть, что если посевы дают окончательный диагноз, лечение антимикробными препаратами должно быть немедленно скорректировано в зависимости от профиля восприимчивости организма-нарушителя. представляет собой алгоритм предлагаемой начальной антибактериальной терапии AHO у детей от 3 месяцев и старше.
Если посевы выявляют микроорганизмы, антимикробную терапию следует немедленно скорректировать (при необходимости).
* Если Kingella kingae вызывает особую озабоченность, добавьте терапию цефазолином.
‡ Если клиндамицин рассматривается для лечения, фенотип устойчивости к индуцибельным макролидам, линкозамиду и стрептограмину B должен быть исключен с помощью D-теста, поскольку этот фенотип связан с неэффективностью лечения.
AHO: Острый гематогенный остеомиелит; CA-MRSA: внебольничный метициллин-устойчивый Staphylococcus aureus .
Триметоприм-сульфаметоксазол (TMP-SMX) успешно применялся для лечения инфекций кожи и мягких тканей (SSTI), вызванных CA-MRSA. Однако эффективность TMP – SMX в лечении остеомиелита MRSA у детей недостаточно изучена. Точно так же доксициклин может быть эффективным вариантом для лечения чувствительных к MRSA SSTI у детей старше 8 лет, но его использование для лечения MRSA-остеомиелита у детей остается неизученным.В последние годы стали доступны новые противомикробные препараты для лечения инфекций, вызванных MRSA. К ним относятся линезолид (оксазолидиноновый антибиотик) и даптомицин (липопептидный антибиотик). Пока что клинический опыт применения этих препаратов в конкретном контексте инфекции костей у детей ограничен, хотя в одном исследовании с участием 13 детей, получавших линезолид в качестве альтернативной терапии костно-суставных инфекций, у 11 из 13 детей были хорошие результаты [21]. ]. Средняя продолжительность терапии составляла 20 дней, и в ходе лечения у двоих детей развилась анемия [21].Миелосупрессия — известный побочный эффект длительной терапии линезолидом, так же как и оптические и периферические нейропатии. По этой причине не рекомендуется курс лечения более 21 дня. Это ограничивает использование линезолида при лечении AHO у детей, что требует длительной антимикробной терапии. Педиатрические исследования эффективности даптомицина отсутствуют. Использование даптомицина для лечения AHO у детей ограничено, поскольку MRSA AHO, осложненный пневмонией, представляет собой растущую проблему, а даптомицин инактивируется сурфактантами легких и не может использоваться для лечения таких сложных инфекций.Также известно, что даптомицин вызывает повышение уровня креатининфосфокиназы. При использовании даптомицина следует внимательно следить за уровнем креатининфосфокиназы, поскольку может возникнуть опасный рабдомиолиз. Недавние исследования показали, что даптомицин особенно эффективен в специфическом контексте биопленки [22] и при лечении связанных с биопленками инфекций, в том числе вызванных MRSA [23-25]. Это может быть особенно важно, особенно в контексте хронического остеомиелита.
Однако эффективность TMP – SMX в лечении остеомиелита MRSA у детей недостаточно изучена. Точно так же доксициклин может быть эффективным вариантом для лечения чувствительных к MRSA SSTI у детей старше 8 лет, но его использование для лечения MRSA-остеомиелита у детей остается неизученным.В последние годы стали доступны новые противомикробные препараты для лечения инфекций, вызванных MRSA. К ним относятся линезолид (оксазолидиноновый антибиотик) и даптомицин (липопептидный антибиотик). Пока что клинический опыт применения этих препаратов в конкретном контексте инфекции костей у детей ограничен, хотя в одном исследовании с участием 13 детей, получавших линезолид в качестве альтернативной терапии костно-суставных инфекций, у 11 из 13 детей были хорошие результаты [21]. ]. Средняя продолжительность терапии составляла 20 дней, и в ходе лечения у двоих детей развилась анемия [21].Миелосупрессия — известный побочный эффект длительной терапии линезолидом, так же как и оптические и периферические нейропатии. По этой причине не рекомендуется курс лечения более 21 дня. Это ограничивает использование линезолида при лечении AHO у детей, что требует длительной антимикробной терапии. Педиатрические исследования эффективности даптомицина отсутствуют. Использование даптомицина для лечения AHO у детей ограничено, поскольку MRSA AHO, осложненный пневмонией, представляет собой растущую проблему, а даптомицин инактивируется сурфактантами легких и не может использоваться для лечения таких сложных инфекций.Также известно, что даптомицин вызывает повышение уровня креатининфосфокиназы. При использовании даптомицина следует внимательно следить за уровнем креатининфосфокиназы, поскольку может возникнуть опасный рабдомиолиз. Недавние исследования показали, что даптомицин особенно эффективен в специфическом контексте биопленки [22] и при лечении связанных с биопленками инфекций, в том числе вызванных MRSA [23-25]. Это может быть особенно важно, особенно в контексте хронического остеомиелита.
Продолжительность стандартной терапии AHO составляет от 4 до 6 недель. Доказательные данные о способе и продолжительности введения антибиотиков для лечения AHO ограничены, а критерии, устанавливающие, когда следует переходить от парентерального к пероральному лечению, не определены [26]. Продолжительное лечение антибиотиками может потребоваться при отсроченной или неполной хирургической эвакуации или при наличии отдаленных очагов инфекции (например, эндокардита). Интервенционная радиологическая установка постоянных венозных катетеров в периферическую вену легко доступна, но затраты на установку катетера, внутривенное введение антибиотиков в домашних условиях и уход на дому значительно выше, чем затраты, необходимые для пероральной терапии.Кроме того, важны осложнения, связанные с размещением центрального венозного катетера, такие как бактериемия, возникающая из-за постоянного устройства и неисправности линии. В обзоре, сравнивающем результаты короткого (<7 дней) и длительного (> 7 дней) курса внутривенного лечения AHO, вызванного главным образом MSSA, у детей от 3 месяцев до 16 лет, 12 проспективных исследований показали общий уровень излечения. 95,2% (95% ДИ: 90,4–97,7) для короткого курса по сравнению с 98,8% (95% ДИ: 93.6–99,8) для более длительного курса в 6 месяцев [26], что является незначительной разницей в свете возможных осложнений и затрат, указанных выше. Кроме того, не было значительной разницы в терапевтических результатах, основанных на продолжительности пероральной терапии, между двумя группами [26].
Доказательные данные о способе и продолжительности введения антибиотиков для лечения AHO ограничены, а критерии, устанавливающие, когда следует переходить от парентерального к пероральному лечению, не определены [26]. Продолжительное лечение антибиотиками может потребоваться при отсроченной или неполной хирургической эвакуации или при наличии отдаленных очагов инфекции (например, эндокардита). Интервенционная радиологическая установка постоянных венозных катетеров в периферическую вену легко доступна, но затраты на установку катетера, внутривенное введение антибиотиков в домашних условиях и уход на дому значительно выше, чем затраты, необходимые для пероральной терапии.Кроме того, важны осложнения, связанные с размещением центрального венозного катетера, такие как бактериемия, возникающая из-за постоянного устройства и неисправности линии. В обзоре, сравнивающем результаты короткого (<7 дней) и длительного (> 7 дней) курса внутривенного лечения AHO, вызванного главным образом MSSA, у детей от 3 месяцев до 16 лет, 12 проспективных исследований показали общий уровень излечения. 95,2% (95% ДИ: 90,4–97,7) для короткого курса по сравнению с 98,8% (95% ДИ: 93.6–99,8) для более длительного курса в 6 месяцев [26], что является незначительной разницей в свете возможных осложнений и затрат, указанных выше. Кроме того, не было значительной разницы в терапевтических результатах, основанных на продолжительности пероральной терапии, между двумя группами [26].
Наш опыт показывает, что детей можно эффективно лечить с помощью последовательной парентеральной / пероральной терапии при соблюдении нескольких условий. Парентерально антибиотики следует назначать до тех пор, пока у ребенка не станет лихорадка и пока не будет продемонстрировано улучшение как при физикальном обследовании, так и при лабораторных анализах.Мы рекомендуем 7–14 дней парентеральной терапии для пациентов с бактериемией; Для детей без бактериемии приемлем более короткий курс внутривенной терапии. В начале лечения следует еженедельно контролировать уровень СРБ и СОЭ, чтобы оценить реакцию на терапию. CRP обычно возвращается к исходному уровню в течение недели после эффективной терапии и используется многими как маркер перехода от парентеральной терапии к пероральной [2]. Еженедельно следует проводить полный анализ крови, чтобы оценить реакцию на терапию и контролировать нейтропению, потенциальное последствие антибактериальной терапии.Общая продолжительность терапии должна основываться на разрешении симптомов и нормализации СОЭ, что обычно занимает 4–6 недель. Должны присутствовать надежные опекуны и организовываться регулярное плановое амбулаторное наблюдение. Пероральный антибиотик должен демонстрировать отличное проникновение в кости, иметь такую же степень антибактериального покрытия, что и парентеральный препарат, и ребенок должен иметь возможность принимать пероральные препараты. Однако в связи с увеличением числа CA-MRSA, который также устойчив к клиндамицину, и отсутствием исследований, касающихся использования других пероральных антибиотиков у детей, соответствие этим критериям может вскоре оказаться затруднительным в США.
CRP обычно возвращается к исходному уровню в течение недели после эффективной терапии и используется многими как маркер перехода от парентеральной терапии к пероральной [2]. Еженедельно следует проводить полный анализ крови, чтобы оценить реакцию на терапию и контролировать нейтропению, потенциальное последствие антибактериальной терапии.Общая продолжительность терапии должна основываться на разрешении симптомов и нормализации СОЭ, что обычно занимает 4–6 недель. Должны присутствовать надежные опекуны и организовываться регулярное плановое амбулаторное наблюдение. Пероральный антибиотик должен демонстрировать отличное проникновение в кости, иметь такую же степень антибактериального покрытия, что и парентеральный препарат, и ребенок должен иметь возможность принимать пероральные препараты. Однако в связи с увеличением числа CA-MRSA, который также устойчив к клиндамицину, и отсутствием исследований, касающихся использования других пероральных антибиотиков у детей, соответствие этим критериям может вскоре оказаться затруднительным в США.
Комментарий экспертов и пятилетний обзор
До появления антибиотиков AHO было серьезным заболеванием с высокой заболеваемостью и смертностью [2]. Благодаря усовершенствованным методам диагностики и лечения смертность от этого заболевания в развитых странах в настоящее время незначительна [4]. Однако вариабельный клинический курс у детей с AHO затрудняет рекомендации по стандартизации терапии. Лечение всегда должно быть индивидуальным с использованием командного подхода, включающего участие педиатрических инфекционистов и ортопедов.
Эпидемиология AHO у детей также изменилась с появлением CA-MRSA в качестве основного патогена. Прошлые исследования клинического течения, диагностики и лечения AHO могут быть неприменимы к CA-MRSA, и по этой причине срочно необходимы дальнейшие исследования всех вопросов, обсуждаемых в этом обзоре. Крайне важно, чтобы эти исследования включали оценку новых противомикробных агентов, которые эффективны против штаммов стафилококков, устойчивых к современным β-лактамным, линкозамидным и гликопептидным антибиотикам. К ним относятся липогликопептиды (бактерицидные агенты с длительным периодом полураспада) телаванцин, оритаванцин и далбаванцин, все из которых являются производными существующих гликопептидных антибиотиков и некоторые из них эффективны против устойчивых к ванкомицину штаммов [27]. Другие антибиотики включают иклаприм, ингибитор дигидрофолатредуктазы, потенциально пригодный для перорального применения, и новые цефалоспорины цефтобипрол и цефтаролин [27]. Важно, чтобы эффективность всех этих новых антибиотиков оценивалась в конкретном контексте детей и в более конкретном контексте детского остеомиелита.
К ним относятся липогликопептиды (бактерицидные агенты с длительным периодом полураспада) телаванцин, оритаванцин и далбаванцин, все из которых являются производными существующих гликопептидных антибиотиков и некоторые из них эффективны против устойчивых к ванкомицину штаммов [27]. Другие антибиотики включают иклаприм, ингибитор дигидрофолатредуктазы, потенциально пригодный для перорального применения, и новые цефалоспорины цефтобипрол и цефтаролин [27]. Важно, чтобы эффективность всех этих новых антибиотиков оценивалась в конкретном контексте детей и в более конкретном контексте детского остеомиелита.
Независимо от наличия каких-либо новых противомикробных препаратов, главной терапевтической проблемой при всех формах остеомиелита является возможность как можно быстрее начать наиболее подходящую терапию. В этом отношении важны два соображения: первое — это сложность, связанная с своевременным подтверждением наличия инфекции, а второе — способность идентифицировать возбудителя болезни и оценить его профиль устойчивости к антибиотикам. Поскольку обычные методы физического и лабораторного анализа имеют ограниченную специфичность, решение первого из них потребует разработки конкретных методов визуализации, способных отличить инфекцию от других форм воспаления и, что не менее важно, определить стадию инфекции как необходимое предварительное условие для разработка эффективного подхода к лечению.Одной из возможностей в этом отношении является FDG-PET, хотя еще раз диагностическая ценность этого метода визуализации не была должным образом оценена, особенно в конкретном контексте детского остеомиелита. Своевременное выявление этиологических агентов AHO в образцах костей и крови, вероятно, будет улучшено за счет более широкого использования методов молекулярной диагностики, включая ПЦР.
Наконец, хотя AHO в настоящее время является наиболее распространенной формой остеомиелита у детей, ситуация может измениться в свете появления инфекций CA-MRSA.Штаммы CA-MRSA, особенно штаммы клональной линии USA300 [3], проявляют повышенную вирулентность, которая приводит к осложнениям как в контексте самого остеомиелита, так и возникновения диссеминированных инфекций у педиатрических пациентов. По этой причине кажется вероятным, что для эффективного лечения детского остеомиелита все чаще требуются терапевтические подходы, более часто связанные с хронической инфекцией, включая хирургическую обработку раны и локальную доставку антибиотиков. Локальная доставка антибиотиков дает несколько преимуществ, наиболее важным из которых является способность достигать высоких уровней антибиотиков в очаге инфекции без риска системной токсичности.Исходя из этого, мы считаем, что исследования должны быть сосредоточены на разработке и оценке как стабильных, так и биоабсорбируемых матриц для локальной доставки антибиотиков. Наиболее часто используемой матрицей доставки, особенно в тех случаях, когда обработка раны приводит к структурно-нестабильному дефекту, требующему последующей реконструкции, является полиметилметакрилат (ПММА). Гранулы из ПММА, пропитанные антибиотиками, коммерчески доступны в некоторых странах, в то время как в других хирурги должны производить свои собственные гранулы из ПММА.Альтернативный подход — имплантация биоабсорбируемой матрицы доставки, которая подходит пациентам, у которых хирургическая обработка раны не создает структурно нестабильного дефекта. Действительно, в таких случаях использование биорассасывающейся матрицы для доставки предпочтительнее ПММА, поскольку не требует удаления гранул по завершении терапии [28,29].
По этой причине кажется вероятным, что для эффективного лечения детского остеомиелита все чаще требуются терапевтические подходы, более часто связанные с хронической инфекцией, включая хирургическую обработку раны и локальную доставку антибиотиков. Локальная доставка антибиотиков дает несколько преимуществ, наиболее важным из которых является способность достигать высоких уровней антибиотиков в очаге инфекции без риска системной токсичности.Исходя из этого, мы считаем, что исследования должны быть сосредоточены на разработке и оценке как стабильных, так и биоабсорбируемых матриц для локальной доставки антибиотиков. Наиболее часто используемой матрицей доставки, особенно в тех случаях, когда обработка раны приводит к структурно-нестабильному дефекту, требующему последующей реконструкции, является полиметилметакрилат (ПММА). Гранулы из ПММА, пропитанные антибиотиками, коммерчески доступны в некоторых странах, в то время как в других хирурги должны производить свои собственные гранулы из ПММА.Альтернативный подход — имплантация биоабсорбируемой матрицы доставки, которая подходит пациентам, у которых хирургическая обработка раны не создает структурно нестабильного дефекта. Действительно, в таких случаях использование биорассасывающейся матрицы для доставки предпочтительнее ПММА, поскольку не требует удаления гранул по завершении терапии [28,29].
Независимо от матрицы доставки наиболее часто используемыми антибиотиками являются гентамицин, тобрамицин и ванкомицин, при этом имеется относительно мало экспериментальных данных в отношении других противомикробных агентов.Недавно было продемонстрировано, что даптомицин может быть включен как в ПММА, так и в другие матрицы доставки (например, сульфат кальция) без потери активности и что он сохраняет эту активность, поскольку он элюируется из гранул с течением времени [30–32]. Клинический опыт применения гранул, пропитанных антибиотиками, в контексте инфекции костей, особенно в отношении этих новых антибиотиков, ограничен у взрослых, но тем более у детей. Как отмечалось выше, важно, чтобы все формы терапии с использованием любого из доступных антибиотиков оценивались на основе как эффективности, так и фармакологических соображений в конкретном контексте детской инфекции.Исходя из этого, крайне важно, чтобы в будущих исследованиях было изучено использование как существующих, так и новых антибиотиков в конкретном контексте локальной доставки антибиотиков при лечении остеомиелита у детей.
Как отмечалось выше, важно, чтобы все формы терапии с использованием любого из доступных антибиотиков оценивались на основе как эффективности, так и фармакологических соображений в конкретном контексте детской инфекции.Исходя из этого, крайне важно, чтобы в будущих исследованиях было изучено использование как существующих, так и новых антибиотиков в конкретном контексте локальной доставки антибиотиков при лечении остеомиелита у детей.
Ключевые проблемы
У детей остеомиелит в основном гематогенный и острый.
Золотистый стафилококк является преобладающим возбудителем остеомиелита.
Метициллин-устойчивый S.aureus (MRSA) увеличилась во всем мире, что изменило эпидемиологию остеомиелита.
Инфекции, вызванные внебольничным MRSA (CA-MRSA), имеют более серьезные проявления, чем метициллин-чувствительный S. aureus острый гематогенный остеомиелит.
МРТ — предпочтительный метод визуализации при остром гематогенном остеомиелите у детей, но с учетом текущих ограничений всех методов визуализации разработка и оптимизация альтернативных методов визуализации является важной клинической целью.
Если выявлен этиологический агент остеомиелита, необходимо назначить специфическое противомикробное лечение, основанное на профиле восприимчивости организма. Чтобы облегчить это, по возможности должны быть получены соответствующие культуры, включая биопсию кости, и альтернативные методы диагностики, способные обнаруживать патогены независимо от их характеристик роста (например, ПЦР).
В сообществах с более чем 10% CA-MRSA ванкомицин или клиндамицин следует использовать для эмпирического лечения острого гематогенного остеомиелита.Ванкомицин является основным препаратом выбора для терапии CA-MRSA в сообществах с уровнем резистентности к клиндамицину более 25% и в условиях резистентности, индуцируемой клиндамицином.
Стандартная антимикробная терапия острого гематогенного остеомиелита длится от 4 до 6 недель.
 Доказательные исследования относительно пути и продолжительности лечения антибиотиками острого гематогенного остеомиелита ограничены, а руководящие принципы, когда следует перейти с парентеральной терапии на пероральную, отсутствуют.
Доказательные исследования относительно пути и продолжительности лечения антибиотиками острого гематогенного остеомиелита ограничены, а руководящие принципы, когда следует перейти с парентеральной терапии на пероральную, отсутствуют.Различное клиническое течение у детей с острым гематогенным остеомиелитом затрудняет рекомендации по стандартизированной терапии. Лечение всегда должно быть индивидуальным с использованием командного подхода, включающего участие специалистов как в области детских инфекционных заболеваний, так и в области ортопедии.
Сноски
Раскрытие информации о финансовых и конкурирующих интересах
Авторы получают финансирование от NIH (RO1 — {«type»: «entrez-nucleotide», «attrs»: {«text»: «AI043356», «term_id»: «3286613», «term_text»: «AI043356»}} AI043356, RO1 — {«type»: «entrez-нуклеотид», «attrs»: {«text»: «AI069087», «term_id»: » 3392062 «,» term_text «:» AI069087 «}} AI069087 и RO1 — {» type «:» entrez-нуклеотид «,» attrs «: {» text «:» AI074007 «,» term_id «:» 3400651 «,» term_text «:» AI074007 «}} AI074007) и от Cubist Pharmaceuticals.Авторы не имеют других соответствующих аффилированных или финансовых отношений с какой-либо организацией или юридическим лицом, имеющим финансовый интерес или финансовый конфликт с предметом или материалами, обсуждаемыми в рукописи, кроме тех, которые раскрыты.
При создании этой рукописи не использовались письменные переводчики.
Информация для авторов
Нада С. Харик, Отделение педиатрии и Отделение микробиологии и иммунологии, Университет медицинских наук Арканзаса и Детская больница Арканзаса, Литл-Рок, AR 72205, США, тел.: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah.
Марк С. Смелцер, Отделение микробиологии и иммунологии и Отделение ортопедической хирургии, Медицинский университет Арканзаса, Литл-Рок, AR 72205, США.
Список литературы
2. Крогстад П. Остеомиелит. В: Фейгин Р. Д., Черри Д.Д., Деммлер-Харрисон Г.Д., Каплан С.Л., редакторы. Учебник детских инфекционных болезней. 6-е издание. Пенсильвания, США: Сондерс Эльзевьер; 2009. С. 725–742. [Google Scholar] 3. Ли М., Ан Дьеп Б., Вильяруз А.Е. и др.Эволюция вирулентности у устойчивых к метициллину эпидемических сообществ Staphylococcus aureus . Proc. Natl Acad. Sci. США. 2009. 106 (14): 5883–5888. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Гутьеррес К. Инфекции костей и суставов у детей. Педиатр. Clin. N. Am. 2005. 52 (3): 779–794. [PubMed] [Google Scholar] 5. Floyed RL, Стил RW. Остеомиелит без посева. Педиатр. Заразить. Дис. J. 2003. 22 (8): 731–736. [PubMed] [Google Scholar] 6. Чометон С., Бенито Ю., Чакер М. и др.Специфическая полимеразная цепная реакция в реальном времени определяет Kingella kingae как наиболее частую причину костно-суставных инфекций у детей раннего возраста. Педиатр. Заразить. Дис. J. 2007; 26 (5): 377–381. [PubMed] [Google Scholar] 7. Gerber JS, Coffin SE, Smathers SA, Zaoutis TE. Тенденции заболеваемости метициллин-устойчивой инфекцией Staphylococcus aureus в детских больницах США. Clin. Заразить. Дис. 2009. 49 (1): 65–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Сааведра-Лозано Дж., Мехиас А., Ахмад Н. и др.Изменение тенденций развития острого остеомиелита у детей: влияние метициллин-резистентных инфекций Staphylococcus aureus . J. Pediatr. Ортоп. 2008. 28 (5): 569–575. [PubMed] [Google Scholar] 9. Мартинес-Агилар Г.А., Авалос-Мишаан А., Халтен К. и др. Внебольничная, метициллин-резистентный и метициллин-чувствительных стафилококк скелетно-мышечные заболевания у детей. Педиатр. Заразить. Дис. J. 2004; 23 (8): 701–706. [PubMed] [Google Scholar] 10. Bocchini CE, Hulten KG, Mason EO Jr и др.Гены лейкоцидина Пантона-Валентайна связаны с усилением воспалительной реакции и локальным заболеванием при остром гематогенном остеомиелите Staphylococcus aureus у детей. Педиатрия. 2006. 117 (2): 433–440.
Д., Черри Д.Д., Деммлер-Харрисон Г.Д., Каплан С.Л., редакторы. Учебник детских инфекционных болезней. 6-е издание. Пенсильвания, США: Сондерс Эльзевьер; 2009. С. 725–742. [Google Scholar] 3. Ли М., Ан Дьеп Б., Вильяруз А.Е. и др.Эволюция вирулентности у устойчивых к метициллину эпидемических сообществ Staphylococcus aureus . Proc. Natl Acad. Sci. США. 2009. 106 (14): 5883–5888. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Гутьеррес К. Инфекции костей и суставов у детей. Педиатр. Clin. N. Am. 2005. 52 (3): 779–794. [PubMed] [Google Scholar] 5. Floyed RL, Стил RW. Остеомиелит без посева. Педиатр. Заразить. Дис. J. 2003. 22 (8): 731–736. [PubMed] [Google Scholar] 6. Чометон С., Бенито Ю., Чакер М. и др.Специфическая полимеразная цепная реакция в реальном времени определяет Kingella kingae как наиболее частую причину костно-суставных инфекций у детей раннего возраста. Педиатр. Заразить. Дис. J. 2007; 26 (5): 377–381. [PubMed] [Google Scholar] 7. Gerber JS, Coffin SE, Smathers SA, Zaoutis TE. Тенденции заболеваемости метициллин-устойчивой инфекцией Staphylococcus aureus в детских больницах США. Clin. Заразить. Дис. 2009. 49 (1): 65–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Сааведра-Лозано Дж., Мехиас А., Ахмад Н. и др.Изменение тенденций развития острого остеомиелита у детей: влияние метициллин-резистентных инфекций Staphylococcus aureus . J. Pediatr. Ортоп. 2008. 28 (5): 569–575. [PubMed] [Google Scholar] 9. Мартинес-Агилар Г.А., Авалос-Мишаан А., Халтен К. и др. Внебольничная, метициллин-резистентный и метициллин-чувствительных стафилококк скелетно-мышечные заболевания у детей. Педиатр. Заразить. Дис. J. 2004; 23 (8): 701–706. [PubMed] [Google Scholar] 10. Bocchini CE, Hulten KG, Mason EO Jr и др.Гены лейкоцидина Пантона-Валентайна связаны с усилением воспалительной реакции и локальным заболеванием при остром гематогенном остеомиелите Staphylococcus aureus у детей. Педиатрия. 2006. 117 (2): 433–440. [PubMed] [Google Scholar] 11. Сойер Дж. Р., Капур М. Хромый ребенок: системный подход к диагностике. Являюсь. Fam. Врач. 2009. 79 (3): 215–224. [PubMed] [Google Scholar] 12. Unkila-Kallio L, Kallio MJ, Peltola H, Eskola J. Сывороточный С-реактивный белок, скорость оседания эритроцитов и количество лейкоцитов при остром гематогенном остеомиелите у детей.Педиатрия. 1994. 93 (1): 59–62. [PubMed] [Google Scholar] 13. Пинеда С., Варгас А., Родригес А.В. Визуализация остеомиелита: современные концепции. Заразить. Дис. Clin. N. Am. 2006. 20 (4): 789–825. [PubMed] [Google Scholar] 14. Коннолли LP, Коннолли С.А., Друбах Л.А., Джарамилло Д., Тревес ST. Острый гематогенный остеомиелит у детей: оценка диагностики на основе скелетной сцинтиграфии в эпоху МРТ. J. Nucl. Med. 2002. 43 (10): 1310–1316. [PubMed] [Google Scholar] 15. Браун Л.П., Мейсон Е.О., Каплан С.Л., Кэссиди С.И., Кришнамурти Р., Гиллерман Р.П.Оптимальная стратегия визуализации для внебольничных стафилококка костно-мышечных инфекций у детей. Педиатр. Радиол. 2008. 38 (8): 841–847. [PubMed] [Google Scholar] 16. Basu S, Chryssikos T, Moghadem-Kia S, Zhuang H, Torigian DA, Alavi A. Позитронно-эмиссонная томография как диагностический инструмент при инфекции: настоящая роль и будущие возможности. Семин. Nucl. Med. 2009. 39 (1): 36–51. [PubMed] [Google Scholar] 17. Strobel K, Stumpe KD. ПЭТ / КТ в костно-мышечной инфекции. Семин. Musculoskelet.Радиол. 2007. 11 (4): 353–364. [PubMed] [Google Scholar] 18. Чанг Т. Магнитно-резонансная томография при остром остеомиелите у детей. Педиатр. Заразить. Дис. J. 2002; 21 (9): 869–870. [PubMed] [Google Scholar] 19. Франк А.Л., Марчинак Дж. Ф., Мангат Д. и др. Лечение клиндамицином метициллин-устойчивых Staphylococcus aureus инфекций у детей. Педиатр. Заразить. Дис. J. 2002; 21 (6): 530–534. [PubMed] [Google Scholar] 20. Сибри Г.К., Текле Т., Кэрролл К., Дик Дж. Неудача лечения клиндамицином метициллин-устойчивого Staphylococcus aureus , экспрессирующего индуцибельную устойчивость к клиндамицину in vitro .
[PubMed] [Google Scholar] 11. Сойер Дж. Р., Капур М. Хромый ребенок: системный подход к диагностике. Являюсь. Fam. Врач. 2009. 79 (3): 215–224. [PubMed] [Google Scholar] 12. Unkila-Kallio L, Kallio MJ, Peltola H, Eskola J. Сывороточный С-реактивный белок, скорость оседания эритроцитов и количество лейкоцитов при остром гематогенном остеомиелите у детей.Педиатрия. 1994. 93 (1): 59–62. [PubMed] [Google Scholar] 13. Пинеда С., Варгас А., Родригес А.В. Визуализация остеомиелита: современные концепции. Заразить. Дис. Clin. N. Am. 2006. 20 (4): 789–825. [PubMed] [Google Scholar] 14. Коннолли LP, Коннолли С.А., Друбах Л.А., Джарамилло Д., Тревес ST. Острый гематогенный остеомиелит у детей: оценка диагностики на основе скелетной сцинтиграфии в эпоху МРТ. J. Nucl. Med. 2002. 43 (10): 1310–1316. [PubMed] [Google Scholar] 15. Браун Л.П., Мейсон Е.О., Каплан С.Л., Кэссиди С.И., Кришнамурти Р., Гиллерман Р.П.Оптимальная стратегия визуализации для внебольничных стафилококка костно-мышечных инфекций у детей. Педиатр. Радиол. 2008. 38 (8): 841–847. [PubMed] [Google Scholar] 16. Basu S, Chryssikos T, Moghadem-Kia S, Zhuang H, Torigian DA, Alavi A. Позитронно-эмиссонная томография как диагностический инструмент при инфекции: настоящая роль и будущие возможности. Семин. Nucl. Med. 2009. 39 (1): 36–51. [PubMed] [Google Scholar] 17. Strobel K, Stumpe KD. ПЭТ / КТ в костно-мышечной инфекции. Семин. Musculoskelet.Радиол. 2007. 11 (4): 353–364. [PubMed] [Google Scholar] 18. Чанг Т. Магнитно-резонансная томография при остром остеомиелите у детей. Педиатр. Заразить. Дис. J. 2002; 21 (9): 869–870. [PubMed] [Google Scholar] 19. Франк А.Л., Марчинак Дж. Ф., Мангат Д. и др. Лечение клиндамицином метициллин-устойчивых Staphylococcus aureus инфекций у детей. Педиатр. Заразить. Дис. J. 2002; 21 (6): 530–534. [PubMed] [Google Scholar] 20. Сибри Г.К., Текле Т., Кэрролл К., Дик Дж. Неудача лечения клиндамицином метициллин-устойчивого Staphylococcus aureus , экспрессирующего индуцибельную устойчивость к клиндамицину in vitro .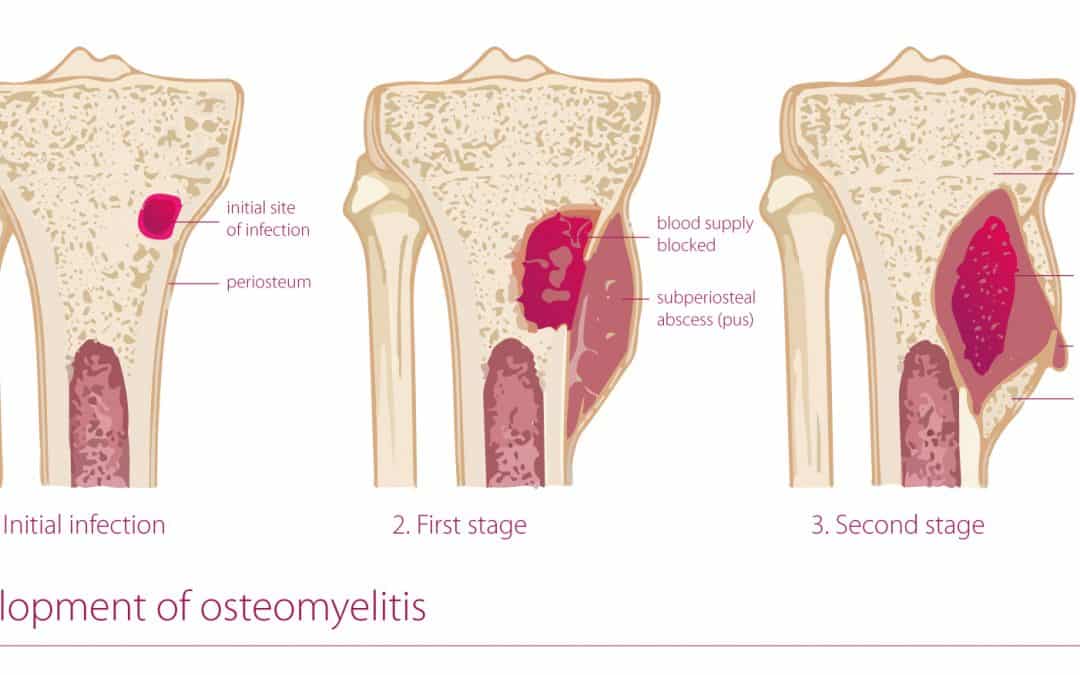 Clin. Заразить. Дис. 2003. 37 (9): 1257–1260. [PubMed] [Google Scholar] 21. Chen CJ, Chiu CH, Lin TY, Lee ZL, Yang WE, Huang YC. Опыт применения линезолида у детей с костно-суставными инфекциями. Педиатр. Заразить. Дис. J. 2008; 26 (11): 985–988. [PubMed] [Google Scholar] 22. Weiss EC, Spencer HJ, Daily SJ, Weiss BD, Smeltzer MS. Влияние sarA на чувствительность к антибиотикам Staphylococcus aureus в катетер-ассоциированной модели образования биопленок in vitro . Противомикробный.Агенты Chemother. 2009. 53 (6): 2475–2482. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Weiss ED, Zielinska A, Beenken KE, Spencer HJ, Daily SJ, Smeltzer MS. Влияние sarA на чувствительность к даптомицину Staphylococcus aureus биопленок in vivo . Противомикробный. Агенты Chemother. 2009. 53 (10): 4096–4102. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Miro JM, Garcia-de-la-Maria C, Armero Y, et al. Добавление гентамицина или рифампицина не увеличивает эффективность даптомицина при лечении экспериментального эндокардита, вызванного устойчивостью к метициллину Staphylococcus aureus .Противомикробный. Агенты Chemother. 2009. 53 (10): 4172–4177. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Мурильо О., Гарригос С., Пачон М.Э. и др. Эффективность высоких доз даптомицина по сравнению с альтернативными методами лечения экспериментальной инфекции инородного тела метициллин-резистентным Staphylococcus aureus . Противомикробный. Агенты Chemother. 2009. 53 (10): 4252–4257. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Le Saux N, Howard A, Barrowman NJ, Gaboury, Sampson M, Moher D. Более короткие курсы парентеральной антибактериальной терапии, по-видимому, не влияют на частоту ответа у детей с острым гематогенным остеомиелитом: систематический обзор.BMC Infect. Дис. 2002; 2: 16–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Стрыевский М.Э., Кори Г.Р. Новые методы лечения метициллин-резистентного Staphylococcus aureus .
Clin. Заразить. Дис. 2003. 37 (9): 1257–1260. [PubMed] [Google Scholar] 21. Chen CJ, Chiu CH, Lin TY, Lee ZL, Yang WE, Huang YC. Опыт применения линезолида у детей с костно-суставными инфекциями. Педиатр. Заразить. Дис. J. 2008; 26 (11): 985–988. [PubMed] [Google Scholar] 22. Weiss EC, Spencer HJ, Daily SJ, Weiss BD, Smeltzer MS. Влияние sarA на чувствительность к антибиотикам Staphylococcus aureus в катетер-ассоциированной модели образования биопленок in vitro . Противомикробный.Агенты Chemother. 2009. 53 (6): 2475–2482. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Weiss ED, Zielinska A, Beenken KE, Spencer HJ, Daily SJ, Smeltzer MS. Влияние sarA на чувствительность к даптомицину Staphylococcus aureus биопленок in vivo . Противомикробный. Агенты Chemother. 2009. 53 (10): 4096–4102. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Miro JM, Garcia-de-la-Maria C, Armero Y, et al. Добавление гентамицина или рифампицина не увеличивает эффективность даптомицина при лечении экспериментального эндокардита, вызванного устойчивостью к метициллину Staphylococcus aureus .Противомикробный. Агенты Chemother. 2009. 53 (10): 4172–4177. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Мурильо О., Гарригос С., Пачон М.Э. и др. Эффективность высоких доз даптомицина по сравнению с альтернативными методами лечения экспериментальной инфекции инородного тела метициллин-резистентным Staphylococcus aureus . Противомикробный. Агенты Chemother. 2009. 53 (10): 4252–4257. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Le Saux N, Howard A, Barrowman NJ, Gaboury, Sampson M, Moher D. Более короткие курсы парентеральной антибактериальной терапии, по-видимому, не влияют на частоту ответа у детей с острым гематогенным остеомиелитом: систематический обзор.BMC Infect. Дис. 2002; 2: 16–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Стрыевский М.Э., Кори Г.Р. Новые методы лечения метициллин-резистентного Staphylococcus aureus . Curr. Opin. Крит. Уход. 2009. 15 (5): 403–412. [PubMed] [Google Scholar] 28. Томас М.В., Пулео Д.А. Сульфат кальция: свойства и клиническое применение. J. Biomed. Матер. Res. Б. Прил. Биоматер. 2009. 88 (2): 597–610. [PubMed] [Google Scholar] 29. Залаврас К.Г., Пацакис М.Дж., Холтом П. Местная антибактериальная терапия при лечении открытых переломов и остеомиелита.Clin. Ортоп. Relat. Res. 2004; 427: 86–93. [PubMed] [Google Scholar] 30. Уэбб Н.Д., Макканлесс Д.Д., Кортни Х.С., Бумгарднер Д.Д., Хаггард В.О. Даптомицин, элюированный из сульфата кальция, оказывается эффективным против Staphylococcus . Clin. Ортоп. Relat. Res. 2008. 466 (6): 1383–1387. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Weiss BD, Weiss EC, Haggard WO, Evans RP, McLaren SG, Smeltzer MS. Оптимизированное элюирование даптомицина из гранул полиметилметакрилата. Противомикробный. Агенты Chemother. 2008. 53 (1): 264–266.[Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Канеллакопулу К., Панагопулос П., Джаннитсиоти Э. и др. In vitro элюция даптомицина синтетической кристаллической полугидратной формой сульфата кальция, стимуланом. Противомикробный. Агенты Chemother. 2009. 53 (7): 3106–3107. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Curr. Opin. Крит. Уход. 2009. 15 (5): 403–412. [PubMed] [Google Scholar] 28. Томас М.В., Пулео Д.А. Сульфат кальция: свойства и клиническое применение. J. Biomed. Матер. Res. Б. Прил. Биоматер. 2009. 88 (2): 597–610. [PubMed] [Google Scholar] 29. Залаврас К.Г., Пацакис М.Дж., Холтом П. Местная антибактериальная терапия при лечении открытых переломов и остеомиелита.Clin. Ортоп. Relat. Res. 2004; 427: 86–93. [PubMed] [Google Scholar] 30. Уэбб Н.Д., Макканлесс Д.Д., Кортни Х.С., Бумгарднер Д.Д., Хаггард В.О. Даптомицин, элюированный из сульфата кальция, оказывается эффективным против Staphylococcus . Clin. Ортоп. Relat. Res. 2008. 466 (6): 1383–1387. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Weiss BD, Weiss EC, Haggard WO, Evans RP, McLaren SG, Smeltzer MS. Оптимизированное элюирование даптомицина из гранул полиметилметакрилата. Противомикробный. Агенты Chemother. 2008. 53 (1): 264–266.[Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Канеллакопулу К., Панагопулос П., Джаннитсиоти Э. и др. In vitro элюция даптомицина синтетической кристаллической полугидратной формой сульфата кальция, стимуланом. Противомикробный. Агенты Chemother. 2009. 53 (7): 3106–3107. [Бесплатная статья PMC] [PubMed] [Google Scholar]Ведение острого гематогенного остеомиелита у детей
Expert Rev Anti Infect Ther. Авторская рукопись; доступно в PMC 2010 1 декабря 2010 г.
Опубликован в окончательной редакции как:
PMCID: PMC2836799
NIHMSID: NIHMS180283
Nada S Harik
Кафедра педиатрии и кафедра микробиологии и иммунологии Университета медицины Арканзас Science and the Arkansas Children’s Hospital, Little Rock, AR 72205, USA, тел.: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah
Марк С. Смелцер
Кафедра микробиологии и иммунологии и кафедра ортопедической хирургии, Университет медицинских наук Арканзаса, Литл-Рок, Арканзас 72205 , США
Нада С. Харик, Департамент педиатрии и Департамент микробиологии и иммунологии, Университет медицинских наук Арканзаса и Детская больница Арканзаса, Литл-Рок, AR 72205, США, тел . : +1 501 364 1416, факс: +1 501 364 3551, уд.smau @ adankirah; † Автор заочного отделения педиатрии и отделения микробиологии и иммунологии Медицинского университета Арканзаса и детской больницы Арканзаса, Литл-Рок, AR 72205, США, тел .: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah См. Другие статьи в PMC, в которых цитируется опубликованная статья.
: +1 501 364 1416, факс: +1 501 364 3551, уд.smau @ adankirah; † Автор заочного отделения педиатрии и отделения микробиологии и иммунологии Медицинского университета Арканзаса и детской больницы Арканзаса, Литл-Рок, AR 72205, США, тел .: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Остеомиелит у детей преимущественно гематогенного происхождения и острый по своей природе. Основной причиной остеомиелита у детей является золотистого стафилококка , а эпидемиология и патогенез S.aureus , включая остеомиелит, изменились за последние годы в связи с появлением устойчивых к метициллину S. aureus , ассоциированных с сообществами. В этом обзоре рассматриваются достижения в диагностике и общем лечении острого гематогенного остеомиелита у детей с учетом этих изменений.
Ключевые слова: острый гематогенный остеомиелит, AHO, антибактериальная терапия, CA-MRSA, дети, внебольничная метициллин-резистентная Staphylococcus aureus , диагностическая визуализация, остеомиелит, Staphylococcus aureus
строго определена как любая форма 9000 воспаления, затрагивающего кости и / или костный мозг, но почти всегда это результат инфекции.Это сложная инфекция, которая принимает различные формы, особенно с точки зрения наиболее подходящего терапевтического подхода к использованию, и по этой причине для описания остеомиелита использовалось несколько схем классификации. Один из них фокусируется на источнике инфекции и различает инфекции, возникающие в результате гематогенного посева из эндостального кровоснабжения, и инфекции, возникающие в результате вышележащей инфекции мягких тканей (остеомиелит, вторичный по отношению к смежному очагу инфекции) и / или сосудистой недостаточности. [1].Вторая схема, которая применяется независимо от основного источника бактерии-нарушителя, различает острую, подострую и хроническую инфекцию в зависимости от времени между появлением симптомов и диагнозом [1].Острый остеомиелит определяется как инфекция, диагностированная в течение 2 недель после появления симптомов [1,2]. Подострый остеомиелит диагностируется через 2 недели после появления симптомов, а хронический остеомиелит — через несколько месяцев после появления симптомов [2]. Хотя нам известно об отсутствии исследований, конкретно посвященных этой проблеме, мы считаем, что эти временные рамки должны зависеть, по крайней мере, до некоторой степени, от свойств вирулентности инфекционного штамма. Staphylococcus aureus является преобладающим патогеном, вызывающим остеомиелит у детей (см. Ниже), и возможно, что временные рамки инфекции могут измениться у детей, инфицированных метициллин-резистентным S. aureus (CA-MRSA). , многие штаммы которых являются гипервирулентными по причинам, которые еще предстоит полностью объяснить [3]. В таком случае возникнет острая необходимость в разработке диагностических методов, способных обнаруживать инфекцию на ранних стадиях.
Обе схемы классификации, процитированные ранее, имеют отношение к этому обсуждению, поскольку, в отличие от инфекции у взрослых, остеомиелит у детей обычно имеет гематогенное происхождение и чаще всего протекает остро [1,2,4]. Основным фактором, способствующим распространению гематогенного пути заражения, является характер эндостального кровоснабжения растущих костей детей [1,2,4].
Ни одно из этих различий не является абсолютным в том смысле, что остеомиелит у детей может быть вызван локальным распространением инфекции смежных мягких тканей или, что реже, прямой инокуляцией патогенного микроорганизма в кость.Хронические инфекции действительно возникают у детей, как правило, в результате неудачной антимикробной терапии или наличия ортопедического имплантата. Хроническая инфекция дополнительно определяется образованием секвестра мертвой кости, и для успешного лечения таких инфекций обычно требуется хирургическая обработка раны и длительное лечение антимикробными препаратами, последнее иногда принимает форму как системной, так и местной доставки антибиотиков [1]. Хотя в этом обзоре рассматриваются оба эти вопроса, учитывая его преобладание среди детей, основное внимание уделяется диагностике и лечению острого гематогенного остеомиелита (ОГД) у педиатрических пациентов.
Микробная этиология острого гематогенного остеомиелита
Острый гематогенный остеомиелит обычно возникает в метафизе длинных трубчатых костей, причем примерно две трети всех случаев затрагивают бедренную, большеберцовую или плечевую кости [1,2,4]. Хотя могут быть задействованы различные бактериальные патогены, наиболее распространенным патогеном является S. aureus , который вызывает 70–90% инфекций AHO у детей [2,4]. Другие этиологические агенты, в произвольном порядке, включают Streptococcus pyogenes , Streptococcus pneumoniae , стрептококки группы B (у младенцев), коагулазонегативные стафилококки (особенно при инфекциях, связанных с имплантатами), Kingella kingae , кишечные грамотрицательные бациллы (особенно Salmonella spp.у лиц с серповидно-клеточной анемией) и анаэробными бактериями. Haemophilus influenzae тип b (Hib) был частой причиной детского остеомиелита, но его распространенность снизилась за счет введения конъюгированной вакцины Hib [2,4]. Такие организмы, как Mycobacterium , Bartonella , грибы ( Histoplasma , Cryptococcus и Blastomyces ), Candida и Coxiella , обычно являются необычными причинами риска развития остеомиелита, обычно наблюдаемыми у пациентов с остеомиелитом. путешествовать или проживать в географических регионах, в которых патогенные микроорганизмы являются эндемичными и / или имеют иммунодепрессивный характер [4].Также важно отметить, что, несмотря на все более широкое использование более чувствительных диагностических методов, которые в меньшей степени зависят от культуры бактерии-нарушителя, особенно ПЦР, этиология AHO у детей остается неизвестной в значительном количестве случаев [5].
В качестве примера недавний отчет показал, что K. kingae было наиболее частой причиной костно-суставных инфекций у французских детей младше 3 лет [6]. Однако приблизительно 70% этих случаев ограничивались септическим артритом, и только приблизительно 18% демонстрировали клинические признаки остеомиелита [6].Это согласуется с обзором педиатрических случаев в Северной Америке, который показал, что, помимо грамположительных кокков, K. kingae были основной причиной костно-суставных инфекций у детей младше 5 лет [4]. Это также согласуется с нашим опытом в Детской больнице Арканзаса (Арканзас, США), где мы обнаружили, что K. kingae является наиболее частой причиной септического артрита у детей в возрасте до 2 лет [Juretschko S, Arkansas Children’s Hospital, Чел.Comm.]. K. kingae — это привередливый организм, который трудно культивировать, и его очевидное увеличение распространенности в качестве возбудителя костно-суставных инфекций вряд ли связано с изменением общей эпидемиологии заболевания, а скорее с увеличением использования большего количества других веществ. чувствительные диагностические методы, такие как ПЦР, для прямой идентификации патогенов, присутствующих в суставной жидкости и образцах костей. Такие исследования подчеркивают необходимость в альтернативных диагностических методах, которые можно использовать для проведения окончательной антимикробной терапии.Однако они не меняют вывода о том, что грамположительные кокки в целом и Staphylococcus aureus в частности, на сегодняшний день являются единственной наиболее распространенной причиной всех типов костно-суставных инфекций у детей всех возрастных групп [2,4].
Как и в случае всех форм инфекции S. aureus , продолжающееся появление метициллин-устойчивых штаммов вызывает все большую озабоченность. Обзор данных из 33 различных детских больниц, представляющих 17 из 20 крупных мегаполисов США, показал, что распространенность остеомиелита, вызванного метициллин-резистентным S.aureus (MRSA) увеличилась с 0,3 до 1,4 на 1000 госпитализаций в период с 2002 по 2007 год, в то время как частота метициллин-чувствительного остеомиелита S. aureus (MSSA) оставалась стабильной [7]. В целом 51% пациентов, поступивших с инфекцией S. aureus , были инфицированы MRSA [7]. Это согласуется с нашим опытом в Детской больнице Арканзаса, где мы обнаружили, что приблизительно 65% наших стационарных случаев инфицирования S. aureus вызваны MRSA [Juretschko S, Arkansas Children’s Hospital, Pers.Comm.]. Важно отметить, что в исследовании всех детей, госпитализированных в Детский медицинский центр Далласа (Техас, США) с острым остеомиелитом в период с 1999 по 2003 год, частота осложнений вторичной инфекции MRSA была значительно выше, чем у пациентов, инфицированных MSSA, и у пациентов, страдающих от острого остеомиелита, вызванного возбудителями, отличными от S. aureus [8]. Осложнения включали миозит, абсцесс кости, патологический перелом, тромбоз глубоких вен и диссеминированное заболевание [8].Следует отметить, что в этом исследовании дети, которые получали соответствующую терапию MRSA в течение 2 дней, имели такую же частоту осложнений, как и дети, у которых была задержка на 2 дня или более в начале соответствующей антибактериальной терапии для острого остеомиелита MRSA [8]. Это означает, что использования только соответствующих противомикробных препаратов может быть недостаточно для лечения остеомиелита, связанного с MRSA. Это особенно верно в отношении инфекций, вызванных CA-MRSA, поскольку у этих пациентов часто наблюдаются более серьезные клинические проявления, которые включают усиленный воспалительный ответ, мультифокальное заболевание и более частые костные абсцессы, требующие хирургического дренирования [8,9,10].В этом отношении важно отметить, что временные рамки исследования в Далласе [8] соответствуют времени, когда возникновение инфекций CA-MRSA началось, но еще не достигло (или, возможно, даже сейчас) своего зенита.
Клинические проявления и диагностика острого гематогенного остеомиелита
Большинство детей и подростков с AHO имеют в анамнезе боли в костях в течение нескольких дней [2,4]. Отличительной чертой боли AHO является ее постоянный характер с постепенным увеличением уровня боли [2,4].У маленьких детей часто бывает трудно определить локализацию боли, в то время как у детей старшего возраста она обычно более локализована [2,4]. Боль обычно приводит к ограничению использования пораженной конечности [2,4]. Поскольку чаще всего поражаются длинные кости нижних конечностей, дети часто хромают [2,11]. Во всех случаях локальная боль в костях и лихорадка должны вызывать клиническое подозрение на AHO. Повышенная неподвижность сустава и отсутствие точечной болезненности над метафизом указывают на септический артрит, а не на остеомиелит (или в дополнение к нему).Классические признаки воспаления (покраснение, тепло и припухлость) не появляются, если инфекция не продвинулась через метафизарный кору в поднадкостничное пространство [2]. Такое прогрессирование чаще встречается у младенцев и детей раннего возраста, у которых кора костей более тонкая.
Повышенная скорость оседания эритроцитов (СОЭ), повышенный уровень С-реактивного белка (СРБ) и лейкоцитоз часто наблюдаются при AHO, причем повышенный уровень СРБ является наиболее чувствительным лабораторным параметром [12]. Однако это также зависит от агента-нарушителя.Например, недавнее исследование показало, что заметно повышенный уровень CRP (> 4 мг / дл) наблюдался у 86% детей с AHO, вызванным MRSA, но только у 58% детей с острым MSSA-остеомиелитом [8].
Поскольку физикальное обследование и лабораторные тесты предполагают, а не окончательные, для облегчения диагностики остеомиелита использовались различные методы визуализации. К ним относятся простые рентгенограммы, сцинтиграфия скелета, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ).
Обычные рентгенограммы необходимы для исключения других диагнозов, таких как перелом. Хотя глубокий отек мягких тканей можно увидеть рентгенологически в течение первых нескольких дней от начала, остеопения или остеолитические поражения в результате разрушения кости обычно не видны до 2–3 недель после появления симптомов [13]. По этой причине диагностическая ценность простых рентгенограмм для диагностики остеомиелита ограничена пациентами с длительными симптомами, и, как отмечалось ранее, это обычно не относится к детям.В результате для диагностики детской ОГО чаще используются другие методы визуализации [13]. Сцинтиграфия скелета с использованием дифосфоната технеция-99m позволяет проводить обследование всего тела, что полезно для пациентов с плохо локализованными симптомами или если вызывает беспокойство мультифокальный остеомиелит, и это имеет чувствительность более 90% [14]. Однако это требует воздействия ионизирующего излучения, а чувствительность новорожденных ниже, что делает сцинтиграфию скелета менее полезной в этой возрастной группе.Также может быть сложно дифференцировать остеомиелит от инфаркта, связанного с серповидно-клеточной анемией, и других заболеваний, не связанных с инфекцией, включая новообразования и переломы [14]. Кроме того, сцинтиграфия скелета может иметь ограниченное применение при диагностике внебольничного остеомиелита S. aureus . Недавнее исследование показало, что сцинтиграфия скелета диагностирует остеомиелит только у 53% детей с внебольничным остеомиелитом S. aureus [15].
Одним из преимуществ компьютерной томографии является то, что она предоставляет конкретную анатомическую информацию о статусе инфекции [13].КТ может обнаруживать секвестры (свидетельствующие о хроническом остеомиелите) и внутрикостные газы, а также определять поднадкостничные абсцессы, все из которых являются важными факторами при разработке общего терапевтического подхода [13]. Однако КТ также требует воздействия радиации. Есть исследования, предполагающие, что позитронно-эмиссионная томография с фтордезоксиглюкозой (ФДГ-ПЭТ) может быть полезной альтернативой для диагностики у взрослых, особенно в сочетании с КТ [16,17]. Однако этот вопрос не был должным образом изучен в конкретном контексте педиатрического пациента.МРТ может использоваться для выявления внутрикостных, поднадкостничных и мягкотканных абсцессов, что позволяет раннее дренировать абсцесс без воздействия радиации [13,18]. Отеки и экссудаты в костномозговом пространстве являются частыми проявлениями острого остеомиелита и могут быть визуализированы с помощью МРТ [13,18]. Однако эти результаты также можно увидеть при других состояниях, таких как перелом и инфаркт [13,18]. Миозит также легко выявляется с помощью МРТ [18]. МРТ дает лучшую анатомическую информацию, предоставляя анатомический атлас для ортопедов, если будет показано хирургическое вмешательство.По этим причинам МРТ становится методом выбора для диагностики AHO у детей [2,13–15,18]. Чувствительность и специфичность МРТ для диагностики остеомиелита колеблются между 82–100% и 75–96% соответственно [13]. Стоимость, доступность и необходимость седации — важные ограничения для использования МРТ.
Хотя представление пациента, лабораторные исследования и диагностическая визуализация важны, ни один из них не является окончательным в отношении диагноза AHO и, что более важно, ни один не дает информации о статусе устойчивости к антибиотикам организма-нарушителя.По этой причине изоляция возбудителя болезни остается золотым стандартом диагностики и в настоящее время является единственным способом установить окончательный микробиологический диагноз [1,2]. В значительном числе случаев невозможно установить окончательную бактериальную этиологию либо потому, что возбудители болезни трудно культивировать, либо потому, что эмпирическая антимикробная терапия не позволила провести микробиологический анализ [2,5]. Когда этиологический агент может быть идентифицирован, эмпирическую противомикробную терапию следует скорректировать на основе профиля специфической чувствительности бактериального штамма-нарушителя.Культивированные образцы должны включать образцы костей, которые имеют более высокую диагностическую ценность по сравнению с культурами крови [2]. Тем не менее, посев крови также должен быть получен, поскольку организм восстанавливается примерно в 50% всех инфекций AHO [2]. Аспирация пораженной кости иглой может выполняться с использованием относительно неинвазивных процедур у новорожденных и маленьких детей, в то время как детям старшего возраста и подросткам часто требуются более инвазивные хирургические методы, такие как сверление или разрезание кости.Прямой посев культурального материала в бутыль для культуры крови увеличивает вероятность выздоровления такого привередливого организма, как K. kingae . Использование ПЦР для выявления патогенов в образцах костей также становится все более распространенным. В Детскую больницу Арканзаса все образцы костей отправляются на ПЦР-анализ с акцентом на S. aureus, S. pneumoniae , а у детей до 8 лет — K. kingae . Также должны быть получены окраски и посевы грибков и микобактерий, особенно в случаях со специфическими факторами риска и в случаях AHO с отрицательными посевами, которые не поддаются эмпирической терапии.Также следует отправить образцы тканей на гистологическое исследование для подтверждения диагноза остеомиелита. Сбор посевов на ранних стадиях AHO полезен, потому что длительная эмпирическая антимикробная терапия снижает вероятность восстановления возбудителя. Действительно, у стабильного пациента, если имеется план быстрого получения культур тканей, мы считаем, что эмпирическую антибиотикотерапию следует отложить до получения культур тканей.
Лечение острого гематогенного остеомиелита
Лечение AHO требует соответствующей антимикробной терапии во всех случаях и может потребовать хирургического разреза и дренирования.По причинам, обсуждавшимся ранее, соответствующий дренаж стал особенно важным в последние годы из-за продолжающегося появления CA-MRSA. Разрез и дренирование следует выполнять при наличии абсцесса (внутрикостного, поднадкостничного и / или мягкотканного) [2]. Следует провести хирургическое удаление омертвевшей кости и очистку пораженных мягких тканей [1,2]. Наш опыт показывает, что у детей и подростков с остеомиелитом, вызванным CA-MRSA, часто необходимы множественные разрезы и дренажные процедуры, даже при соответствующей антибактериальной терапии.Хирургический дренаж также следует рассмотреть, если ребенок не реагирует на эмпирическую антибактериальную терапию. В этом случае хирургическое вмешательство может улучшить лечение. Кроме того, хирургическое вмешательство позволяет собрать ткань, которую можно микробиологически оценить на предмет необычной этиологии остеомиелита и гистологически исследовать для подтверждения диагноза.
Независимо от того, требуется ли хирургическое вмешательство, для успешного лечения всех форм остеомиелита необходима соответствующая антибактериальная терапия [1,2,4].Антибиотики, которые доказали свою эффективность против инфекций костей и суставов S. aureus , включают нафциллин, клиндамицин, цефалоспорины первого поколения и ванкомицин [1,2]. Если MRSA не вызывает беспокойства (сообщества с ≤10% CA-MRSA, определенным местной антибиотикограммой), то, по нашему мнению, эмпирическая терапия для детей (детей в возрасте 3 месяцев и старше) должна представлять собой антистафилококковый пенициллин (нафциллин). и оксациллин) или цефалоспорин первого поколения (цефазолин). Эти агенты эффективны не только против MSSA, но и против других причин AHO, включая S.pyogenes и K. kingae . К сожалению, стойкое появление MRSA среди изолятов, ассоциированных с сообществом, ограничивает возможности лечения, поскольку все β-лактамные антибиотики исключены из рассмотрения.
В общинах с 10% или более CA-MRSA, ванкомицин или клиндамицин (если местные показатели устойчивости к клиндамицину ≤25%), по нашему мнению, должны использоваться для эмпирического лечения детей. Однако следует отметить, что ни ванкомицин, ни клиндамицин не проявляют активности в отношении К.kingae . Если клиндамицин рассматривается для лечения, фенотип устойчивости к индуцибельным макролидам, линкозамиду и стрептограмину B (MLS B ) должен быть исключен с помощью D-теста (тест индукции эритромицина, который показывает притупление зоны ингибирования клиндамицина на стороне соседний эритромициновый диск при наличии фенотипа устойчивости к MLS B ), поскольку этот фенотип был связан с неудачей лечения [19,20]. По нашему мнению, ванкомицин является основным препаратом выбора для терапии при резистентности, индуцируемой клиндамицином, и в сообществах с уровнем резистентности к клиндамицину более 25%.Если K. kingae вызывает особую озабоченность в области со значительным MRSA, следует рассмотреть возможность терапии цефазолином в дополнение к соответствующей эмпирической терапии MRSA. Следует также еще раз подчеркнуть, что если посевы дают окончательный диагноз, лечение антимикробными препаратами должно быть немедленно скорректировано в зависимости от профиля восприимчивости организма-нарушителя. представляет собой алгоритм предлагаемой начальной антибактериальной терапии AHO у детей от 3 месяцев и старше.
Алгоритм предлагаемой начальной антибактериальной терапии острого гематогенного остеомиелита у детей в возрасте 3 месяцев и старшеЕсли посевы выявляют микроорганизмы, антимикробную терапию следует немедленно скорректировать (при необходимости).
* Если Kingella kingae вызывает особую озабоченность, добавьте терапию цефазолином.
‡ Если клиндамицин рассматривается для лечения, фенотип устойчивости к индуцибельным макролидам, линкозамиду и стрептограмину B должен быть исключен с помощью D-теста, поскольку этот фенотип связан с неэффективностью лечения.
AHO: Острый гематогенный остеомиелит; CA-MRSA: внебольничный метициллин-устойчивый Staphylococcus aureus .
Триметоприм-сульфаметоксазол (TMP-SMX) успешно применялся для лечения инфекций кожи и мягких тканей (SSTI), вызванных CA-MRSA. Однако эффективность TMP – SMX в лечении остеомиелита MRSA у детей недостаточно изучена. Точно так же доксициклин может быть эффективным вариантом для лечения чувствительных к MRSA SSTI у детей старше 8 лет, но его использование для лечения MRSA-остеомиелита у детей остается неизученным.В последние годы стали доступны новые противомикробные препараты для лечения инфекций, вызванных MRSA. К ним относятся линезолид (оксазолидиноновый антибиотик) и даптомицин (липопептидный антибиотик). Пока что клинический опыт применения этих препаратов в конкретном контексте инфекции костей у детей ограничен, хотя в одном исследовании с участием 13 детей, получавших линезолид в качестве альтернативной терапии костно-суставных инфекций, у 11 из 13 детей были хорошие результаты [21]. ]. Средняя продолжительность терапии составляла 20 дней, и в ходе лечения у двоих детей развилась анемия [21].Миелосупрессия — известный побочный эффект длительной терапии линезолидом, так же как и оптические и периферические нейропатии. По этой причине не рекомендуется курс лечения более 21 дня. Это ограничивает использование линезолида при лечении AHO у детей, что требует длительной антимикробной терапии. Педиатрические исследования эффективности даптомицина отсутствуют. Использование даптомицина для лечения AHO у детей ограничено, поскольку MRSA AHO, осложненный пневмонией, представляет собой растущую проблему, а даптомицин инактивируется сурфактантами легких и не может использоваться для лечения таких сложных инфекций.Также известно, что даптомицин вызывает повышение уровня креатининфосфокиназы. При использовании даптомицина следует внимательно следить за уровнем креатининфосфокиназы, поскольку может возникнуть опасный рабдомиолиз. Недавние исследования показали, что даптомицин особенно эффективен в специфическом контексте биопленки [22] и при лечении связанных с биопленками инфекций, в том числе вызванных MRSA [23-25]. Это может быть особенно важно, особенно в контексте хронического остеомиелита.
Продолжительность стандартной терапии AHO составляет от 4 до 6 недель.Доказательные данные о способе и продолжительности введения антибиотиков для лечения AHO ограничены, а критерии, устанавливающие, когда следует переходить от парентерального к пероральному лечению, не определены [26]. Продолжительное лечение антибиотиками может потребоваться при отсроченной или неполной хирургической эвакуации или при наличии отдаленных очагов инфекции (например, эндокардита). Интервенционная радиологическая установка постоянных венозных катетеров в периферическую вену легко доступна, но затраты на установку катетера, внутривенное введение антибиотиков в домашних условиях и уход на дому значительно выше, чем затраты, необходимые для пероральной терапии.Кроме того, важны осложнения, связанные с размещением центрального венозного катетера, такие как бактериемия, возникающая из-за постоянного устройства и неисправности линии. В обзоре, сравнивающем результаты короткого (<7 дней) и длительного (> 7 дней) курса внутривенного лечения AHO, вызванного главным образом MSSA, у детей от 3 месяцев до 16 лет, 12 проспективных исследований показали общий уровень излечения. 95,2% (95% ДИ: 90,4–97,7) для короткого курса по сравнению с 98,8% (95% ДИ: 93.6–99,8) для более длительного курса в 6 месяцев [26], что является незначительной разницей в свете возможных осложнений и затрат, указанных выше. Кроме того, не было значительной разницы в терапевтических результатах, основанных на продолжительности пероральной терапии, между двумя группами [26].
Наш опыт показывает, что детей можно эффективно лечить с помощью последовательной парентеральной / пероральной терапии при соблюдении нескольких условий. Парентерально антибиотики следует назначать до тех пор, пока у ребенка не станет лихорадка и пока не будет продемонстрировано улучшение как при физикальном обследовании, так и при лабораторных анализах.Мы рекомендуем 7–14 дней парентеральной терапии для пациентов с бактериемией; Для детей без бактериемии приемлем более короткий курс внутривенной терапии. В начале лечения следует еженедельно контролировать уровень СРБ и СОЭ, чтобы оценить реакцию на терапию. CRP обычно возвращается к исходному уровню в течение недели после эффективной терапии и используется многими как маркер перехода от парентеральной терапии к пероральной [2]. Еженедельно следует проводить полный анализ крови, чтобы оценить реакцию на терапию и контролировать нейтропению, потенциальное последствие антибактериальной терапии.Общая продолжительность терапии должна основываться на разрешении симптомов и нормализации СОЭ, что обычно занимает 4–6 недель. Должны присутствовать надежные опекуны и организовываться регулярное плановое амбулаторное наблюдение. Пероральный антибиотик должен демонстрировать отличное проникновение в кости, иметь такую же степень антибактериального покрытия, что и парентеральный препарат, и ребенок должен иметь возможность принимать пероральные препараты. Однако в связи с увеличением числа CA-MRSA, который также устойчив к клиндамицину, и отсутствием исследований, касающихся использования других пероральных антибиотиков у детей, соответствие этим критериям может вскоре оказаться затруднительным в США.
Комментарий экспертов и пятилетний обзор
До появления антибиотиков AHO было серьезным заболеванием с высокой заболеваемостью и смертностью [2]. Благодаря усовершенствованным методам диагностики и лечения смертность от этого заболевания в развитых странах в настоящее время незначительна [4]. Однако вариабельный клинический курс у детей с AHO затрудняет рекомендации по стандартизации терапии. Лечение всегда должно быть индивидуальным с использованием командного подхода, включающего участие педиатрических инфекционистов и ортопедов.
Эпидемиология AHO у детей также изменилась с появлением CA-MRSA в качестве основного патогена. Прошлые исследования клинического течения, диагностики и лечения AHO могут быть неприменимы к CA-MRSA, и по этой причине срочно необходимы дальнейшие исследования всех вопросов, обсуждаемых в этом обзоре. Крайне важно, чтобы эти исследования включали оценку новых противомикробных агентов, которые эффективны против штаммов стафилококков, устойчивых к современным β-лактамным, линкозамидным и гликопептидным антибиотикам.К ним относятся липогликопептиды (бактерицидные агенты с длительным периодом полураспада) телаванцин, оритаванцин и далбаванцин, все из которых являются производными существующих гликопептидных антибиотиков и некоторые из них эффективны против устойчивых к ванкомицину штаммов [27]. Другие антибиотики включают иклаприм, ингибитор дигидрофолатредуктазы, потенциально пригодный для перорального применения, и новые цефалоспорины цефтобипрол и цефтаролин [27]. Важно, чтобы эффективность всех этих новых антибиотиков оценивалась в конкретном контексте детей и в более конкретном контексте детского остеомиелита.
Независимо от наличия каких-либо новых противомикробных препаратов, главной терапевтической проблемой при всех формах остеомиелита является возможность как можно быстрее начать наиболее подходящую терапию. В этом отношении важны два соображения: первое — это сложность, связанная с своевременным подтверждением наличия инфекции, а второе — способность идентифицировать возбудителя болезни и оценить его профиль устойчивости к антибиотикам. Поскольку обычные методы физического и лабораторного анализа имеют ограниченную специфичность, решение первого из них потребует разработки конкретных методов визуализации, способных отличить инфекцию от других форм воспаления и, что не менее важно, определить стадию инфекции как необходимое предварительное условие для разработка эффективного подхода к лечению.Одной из возможностей в этом отношении является FDG-PET, хотя еще раз диагностическая ценность этого метода визуализации не была должным образом оценена, особенно в конкретном контексте детского остеомиелита. Своевременное выявление этиологических агентов AHO в образцах костей и крови, вероятно, будет улучшено за счет более широкого использования методов молекулярной диагностики, включая ПЦР.
Наконец, хотя AHO в настоящее время является наиболее распространенной формой остеомиелита у детей, ситуация может измениться в свете появления инфекций CA-MRSA.Штаммы CA-MRSA, особенно штаммы клональной линии USA300 [3], проявляют повышенную вирулентность, которая приводит к осложнениям как в контексте самого остеомиелита, так и возникновения диссеминированных инфекций у педиатрических пациентов. По этой причине кажется вероятным, что для эффективного лечения детского остеомиелита все чаще требуются терапевтические подходы, более часто связанные с хронической инфекцией, включая хирургическую обработку раны и локальную доставку антибиотиков. Локальная доставка антибиотиков дает несколько преимуществ, наиболее важным из которых является способность достигать высоких уровней антибиотиков в очаге инфекции без риска системной токсичности.Исходя из этого, мы считаем, что исследования должны быть сосредоточены на разработке и оценке как стабильных, так и биоабсорбируемых матриц для локальной доставки антибиотиков. Наиболее часто используемой матрицей доставки, особенно в тех случаях, когда обработка раны приводит к структурно-нестабильному дефекту, требующему последующей реконструкции, является полиметилметакрилат (ПММА). Гранулы из ПММА, пропитанные антибиотиками, коммерчески доступны в некоторых странах, в то время как в других хирурги должны производить свои собственные гранулы из ПММА.Альтернативный подход — имплантация биоабсорбируемой матрицы доставки, которая подходит пациентам, у которых хирургическая обработка раны не создает структурно нестабильного дефекта. Действительно, в таких случаях использование биорассасывающейся матрицы для доставки предпочтительнее ПММА, поскольку не требует удаления гранул по завершении терапии [28,29].
Независимо от матрицы доставки наиболее часто используемыми антибиотиками являются гентамицин, тобрамицин и ванкомицин, при этом имеется относительно мало экспериментальных данных в отношении других противомикробных агентов.Недавно было продемонстрировано, что даптомицин может быть включен как в ПММА, так и в другие матрицы доставки (например, сульфат кальция) без потери активности и что он сохраняет эту активность, поскольку он элюируется из гранул с течением времени [30–32]. Клинический опыт применения гранул, пропитанных антибиотиками, в контексте инфекции костей, особенно в отношении этих новых антибиотиков, ограничен у взрослых, но тем более у детей. Как отмечалось выше, важно, чтобы все формы терапии с использованием любого из доступных антибиотиков оценивались на основе как эффективности, так и фармакологических соображений в конкретном контексте детской инфекции.Исходя из этого, крайне важно, чтобы в будущих исследованиях было изучено использование как существующих, так и новых антибиотиков в конкретном контексте локальной доставки антибиотиков при лечении остеомиелита у детей.
Ключевые проблемы
У детей остеомиелит в основном гематогенный и острый.
Золотистый стафилококк является преобладающим возбудителем остеомиелита.
Метициллин-устойчивый S.aureus (MRSA) увеличилась во всем мире, что изменило эпидемиологию остеомиелита.
Инфекции, вызванные внебольничным MRSA (CA-MRSA), имеют более серьезные проявления, чем метициллин-чувствительный S. aureus острый гематогенный остеомиелит.
МРТ — предпочтительный метод визуализации при остром гематогенном остеомиелите у детей, но с учетом текущих ограничений всех методов визуализации разработка и оптимизация альтернативных методов визуализации является важной клинической целью.
Если выявлен этиологический агент остеомиелита, необходимо назначить специфическое противомикробное лечение, основанное на профиле восприимчивости организма. Чтобы облегчить это, по возможности должны быть получены соответствующие культуры, включая биопсию кости, и альтернативные методы диагностики, способные обнаруживать патогены независимо от их характеристик роста (например, ПЦР).
В сообществах с более чем 10% CA-MRSA ванкомицин или клиндамицин следует использовать для эмпирического лечения острого гематогенного остеомиелита.Ванкомицин является основным препаратом выбора для терапии CA-MRSA в сообществах с уровнем резистентности к клиндамицину более 25% и в условиях резистентности, индуцируемой клиндамицином.
Стандартная антимикробная терапия острого гематогенного остеомиелита длится от 4 до 6 недель. Доказательные исследования относительно пути и продолжительности лечения антибиотиками острого гематогенного остеомиелита ограничены, а руководящие принципы, когда следует перейти с парентеральной терапии на пероральную, отсутствуют.
Различное клиническое течение у детей с острым гематогенным остеомиелитом затрудняет рекомендации по стандартизированной терапии. Лечение всегда должно быть индивидуальным с использованием командного подхода, включающего участие специалистов как в области детских инфекционных заболеваний, так и в области ортопедии.
Сноски
Раскрытие информации о финансовых и конкурирующих интересах
Авторы получают финансирование от NIH (RO1 — {«type»: «entrez-nucleotide», «attrs»: {«text»: «AI043356», «term_id»: «3286613», «term_text»: «AI043356»}} AI043356, RO1 — {«type»: «entrez-нуклеотид», «attrs»: {«text»: «AI069087», «term_id»: » 3392062 «,» term_text «:» AI069087 «}} AI069087 и RO1 — {» type «:» entrez-нуклеотид «,» attrs «: {» text «:» AI074007 «,» term_id «:» 3400651 «,» term_text «:» AI074007 «}} AI074007) и от Cubist Pharmaceuticals.Авторы не имеют других соответствующих аффилированных или финансовых отношений с какой-либо организацией или юридическим лицом, имеющим финансовый интерес или финансовый конфликт с предметом или материалами, обсуждаемыми в рукописи, кроме тех, которые раскрыты.
При создании этой рукописи не использовались письменные переводчики.
Информация для авторов
Нада С. Харик, Отделение педиатрии и Отделение микробиологии и иммунологии, Университет медицинских наук Арканзаса и Детская больница Арканзаса, Литл-Рок, AR 72205, США, тел.: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah.
Марк С. Смелцер, Отделение микробиологии и иммунологии и Отделение ортопедической хирургии, Медицинский университет Арканзаса, Литл-Рок, AR 72205, США.
Список литературы
2. Крогстад П. Остеомиелит. В: Фейгин Р.Д., Черри Д.Д., Деммлер-Харрисон Г.Д., Каплан С.Л., редакторы. Учебник детских инфекционных болезней. 6-е издание. Пенсильвания, США: Сондерс Эльзевьер; 2009. С. 725–742. [Google Scholar] 3. Ли М., Ан Дьеп Б., Вильяруз А.Е. и др.Эволюция вирулентности у устойчивых к метициллину эпидемических сообществ Staphylococcus aureus . Proc. Natl Acad. Sci. США. 2009. 106 (14): 5883–5888. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Гутьеррес К. Инфекции костей и суставов у детей. Педиатр. Clin. N. Am. 2005. 52 (3): 779–794. [PubMed] [Google Scholar] 5. Floyed RL, Стил RW. Остеомиелит без посева. Педиатр. Заразить. Дис. J. 2003. 22 (8): 731–736. [PubMed] [Google Scholar] 6. Чометон С., Бенито Ю., Чакер М. и др.Специфическая полимеразная цепная реакция в реальном времени определяет Kingella kingae как наиболее частую причину костно-суставных инфекций у детей раннего возраста. Педиатр. Заразить. Дис. J. 2007; 26 (5): 377–381. [PubMed] [Google Scholar] 7. Gerber JS, Coffin SE, Smathers SA, Zaoutis TE. Тенденции заболеваемости метициллин-устойчивой инфекцией Staphylococcus aureus в детских больницах США. Clin. Заразить. Дис. 2009. 49 (1): 65–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Сааведра-Лозано Дж., Мехиас А., Ахмад Н. и др.Изменение тенденций развития острого остеомиелита у детей: влияние метициллин-резистентных инфекций Staphylococcus aureus . J. Pediatr. Ортоп. 2008. 28 (5): 569–575. [PubMed] [Google Scholar] 9. Мартинес-Агилар Г.А., Авалос-Мишаан А., Халтен К. и др. Внебольничная, метициллин-резистентный и метициллин-чувствительных стафилококк скелетно-мышечные заболевания у детей. Педиатр. Заразить. Дис. J. 2004; 23 (8): 701–706. [PubMed] [Google Scholar] 10. Bocchini CE, Hulten KG, Mason EO Jr и др.Гены лейкоцидина Пантона-Валентайна связаны с усилением воспалительной реакции и локальным заболеванием при остром гематогенном остеомиелите Staphylococcus aureus у детей. Педиатрия. 2006. 117 (2): 433–440. [PubMed] [Google Scholar] 11. Сойер Дж. Р., Капур М. Хромый ребенок: системный подход к диагностике. Являюсь. Fam. Врач. 2009. 79 (3): 215–224. [PubMed] [Google Scholar] 12. Unkila-Kallio L, Kallio MJ, Peltola H, Eskola J. Сывороточный С-реактивный белок, скорость оседания эритроцитов и количество лейкоцитов при остром гематогенном остеомиелите у детей.Педиатрия. 1994. 93 (1): 59–62. [PubMed] [Google Scholar] 13. Пинеда С., Варгас А., Родригес А.В. Визуализация остеомиелита: современные концепции. Заразить. Дис. Clin. N. Am. 2006. 20 (4): 789–825. [PubMed] [Google Scholar] 14. Коннолли LP, Коннолли С.А., Друбах Л.А., Джарамилло Д., Тревес ST. Острый гематогенный остеомиелит у детей: оценка диагностики на основе скелетной сцинтиграфии в эпоху МРТ. J. Nucl. Med. 2002. 43 (10): 1310–1316. [PubMed] [Google Scholar] 15. Браун Л.П., Мейсон Е.О., Каплан С.Л., Кэссиди С.И., Кришнамурти Р., Гиллерман Р.П.Оптимальная стратегия визуализации для внебольничных стафилококка костно-мышечных инфекций у детей. Педиатр. Радиол. 2008. 38 (8): 841–847. [PubMed] [Google Scholar] 16. Basu S, Chryssikos T, Moghadem-Kia S, Zhuang H, Torigian DA, Alavi A. Позитронно-эмиссонная томография как диагностический инструмент при инфекции: настоящая роль и будущие возможности. Семин. Nucl. Med. 2009. 39 (1): 36–51. [PubMed] [Google Scholar] 17. Strobel K, Stumpe KD. ПЭТ / КТ в костно-мышечной инфекции. Семин. Musculoskelet.Радиол. 2007. 11 (4): 353–364. [PubMed] [Google Scholar] 18. Чанг Т. Магнитно-резонансная томография при остром остеомиелите у детей. Педиатр. Заразить. Дис. J. 2002; 21 (9): 869–870. [PubMed] [Google Scholar] 19. Франк А.Л., Марчинак Дж. Ф., Мангат Д. и др. Лечение клиндамицином метициллин-устойчивых Staphylococcus aureus инфекций у детей. Педиатр. Заразить. Дис. J. 2002; 21 (6): 530–534. [PubMed] [Google Scholar] 20. Сибри Г.К., Текле Т., Кэрролл К., Дик Дж. Неудача лечения клиндамицином метициллин-устойчивого Staphylococcus aureus , экспрессирующего индуцибельную устойчивость к клиндамицину in vitro .Clin. Заразить. Дис. 2003. 37 (9): 1257–1260. [PubMed] [Google Scholar] 21. Chen CJ, Chiu CH, Lin TY, Lee ZL, Yang WE, Huang YC. Опыт применения линезолида у детей с костно-суставными инфекциями. Педиатр. Заразить. Дис. J. 2008; 26 (11): 985–988. [PubMed] [Google Scholar] 22. Weiss EC, Spencer HJ, Daily SJ, Weiss BD, Smeltzer MS. Влияние sarA на чувствительность к антибиотикам Staphylococcus aureus в катетер-ассоциированной модели образования биопленок in vitro . Противомикробный.Агенты Chemother. 2009. 53 (6): 2475–2482. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Weiss ED, Zielinska A, Beenken KE, Spencer HJ, Daily SJ, Smeltzer MS. Влияние sarA на чувствительность к даптомицину Staphylococcus aureus биопленок in vivo . Противомикробный. Агенты Chemother. 2009. 53 (10): 4096–4102. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Miro JM, Garcia-de-la-Maria C, Armero Y, et al. Добавление гентамицина или рифампицина не увеличивает эффективность даптомицина при лечении экспериментального эндокардита, вызванного устойчивостью к метициллину Staphylococcus aureus .Противомикробный. Агенты Chemother. 2009. 53 (10): 4172–4177. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Мурильо О., Гарригос С., Пачон М.Э. и др. Эффективность высоких доз даптомицина по сравнению с альтернативными методами лечения экспериментальной инфекции инородного тела метициллин-резистентным Staphylococcus aureus . Противомикробный. Агенты Chemother. 2009. 53 (10): 4252–4257. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Le Saux N, Howard A, Barrowman NJ, Gaboury, Sampson M, Moher D. Более короткие курсы парентеральной антибактериальной терапии, по-видимому, не влияют на частоту ответа у детей с острым гематогенным остеомиелитом: систематический обзор.BMC Infect. Дис. 2002; 2: 16–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Стрыевский М.Э., Кори Г.Р. Новые методы лечения метициллин-резистентного Staphylococcus aureus . Curr. Opin. Крит. Уход. 2009. 15 (5): 403–412. [PubMed] [Google Scholar] 28. Томас М.В., Пулео Д.А. Сульфат кальция: свойства и клиническое применение. J. Biomed. Матер. Res. Б. Прил. Биоматер. 2009. 88 (2): 597–610. [PubMed] [Google Scholar] 29. Залаврас К.Г., Пацакис М.Дж., Холтом П. Местная антибактериальная терапия при лечении открытых переломов и остеомиелита.Clin. Ортоп. Relat. Res. 2004; 427: 86–93. [PubMed] [Google Scholar] 30. Уэбб Н.Д., Макканлесс Д.Д., Кортни Х.С., Бумгарднер Д.Д., Хаггард В.О. Даптомицин, элюированный из сульфата кальция, оказывается эффективным против Staphylococcus . Clin. Ортоп. Relat. Res. 2008. 466 (6): 1383–1387. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Weiss BD, Weiss EC, Haggard WO, Evans RP, McLaren SG, Smeltzer MS. Оптимизированное элюирование даптомицина из гранул полиметилметакрилата. Противомикробный. Агенты Chemother. 2008. 53 (1): 264–266.[Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Канеллакопулу К., Панагопулос П., Джаннитсиоти Э. и др. In vitro элюция даптомицина синтетической кристаллической полугидратной формой сульфата кальция, стимуланом. Противомикробный. Агенты Chemother. 2009. 53 (7): 3106–3107. [Бесплатная статья PMC] [PubMed] [Google Scholar]Информация о здоровье детей: Остеомиелит
Остеомиелит ( oss-tee-owe-my-eh-lie-tis ) — это инфекция в кости. Чаще всего поражаются кости в области колена, бедра или лодыжки.Остеомиелит вызывается бактериями, попадающими в кость, часто после незначительной кожной инфекции, простуды или колотой раны. Часто бывает трудно выяснить точную причину.
Признаки и симптомы остеомиелита
Ваш ребенок может внезапно:
- есть отек, покраснение, тепло или боль в этой области
- не хочу использовать пораженный участок
- у вас жар и в целом плохой внешний вид.
Состояние с похожими симптомами, поражающее суставы, — септический артрит.Смотрите наш информационный бюллетень Септический артрит.
Когда обращаться к врачу
Если у вашего ребенка есть какие-либо симптомы остеомиелита, обратитесь к терапевту. Врачу вашего ребенка может понадобиться:
- осмотрите своего ребенка, особенно болезненную область
- закажите сканирование костей, которое представляет собой специальный рентгеновский снимок, который включает инъекцию — нормальный рентген не покажет остеомиелит
- закажите анализ крови.
Лечение остеомиелита
Большинство детей с остеомиелитом должны быть госпитализированы, где им могут наложить пластырь или шину, чтобы область оставалась неподвижной.
- Вашему ребенку будут вводить антибиотики непосредственно в вену через капельницу (внутривенная или внутривенная терапия). Каждый ребенок по-разному реагирует на лечение, и это повлияет на количество времени, в течение которого ваш ребенок должен оставаться в больнице.
- Внутривенное лечение антибиотиками будет продолжаться до тех пор, пока состояние вашего ребенка не улучшится, а его температура не вернется к норме. После этого вашему ребенку необходимо будет принимать пероральные антибиотики (таблетки или сироп) в течение трех-шести недель.
- Некоторым детям может потребоваться более длительное лечение внутривенными антибиотиками (от четырех до шести недель), а иногда ваш ребенок может пойти домой из больницы, все еще получая внутривенное лечение.
- Анализы крови будут взяты, чтобы убедиться, что используется правильный антибиотик, и чтобы убедиться, что состояние вашего ребенка улучшается, даже если он лечится дома.
- В случае неудачного лечения антибиотиками может потребоваться операция, но это случается редко.
Уход на дому
Очень важно, чтобы ваш ребенок прошел полный курс назначаемых им пероральных антибиотиков.
Обратитесь к своему терапевту или лечащему врачу, если какой-либо из симптомов, перечисленных в разделе «Признаки и симптомы» выше, возвращается, или если у вашего ребенка разовьется диарея и / или лихорадка выше 38.5 ° С.
Продолжение
Вашему ребенку назначат контрольный прием примерно через неделю после возвращения домой. Это очень важно, даже если кажется, что вашему ребенку стало лучше.
Если ваш ребенок проходит лечение в Королевской детской больнице, вам нужно будет явиться в больницу за три часа до приема, чтобы ваш ребенок мог сдать анализ крови, чтобы проверить его прогресс. После этого результаты анализа крови будут готовы к встреча.
Ключевые моменты, которые следует запомнить
- Остеомиелит — это инфекция кости.
- Вашему ребенку потребуется лечение в больнице, и ему может потребоваться внутривенное введение (в вену) антибиотиков с последующим приемом пероральных антибиотиков.
- Вашему ребенку потребуются регулярные анализы крови, чтобы следить за его прогрессом, даже после того, как он уйдет домой.
- Последующие встречи очень важны, и ваш ребенок должен прийти, даже если он выглядит здоровым.
Для получения дополнительной информации
Общие вопросы, которые задают нашим врачам
Что произойдет, если остеомиелит не лечить быстро, для Например, если изначально думали, что это просто вывихнутая лодыжка?
Важно, чтобы остеомиелит лечился на ранней стадии, чтобы избавить от инфекции и предотвратить повреждение кости.Вывихнутая лодыжка не будет вызвать у ребенка жар и недомогание. Если ребенку больно, а также у него жар и он плохо себя чувствует, ему всегда следует обращаться к терапевту.
Будет ли кость моего ребенка слабее и более склонной к переломам? после остеомиелита?
Нет. Почти все дети получат полный
выздоровление после окончания лечения остеомиелита. Обычно это происходит
всего один раз, и большинство детей не предрасположены к повторному появлению этого заболевания.
Разработано ортопедическим отделением Королевской детской больницы. Мы признательны потребителям и опекунам RCH.
Отзыв написан в июне 2018 г.
Kids Health Info поддерживается Фондом Королевской детской больницы. Чтобы сделать пожертвование, посетите www.rchfoundation.org.au.
NORD (Национальная организация по редким заболеваниям)
ОБЗОР СТАТЕЙ
Колстон Дж., Аткинс Б. Инфекция костей и суставов.Clin Med (Лондон). 2018; 18 (2): 150-4.
Лам К., ван Астен С.А., Нгуен Т., Ла Фонтен Дж., Лавери, Лос-Анджелес. Диагностическая точность зонда к кости для выявления остеомиелита в диабетической стопе: систематический обзор. Clin Infect Dis. 2016; 63 (7): 944-8.
Kremers, HM, et al., Тенденции в эпидемиологии остеомиелита: популяционное исследование, 1969–2009 гг. J Bone Joint Surg Am. 2015; 97 (10): 837-45.
Пинеда С., Эспиноза Р., Пена А. Радиографические изображения при остеомиелите: роль простой рентгенографии, компьютерной томографии, ультрасонографии, магнитно-резонансной томографии и сцинтиграфии.Semin Plast Surg. 2009; 23 (2): 80-9.
Фриц Дж. М., Макдональд Дж. Р. Остеомиелит: подход к диагностике и лечению. Phys Sportsmed. 2008; 36 (1): nihpa116823.
Кленерман, Л., История остеомиелита из журнала хирургии костей и суставов: 1948–2006 гг. J Bone Joint Surg Br. 2007; 89 (5): 667-70.
Залаврас К.Г., Пацакис М.Дж., Холтом П. Местная антибактериальная терапия при лечении открытых переломов и остеомиелита. Clin Orthop. 2004; (427): 86-93.
Джуд Э.Б., Ансуорт П.Ф.Оптимальное лечение инфицированных язв диабетической стопы. Лекарства от старения 2004; 21: 833-50.
Harden SP, Argent JD, Blaquiere RM. Болезненный склероз лечебного конца ключицы. Clin Radiol. 2004; 59: 992-99.
Сайгал Г. Азуз Е.М., Абденур Г. Визуализация остеомиелита с особым вниманием к детям. Semin Musculoskelet Radiol. 2004; 8: 243-53.
Аркун Р. Паразитарные и грибковые заболевания костей и суставов. Semin Musculoskelet Radiol .. 2004; 8: 231-42.
Lazzarini L, Mader JT, Calhoun JH.Остеомиелит длинных костей. J Bone Joint Surg Am. 2004; 86-А: 2305-18.
Лев Д.П., Вальдфогель Ф.А. Остеомиелит. Lancet 2004; 364 (9431): 369-79.
Липский Б.А., Берендт А.Р., Дери Х.Г. и др. Диагностика и лечение инфекций диабетической стопы. Clin Infect Dis. 2004; 39 (7): 885-910.
McLaren AC. Материалы, альтернативные акриловому костному цементу, для доставки депо антибиотиков при ортопедических инфекциях. Clin Orthop. 2004; (427): 101-06.
Гульельмо Б.Дж., Любер А.Д., Палетта Д., мл., Джейкобс Р.А. Цефтриаксоновая терапия стафилококкового остеомиелита: обзор. Clin Infect Dis. 2000; 30 (1): 205-7.
Хаас Д.В., МакЭндрю, член парламента. Бактериальный остеомиелит у взрослых: новые аспекты диагностики и лечения. Am J Med 1996; 101 (5): 550-61.
Вальдфогель Ф.А., Медофф Г., Шварц Миннесота. Остеомиелит: обзор клинических особенностей, терапевтических соображений и необычных аспектов. 3. Остеомиелит, связанный с сосудистой недостаточностью. N Engl J Med. 1970; 282 (6): 316-22.
ИНТЕРНЕТ
Лалани Т., Секстон Д., Барон Э. Обзор остеомиелита у взрослых. последнее обновление темы: 28 марта 2019 г. https://www.uptodate.com/contents/overview-of-osteomyelitis-in-adults?source=history_widget Проверено 24 июня 2019 г.
Shah M. Charcot Arthropathy. Обновлено: 21 июня 2018 г. https://emedicine.medscape.com/article/1234293-overview По состоянию на 24 июня 2019 г.
Кошхал К., Подострый остеомиелит (абсцесс Броди). Обновлено: 9 августа 2018 г. https: // emedicine.medscape.com/article/1248682-overview По состоянию на 24 июня 2019 г.
Редкий случай остеомиелита ключицы у ребенка и обзор литературы
Острый остеомиелит ключицы у детей встречается редко и составляет <3% случаев остеомиелита. Мы лечили 12-летнего мальчика с острой болью в правой ключице и высокой температурой в течение 4 дней. МРТ показала аномальный сигнал в правой ключице с периостальной реакцией. Staphylococcus aureus , выделенный из крови, был чувствителен к метициллину, клиндамицину и макролидам.Клиндамицин вводили внутривенно в течение 3 недель и перорально в течение еще 3 недель без рецидива. Мы рассмотрели случаи остеомиелита ключицы у детей, ищущих английскую литературу в PubMed. Из 89 извлеченных исследований только 6 соответствовали критериям и были проанализированы. В исследование были включены шестнадцать пациентов (56% женщин), средний возраст которых составлял 9 лет (диапазон от 2 недель до 16 лет). Остеомиелит в большинстве случаев был гематогенным, причем наиболее частой причиной был S. aureus , выделенный из крови или ткани.Симптомы включали жар, отек и локализованную болезненность костей. Антимикробная терапия длилась 4–12 недель (медиана 7,5). Трем пациентам потребовалось дренирование или кюретаж. Рецидив произошел в 1/16 случаев (6,2%), а сохранение симптомов наблюдалось в 2/16 случаях (12,5%), зарегистрированных до 90-х годов с неизвестной чувствительностью возбудителя к противомикробным препаратам. Острый остеомиелит ключицы в основном поражает детей старшего возраста и в целом имеет хороший прогноз. Золотистый стафилококк чаще всего поражается, и может потребоваться хирургическое вмешательство.
1. Введение
Остеомиелит — это воспаление костей, расположенных в метафизе и чаще встречается в нижних конечностях [1]. Диагноз остеомиелита в детстве, как правило, не вызывает затруднений, а своевременное применение соответствующей противомикробной терапии практически устранило смертность и отдаленные последствия. Однако частота хронических заболеваний, деформаций и инвалидности значительна, если диагностика и лечение задерживаются или оказываются неверными. В 65–75% случаев поражается бедренная, большеберцовая или плечевая кость.Вовлечение других длинных костей встречается реже, а таких костей, как ключицы, ребра, позвоночник и костей рук и ног — необычно; таким образом, на этих сайтах могут возникать диагностические проблемы. Среди этих костей ключица задействована в 1–3% [2].
Ключица — уникальная кость. Это первая кость, окостеневшая у эмбриона человека, и единственная длинная кость, окостеневшая внутримембранно [3–6]. Большинство поражений ключицы травматичны и не создают диагностических трудностей. С другой стороны, нетравматические поражения ключицы встречаются редко и часто создают проблемы при диагностике [7].В настоящем документе мы сообщаем о случае остеомиелита ключицы у ребенка и рассматриваем опубликованные случаи острого остеомиелита ключицы у педиатрических пациентов.
2. Пациенты и методы
Мы описываем случай остеомиелита ключицы, который был диагностирован и пролечен в наших педиатрических отделениях. Кроме того, мы изучили литературу PubMed на английском языке по остеомиелиту ключицы у детей. В качестве ключевых слов мы использовали термины «остеомиелит», «ключица» и «дети». Мы включили те случаи, для которых был поставлен диагноз острого остеомиелита ключицы, возраст (до 16 лет) и пол пациентов.Мы исключили хронические случаи остеомиелита ключицы, а также те случаи, когда возраст и пол пациентов были неизвестны. Для каждого проанализированного случая острого остеомиелита ключицы мы записывали возраст, пол, симптомы и признаки, сторону поражения ключицы, выделенный микроорганизм, лечение (вид антибиотика, способ и продолжительность введения, хирургический дренаж или выскабливание) и результат (излечение, рецидив или стойкость).
3. Описание клинического случая
Α Мальчик 12 лет поступил в педиатрическое отделение больницы общего профиля Серре с острой болью в правой ключице и высокой температурой (39-40 ° C) в течение четырех дней.Во время госпитализации было зарегистрировано два эпизода рвоты и один эпизод диареи, но они не повторились. Клиническое обследование выявило легкую припухлость, покраснение и сильную боль при надавливании на грудинный конец правой ключицы, которая распространилась на надключичную ямку и вызвала кривошея.
Лабораторные тесты: WBC 9770/ μ L (neu 81,6%, лимфа 12,1%), PLT 162000/ μ L, Hb 14,8 г / дл, Hct 43,1% и CRP 8,5 мг / дл. Рентген ключицы без особенностей.КТ показала расширение грудино-ключичного сустава с отеком мышечной ткани в ипсилатеральной области (рис. 1 (а)). После посева крови и возможного диагноза остеомиелита эмпирически было начато внутривенное противомикробное лечение ванкомицином и цефотаксимом. Затем ребенок был переведен в 3-е педиатрическое отделение больницы Гиппократион в Салониках для дальнейшего обследования и лечения.
МРТ, проведенное в больнице Гиппократион, показало аномальный сигнал в правой ключице, в основном в ее стернальном конце, с периостальной реакцией; кроме того, сигнал был сильно ненормальным в мышцах и мягких тканях надключичной и подключичной ямок с уменьшенной диффузией и интенсивным обогащением вышеуказанных областей (Рисунок 1 (b)).Эти данные свидетельствовали о наличии остеомиелита с наличием небольшого абсцесса в грудинном конце ключицы с одновременным наличием обширного пиомиозита (рис. 1 (b)).
На 3-й день из культуры крови был выделен Staphylococcus aureus , чувствительный к метициллину, макролидам и клиндамицину. Затем лечение было изменено на клиндамицин. Пациент был переведен на 5-й день госпитализации, в последующие 1-2 недели наблюдалось постепенное клиническое и лабораторное улучшение.Лечение продолжалось внутривенными антибиотиками в течение 3 недель и пероральным клиндамицином еще 3 недели. Рецидивов не наблюдалось.
4. Обзор литературы
В результате поиска в литературе было извлечено 89 статей, из которых в 6 [2, 3, 7–10] сообщалось о 16 случаях острого остеомиелита ключицы у детей и подростков (возраст от 0 до 16 лет), которые были включены в анализ. Мы исключили хронические случаи остеомиелита ключицы, а также те, для которых не были указаны возраст и пол пациентов.Всего в эти исследования были включены 16 пациентов (56% женщин), средний возраст которых составлял 9 лет, в диапазоне от 2 недель до 16 лет. Во всех 16 случаях основным признаком была местная боль, тогда как в 4 случаях наблюдалась дополнительная опухоль, а в 5 случаях — лихорадка. В 9/16 (56%) случаях пораженным местом оказалась правая ключица. Среди этих 16 случаев S. aureus был наиболее распространенным организмом (6 случаев, 60% из 10 случаев, в которых были зарегистрированы результаты посева), выделенных из крови или ткани.Микроорганизм не вырос в 3 случаях, о которых сообщалось о результатах культивирования, в 2 случаях культуры не были получены и в 4 случаях не сообщалось. Остеомиелит оказался гематогенным в большинстве случаев с указанным способом распространения. Продолжительность противомикробной терапии варьировалась от 4 недель до 3 месяцев со средним значением 7,5 лет. Трем пациентам потребовалось хирургическое вмешательство: дренаж 2 и выскабливание 1. Рецидив произошел в 1/16 случая и сохранение симптомов в 2/16 случаях, зарегистрированных до 90-х годов, с неизвестной чувствительностью к антимикробным препаратам.Таблица 1 содержит сводные данные опубликованных случаев и нашего случая.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| только не сообщалось При остром и хроническом остеомиелите посевы были положительными. В 2 из 16 случаев остеомиелита потребовалось хирургическое вмешательство. В противном случае исход благоприятный. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5. Обсуждение
В этой статье мы сообщаем о редком случае остеомиелита ключицы у ребенка и рассматриваем ранее опубликованные случаи острого остеомиелита ключицы у детей.Острый стафилококковый остеомиелит ключицы — редкое, но важное заболевание. До введения антибиотиков острый гематогенный остеомиелит был тяжелым заболеванием с высокой заболеваемостью и смертностью. После разработки усовершенствованных диагностических инструментов и методов лечения смертность от остеомиелита в развитых странах стала незначительной [11].
Наше исследование показывает, что острый остеомиелит ключицы чаще поражает детей старшего возраста, как в нашем случае, когда пациентом был 12-летний мальчик.Рецидив произошел в 1/16 случаев, а сохранение симптомов — в 2/16 случаях. Анатомия кровоснабжения ключицы — возможная причина того, что лечение острого стафилококкового остеомиелита ключицы затруднено. Когда питательная артерия входит латерально, патологический перелом и нарушение кровоснабжения могут предрасполагать к остеолизу медиального сегмента. Остеомиелит ключицы, по-видимому, ведет себя так же, как и остеомиелит других плоских перепончатых костей, например подвздошной кости, и, возможно, его труднее лечить, чем остеомиелит длинных костей [2, 12].
Редкость острого остеомиелита ключицы и его клиническое сходство с травмой часто приводят к ошибочной диагностике. Когда впервые появляется пациент с острой очаговой болью и отеком ключицы, клинические возможности, которые следует учитывать, включают перелом, целлюлит и абсцесс мягких тканей. После рассмотрения травмы при дифференциальной диагностике хронического остеомиелита необходимо взвесить грудинно-ключичный артрит, ишемический некроз, аномалии развития и опухолевые или опухолевидные состояния, такие как эозинофильная гранулема, аневризматическая киста кости, гемангиома и остеоид-остеома.Из-за своей распространенности у детей саркома Юинга всегда должна рассматриваться, когда ребенок проявляет местную боль, отек и лихорадку [7].
Наше исследование показало, что чаще всего поражается S. aureus (60%), и может потребоваться хирургическое дренирование. Хотя могут быть задействованы различные бактериальные патогены, S. aureus является основным возбудителем острого гематогенного остеомиелита у детей [11]. Другие возбудители включают Streptococcus pyogenes , Streptococcus agalactiae (у младенцев), Streptococcus pneumoniae , коагулазонегативные стафилококки (при инфекциях, ассоциированных с устройством), Kingella kingae и кишечные бактерии (особенно сальмонеллезные грамотрицательные бактерии 908). видыу больных серповидноклеточной анемией) [1, 11].
МРТ является наиболее подходящим методом для оценки изменений костного мозга и может обнаруживать остеомиелит с чувствительностью 82–100% и специфичностью 75–95% [13]. МРТ также полезна для оценки таких осложнений, как абсцессы, суставные выпоты и разрастания мягких тканей, которые могут потребовать хирургического вмешательства [14].
Компьютерная томография (КТ) показывает разрушение костей и обнаруживает такие осложнения, как абсцессы, свищи или образование секвестра. Сравнивая два метода, МРТ имеет значительное преимущество перед КТ в отношении визуализации поражения мягких тканей [15].
Компьютерная томография несет на себе лучевую нагрузку; и остается проблема с доступностью МРТ / введения контрастного вещества. Ультрасонография может быть лучшей альтернативой абсцессам и изменениям мягких тканей. Это быстрый, неионизирующий и очень чувствительный метод сбора инфекционных жидкостей и суставных выпотов. Более того, изображения не искажаются металлическими артефактами или артефактами движения (как при КТ и МРТ), и, наконец, УЗИ дает возможность тонкоигольной аспирации для подтверждения инфекционной природы скопления жидкости без ненужного загрязнения соседних анатомических отделов [16].Выявление остеомиелита в нашем случае было основано на результатах МРТ (рис. 1 (б)).
Хотя симптомы и признаки пациента, результаты лабораторных исследований и диагностическая визуализация важны, ни один из них не является окончательным в отношении диагноза острого гематогенного остеомиелита и, что более важно, ни один из них не дает информации о чувствительности вызывающего заболевания организма к антибиотикам. По этой причине изоляция этиологического организма остается золотым стандартом диагностики и в настоящее время является единственным способом установить окончательный микробиологический диагноз [11, 17].Когда этиологический агент идентифицирован, эмпирическую антимикробную терапию следует скорректировать на основании профиля специфической чувствительности вызывающего бактерию штамма.
Для успешного лечения всех форм остеомиелита необходима соответствующая антибактериальная терапия. Антибиотики, которые доказали свою эффективность против инфекций костей и суставов S. aureus , включают антистафилококковые пенициллины, клиндамицин, цефалоспорины первого поколения и ванкомицин [1, 17]. Харик и Смелцер утверждают, что в сообществах с> 10% CA-MRSA ванкомицин или клиндамицин (если местная устойчивость к клиндамицину <25%) должны использоваться в качестве эмпирического лечения [18].В нашем случае выбор клиндамицина привел к успешному результату.
Стандартная терапия острого гематогенного остеомиелита составляет от 4 до 6 недель [19]. Обзор случаев показывает среднее значение продолжительности 7,5 недель. Доказательные данные о способе и продолжительности приема антибиотиков при остром гематогенном остеомиелите ограничены, а критерии, устанавливающие, когда следует переходить с парентеральной терапии на пероральную, не определены [19]. СРБ обычно становится нормальным в течение недели после соответствующей терапии и часто используется в качестве маркера перехода от парентеральной терапии к пероральной [1].Пероральный антибиотик должен демонстрировать адекватное проникновение в кости и иметь такой же антибактериальный спектр и активность, что и парентеральный препарат, и маленький пациент должен уметь проглатывать пероральные препараты [18].
В заключение, острый остеомиелит ключицы поражает в основном детей старшего возраста и в целом имеет хороший прогноз. Золотистый стафилококк чаще всего поражается, и может потребоваться хирургическое вмешательство.
Конкурирующие интересы
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.
Остеомиелит: симптомы, причины и лечение
Остеомиелит — это инфекция костей, редкое, но серьезное заболевание. Кости могут инфицироваться разными способами: инфекция в одной части тела может распространиться через кровоток в кость, либо открытый перелом или хирургическое вмешательство могут привести к заражению кости.
Что вызывает остеомиелит?
В большинстве случаев бактерии под названием Staphylococcus aureus , тип стафилококка, вызывают остеомиелит.
Определенные хронические состояния, такие как диабет, могут повысить риск развития остеомиелита.
Кто заболевает остеомиелитом?
Только 2 человека из 10 000 заболевают остеомиелитом. Заболевание поражает детей и взрослых, хотя и по-разному. Определенные состояния и поведение, которые ослабляют иммунную систему, увеличивают риск остеомиелита, в том числе:
- Диабет (большинство случаев остеомиелита вызвано диабетом)
- Серповидно-клеточная анемия
- ВИЧ или СПИД
- Ревматоидный артрит
- Внутривенное употребление наркотиков
- Алкоголизм
- Длительное употребление стероидов
- Гемодиализ
- Плохое кровоснабжение
- Недавняя травма
Операции на костях, включая замену тазобедренных и коленных суставов, также увеличивают вероятность инфицирования костей.
Остеомиелит у детей и взрослых
У детей остеомиелит обычно протекает остро. Острый остеомиелит возникает быстро, легче поддается лечению и в целом протекает лучше, чем хронический остеомиелит. У детей остеомиелит обычно проявляется в костях рук или ног.
У взрослых остеомиелит может быть острым или хроническим. Люди с диабетом, ВИЧ или заболеванием периферических сосудов более склонны к хроническому остеомиелиту, который сохраняется или рецидивирует, несмотря на лечение.Хронический или острый остеомиелит часто поражает таз взрослого человека или позвонки позвоночника. Это также может произойти в ногах, особенно у человека с диабетом.
Симптомы остеомиелита
Острый остеомиелит быстро развивается в течение 7-10 дней. Симптомы острого и хронического остеомиелита очень похожи и включают:
- Лихорадка, раздражительность, усталость
- Тошнота
- Болезненность, покраснение и тепло в области инфекции
- Отек вокруг пораженной кости
- Утраченный диапазон движение
Остеомиелит позвонков проявляется сильной болью в спине, особенно ночью.
Лечение остеомиелита
Выявление остеомиелита — это первый шаг в лечении. Это также на удивление сложно. Врачи полагаются на рентген, анализы крови, МРТ и сканирование костей, чтобы получить представление о том, что происходит. Биопсия кости помогает определить тип организма, обычно бактерии, вызывающие инфекцию, поэтому можно назначить правильное лекарство.
Продолжение
Лечение направлено на то, чтобы остановить распространение инфекции и сохранить как можно больше функций.Большинство людей с остеомиелитом лечат антибиотиками, хирургическим вмешательством или обоими способами.
Антибиотики помогают контролировать инфекцию и часто позволяют избежать хирургического вмешательства. Люди с остеомиелитом обычно получают антибиотики в течение нескольких недель через капельницу, а затем переходят на таблетки.
Более серьезный или хронический остеомиелит требует хирургического вмешательства для удаления инфицированной ткани и кости. Операция по поводу остеомиелита предотвращает дальнейшее распространение инфекции или настолько серьезное заболевание, что ампутация остается единственным вариантом.
Профилактика остеомиелита
Лучший способ предотвратить остеомиелит — это содержать вещи в чистоте. Если у вас или вашего ребенка есть порез, особенно глубокий, промойте его полностью.



 Доказательные исследования относительно пути и продолжительности лечения антибиотиками острого гематогенного остеомиелита ограничены, а руководящие принципы, когда следует перейти с парентеральной терапии на пероральную, отсутствуют.
Доказательные исследования относительно пути и продолжительности лечения антибиотиками острого гематогенного остеомиелита ограничены, а руководящие принципы, когда следует перейти с парентеральной терапии на пероральную, отсутствуют.