Клинический случай гипертрофической кардиомиопатии у подростка Текст научной статьи по специальности «Клиническая медицина»
БОЛЕЗНИ МИОКАРДА
с цветовым допплеровским картированием и доппле-рографией, рентгенография органов грудной клетки в прямой и второй косой проекции, компьютерная томография грудной клетки.
Результаты: ребенок поступил с жалобами на одышку при двигательной активности, быструю утомляемость, беспокойный сон, повышенную возбудимость, периодически учащенное сердцебиение, впервые жалобы появились около полугода назад. Ребенок от 1 беременности, протекавшей с угрозой прерывания, на фоне фето — плацентарной недостаточности, хронической внутриутробной гипоксии плода, 1 срочных родов, массой 3590 гр., ростом 52 см, оценка по Апгар 7/7 баллов. Ребенок наблюдался у невролога с диагнозом: перинатальное поражение ЦНС, кефалогематома левой теменной кости.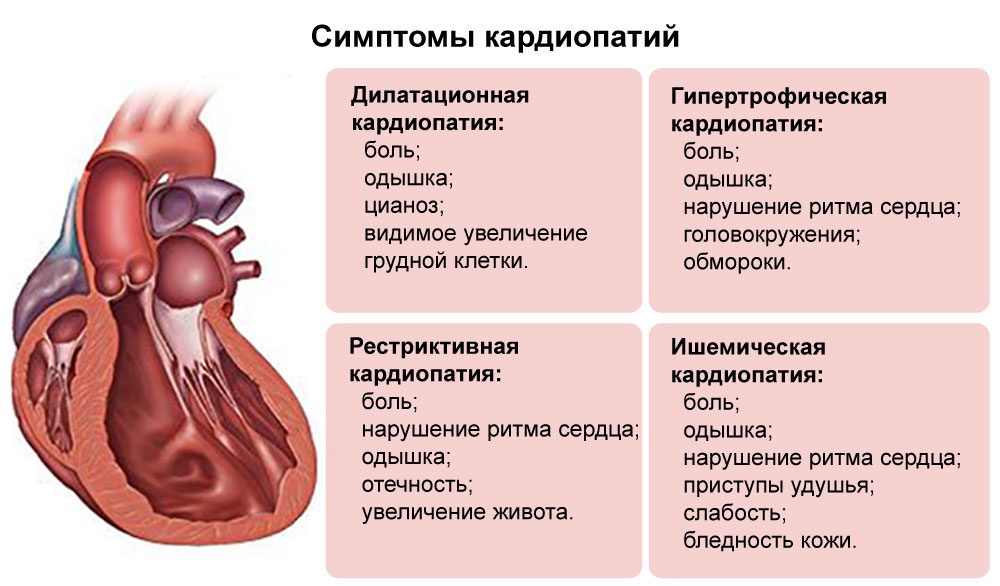

Обсуждение: первичные опухоли сердца являются редкой, серьезной патологией, иногда протекающие под видом других заболеваний, в том числе инфекционных, неврологических, требующие исключения кардиомиопатий, клапанной патологии сердца, проведения современных диагностических методов обследования.
Выводы: данное наблюдение приведено как описание редкой патологии, раннее выявление которой возможно при своевременном проведении эхокар-диографии, а прогноз зависит от правильного выбора тактики лечения.
КЛИНИЧЕСКИЙ СЛУЧАЙ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ У ПОДРОСТКА
КАЧМАРИКH.A., ЛЕВКИНА Г.Ф., ЩЕГРОВА Н.А., АВЕРЬЯНОВА О.В.
КГБУЗ «КМРД № 4 ОТДЕЛЕНИЕ УЗД №1, КРАСНОЯРСК
Цель исследования: демонстрация клинического наблюдения гипертрофической кардиомиопатии у подростка, занимающегося профессиональным спортом.
Методы: анализ данных электронной карты в программе «Видар» в диагностическом отделении для детей города Красноярска на базе КГБУЗ «КМ РД №4» (протоколы эхокардиографии и других функциональных исследований, видеоматериалы), а также данных амбулаторной карты подростка с гипертрофической кардиомиопатией (ГКМП).
Результаты и их обсуждение: гипертрофическая кардиомиопатия относится к группе некоронароген-ных заболеваний миокарда и может диагностироваться в любом возрасте, независимо от пола и расовой принадлежности, однако преимущественно заболевание выявляется у лиц молодого трудоспособного возраста.
РОССИЙСКИЙ ВЕСТНИК ПЕРИНАТОЛОГИИ И ПЕДИАТРИИ, 3, 2016 ROSSIYSKIY VESTNIK PERINATOLOGE IPEDIATRII, 3, 2016
ТЕЗИСЫ. IX ВСЕРОССИЙСКИЙ КОНГРЕСС «ДЕТСКАЯ КАРДИОЛОГИЯ 2016»
области сердца, после чего подросток был обследован в ФЦ ССХ г. Красноярска, где и был выставлен диагноз гипертрофической кардиомиопатии ЛЖ без обструкции выходного тракта. При холтеровском мониторировании определялся синусовый ритм, синусовая аритмия, выраженная элевация сегмента ST во II и III отведениях до 4 мм (расцененная, как признак гипертрофии МЖП). Последние данные ЭКГ — синусовая аритмия, ЭОС отклонена резко влево, угол альфа — 64°, выявлена БПВЛНПГ и НБПНПГ, а также выраженное нарушение процессов реполяризации в миокарде.
В настоящее время подросток обследуется с периодичностью 1 раз в 3 месяца, отрицательной динамики не зарегистрировано, лекарственную терапию не получает из-за отсутствия объективных жалоб. Последнее эхокардиографическое обследование в возрасте 17 лет выявило выраженное утолщение МЖП и задней стенки ЛЖ, увеличение массы миокарда, уменьшение конечного диастолическо-го объема ЛЖ. Данные показатели соответствовали концентрической гипертрофии ЛЖ. Наличие разницы между МЖП и задней стенкой ЛЖ подтвердили асимметричную форму. Диастолическая функция ЛЖ сохранена.
Выводы: в представленном клиническом наблюдении продемонстрирована поздняя диагностика ГКМП у подростка, занимающегося профессиональным спортом. Для своевременного выявления патологических изменений и их коррекции у профессиональных спортсменов необходимо контролировать состояние ССС при помощи физикальных и инструментальных (ЭКГ, ЭХО КГ) исследований с периодичностью не реже одного раза в год.
КЛИНИЧЕСКИЕ ОСОБЕННОСТИ ДЕБЮТА СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ У ДЕТЕЙ И ПОДРОСТКОВ
ЛУКЬЯНОВА В.Н., УШАКОВА С.А., ХАЛИДУЛЛИНА О.Ю., ПЕТРУШИНА А.Д., КОНЕВА Л.Н., МАРИНА О.Д.
Цель: определить наиболее характерные признаки системной красной волчанки (СКВ) у детей и подростков в дебюте заболевания.
Методы: проведено ретроспективное исследование с анализом историй болезни 24 детей в возрасте от 3 лет до 17 лет (18 девочек и 6 мальчиков) с верифицированным диагнозом «Системная красная волчанка», проходивших стационарное обследование и лечение в детском отделении № 1 ГБУЗ ТО «ОКБ
№1» г.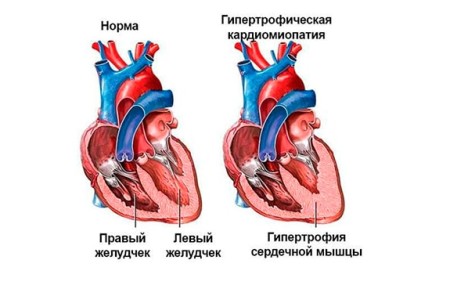
Результаты: две трети пациентов с СКВ были представлены лицами женского пола. Возраст детей в момент дебюта СКВ — 12,5±5,3 лет). В группе обследованных длительность заболевания на момент верификации диагноза составляла от 1 месяца до 12 лет (медиана — 6 месяцев), при этом у 3 детей проводилась ревизия диагноза после наблюдения в течение нескольких лет с установленным ранее «ювенильным ревматоидным артритом». Характерные клинические проявления в виде эритемы лица и сыпи в зоне декольте определялись в дебюте у 90% пациентов. Суставной синдром был выявлен у 70% больных СКВ, он характеризовался поражением коленных, голеностопных, тазобедренных, лучезапястных и мелких суставов кистей. В дебюте заболевания 60% детей имели установленное поражение почек (люпус-нефрит). У 55% больных заболевание началось с фебрильной лихорадки и немотивированной слабости. Поражение слизистых оболочек отмечено в 45% случаев. В группе обследованных больных поражение серозных оболочек наблюдалось у 37,5% пациентов, центральной нервной системы — у 33,3% больных, органов желудочно-кишечного тракта — у 33,3% пациентов, органов дыхания — у 25% больных.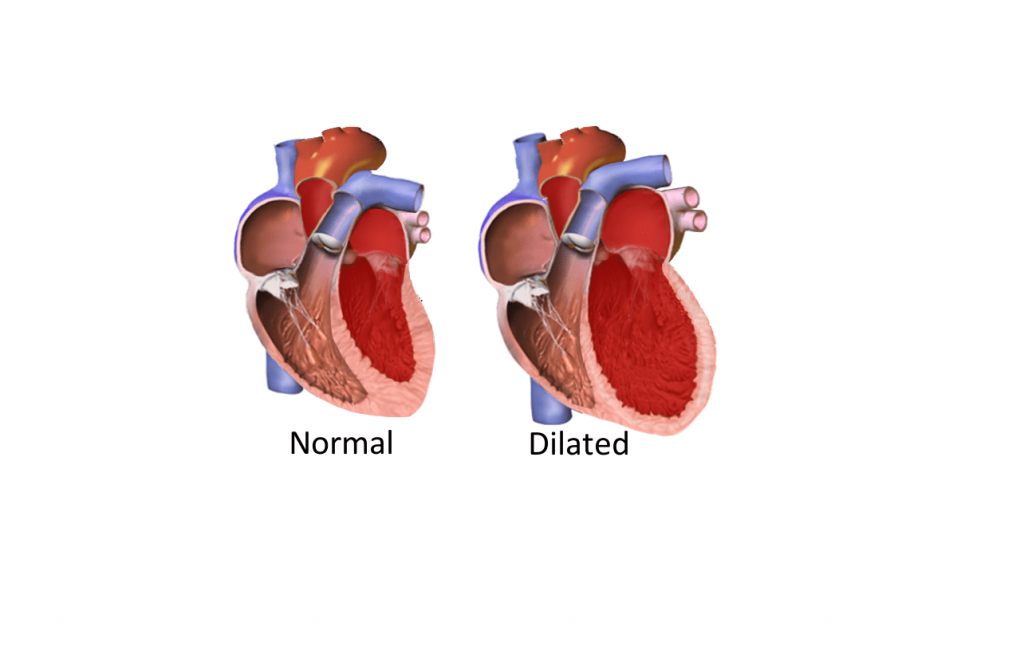 Вовлечение сердечно-сосудистой системы (эндомиокардит, экссуда-тивный перикардит) в дебюте отмечено у 17% пациентов с СКВ. Из лабораторных данных превалировали анемия (91%), ускорение СОЭ (87%). Тромбоцитопе-ния и лейкопения выявлены в 58% и в 54% случаев, соответственно. При иммунологическом исследовании у 75% пациентов отмечалось повышение антител к ДНК, у 54% больных — повышение титра к антину-клеарному фактору, у 29% пациентов — снижение титра фракций комплемента и повышение суммарных антител к кардиолипину. У двух подростков выявлена ложноположительная реакция Вассермана.
Вовлечение сердечно-сосудистой системы (эндомиокардит, экссуда-тивный перикардит) в дебюте отмечено у 17% пациентов с СКВ. Из лабораторных данных превалировали анемия (91%), ускорение СОЭ (87%). Тромбоцитопе-ния и лейкопения выявлены в 58% и в 54% случаев, соответственно. При иммунологическом исследовании у 75% пациентов отмечалось повышение антител к ДНК, у 54% больных — повышение титра к антину-клеарному фактору, у 29% пациентов — снижение титра фракций комплемента и повышение суммарных антител к кардиолипину. У двух подростков выявлена ложноположительная реакция Вассермана.
Обсуждение: половая и возрастная характеристика обследованных пациентов в целом соответствует распространенным данным о наибольшей уязвимости к развитию СКВ девочек в пубертатном периоде, но имелись случаи выявления заболевания и у мальчиков в дошкольном возрасте. Клинические и лабораторные проявления СКВ в дебюте заболевания характеризовались в большинстве наблюдений полным набором основных признаков, позволяющим установить достоверный диагноз. Поздняя диагностика СКВ (спустя более года после появления первых симптомов заболевания) наблюдалась у 12,5% пациентов, что могло быть связано с недооценкой симпто-мокомплекса клинических проявлений и результатов иммунологического обследования.
Поздняя диагностика СКВ (спустя более года после появления первых симптомов заболевания) наблюдалась у 12,5% пациентов, что могло быть связано с недооценкой симпто-мокомплекса клинических проявлений и результатов иммунологического обследования.
Выводы: учитывая многообразие клинических проявлений в дебюте заболевания у детей и подростков, необходима настороженность врачей всех специальностей в отношении системной красной волчанки.
РОССИЙСКИЙ ВЕСТНИК ПЕРИНАТОЛОГИИ И ПЕДИАТРИИ, 3, 2016 ROSSIYSKIY VESTNIK PERINATOLOGIII PEDIATRII, 3, 2016
Метаболическая кардиомиопатия | Руководство по кардиологии
(Е.Г. Несукай)
Определение
Метаболическая кардиомиопатия (ранее ее определяли как дистрофию миокарда, миокардиодистрофию) — невоспалительное поражение миокарда различной этиологии, в основе которого лежит нарушение обмена веществ, процесса образования энергии и/или нарушение ее превращения в механическую работу, приводящее к дистрофии миокарда и недостаточности сократительной и других функций сердца.
Этиология
Метаболическая кардиомиопатия развивается в результате воздействия патогенных факторов при различных заболеваниях и состояниях (схема 8.1).
Среди физических факторов могут рассматриваться радиация, вибрация, перегревание, переохлаждение, гиперинсоляция.
К химическим факторам относятся лекарственные средства, токсическое воздействие бытовых и промышленных ядов.
Патогенез
В возникновении и развитии метаболических поражений миокарда при разных заболеваниях существенное значение имеет нарушение иннервации, транспорта и утилизации энергии в кардиомиоцитах, то есть их энергообеспечение.
Напряжение регулирующих систем, функции миокарда и метаболических процессов в кардиомиоцитах ограничивает резервные возможности сердца. Длительная гиперфункция сама по себе, а особенно в неблагоприятных условиях на фоне основного заболевания, может привести к возникновению энергетического дефицита и нарушению приспособительных изменений в миокарде.
Механизмы снижения продукции энергии в поврежденном сердце включают снижение плотности капилляров, увеличение межкапиллярного расстояния, а также больший диаметр гипертрофированных кардиомиоцитов, что ухудшает диффузию кислорода и обусловливает возникновение гипоксии миокарда. Один из механизмов связан также с нарушением функции митохондрий, которое вызвано редуцированным синтезом окислительных энзимов вследствие нарушения пролиферативной реакции, которая частично опосредована экспрессией рецепторов PPARα, играющих ключевую роль в биогенезе митохондрий. Эти рецепторы регулируют транскрипцию многих энзимов и переносчиков (транспортеров), которые участвуют в транспорте и окислении жирных кислот. Также снижается способность сердца восстанавливать запасы макроэргических фосфатов. Уменьшение окисления жирных кислот вызывает накопление липидов и вносит вклад в некроз поврежденных мембран, при этом высвобождение реактивных молекул (цитохромов, радикалов кислорода) приводит к апоптозу. Ускоренный гликолиз, вызванный нарушением окислительного фосфорилирования, приводит к ацидозу, который ингибирует многие процессы, включенные в процесс сокращения — расслабления. Из последних наиболее важным является повышение концентрации кальция в цитозоле, который инициирует множество порочных кругов, приводящих к некрозу миоцитов.
Из последних наиболее важным является повышение концентрации кальция в цитозоле, который инициирует множество порочных кругов, приводящих к некрозу миоцитов.
В прогрессировании метаболической кардиомиопатии ведущую роль играет усиление реакций свободнорадикального перекисного окисления липидов клеточных мембран. Повреждая мембраны, гидроперекиси и свободные радикалы снижают активность липидозависимых ферментативных реакций (к которым относятся основные жизненно важные ферменты ионного транспорта и дыхательной цепи митохондрий), изменяют мембранорецепторные системы клетки с развитием медиаторного дисбаланса, активируют протеолитические и лизосомальные ферменты.
Патологическая анатомия
Метаболические поражения миокарда охватывают все стадии нарушения обмена сердечной мышцы — от функциональных расстройств до грубых структурных изменений. Морфологические изменения происходят внутри клеток миокарда и не сопровождаются увеличением их количества. Наиболее чувствительны к патогенным воздействиям митохондрии и эндоплазматическая сеть. Для дегенеративных изменений миокарда характерно мозаичное нарушение структуры кардиомиоцитов: в одной и той же клетке среди набухших митохондрий с частично или полностью разрушенными внутренними перегородками могут быть митохондрии с нормальным строением.
Для дегенеративных изменений миокарда характерно мозаичное нарушение структуры кардиомиоцитов: в одной и той же клетке среди набухших митохондрий с частично или полностью разрушенными внутренними перегородками могут быть митохондрии с нормальным строением.
Как правило, устранение патогенной причины приводит к постепенной нормализации ультраструктур кардиомиоцита, что обусловлено внутриклеточными регенераторными процессами. Поврежденные миофибриллы восстанавливаются в результате активной деятельности рибосом: постепенно устраняется внутриклеточный отек, появляются зерна гликогена, уменьшается количество жировых включений. При длительном и интенсивном воздействии повреждающих факторов на миокард дистрофические изменения могут приводить к глубоким морфологическим изменениям, заканчивающимся развитием миокардиофиброза.
Гибель части миокарда восполняется увеличением массы специфических структур в неповрежденных клетках, происходит гиперплазия митохондрий, саркоплазматического ретикулума, рибосом. В результате развивается гипертрофия миокарда, представляющая собой компенсаторную регенераторно-гиперпластическую реакцию, характерную для миокарда. Биохимические процессы чаще нарушаются в ЛЖ.
В результате развивается гипертрофия миокарда, представляющая собой компенсаторную регенераторно-гиперпластическую реакцию, характерную для миокарда. Биохимические процессы чаще нарушаются в ЛЖ.
Клиническая картина
Клинические проявления многообразны и не являются специфичными. Начальные стадии могут протекать бессимптомно, со временем снижение сократительной способности миокарда может привести к тяжелой СН.
Нередко на фоне проявлений основного заболевания отмечают кардиалгию (чаще в области верхушки сердца (92%), реже за грудиной (15%)), расширение границ сердца, приглушенность тонов, небольшой систолический шум на верхушке сердца, нарушения ритма (в основном экстрасистолическую аритмию).
Диагностика
ЭКГ является ведущим методом в распознавании дистрофических изменений в миокарде, которые касаются в основном процесса реполяризации и проявляются чаще всего изменениями конечной части желудочкового комплекса: отмечается депрессия сегмента ST, которая имеет восходящий характер к положительному зубцу Т. Зубец Т также может быть деформированным, низкоамплитудным, сглаженным или отрицательным.
Зубец Т также может быть деформированным, низкоамплитудным, сглаженным или отрицательным.
Также может определяться снижение вольтажа комплекса QRS, особенно выраженное при ожирении и микседеме, при тиреотоксикозе амплитуда зубцов чаще увеличена. В некоторых случаях могут возникать замедление внутрипредсердной проводимости, увеличение интервала Q–T, нарушения внутрижелудочковой проводимости. Из нарушений ритма наиболее часто отмечают синусовую тахикардию и экстрасистолическую аритмию.
При формулировке диагноза следует прежде всего указать основное заболевание или этиологический фактор, характер течения кардиомиопатии и основные клинические проявления (наличие нарушений ритма и проводимости, стадию СН).
В дифференциальной диагностике метаболической кардиомиопатии могут иметь значение нагрузочные и медикаментозные пробы, в случае необходимости — проведение коронарографии.
Лечение
Независимо от повреждающего фактора принципиальными для метаболической кардиомиопатии могут быть следующие положения:
- нарушения метаболизма миокарда при своевременном лечении обратимы;
- выраженная СН развивается сравнительно редко, в основном в конечной стадии заболевания, но возникшая СН резистентна к сердечным гликозидам и успех терапии целиком зависит от степени восстановления нарушенного обмена веществ в миокарде.

Помощь больным следует начинать с устранения причины развития дистрофии миокарда. Немаловажное значение имеет отказ от курения и злоупотребления алкоголем, исключение физического и психоэмоционального перенапряжения.
Наряду с лечением основного заболевания необходимо восстановление адекватного энергетического обмена. На первый план выступает применение комплекса лекарственных средств, направленных на улучшение транспорта кислорода в ткани и его утилизации.
На обмен веществ в клетке могут оказывать влияние две группы лекарственных средств: регуляторы экстрацеллюлярной природы (гормональные препараты, блокаторы и стимуляторы центральной и периферической нервной системы) и регуляторы метаболизма интрацеллюлярной природы (ферменты и антиферменты, витамины, кофакторы, разнообразные метаболиты), оказывающие действие на различные пути обмена веществ.
При нарушении процессов окислительного фосфорилирования применяют комплекс витаминов, включающий витамины В1, В2, пантотеновую и липоевую кислоты.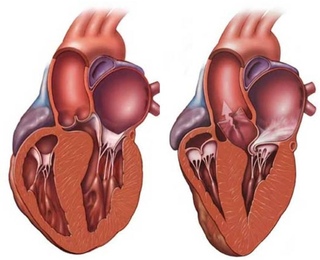 Витамины группы В влияют на белковый, липидный, углеводно-энергетический обмен, синтез аминокислот, нуклеотидов.
Витамины группы В влияют на белковый, липидный, углеводно-энергетический обмен, синтез аминокислот, нуклеотидов.
Среди препаратов с антиоксидантными свойствами широко применяют токоферола ацетат, его сочетание с витамином РР (никотиновой кислотой) способствует улучшению энергетического обеспечения сократительной функции миокарда. Активным антиоксидантом, который участвует в окислительно-восстановительных процессах, является витамин С.
Большое значение для нормализации метаболизма миокарда имеет достаточное поступление в организм незаменимых аминокислот; в том числе метионина, лейцина, аланина, валина, лизина, трионина, триптофана, являющихся пластическим материалом для синтеза белка, ферментов, коферментов. Для улучшения их усвоения рекомендуется назначать их в комплексе с анаболическими стероидами (метандиенон, нандролон).
При прогрессировании дистрофического процесса показано применение внутрь калия хлорида, калия и магния аспарагината для устранения закономерного дефицита внутриклеточного калия, нарушения баланса кальция и магния, что приводит к восстановлению регуляции возбудимости и проводимости миокарда, его автоматизма и сократимости.
Для активации синтеза белков и нуклеиновых кислот применяют соли оротовой кислоты (оротат калия/магния).
Проводимая терапия должна быть направлена на повышение генерации энергии и повышение устойчивости миокарда к гипоксии. В последнее время большое внимание уделяют роли серотонинергической системы в регуляции стрессорной реакции. Специфической особенностью никотинамида является его способность стимулировать процессы аэробного окисления и обмен гликогена, тем самым повышая устойчивость кардиомиоцитов к гипоксии.
Прямое цито- и мембранопротекторное действие на кардиомиоциты в условиях гипоксических состояний оказывает триметазидин.
Продолжительность интенсивной метаболической терапии на ранних стадиях у больных с преимущественно функциональными нарушениями составляет 2–3 нед. При прогрессировании дистрофии миокарда и выявлении органического поражения сердца курс терапии следует повторять несколько раз в год.
ПОРАЖЕНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ ПРИ ЭНДОКРИННЫХ НАРУШЕНИЯХ
Сердечно-сосудистая система часто вовлекается в патологический процесс при заболеваниях желез внутренней секреции. Функциональные изменения сердца могут превалировать в клинической картине, и пациент с эндокринным заболеванием становится фактически «кардиальным» больным. Поражение сердца при эндокринных заболеваниях в основном обусловлено обменными нарушениями, вызванными недостатком или избытком того или иного гормона в организме.
Функциональные изменения сердца могут превалировать в клинической картине, и пациент с эндокринным заболеванием становится фактически «кардиальным» больным. Поражение сердца при эндокринных заболеваниях в основном обусловлено обменными нарушениями, вызванными недостатком или избытком того или иного гормона в организме.
ПОРАЖЕНИЕ СЕРДЦА ПРИ САХАРНОМ ДИАБЕТЕ
Термин «диабетическая кардиомиопатия» впервые предложен в 1954 г. для обозначения кардиальных изменений, предшествующих ИБС.
Патогенез
Патогенез метаболической кардиомиопатии при сахарном диабете многофакторный, поражение сердечно-сосудистой системы обусловлено сложными обменными нарушениями, возникающими в связи с абсолютной или относительной недостаточностью инсулина и нарушением толерантности к глюкозе.
Патогенез миокардиальных нарушений включает несколько основных механизмов: повреждение кардиомиоцитов, микроциркуляторные и нейровегетативные нарушения. Первый механизм связан с нарушением метаболизма кардиомиоцитов, снижением эффективности энергетических, пластических процессов и изменением ионного метаболизма, в результате чего снижаются компенсаторные возможности сердечно-сосудистой системы, нарушается сократительная функция миокарда, уменьшается толерантность к физическим нагрузкам. Второй механизм основывается на микроциркуляторных нарушениях в мелких артериях миокарда как локального проявления генерализованной микроангиопатии. Третий механизм включает поражение вегетативной нервной системы в результате формирования нейровегетодистрофии.
Второй механизм основывается на микроциркуляторных нарушениях в мелких артериях миокарда как локального проявления генерализованной микроангиопатии. Третий механизм включает поражение вегетативной нервной системы в результате формирования нейровегетодистрофии.
Кардиомиопатия, не обусловленная нарушением коронарного кровообращения, возникает у больных молодого возраста с ювенильным сахарным диабетом, для которых нехарактерно развитие выраженного атеросклероза, или у пациентов старшего возраста без сопутствующей ИБС.
Инсулин оказывает на сердце прямое действие, которое заключается в увеличении поступления и стимуляции окисления глюкозы и лактата, увеличении образования гликогена в миокарде. Непрямой эффект инсулина состоит в снижении содержания жирных кислот в плазме крови, уменьшении их поступления в сердце.
Дефицит инсулина вызывает нарушение утилизации тканями глюкозы и усиливает расщепление липидов и белков, также приводит к выраженным изменениям состава внутренней среды организма — гипергликемии, гиперкетонемии, гиперлипидемии с накоплением в крови жирных кислот, диспротеинемии, метаболическому ацидозу, оксидантный стресс вызывает апоптоз миоцитов. Эти нарушения являются определяющими факторами изменения структуры и функции миокарда.
Эти нарушения являются определяющими факторами изменения структуры и функции миокарда.
Патогенез и морфогенез диабетического поражения сердца обусловлены не только влиянием гиперинсулинемии на эндотелий сосудов, энергетические и метаболические процессы в миокарде, но и непосредственно связаны с токсико-метаболическим повреждением кардиомиоцитов.
Есть мнение, что причиной разрушения структур кардиомиоцитов, нарушения структуры сарколеммы и ее дериватов, изменения ионного равновесия и снижения активности актомиозинового комплекса кардиомиоцитов является прямая глюкозотоксичность.
В патогенезе кардиомиопатии важную роль играет тканевая гипоксия. Большое значение в развитии гипоксии имеет нарушение транспорта кислорода кровью, функции дыхательных ферментов под влиянием выраженного ацидоза. При сахарном диабете потребность тканей, в том числе миокарда, в кислороде повышена.
Важным фактором развития миокардиодистрофии является нарушение нейроэндокринной регуляции сердца, связанное с преобладанием эффектов контринсулярных гормонов. Доказано, что у пациентов происходит повышение продукции адренокортикотропного и соматотропного гормонов, а также глюкокортикоидов, катехоламинов и глюкагона, это приводит к инициации целой группы метаболических и ультраструктурных процессов, вызывающих развитие метаболической кардиомиопатии.
Доказано, что у пациентов происходит повышение продукции адренокортикотропного и соматотропного гормонов, а также глюкокортикоидов, катехоламинов и глюкагона, это приводит к инициации целой группы метаболических и ультраструктурных процессов, вызывающих развитие метаболической кардиомиопатии.
Патогенез увеличения жесткости миокарда связан с нарушением транспорта кальция, электромеханическим дисбалансом, сопровождающимся асинхронностью расслабления и механическими факторами.
Патологическая анатомия
Характерен фиброз миокарда, связанный с нарушением внутриклеточного метаболизма оксида азота и кальция, а также с пролиферативными процессами, обусловленными действием инсулина и ИФР. Морфологической основой дистрофии миокарда при сахарном диабете является микроангиопатия, характеризующаяся инфильтрацией тучными клетками и фибриноидным набуханием стенок мелких сосудов. При морфологическом исследовании выявляют развитие апоптозной дегенерации, потерю синаптических пузырьков, появление больших вакуолей в цитоплазме клеток симпатических ганглиев. При гистохимическом исследовании в стенках сосудов определяются отложения гликопротеинов. На ультраструктурном уровне определяется утолщение базальной мембраны сосудистой стенки. Важное значение придают дезорганизации мышечных волокон гипертрофированного миокарда.
При гистохимическом исследовании в стенках сосудов определяются отложения гликопротеинов. На ультраструктурном уровне определяется утолщение базальной мембраны сосудистой стенки. Важное значение придают дезорганизации мышечных волокон гипертрофированного миокарда.
Клиническая картина и диагностика
Больные с ювенильным сахарным диабетом изредка отмечают колющую боль в области сердца. Возникновение тахикардии покоя связано с поражением блуждающего нерва и относительным преобладанием тонуса симпатического отдела вегетативной нервной системы. Тахикардия сопровождается неэффективными сокращениями миокарда, что приводит к истощению энергоресурсов и в конечном счете к снижению сократительной функции миокарда и развитию СН.
Размеры сердца в пределах нормы. Некоторое приглушение тонов сердца и систолический шум на верхушке чаще отмечают у болеющих сахарным диабетом более 5 лет. В дальнейшем гипергликемия и инсулинорезистентность ассоциируются с увеличением массы ЛЖ и появлением симптомов СН.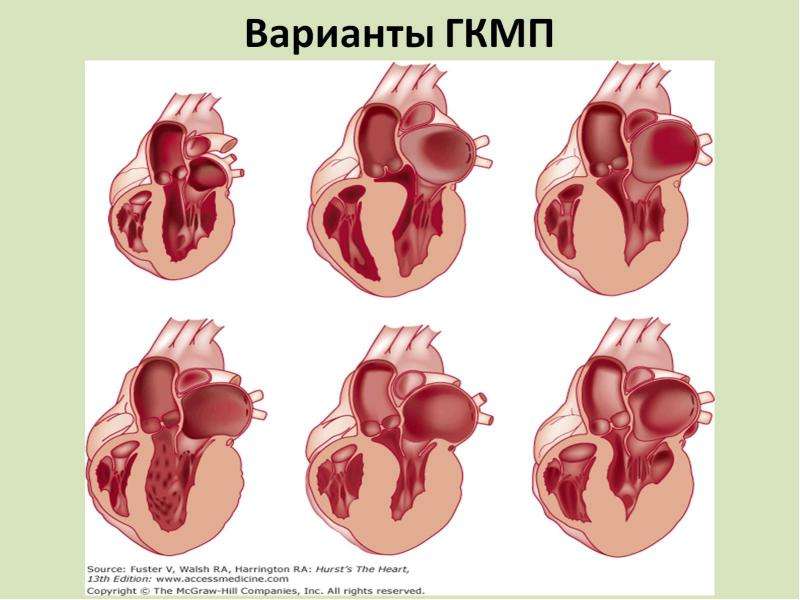
На ЭКГ отмечаются синусовая тахикардия или брадикардия, желудочковая экстрасистолическая аритмия, нарушения процессов реполяризации: смещение сегмента ST, изменение амплитуды, инверсия, уплощение, сглаженность или двухфазность зубца Т, нарушение внутрижелудочковой проводимости.
При эхоКГ-исследовании наиболее ранним признаком поражения миокарда при сахарном диабете является нарушение диастолической функции, которое отмечают у 27–69% бессимптомных больных.
При анализе крови уровень гликемии в плазме крови натощак >7,0 ммоль/л.
Лечение
Одной из основных задач лечения больных диабетической кардиомиопатией является профилактика дальнейшего прогрессирования поражения миокарда и развития СН. Важным является борьба с факторами риска: курением, ожирением, малоподвижным образом жизни, несбалансированным питанием. Рекомендации по оптимизации образа жизни должны содержать обоснование соответствующей низкокалорийной диеты для уменьшения массы тела, отказ от курения, регулярные физические нагрузки.
Важной задачей является нормализация обмена веществ, что включает достижение целевых уровней глюкозы, аглюкозурии, нормализации уровня гликированного гемоглобина. Регулярные физические нагрузки позволяют снизить резистентность к инсулину, повысить толерантность к глюкозе, способствуют утилизации глюкозы крови и свободных жирных кислот в мышцах, оказывают благоприятное влияние на функционирование сердечно-сосудистой системы.
Фармакотерапия сахарного диабета II типа направлена на усиление секреции инсулина, снижение инсулинорезистентности и представлена препаратами с различными механизмами действия: бигуаниды, производные сульфонилмочевины, глитазоны, глиниды, ингибиторы α-глюкозидазы, инсулин. Применение метформина позволяет улучшить контроль глюкозы крови у больных сахарным диабетом и способствует снижению общей смертности на 36%.
Для восстановления метаболических нарушений в миокарде назначают препараты α-липоевой кислоты, которая активирует ферменты митохондрий, увеличивает окисление глюкозы, замедляет глюконеогенез и кетогенез, как антиоксидант защищает клетки от повреждающего действия свободных радикалов. Также применяют препараты, способствующие коррекции нарушений обмена в миокарде: триметазидин, триметилгидразиния пропионат.
Также применяют препараты, способствующие коррекции нарушений обмена в миокарде: триметазидин, триметилгидразиния пропионат.
ТИРЕОТОКСИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Патогенез
Нарушение функции сердечно-сосудистой системы — появление «тиреотоксического сердца» является частым осложнением тиреотоксикоза. Изменения сердечно-сосудистой системы при тиреотоксикозе («тиреотоксическое сердце») обусловлены воздействием избыточного количества тиреоидных гормонов (L-тироксина и 3,5,3-трийод-L-тиронина) на обменные процессы в миокарде, гемодинамику и симпатическую нервную систему. Одним из важных эффектов тиреоидных гормонов является разобщение окислительного фосфорилирования, что приводит к снижению в сердечной мышце содержания АТФ и креатинфосфата. В результате происходит угнетение анаболических процессов: снижается синтез и усиливается распад гликогена и белка, снижается содержание калия в эритроцитах и других клетках. Потребление кислорода миокардом увеличивается, однако эффективность его утилизации в процессе биологического окисления снижается. При избытке тироксина нарушается проницаемость митохондриальных мембран.
При избытке тироксина нарушается проницаемость митохондриальных мембран.
Под влиянием тиреоидных гормонов происходит усиление сократительной функции миокарда, вероятно, вследствие активизации стимулирующего влияния на сердце и прямого действия тироксина на сердечную мышцу. Вследствие нарушений энергетических процессов и изменения калий-натриевого насоса происходит ускорение спонтанной деполяризации в клетках синусного узла, что обусловливает более частое образование в нем импульсов. Избыток тиреоидных гормонов изменяет симпатические и парасимпатические влияния на миокард. При высокой степени тиреотоксикоза в результате резкого снижения эффективности биологического окисления, преобладания распада белка над его синтезом снижается уровень энергетических ресурсов и пластических процессов, что приводит в конечном итоге к угнетению сократительной функции миокарда.
Гемодинамика
В основе гиперфункции сердца при тиреотоксикозе лежит повышение сократительной способности миокарда, что обусловлено как повышением активности симпатической нервной системы, так и непосредственным действием тиреоидных гормонов на миокард. При тиреотоксикозе происходят резкие изменения гемодинамики: увеличивается МОК (в основном за счет повышения ЧСС), скорость кровотока и ОЦК. Периферическое сосудистое сопротивление в большом круге кровообращения снижается, а в малом повышается. В результате повышается пульсовое давление. Сердце испытывает диастолическую перегрузку, а правые отделы сердца еще и систолическую перегрузку, увеличенная работа сердца происходит в крайне неблагоприятном для него режиме: вследствие изменений гемодинамики ЛЖ работает в условиях постоянной изотонической гиперфункции, а правый — в условиях смешанного типа гиперфункции (нагрузка объемом и сопротивлением), однако при этом отсутствуют условия для развития компенсаторной гипертрофии миокарда (усилен распад и снижен синтез белка, уменьшено количество АТФ и креатинфосфата). Все это достаточно быстро приводит к развитию СН.
При тиреотоксикозе происходят резкие изменения гемодинамики: увеличивается МОК (в основном за счет повышения ЧСС), скорость кровотока и ОЦК. Периферическое сосудистое сопротивление в большом круге кровообращения снижается, а в малом повышается. В результате повышается пульсовое давление. Сердце испытывает диастолическую перегрузку, а правые отделы сердца еще и систолическую перегрузку, увеличенная работа сердца происходит в крайне неблагоприятном для него режиме: вследствие изменений гемодинамики ЛЖ работает в условиях постоянной изотонической гиперфункции, а правый — в условиях смешанного типа гиперфункции (нагрузка объемом и сопротивлением), однако при этом отсутствуют условия для развития компенсаторной гипертрофии миокарда (усилен распад и снижен синтез белка, уменьшено количество АТФ и креатинфосфата). Все это достаточно быстро приводит к развитию СН.
Патологическая анатомия
Гистологические изменения миокарда при тиреотоксикозе характеризуются воспалением и дегенерацией вплоть до развития очагов некроза и фиброза. Гистологические изменения в миокарде непостоянны и неспецифичны. Факторы, обусловливающие поражение сердечно-сосудистой системы у больных с диффузным токсическим зобом, вначале вызывают дистрофические изменения, а в дальнейшем дегенеративно-склеротические. При тяжелом течении заболевания возникают дегенеративные изменения в митохондриях и их распад.
Гистологические изменения в миокарде непостоянны и неспецифичны. Факторы, обусловливающие поражение сердечно-сосудистой системы у больных с диффузным токсическим зобом, вначале вызывают дистрофические изменения, а в дальнейшем дегенеративно-склеротические. При тяжелом течении заболевания возникают дегенеративные изменения в митохондриях и их распад.
Клиническая картина и диагностика
Больные нередко жалуются на боль в области сердца, часто ноющего, колющего, нередко стенокардитического характера, а также на сердцебиение, которое возникает в состоянии покоя, но при физических нагрузках неадекватно усиливается. Больные отмечают повышенную возбудимость, потливость, мышечную слабость, тремор рук, похудение. Существенным симптомом является постоянная синусовая тахикардия, выраженность которой соответствует тяжести токсического зоба. У 10–20% больных диагностируется тахисистолическая форма фибрилляции предсердий. Характерно повышение САД, что обусловлено увеличением сердечного выброса. Одышка отмечается как при нагрузках, так и в покое. СН, в основном правожелудочковую, отмечают в 15–25% случаев. Признаки левожелудочковой недостаточности обычно выражены меньше, поскольку очень быстро возникает слабость ПЖ.
Одышка отмечается как при нагрузках, так и в покое. СН, в основном правожелудочковую, отмечают в 15–25% случаев. Признаки левожелудочковой недостаточности обычно выражены меньше, поскольку очень быстро возникает слабость ПЖ.
При осмотре отмечается прекардиальная пульсация и пульсация артерий. Аускультативно определяется повышение звучности сердечных тонов, особенно первого, почти всегда выслушивается систолический шум на верхушке сердца и ЛА.
На ЭКГ, кроме синусовой тахикардии или фибрилляции предсердий, отмечается повышение амплитуды зубца Р, иногда изменения комплекса QRS, снижение сегмента ST и вольтажа зубца Т.
При эхоКГ-исследовании на ранней стадии заболевания выявляют умеренную гипертрофию — утолщение задней стенки, межжелудочковой перегородки и увеличение сократительной функции ЛЖ. В дальнейшем развивается дилатация полостей сердца, увеличивается масса миокарда, уменьшается систолический и минутный объем крови, снижается сократительная функция миокарда.
В сыворотке крови определяется повышение уровней общего и свободного тироксина, трийодтиронина, снижение уровня тиреотропного гормона.
Лечение
Проводится по трем направлениям: нормализация функции щитовидной железы (достижение эутиреоидного состояния), устранение недостаточности кровообращения и восстановление синусового ритма (при фибрилляции предсердий).
Компенсация тиреотоксикоза достигается применением антитиреоидных препаратов или проведением хирургической операции или радиойодтерапии.
Для уменьшения синусовой тахикардии нецелесообразно применять сердечные гликозиды, широко назначают блокаторы β-адренорецепторов. При тахисистолической форме фибрилляции предсердий проводят комбинированное лечение антиаритмическими средствами (пропафенон) и блокаторами β-адренорецепторов, добиваясь восстановления синусового ритма или перевода фибрилляции предсердий в нормосистолическую форму.
Лечение СН не имеет специфических особенностей и обязательно должно проводиться на фоне антитиреоидной терапии. Следует учитывать, что чувствительность миокарда к гликозидам наперстянки может быть повышена.
КЛИМАКТЕРИЧЕСКАЯ (ДИСГОРМОНАЛЬНАЯ) КАРДИОМИОПАТИЯ
Эпидемиология
Изменение демографической структуры общества привело к увеличению в популяции доли женщин старшей возрастной группы (в настоящее время в мире около 500 млн женщин старше 50 лет, то есть в менопаузе).
О существовании связи между расстройством деятельности сердца и изменением функции женских половых органов известно давно. Заболевание может развиваться вследствие дефицита эстрогенов не только в климактерический период, но и у женщин молодого возраста с различными гинекологическими заболеваниями (миома матки, эндометриоз и др.), при посткастрационном и предменструальном синдромах. Климактерическая кардиомиопатия диагностируется иногда и у мужчин (климакс отмечают у 10–20% лиц мужского пола).
Патогенез
Менопауза, не являясь собственно заболеванием, приводит к нарушению эндокринного равновесия в организме и способствует развитию сердечно-сосудистых заболеваний.
В патогенезе обменных нарушений основное значение имеет нарушение активности эстрогенов, в норме благоприятно влияющих на белковый и электролитный обмен в миокарде и регулирующих симпатические влияния на сердце. При патологическом климаксе в миокарде происходят метаболические нарушения, приводящие к дистрофическим изменениям, в большинстве случаев носящим обратимый характер и лишь в некоторых случаях заканчивающимся развитием миокардиофиброза (кардиосклероза) (схема 8.2). Увеличение количества абдоминального жира и развитие абдоминального ожирения связано как с физиологическими изменениями, так и с изменениями образа жизни. Среди причин абдоминального ожирения после менопаузы можно выделить изменение баланса энергии — снижение скорости обменных процессов наряду с повышением аппетита и увеличением поступления энергии с пищей на фоне повышения тонуса симпатической нервной системы, усиления глюкокортикоидной стимуляции и падения уровня гормона роста. В основе патогенеза климактерической АГ лежит гипоэстрогения, которая сопровождается повышением возбудимости гипоталамо-гипофизарных структур, нарушением центральной и периферической регуляции сосудистого тонуса. Одним из механизмов является отсутствие в период менопаузы депрессорного эффекта фолликулярного гормона.
При патологическом климаксе в миокарде происходят метаболические нарушения, приводящие к дистрофическим изменениям, в большинстве случаев носящим обратимый характер и лишь в некоторых случаях заканчивающимся развитием миокардиофиброза (кардиосклероза) (схема 8.2). Увеличение количества абдоминального жира и развитие абдоминального ожирения связано как с физиологическими изменениями, так и с изменениями образа жизни. Среди причин абдоминального ожирения после менопаузы можно выделить изменение баланса энергии — снижение скорости обменных процессов наряду с повышением аппетита и увеличением поступления энергии с пищей на фоне повышения тонуса симпатической нервной системы, усиления глюкокортикоидной стимуляции и падения уровня гормона роста. В основе патогенеза климактерической АГ лежит гипоэстрогения, которая сопровождается повышением возбудимости гипоталамо-гипофизарных структур, нарушением центральной и периферической регуляции сосудистого тонуса. Одним из механизмов является отсутствие в период менопаузы депрессорного эффекта фолликулярного гормона.
Клиническая картина
Наиболее распространенными являются жалобы на продолжительную, почти постоянную боль в области сердца разнообразного характера, локализующуюся слева от грудины, в области верхушки. Боль не провоцируется физическим напряжением. Кардиалгия не прекращается после приема нитроглицерина. Характерно сердцебиение при нормальном пульсе, не связанное с физической нагрузкой, нередко появляется в покое.
Больные часто жалуются на ощущение неудовлетворенности вдохом, невозможность вдохнуть полной грудью, которое не связано с физическими нагрузками и часто возникает в покое.
Типичны нарушения функции вегетативной нервной системы: гиперемия или побледнение кожи, потливость, приливы крови, сердцебиение, онемение конечностей, озноб, нарушение ритма дыхания, полиурия, головокружение, нарушение терморегуляции.
Большое количество жалоб обусловлено изменениями психического состояния: эмоциональная лабильность, раздражительность, плаксивость, повышенная возбудимость, нередко подавленное настроение, страхи, ухудшение памяти. Усугубление симптомов связано с нагрузками, особенно эмоциональными.
Усугубление симптомов связано с нагрузками, особенно эмоциональными.
При патологическом климаксе нередко возникает симптоматическая АГ. Впоследствии, после исчезновения приливов крови и других проявлений климактерического синдрома, невротическое состояние может стать причиной развития гипертонической болезни.
У большинства мужчин с климактерической кардиомиопатией отмечают те или иные симптомы патологического климакса со стороны мочеполовой системы: отсутствие или снижение (редко повышение) либидо, снижение потенции. Больные часто жалуются на расстройства мочеиспускания, что обычно связано с доброкачественной гиперплазией предстательной железы.
Вазомоторный синдром проявляется в виде приливов крови, то есть внезапно возникающего ощущения жара в верхней половине туловища, коже лица, шеи, которое сменяется последовательно гиперемией и потоотделением. Наряду с приливами крови в отдельных областях тела периодически появляются парестезии: ощущение онемения, покалывания, ползания мурашек.
Климактерическая кардиомиопатия может возникнуть остро или развиваться постепенно. Характерно несоответствие между интенсивностью и длительностью болевого синдрома и удовлетворительным состоянием кровообращения.
При объективном обследовании характерно несоответствие между обилием жалоб и отсутствием клинических признаков коронарной или СН.
Диагностика
На ЭКГ самыми частыми изменениями являются снижение сегмента ST и/или инверсия зубца Т, которые в основном регистрируют в правых и средних грудных отведениях (V1–4). Зубец Т может длительное время быть отрицательным, затем положительным, а через несколько дней вновь отрицательным без какой-либо связи с клинической картиной болезни, на фоне удовлетворительного состояния больного. Изменения на ЭКГ не соответствуют клиническим проявлениям, физические нагрузки практически не влияют на конфигурацию зубцов. Часто возникают синусовая аритмия, предсердная и желудочковая экстрасистолия, пароксизмальная суправентрикулярная тахикардия. Изредка регистрируют нарушения предсердно-желудочковой и внутрижелудочковой проводимости.
Изредка регистрируют нарушения предсердно-желудочковой и внутрижелудочковой проводимости.
На ранних стадиях климактерическая кардиомиопатия протекает чаще изолированно и характеризуется типичной клинической картиной заболевания. В более поздние периоды клиническая картина зависит от присоединения ИБС, воспалительных процессов в миокарде и других болезней, что несомненно отягощает течение кардиомиопатии и ухудшает прогноз.
Лечение
Должно быть направлено на устранение всех симптомов заболевания. Важное значение имеет модификация образа жизни, включающая повышение физической активности и соблюдение диеты с ограничением потребления насыщенных жиров и увеличением в рационе доли моно- и полиненасыщенных жиров и грубой клетчатки. Для нормализации деятельности нервной системы обычно назначают седативные препараты, транквилизаторы, иногда антидепрессанты.
Для лечения АГ в постменопаузе наиболее целесообразно назначение ингибиторов АПФ и диуретиков, которые должны быть нейтральными в отношении показателей углеводного и липидного обмена. Женщинам в постменопаузе должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
Женщинам в постменопаузе должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
Назначение заместительной гормонотерапии является патогенетически обоснованным в лечении больных с климактерической кардиомиопатией. Применяют препараты, содержащие эстрогены и гестагены. Половые гормоны подавляют повышенную активность гипоталамо-гипофизарных структур мозга и опосредованно влияют на сердце, нормализуя влияние вегетативной нервной системы. Не исключено, что половые гормоны ослабляют повышенную активность САС и тем самым нормализуют метаболические процессы в миокарде. Эстрогены оказывают непосредственное сосудорасширяющее действие на коронарные сосуды, а также нормализуют электролитный и белковый обмен в миокарде. Дозы и общая продолжительность лечения зависят от исходного гормонального фона и уровня эстрогенов, лечение следует проводить под наблюдением эндокринолога. Необходимо отметить, что климактерическая кардиомиопатия является самоизлечивающимся заболеванием, при котором гормоны оказывают лишь вспомогательное заместительное действие, гормональную терапию следует назначать на длительный срок. Лечение гормонами устраняет тягостные проявления климактерического синдрома и после окончания возрастной перестройки эндокринной системы заболевание исчезает.
Лечение гормонами устраняет тягостные проявления климактерического синдрома и после окончания возрастной перестройки эндокринной системы заболевание исчезает.
Прогноз
Как правило, благоприятный. Снижение трудоспособности в большинстве случаев носит временный характер. Полное выключение больных из привычной трудовой обстановки, как правило, играет отрицательную роль, приводит к излишней концентрации внимания на тягостных ощущениях со стороны сердца.
ПОРАЖЕНИЯ СЕРДЦА ПРИ НАРУШЕНИИ ОБМЕНА ВЕЩЕСТВ
Нарушения обмена веществ в организме всегда отражаются на течении метаболических процессов в миокарде, нередко вызывая нарушение его функции и структуры. При различных заболеваниях первоначально могут нарушаться один или несколько путей метаболизма, что в дальнейшем обязательно отражается на энергообеспечении сердечной мышцы. При некоторых нарушениях обмена в межуточной ткани миокарда и в коронарных сосудах откладываются патологические продукты нарушенного метаболизма белков, углеводов, минералов или накапливаются избыточные компоненты нормального обмена. К таким заболеваниям относят амилоидоз, гликогеноз, гемохроматоз и др.
К таким заболеваниям относят амилоидоз, гликогеноз, гемохроматоз и др.
НАРУШЕНИЯ БЕЛКОВОГО ОБМЕНА. АМИЛОИДОЗ
Определение
Амилоидоз — системное заболевание неустановленной этиологии, характеризующееся внеклеточным отложением в органах и тканях (главным образом в медии артерий, периваскулярной соединительной и нервной ткани, в ретикулоэндотелиальной системе, а также миокарде, почках, печени, коже) особого белка β-фибриллярной структуры — амилоида.
Этиология и патогенез
Амилоидоз является следствием нарушения белкового обмена и может быть приобретенным или наследственным. Наследственный амилоидоз является аутосомным доминантным заболеванием. Ряд авторов связывают развитие заболевания с изменением свойств белков тканей вследствие аутоиммунных процессов под влиянием комплекса антиген — антитело. Диспротеинемия с накоплением в плазме крови грубодисперсных фракций белка и аномальных белков (парапротеинов) ведет к выходу последних из сосудов ткани с образованием амилоидных субстанций.
В последние годы стала возможной более точная биохимическая идентификация белков, входящих в состав амилоидных фибрилл, на основании чего выделены типы амилоида, определена связь отдельных типов с клиническими формами амилоидоза, изучены белки-предшественники, предположительно участвующие в синтезе белков.
Выделяют четыре типа амилоидоза: первичный (системный), вторичный, семейный (наследственный) и сенильный (старческий).
Наиболее распространен первичный тип (85%) с преимущественным поражением сердца, при котором амилоид образован легкими цепями молекул k и λ иммуноглобулина (AL-тип), часто ассоциирован с миеломной болезнью, более часто отмечают у мужчин и редко в возрасте младше 30 лет.
Вторичный амилоидоз возникает в результате образования неиммуноглобулиновых белков, миофибриллы содержат амилоидный протеин А, не относящийся к иммуноглобулинам (АА-тип), что часто происходит при хронических воспалительных заболеваниях — ревматоидном артрите, туберкулезе, болезни Крона и при семейной средиземноморской лихорадке.
Семейный или наследственный амилоидоз чаще всего является следствием образования мутантного белка преальбумина (транстиретина). Установлен аутосомно-доминантный тип наследования. Выявлены гены, ответственные за синтез этих белков, и идентифицирован характер генных мутаций.
Сенильный кардиальный амилоидоз, также известный как амилоид SSA, возникает вследствие образования патологического транстиретина у лиц старшего возраста. Выделяют две формы связанного с возрастом амилоидоза — амилоидоз предсердий, который охватывает только предсердия, и старческий аортальный амилоидоз, ограниченный аортой.
Патологическая анатомия
Миокард при амилоидозе сердца очень плотный на ощупь, утолщенный, мало поддается растяжению. Объем полостей сердца существенно не изменен или незначительно увеличен. Амилоид откладывается в разных отделах сердца, преимущественно в миокарде предсердий и желудочков, эндокарде, в клапанах, перикарде, нередко в синусном и AV-узлах, а также в мелких артериальных и венозных сосудах, включая vasa vasorum коронарных артерий, суживая их просвет вплоть до полной обтурации. В результате мышечные волокна сердца оказываются «замурованными» в массах амилоида, что приводит к атрофии сократительного миокарда.
В результате мышечные волокна сердца оказываются «замурованными» в массах амилоида, что приводит к атрофии сократительного миокарда.
Клиническая картина
Амилоидное поражение сердца не имеет специфических симптомов, развивается постепенно и может длительное время протекать бессимптомно, даже при выявлении отложений амилоида в миокарде при биопсии. Следует обратить внимание, что во время появления симптомов существует весьма значительная инфильтрация сердца амилоидом. У некоторых пациентов возникает боль в области сердца, иногда носящая стенокардический характер как следствие накопления депозитов амилоида в коронарных артериях.
В 10–15% случаев отмечается ортостатическая гипотензия, иногда с симптомами синкопальных состояний.
При аускультации на фоне глухих тонов сердца можно выслушать систолический шум митральной регургитации, при развитии СН — протодиастолический ритм галопа.
Часто определяют различные нарушения ритма, которые нередко могут быть причиной внезапной смерти. У некоторых больных отмечается выраженная брадикардия.
У некоторых больных отмечается выраженная брадикардия.
СН выявляют у 45–56% больных. Вначале доминирует правожелудочковая СН с повышенным давлением в яремных венах, гепатомегалией, периферическими отеками, асцитом. Затем возникает систолическая дисфункция и застойная СН.
Диагностика
Изменения на ЭКГ неспецифичны, наиболее типично наличие брадикардии, снижение амплитуды зубцов. Иногда наличие патологического зубца Q и отсутствие зубца R в отведениях V1–3 симулируют ИМ. Накопление депозитов амилоида в проводящей системе могут обусловливать различные расстройства образования импульса и проведения — возможны различные нарушения проводимости, включая полную блокаду сердца: часто выявляются предсердные и желудочковые нарушения ритма (синдром слабости синусного узла, фибрилляция предсердий (у 30% больных), желудочковая экстрасистолическая аритмия).
Двухмерная эхоКГ и допплерография являются основными методами неинвазивной диагностики. При обследовании выявляют нормальные или уменьшенные размеры полости ЛЖ со значительным утолщением миокарда и характерным нарушением его структуры с диффузным гранулярным блеском (рис. 8.1а, б). Отмечается также утолщение межпредсердной перегородки и створок клапанов, увеличение предсердий, наличие небольшого или умеренного перикардиального выпота. Нарушение диастолической функции ЛЖ и ПЖ происходит по рестриктивному типу нарушения их наполнения. В тяжелых случаях выявляются признаки различной степени нарушения систолической функции обоих желудочков.
8.1а, б). Отмечается также утолщение межпредсердной перегородки и створок клапанов, увеличение предсердий, наличие небольшого или умеренного перикардиального выпота. Нарушение диастолической функции ЛЖ и ПЖ происходит по рестриктивному типу нарушения их наполнения. В тяжелых случаях выявляются признаки различной степени нарушения систолической функции обоих желудочков.
При рентгеноскопии отмечают уменьшение пульсации контура сердца, размеры сердца увеличены (кардиомегалия) и обычно не соответствуют степени тяжести застойной СН.
К достижениям последних лет относится введение в клиническую практику метода сцинтиграфии с меченным 123I сывороточным Р-компонентом (SАР) для оценки распределения амилоида в организме. Р-компонент содержится в небольшом количестве (5–10%) в амилоиде всех типов; радиоактивный SАР, введенный больному амилоидозом, специфически связывается с амилоидными депозитами и может быть визуализирован и количественно оценен на серии сцинтиграмм. Метод особенно полезен для контроля за динамикой тканевых отложений амилоида в процессе лечения.
Метод особенно полезен для контроля за динамикой тканевых отложений амилоида в процессе лечения.
Для диагностики также используют сцинтиграфию с изотопом технеция 99mТс-пирофосфатом, способным связываться с амилоидом многих типов, однако эта проба оказывается положительной только при значительных отложениях амилоида в сердце, которые можно определить и с помощью эхоКГ.
МРТ используется для идентификации утолщения миокарда и небольшого размера полости ЛЖ при амилоидозе, что сопоставимо с данными эхоКГ.
Диагноз «амилоидоз» должен быть подтвержден эндомиокардиальной биопсией. При изучении биоптатов тканей важно не только выявить амилоид, но и провести иммуногистохимическое исследование для идентификации его типа.
Диагноз «амилоидоз сердца» чаще устанавливают при аутопсии, поскольку при жизни в ряде случаев не выявляют объективных причин, которыми можно было бы объяснить возникновение патологических признаков.
Лечение
Терапия при первичном амилоидозе включает клеточную антиплазменную терапию, которая останавливает продукцию легких цепей, а также применение алкилирующих средств (мелфалан) и преднизолона. Благоприятный эффект химиотерапии показан в двух рандомизированных испытаниях. Перспективна трансплантация стволовых клеток с органной ремиссией в 50% случаев. Другим подходом к лечению амилоидоза сердца может быть применение талидомида с дексаметазоном. Недавно показана эффективность леналидомида.
Благоприятный эффект химиотерапии показан в двух рандомизированных испытаниях. Перспективна трансплантация стволовых клеток с органной ремиссией в 50% случаев. Другим подходом к лечению амилоидоза сердца может быть применение талидомида с дексаметазоном. Недавно показана эффективность леналидомида.
Для лечения пациентов с нарушениями ритма сердца назначают антиаритмические препараты. При явлениях полной поперечной блокады и слабости синусного узла эффективна имплантация искусственного водителя ритма. Кардиостимуляторы применяют для лечения пациентов с тяжелыми клинически выраженными нарушениями проводимости.
СН часто рефрактерна к медикаментозной терапии. Для уменьшения недостаточности кровообращения основными препаратами являются диуретики, которые применяют с осторожностью в низких дозах, и вазодилататоры — ингибиторы АПФ или блокаторы рецепторов ангиотензина II, хотя они плохо переносятся и могут вызвать значительную артериальную гипотензию или ортостатические симптомы, особенно у пациентов с амилоид-индуцированной дисфункцией автономной нервной системы. Не рекомендуется применять дигоксин из-за его токсичности и опасности развития аритмий, однако при тщательном ЭКГ-мониторировании его можно применять для контроля ритма у пациентов с фибрилляцией предсердий.
Не рекомендуется применять дигоксин из-за его токсичности и опасности развития аритмий, однако при тщательном ЭКГ-мониторировании его можно применять для контроля ритма у пациентов с фибрилляцией предсердий.
Блокаторы кальциевых каналов неэффективны в лечении при амилоидозе сердца. Больные могут быть гиперчувствительны к негативным инотропным эффектам блокаторов кальциевых каналов, их применение может привести к нарастанию симптомов декомпенсации.
Блокаторы β-адренорецепторов могут спровоцировать угрожающие жизни нарушения проводимости.
При резком снижении сократительной способности предсердий, свидетельствующем о массивной инфильтрации, даже при синусовом ритме показано применение антиагрегантов или антикоагулянтов, что обусловлено повышенным риском тромбообразования.
Трансплантация сердца обычно не проводится, поскольку возникают рецидивы амилоидоза в аллотрансплантате, а также неуклонное прогрессирование его в других органах, что сокращает продолжительность жизни больных.
Прогноз
Течение амилоидоза прогрессирующее, прогноз неблагоприятный, хотя зависит от формы, сроков диагностики и степени вовлечения жизненно важных органов. Каждый из четырех основных типов амилоидной болезни имеет различные степени вовлечения сердца, клинические симптомы и прогноз. Выживаемость больных со старческим амилоидозом намного выше, чем с первичным амилоидозом, — в среднем соответственно 60,0 и 5,5 мес со времени установления диагноза. Летальный исход (приблизительно через 1,5–2,5 года после появления первых признаков поражения сердца) обычно наступает вследствие нарушений ритма и проводимости, а также внесердечных осложнений (легочной или системной эмболии). У больных с вовлечением проводящей системы нередко возникает внезапная смерть. Самая низкая выживаемость отмечена у больных с рефрактерной к терапии застойной СН (в среднем 6 мес), особенностью которой является преимущественно правосердечный или тотальный ее тип с резким набуханием шейных вен и значительным повышением венозного давления, застойным увеличением печени и полостными отеками (гидроторакс, гидроперикард, асцит).
НАРУШЕНИЯ ПРЕИМУЩЕСТВЕННО ЛИПИДНОГО ОБМЕНА
ГОЛОДАНИЕ И КАХЕКСИЯ
Патогенез
Голодание, длительное неполноценное питание, кахексия приводят к нарушениям деятельности сердца, которые сопровождаются уменьшением массы миокарда, обычно пропорционально меньшим, чем уменьшение массы тела вследствие атрофии мышечных волокон, дегенеративным изменениям в миокарде и к СН.
Патологическая анатомия
При голодании микроскопически отмечают вакуолизацию миофибрилл, особенно вокруг ядер, изменения хроматина ядер и митохондрий. В далеко зашедших случаях выявляют бурую атрофию и дистрофические изменения миокарда.
Клиническая картина и диагностика
Основными проявлениями нарушения функции сердечно-сосудистой системы при голодании являются синусовая брадикардия, уменьшение МОК, снижение венозного давления и АД (преимущественно систолического), что нередко сопровождается головокружением, а при быстром перемещении из горизонтального положения в вертикальное — обмороком.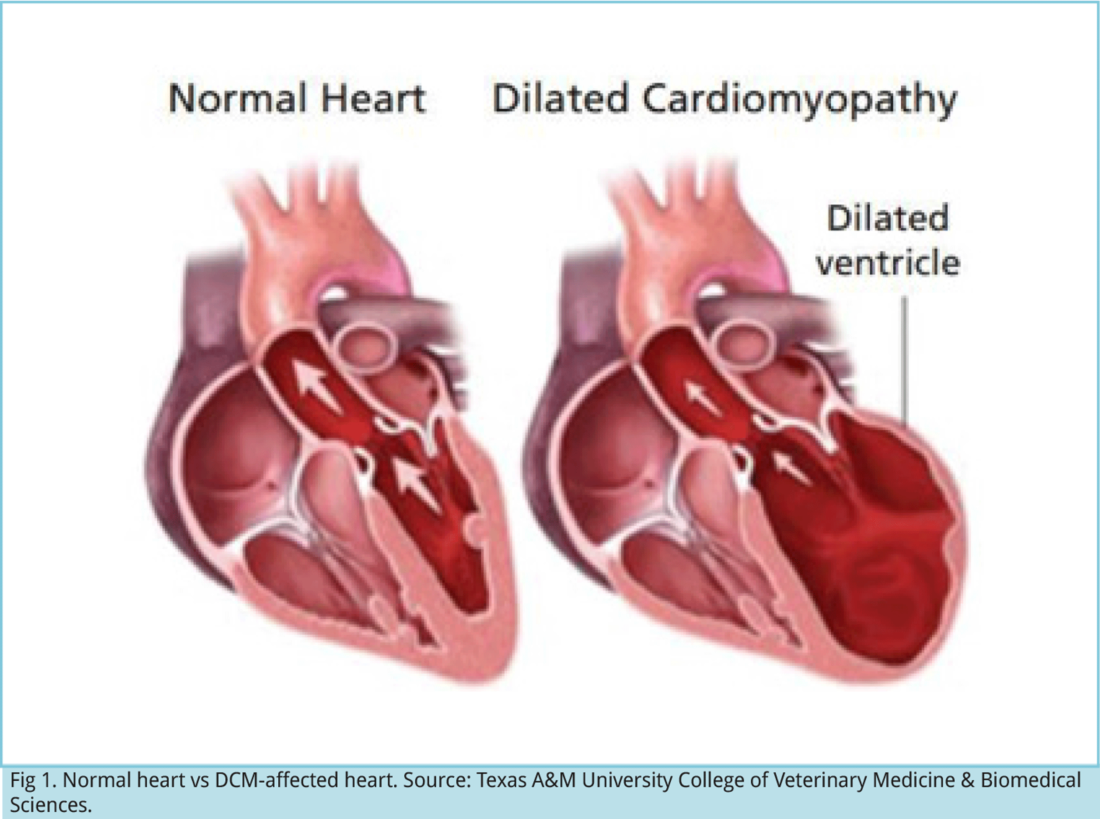 Часто возникают отеки, обусловленные гипопротеинемией и увеличением ОЦК (но не СН).
Часто возникают отеки, обусловленные гипопротеинемией и увеличением ОЦК (но не СН).
На ЭКГ отмечаются отклонение оси сердца вправо, синусовая брадикардия, низкий вольтаж зубцов, иногда изменения зубца Т и комплекса QRS, которые, по-видимому, обусловлены нарушением обмена энергии и электролитов в миокарде.
Лечение заключается в восстановлении полноценного питания.
ОЖИРЕНИЕ
Эпидемиология
Эпидемиологические исследования свидетельствуют, что ожирение связано с сердечно-сосудистыми заболеваниями и преждевременной смертностью. Ожирение само по себе приводит к комплексному и прогностически неблагоприятному поражению сердца. Вероятность развития ГЛЖ у лиц с нормальной массой тела составляет 5,5%, а у лиц с ожирением — 30%. По данным Фремингемского исследования установлено наличие высокодостоверной связи между ИМТ, полостными размерами и толщиной стенок ЛЖ.
По современным представлениям ожирение представляет собой независимый фактор риска развития СН, являясь ее причиной у 11% мужчин и 14% женщин в США.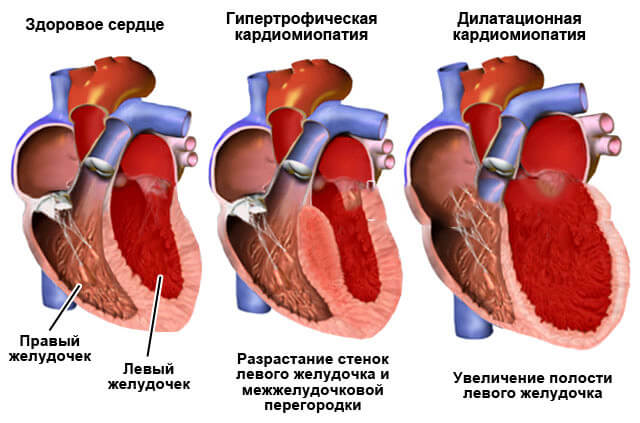 По данным Фремингемского исследования увеличение ИМТ на каждый 1 кг/м2 повышает риск развития СН на 5% у мужчин и на 7% у женщин независимо от других факторов риска.
По данным Фремингемского исследования увеличение ИМТ на каждый 1 кг/м2 повышает риск развития СН на 5% у мужчин и на 7% у женщин независимо от других факторов риска.
Этиология
Ожирение может быть самостоятельным заболеванием, возникающим вследствие избыточного потребления пищи с высокой калорийностью, или синдромом, сопровождающим различные заболевания, и развиваться вследствие ряда нейроэндокринных, социальных, поведенческих и генетических факторов. Генетические факторы играют важную роль в развитии ожирения. Результаты исследований свидетельствуют, что существует редко идентифицируемая группа генов, вызывающих значительное ожирение, однако чаще выявляют гены «восприимчивости», которые детерминируют склонность к ожирению и регулируют распределение жировой массы в организме, скорость обменных процессов и их реакцию на физическую активность и диету, контролируют пищевые привычки. Идентифицировано более 41 сайта в геноме, которые, возможно, связаны с развитием ожирения в популяции.
Патогенез
При ожирении происходит постепенное увеличение размеров клеток жировой ткани, ведущее к изменению их свойств. Гормонально-метаболические сдвиги, характерные для ожирения, могут напрямую воздействовать на структуру и массу миокарда. У пациентов с ожирением адипоциты жировой ткани высвобождают большое количество биологически активных субстанций, участвующих в регуляции сосудистого тонуса: ангиотензин II, интерлейкины, простагландины, эстрогены, ИФР, ФНО-α, ингибитор активатора плазминогена-1, лептин и другие, что повышает риск развития сердечно-сосудистых осложнений, при этом снижается уровень адипонектина, специфического циркулирующего белка жировой ткани, который вовлечен в регулирование метаболизма липидов и глюкозы (схема 8.3). Синтезируемый в жировой ткани лептин, важный маркер энергетического баланса, стимулирует гиперсимпатикотонию, способствует повышению уровня АКТГ, кортизола и альдостерона.
Ведущее значение в развитии различных форм ожирения имеют изменения функционирования гипоталамо-гипофизарной системы. Эндоканнабиноидная система, представленная в мозге (гипоталамусе) и периферически в жировой ткани (адипоцитах), печени, скелетных мышцах и пищеварительном тракте, посредством каннабиноидных рецепторов 1-го типа (СВ1) участвует в центральной и периферической регуляции энергетического баланса, а также метаболизме глюкозы и липидов, играет роль в контроле потребления пищи и массы тела. Гиперактивация этой системы ассоциирована с мотивацией к увеличенному потреблению пищи и ожирением и приводит к нарушению механизмов обратной связи, которые поддерживают устойчивый гомеостаз.
Эндоканнабиноидная система, представленная в мозге (гипоталамусе) и периферически в жировой ткани (адипоцитах), печени, скелетных мышцах и пищеварительном тракте, посредством каннабиноидных рецепторов 1-го типа (СВ1) участвует в центральной и периферической регуляции энергетического баланса, а также метаболизме глюкозы и липидов, играет роль в контроле потребления пищи и массы тела. Гиперактивация этой системы ассоциирована с мотивацией к увеличенному потреблению пищи и ожирением и приводит к нарушению механизмов обратной связи, которые поддерживают устойчивый гомеостаз.
Присоединение АГ при ожирении происходит примерно у 60% больных, механизмы ее формирования связывают с развитием гормонально-метаболических отклонений, вызванных накоплением жировой ткани. Ключевую роль среди них играет развитие инсулинорезистентности и компенсаторной гиперинсулинемии, которая, усиливая задержку натрия почками, способствует дальнейшему росту ОЦК. Гипертензивное действие может оказывать и лептин, стимулирующий симпатическую нервную систему. Ожирение, АГ, дислипидемию и гипергликемию, в основе которых лежит инсулинорезистентность, объединяют в понятие «метаболический синдром».
Ожирение, АГ, дислипидемию и гипергликемию, в основе которых лежит инсулинорезистентность, объединяют в понятие «метаболический синдром».
При высокой степени ожирения нельзя исключить определенную роль гипоксии в изменении нейроэндокринной регуляции кровообращения и в развитии дистрофии миокарда. Включение гипоксического фактора в патогенез дистрофических поражений сердца может стать существенным механизмом не только их возникновения, но и развития СН.
Гемодинамика
Сердце у больных ожирением испытывает перегрузку объемом. ОЦК и объем плазмы крови увеличиваются пропорционально степени увеличения массы тела, что приводит к увеличению наполнения ЛЖ и ударного объема, дилатации и росту массы ЛЖ. Считается, что нарастание сердечного выброса при ожирении физиологически связано с удовлетворением метаболических потребностей возросшей тканевой массы тела. Развитие сердечно-сосудистых осложнений при ожирении связано с истощением компенсаторных механизмов миокарда, обусловленным увеличением величины ОЦК, которая формируется пропорционально объему сосудистой сети периферических тканей. Нарастающее содержание жировой ткани в организме десинхронизирует физиологические взаимосвязи между сердцем и кровотоком периферических метаболически активных тканей.
Нарастающее содержание жировой ткани в организме десинхронизирует физиологические взаимосвязи между сердцем и кровотоком периферических метаболически активных тканей.
Сердечный выброс в состоянии покоя у больных с тяжелой степенью ожирения достигает 10 л/мин, причем на обеспечение кровотока в жировой ткани используется от ⅓ до ½ этого объема. Увеличенный объем крови в свою очередь увеличивает венозный возврат в ПЖ и ЛЖ, вызывая их дилатацию, увеличивая напряжение стенки. Это приводит к ГЛЖ, которая сопровождается снижением диастолической податливости камеры, приводя к повышению давления наполнения ЛЖ и его расширению.
Увеличение толщины миокарда снижает чрезмерное напряжение его волокон, что позволяет сохранить нормальную сократительную способность ЛЖ, одновременно создает предпосылки для диастолической дисфункции, в основе которой лежит относительное уменьшение количества капилляров на единицу объема мышечной ткани и ухудшение условий диффузии кислорода в гипертрофированных мышечных волокнах.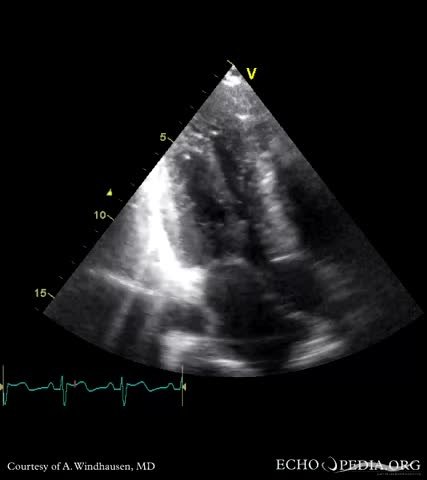 По мере прогрессирования дилатации ЛЖ увеличение напряжения стенки приводит к систолической дисфункции.
По мере прогрессирования дилатации ЛЖ увеличение напряжения стенки приводит к систолической дисфункции.
Патологическая анатомия
При ожирении отмечают увеличенное отложение жировой ткани под эпикардом обоих желудочков и в поверхностных слоях миокарда, что со временем приводит к атрофии мышечных волокон, замещению их жировой тканью (cor adiposum). Миокард на разрезе имеет желтоватый оттенок. Выявляют наличие диффузной мышечной гипертрофии, которая является наиболее характерным проявлением ожирения со стороны сердечно-сосудистой системы.
Клиническая картина
У взрослого ожирение устанавливают при ИМТ >30,0 кг/м2. Клинически выраженные расстройства кровообращения развиваются у больных с ИМТ >40,0 кг/м2.
Жалобы на боль в сердце ноющего, колющего характера, сердцебиение и перебои в работе сердца при физических нагрузках. По мере накопления избыточной массы тела постепенно развивается прогрессирующая одышка при нагрузках, возникает ортопноэ и пароксизмальная ночная одышка, появляются отеки нижних конечностей, возможно увеличение живота в объеме.
Во многих проспективных исследованиях установлено, что увеличение массы тела приводит к повышению АД. У больных с ожирением высок риск присоединения ИБС, течение которой особенно агрессивно и тяжело.
Сердце принимает «поперечное» положение из-за высокого стояния диафрагмы, смещаясь влево и несколько кзади. Аускультативно определяется выраженная глухость тонов. Пульс имеет склонность к учащению.
При крайних степенях ожирения иногда отмечают клинический синдром, проявляющийся сочетанием сонливости, альвеолярной гиповентиляции и легочной гипертензии с гипертрофией ПЖ — синдром Пиквика.
Диагностика
На ЭКГ обычно синусовая тахикардия, отклонение электрической оси сердца влево, снижение сегмента ST в I–II и V5–6 отведениях, уплощенный и отрицательный зубец Т. У некоторых больных регистрируется низкоамплитудный зубец РІІІ и глубокий QІІІ. Отмечаются признаки ГЛЖ.
При эхоКГ-исследовании выявляют гипертрофию и дилатацию ЛЖ, увеличение левого предсердия, диаметра восходящей аорты. С помощью допплеровской эхоКГ выявляют признаки диастолической дисфункции, может определяться аортальная регургитация. В последующем происходит нарушение и систолической функции. Возможно расслоение листков перикарда за счет отложения жира. Проведение эхоКГ-исследования часто затруднено из-за большой толщины грудной клетки, сужения межреберных промежутков, смещения сердца кзади.
С помощью допплеровской эхоКГ выявляют признаки диастолической дисфункции, может определяться аортальная регургитация. В последующем происходит нарушение и систолической функции. Возможно расслоение листков перикарда за счет отложения жира. Проведение эхоКГ-исследования часто затруднено из-за большой толщины грудной клетки, сужения межреберных промежутков, смещения сердца кзади.
При изучении гемодинамических показателей у всех пациентов выявлено увеличение ОЦК, что сопровождается нарастанием ригидности миокарда ЛЖ, ростом давления его наполнения и УОК. С увеличением степени ожирения повышается конечное диастолическое давление в ПЖ, среднее давление в ЛА, давление заклинивания в легочных капиллярах и конечное диастолическое давление в ЛЖ. Эти изменения вызывают расширение полостей левого предсердия, ПЖ и правого предсердия. Давление крови в ПЖ, как правило, также повышено.
Рентгенологическая картина всегда изменена вследствие высокого стояния диафрагмы и скопления жира в области верхушки сердца, что создает картину его кажущегося увеличения. Пульсация вялая, тонус сердца понижен.
Пульсация вялая, тонус сердца понижен.
Лечение
Начальные дистрофические изменения миокарда при ожирении являются в значительной мере обратимыми при нормализации массы тела. Первоочередным этапом лечения является коррекция пищевых привычек и повышение физической активности. Специфические рекомендации включают 30 мин физической активности по крайней мере 5 раз в неделю, уменьшение калорийности пищи в среднем до 1500 ккал/сут, снижение потребления жиров до 30–35% дневной энергетической ценности (с оговоркой 10% для мононенасыщенных жирных кислот, например оливковое масло), отказ от трансгенных жиров, увеличение потребления продуктов, содержащих волокна, до 30 г/сут и отказ от жидких моно-и дисахаридов.
Для уменьшения массы тела применяют медикаментозные и хирургические методы лечения ожирения. Назначают ингибиторы липаз (средства периферического действия) и анорексигенные средства (центрального действия).
Лечение сердечно-сосудистых расстройств у больных с ожирением зависит от характера поражения сердца. Для лечения АГ наиболее целесообразно назначение ингибиторов АПФ и диуретиков, которые должны быть нейтральными в отношении показателей углеводного и липидного обмена. Должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
Для лечения АГ наиболее целесообразно назначение ингибиторов АПФ и диуретиков, которые должны быть нейтральными в отношении показателей углеводного и липидного обмена. Должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
При наличии признаков СН лечение проводят в соответствии с современными рекомендациями.
АЛКОГОЛЬНАЯ КАРДИОМИОПАТИЯ
Эпидемиология
Одна из форм алкогольного поражения сердца, отмечается у 50% лиц, на протяжении длительного времени злоупотребляющих алкоголем.
Алкогольную кардиомиопатию выявляют приблизительно у ⅓ всех больных с неишемической кардиомиопатией, 40–50% больных умирают в течение 3–6 лет.
Этиология
Этиологическим фактором является этанол и/или его метаболиты. Развитие алкогольной кардиомиопатии могут обусловить стрессовые состояния, недостаточность питания (дефицит белков, витаминов), наследственная предрасположенность, вирусная инфекция на фоне снижения иммунитета, изменения исходного состояния миокарда. Не всегда отмечается отчетливый параллелизм между количеством употребляемого этанола, длительностью интоксикации и выраженностью поражения сердца.
Не всегда отмечается отчетливый параллелизм между количеством употребляемого этанола, длительностью интоксикации и выраженностью поражения сердца.
Патогенез
Основной из метаболитов этанола, ацетальдегид, оказывает прямое повреждающее воздействие на клеточные и субклеточные мембраны кардиомиоцитов, связанное с их способностью растворять липиды и увеличивать текучесть биологических мембран. На определенном этапе интоксикации это может вызывать нарушение обмена веществ в миокарде и ингибирование основных путей утилизации энергии в клетках сердца, в результате угнетения функции дыхательной цепи митохондрий возникает гипоксия миокарда. Опосредованное воздействие происходит в результате влияния алкоголя на различные отделы нервной системы и функцию надпочечников.
Патологическая анатомия
Длительное употребление алкоголя вызывает жировую инфильтрацию миокарда, дегенеративные изменения в стенках коронарных артерий и нейронах, расположенных в сердце. При микроскопическом исследовании отмечают исчезновение поперечной исчерченности миофибрилл, пикноз ядер, интерстициальный отек, вакуольную и жировую дистрофию, иногда единичные или множественные очаги некроза, мелкие участки фиброза.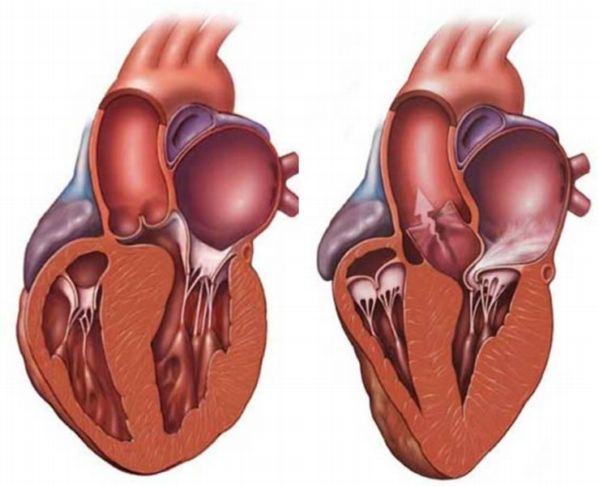
Клиническая картина
Как правило, больные упорно отрицают злоупотребление алкоголем.
Развернутую клиническую картину с явлениями СН, стойкими нарушениями ритма и проводимости, тромбоэмболическими осложнениями, кардиомегалией выявляют редко.
Первым клиническим проявлением наиболее часто бывают нарушения ритма без признаков застойной СН. Развитие заболевания имеет несколько стадий — от функциональных расстройств, нарушений ритма сердца преходящего характера до стойкой гипертрофии миокарда с последующим развитием СН.
К наиболее частым и типичным клиническим симптомам относят:
- возбуждение, тремор рук, суетливость, многословность;
- ощущение нехватки воздуха, кардиалгию, тахикардию;
- похолодение конечностей;
- ощущение жара во всем теле, гиперемию кожи лица, инъецированность склер;
- потливость;
- повышение АД.
Начальными признаками заболевания принято считать сердцебиение и одышку при физической нагрузке. На более поздних стадиях заболевания состояние пациентов постепенно ухудшается.
На более поздних стадиях заболевания состояние пациентов постепенно ухудшается.
Диагностика
На ЭКГ характерными изменениями являются укорочение интервала Р–Q, удлинение интервала Q–T в сочетании с небольшой элевацией сегмента ST и заостренным высоким с широким основанием зубцом Т, синусовая аритмия, бради- или тахикардия. Нередко нарушения ритма (предсердная и желудочковая экстрасистолическая аритмия, фибрилляция предсердий) и проводимости (атриовентрикулярная и внутрижелудочковая блокады) возникают после длительного и/или однократного употребления большого количества алкоголя (синдром «праздничного» сердца).
О наличии алкогольной кардиомиопатии может свидетельствовать отсутствие определенной причины фибрилляции предсердий (тиреотоксикоз, ревматический порок сердца) у мужчин молодого возраста.
Диагностику затрудняет и отсутствие маркеров алкогольного поражения сердца.
Диагностировать алкогольную кардиомиопатию легче в том случае, если в анамнезе имеются указания на длительное употребление алкоголя и определяются клинические признаки кардиомегалии, аритмии или застойной СН при отсутствии других причин, способных привести к аналогичным нарушениям сердечной деятельности.
При эхоКГ-исследовании отмечается дилатация полости ЛЖ, снижение его сократительной способности, возможна диффузная гипоксия. При допплеровском исследовании могут выявляться признаки митральной регургитации.
Лечение
При лечении обязательно исключают употребление алкоголя. Полная абстиненция может остановить прогрессирование поражения сердца на ранних этапах (обычно в первые 2–6 мес).
На ранних стадиях без проявлений СН и при наличии кардиалгии, тахикардии, АГ и аритмии рекомендованы блокаторы β-адренорецепторов. При выраженной кардиомегалии следует назначать сердечные гликозиды, однако строго контролировать их прием в целях предупреждения кардиотоксического эффекта. В комплексное лечение включают мочегонные средства, витамины, анаболические гормоны, соли калия и магния.
Прогноз
При полном отказе от употребления спиртных напитков и под влиянием лечения размеры сердца у больных с алкогольной кардиомиопатией нередко уменьшаются. Восстановление основных функций миокарда и улучшение общего состояния наступают очень медленно, сроки относительного выздоровления исчисляются месяцами и годами.
ЛИТЕРАТУРА
- Александров А.А., Кухаренко С.С. (2006) Миокардиальные проблемы ожирения. Рос. кардиол. журн., 2: 11-17.
- Артемчук А.Ф. (2000) Клинические особенности и терапия сердечно-сосудистых нарушений при алкоголизме. Укр. кардіол. журн., 4: 68-71.
- Ефимов А.С., Соколова Л.К., Рыбченко Ю.Б. (2005) Сахарный диабет и сердце. Мистецтво лікування, 34: 44-49.
- Зубкова С.Т., Тронько Н.Д. (2006) Сердце при эндокринных заболеваниях. Библиотечка практикующего врача, Киев, 200 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Моисеев В.С., Сумароков А.В. (2001) Болезни сердца. Универсум паблишинг, Москва, с. 369-378.
- Alpert M.A. (2001) Obesity cardiomyopathy: pathophysiology and evolution of the clinical syndrome. Amer. J. Med. Sci., 321: 225-236.
- Bartnik M., Van der Berghe G., Betteridge J. et al. (2007) Guidelines on diabetes, pre-diabetes and cardiovascular diseases.
 Eur. Heart J., 28: 88-136.
Eur. Heart J., 28: 88-136. - Cooper L.T., Baughman K.L., Feldman A.M. (2007) The role of endomyocardial biopsy in the management of cardiovascular disease. Eur. Heart J., 28: 3077-3093.
- Cote M., Matias I., Lemieux I. et al. (2007) Circulating endocannabinoid levels, abdominal adiposity and related cardiometabolic risk factors in obese men. Int. J. Obes. (Lond), 31: 692-699.
- Di Marzo V., Matias I. (2005) Endocannabinoid control of food intake and energy balance. Nature Neuroscience, 8: 585-589.
- Falk R.H. (2005) Diagnosis and management of the cardiac amyloidoses. Circulation, 112: 2047-2060.
- Fauchier L. (2003) Alcoholic cardiomyopathy and ventricular arrhythmias. Chest., 123: 1320-1325.
- Galinier M., Pathak K., Roncalli J. et al. (2005) Obesity and cardiac failure. Arch. Mal. Coeur. Vaiss., 98: 39-45.
- Gertz M.A., Blood E., Vesole D.H. et al. (2004) A multicenter phase 2 trial of stem cell transplantation for immunoglobulin light-chain amyloidosis (E4A97): An Eastern Cooperative Oncology Group Study.
 Bone Marrow Transplant., 34: 149-154.
Bone Marrow Transplant., 34: 149-154. - Hemery Y., Broustet H., Guiraude O. et al. (2000) Alcohol and rhythm disorders. Ann. Cardiol. Angeiol., 49: 473-479.
- Huss J.M., Kelly D.P. (2005) Mitochondrial energy metabolism in heart failure: a question of balance. J. Clin. Invest., 115: 547-555.
- Ingwall J.S., Weiss R.G. (2004) Is the failing heart energy starved? On using chemical energy to support cardiac function. Circ. Res., 95: 135-145.
- Katz A.M. (2006) Physiology of the heart. 4th ed. Williams&Wilkins, Lippincot, 644 p.
- Kholova I., Niessen H.W. (2005) Amyloid in the cardiovascular system: a review. J. Clin. Pathol., 58: 125-133.
- Maceira A.M., Joshi J., Prasad S.K. et al. (2005) Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation, 111: 186-193.
- Matias I., Gonthier M.P., Orlando P. et al. (2006) Regulation, function, and dysregulation of endocannabinoids in models of adipose and beta-pancreatic cells and in obesity and hyperglycemia.
 J. Clin. Endocrinol. Metab., 91: 3171-3180.
J. Clin. Endocrinol. Metab., 91: 3171-3180. - Miller S.R., SekijimaY., Kelly J.W. (2004) Native state stabilization by NSAIDs inhibits transthyretin amyloidogenesis from the most common familial disease variants. Lab. Invest., 84: 545-552.
- Murtagh B., Hammill S.C., Gertz M.A. et al. (2005) Electrocardiographic findings in primary systemic amyloidosis and biopsy-proven cardiac involvement. Amer. J. Cardiol., 95: 535-537.
- Poirier P., Giles T.D., Bray G.A. et al. (2006) Obesity and cardiovascular disease: pathophysiology, evaluation and effect of weight loss. Circulation,113: 898-918.
- Rajkumar S.V., Dispenzieri A., Kyle R.A. (2006) Monoclonal gammopathy of undetermined significance, Waldenstrom macroglobulinemia, AL amyloidosis, and related plasma cell disorders: Diagnosis and treatment. Mayo Clin. Proc., 81: 693-703.
- Rutter M.K., Parise H., Benjamin E.J. et al. (2003) Impact of glucose intolerance and insulin resistance on cardiac structure and function: sex-related differences in the Framingham Heart Study.
 Circulation, 107: 448-454.
Circulation, 107: 448-454. - Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Williams& Wilkins, Lippincott, 1628 p.
- Torp-Pedersen C., Caterson I., Coutinho W. et al. (2007) Cardiovascular responses to weight management and sibutramine in high-risk subjects: an analysis from the SCOUT trial. Eur. Heart J., 28: 2915-2923.
- Trayhurn P., Wood I.S. (2004) Adipokines: inflammation and the pleiotropic role of white adipose tissue. Br. J. Nutr., 92: 347-355.
Метаболическая кардиомиопатия в практике педиатра | Триль
1. Леонтьева И.В., Лебедькова С.Е. Миокардиодистрофия у детей и подростков. М.: Медицина; 2010. 75 с.
2. Беляева Л.М. Педиатрия. Курс лекций. Минск: Медицинская литература; 2011. 568 с.
3. Беляева Л.М., Хрусталева Е.К., Колупаева Е.А. Проблемы детской кардиологии (пролапсы сердечных клапанов, малые аномалии развития сердца, миокардиодистрофия). Минск: БелМАПО; 2007. 48 с.
Беляева Л.М., Хрусталева Е.К., Колупаева Е.А. Проблемы детской кардиологии (пролапсы сердечных клапанов, малые аномалии развития сердца, миокардиодистрофия). Минск: БелМАПО; 2007. 48 с.
4. Thiene G., Corrado D., Basso C. Cardiomyopathies: is it time for a molecular classifi cation? Eur. Heart J. 2004; 25(30): 1772–1775. DOI: 10.1016/j.ehj.2004.07.026
5. Maron B.J., Towbin J.A., Thiene G. Antzelevitch C., Corrado D., Arnett D., Moss A.J., Seidman C.E., Young J.B.; American Heart Association; Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; Council on Epidemiology and Prevention. and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation. 2006; 113: 1807–1816.
2006; 113: 1807–1816.
6. Elliott P., Andersson B., Arbustini E., Bilinska Z., Cecchi F., Charron P., Dubourg O., Kühl U., Maisch B., McKenna W.J., Monserrat L., Pankuweit S., Rapezzi C., Seferovic P., Tavazzi L., Keren A. Classifi cation of the cardiomyopathies: a position statement from the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur. Heart. J. 2008; 29 (2): 270-276. DOI: 10.1093/eurheartj/ehm342
7. Арутюнов Г.П. Диагностика и лечение заболеваний сердца и сосудов. М.: ГЭОТАР-Медиа; 2015. 504 с.
8. Шляхт Е.В., редактор. Национальное руководство: кардиология. М.: ГЭОТАР-Медиа; 2015. 800 с.
9. Агеев Ф.Т., Беленков Ю.Н. Хроническая сердечная недостаточность. М.: ГЭОТАР-Медиа; 2010. 331 с.
М.: ГЭОТАР-Медиа; 2010. 331 с.
10. Caforio A.L., Pankuweit S., Arbustini E., Basso C., GimenoBlanes J., Felix S.B., Fu M., Heliö T., Heymans S., Jahns R., Klingel K., Linhart A., Maisch B., McKenna W., Mogensen J., Pinto Y.M., Ristic A., Schultheiss H.P., Seggewiss H., Tavazzi L., Thiene G., Yilmaz A., Charron P., Elliott P.M.; European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur. Heart J. 2013; 34(33): 2636–2648. DOI: 10.1093/eurheartj/eht210
11. Pinto Y., Elliott P., Arbustini E., Adler Y., Anastasakis A., Böhm M., Duboc D., Gimeno J., de Groote P., Imazio M., Heymans S., Klingel K., Komajda M. , Limongelli G., Linhart A., Mogensen J., Moon J., Pieper P.G., Seferovic P.M., Schueler S., Zamorano J.L., Caforio A.L., Charron P. Proposal for a revised defi nition of dilated cardiomyopathy, hypokinetic non-dilated cardiomyopathy, and its implications for clinical practice: a position statement of the ESC working group on myocardial and pericardial diseases. Eur. Heart J. 2016; 37(23): 1850–1858. DOI: 10.1093/eurheartj/ehv727
, Limongelli G., Linhart A., Mogensen J., Moon J., Pieper P.G., Seferovic P.M., Schueler S., Zamorano J.L., Caforio A.L., Charron P. Proposal for a revised defi nition of dilated cardiomyopathy, hypokinetic non-dilated cardiomyopathy, and its implications for clinical practice: a position statement of the ESC working group on myocardial and pericardial diseases. Eur. Heart J. 2016; 37(23): 1850–1858. DOI: 10.1093/eurheartj/ehv727
12. Briongos F., Acena Navarro A. Isolated right ventricular dilated cardiomyopathy: an early diagnosis. J. Clin. Med. Res. 2015; 7(10): 817-819. DOI: 10.14740/jocmr2165w
13. Беленков Ю.Н., Привакова Е.В., Клилунова В.Б. Гипертрофическая кардиомиопатия: патофизиология, клиника и диагностика. М.: Альфа-М; 2013. 256 с.
14. Mancio J. , Bettencourt N., Oliveira M., Pires-Morais G., Ribeiro V.G. Acute right ventricular myocarditis presenting with chest pain and syncope. BMJ Case Rep. 2013; 2013: pii: bcr2012007173. DOI: 10.1136/bcr-2012-007173
, Bettencourt N., Oliveira M., Pires-Morais G., Ribeiro V.G. Acute right ventricular myocarditis presenting with chest pain and syncope. BMJ Case Rep. 2013; 2013: pii: bcr2012007173. DOI: 10.1136/bcr-2012-007173
15. Абдуллаева Ч.А., Камилова У.К. Взаимосвязь процессов ремоделирования сердца с дисфункцией эндотелия у больных с хронической сердечной недостаточностью. Кардиоваскулярная терапия и профилактика. 2016; 15(1): 16–19. DOI: 10.15829/1728-8800-2016-1-16-19
16. Алибейли К.А. Возможности коэнзима Q10 в коррекции эндотелиальной дисфункции у больных хронической сердечной недостаточностью ишемической этиологии. Евразийский союз ученых. 2015; 5-5(14): 12–14.
17. Драпкина О.М., Дуболазова Ю.В. Применение биологических маркеров в диагностике диастолической сердечной недостаточности. Артериальная гипертензия. 2011; 17(4): 305–315.
Артериальная гипертензия. 2011; 17(4): 305–315.
18. Гавриш А.С., Пауков В.С. Ишемическая кардиомиопатия. М.: ГЭОТАР-Медиа; 2015. 536 с.
19. Сулимов В.А., Благова О.В., редакторы. Клинические разборы в Факультетской терапевтической клинике им. В. Н. Виноградова (редкие и диагностически трудные заболевания в клинике внутренних болезней). М.: ГЭОТАР-Медиа; 2012. 686 с.
20. Аронов Д.М., Лупанов В.П. Некоторые аспекты патогенеза атеросклероза. Атеросклероз и дислипидемии. 2011; 1(2): 48–56.
21. Асташкин Е.И., Глезер М.Г. Гибель клеток при ишемии/реперфузии сердца. Современные подходы к профилактике и лечению. М.: Медиком; 2012. 12 с.
22. Ефремова Ю.Е. Эффективность и безопасность применения L-карнитина при хронической сердечной недостаточности: метаанализрандомизированных контролируемых исследований (реферат). РМЖ. 2017; 25(20): 1471–1480.
Ефремова Ю.Е. Эффективность и безопасность применения L-карнитина при хронической сердечной недостаточности: метаанализрандомизированных контролируемых исследований (реферат). РМЖ. 2017; 25(20): 1471–1480.
23. Hazebroek M., Moors S., Dennert R., de Vries B., Wolffs P.F., Crijns H.J., Brunner-La Rocca H.P., Heymans S. Prognostic Relevance of Gene-Environment Interactions in Patients With Dilated Cardiomyopathy: Applying the MOGE(S) Classifi cation. J. Am. Coll. Cardiol. 2015; 66(12): 1313–1323. DOI: 10.1016/j.jacc.2015.07.023
24. Иванов А.В., Городецкая Е.А., Каленикова Е.И., Медведев О.С. Коэнзим Q10, введенный однократно внутривенно, защищает миокард от последующей ишемии-реперфузии. Экспериментальная и клиническая фармакология. 2013; 76(2): 6–8.
25. Fuchs F., Martyn D. Length-dependent Ca(2+) activation in cardiac muscle: some remaining questions. AI Muscle Res. Cell Motil. 2005; 26(4–5): 199–212. DOI: 10.1007/s10974-005-9011-z
Fuchs F., Martyn D. Length-dependent Ca(2+) activation in cardiac muscle: some remaining questions. AI Muscle Res. Cell Motil. 2005; 26(4–5): 199–212. DOI: 10.1007/s10974-005-9011-z
26. Михин В.П. Кардиопротекторы — новое направление клинической медицины. Архивъ внутренней медицины. 2011; 1: 21–28.
27. Егорова Е.Н., Калинкин М.Н., Мазур Е.С. Иммунные механизмы в патогенезе хронической сердечной недостаточности. Патологическая физиология и экспериментальная терапия. 2012; 56(2): 56–61.
28. Поскребышева А.С., Смурова Ю.В., Трофимов Е.С. Хроническая сердечная недостаточность — нейроиммуноэндокринные взаимодействия. Вестник Российского государственного медицинского университета. 2010; 1: 54–59.
29. Полунина Е.А. Дисфункция эндотелия при хронической сердечной недостаточности. Успехи современной науки и образования. 2017; 4(3): 34–36.
Полунина Е.А. Дисфункция эндотелия при хронической сердечной недостаточности. Успехи современной науки и образования. 2017; 4(3): 34–36.
30. Arbustini E., Narula N., Tavazzi L., Serio A., Grasso M., Favalli V., Bellazzi R., Tajik J.A., Bonow R.O., Fuster V., Narula J. The MOGE(S) classifi cation of cardiomyopathy for clinicians. J. Am. Coll. Cardiol. 2014; 64(3): 304–318. DOI: 10.1016/j.jacc.2014.05.027
31. Палеев Н.Р., Палеев Ф.Н. Некоронарогенные заболевания миокарда и их классификация. Российский кардиологический журнал. 2009; 14(3): 5–9.
Синкопальные состояния у детей с гипертрофической кардиомиопатией | Леонтьева
1. Elliott P.M., Anastasakis A., Borger M.A. et al. 2014 ESC Guidelines on diagnosis and management of hypertropliic cardiomyopathy The Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology.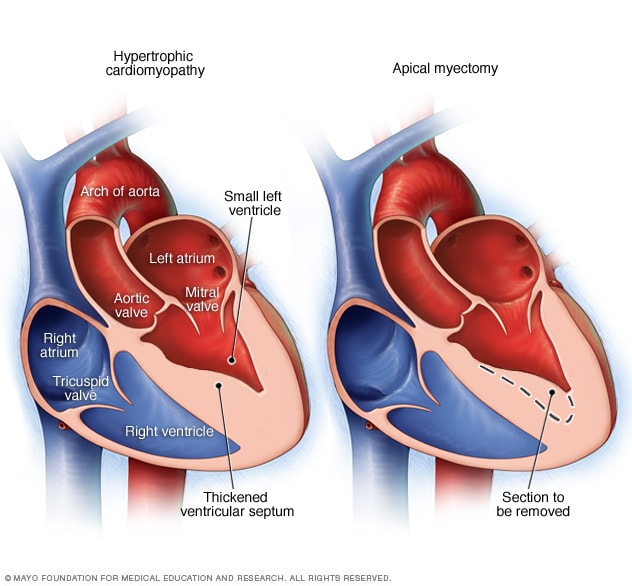 Eur Heart J 2014; doi:10.1093/eurheartj/ehu284. www escardio.org/ guidelines.
Eur Heart J 2014; doi:10.1093/eurheartj/ehu284. www escardio.org/ guidelines.
2. Gersh B.J., Maron B.J., Bonow R.O. et al. ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American college of cardiology foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 124: 213—260.
3. Efthimiadis G., Pagourelias E., Gossios Т., Zegkos T. Hypertrophic cardiomyopathy in 2013: Current speculations and future perspectives. World J Cardiol 2014; 6: 2: 26—37.
4. Biagini E., Coccolo F., Ferlito M. et al. Dilated-hypokinetic evolution of hypertrophic cardiomyopathy: prevalence, incidence, risk factors and prognostic implications in pediatric and adult patients. J Am Coll Cardiol 2005; 46: 1543—1550.
5. Maron В., Spirito P., Ackerman M. Prevention of Sudden Cardiac Death With Implantable Cardioverter-Defibrfflators in Children and Adolescents With Hypertrophic Cardiomyopathy. J Am Coll Cardiol 2013; 61: 14: 1527—1535.
6. Ostman-Smith I. Hypertrophic cardiomyopathy in childhood and adolescence — strategies to prevent sudden death. Fundam Clin Pharmacol 2010; 24: 637—652.
7. Ostman-Smith I., Wettrell G., Keeton B. et al. Age-and gender specific mortality rates in childhood hypertrophic cardiomyopathy. Eur Heart J 2008; 29: 1160—1167.
8. Maron B.J. Risk Stratification and Role of Implantable Deibrillators for Prevention of Sudden Death in Patients With Hypertrophic Cardiomyopathy. Circ J 2010; 74: 2271—2282.
Circ J 2010; 74: 2271—2282.
9. Deccker J., Rossano J., Smith O. Risk factors and mode of death in isolated hypertrophic cardiomyopathy in children Am Coll Cardiol 2009; 54: 3: 250—254.
10. Anastasakis A., Theopistou A., Rigopoulos A., Kotsiopoulou С Sudden Cardiac Death: Investigation of the Classical Risk Factors in a Community-Based Hypertrophic Cardiomyopathy Cohort. Hellenic J Cardiol 2013; 54: 281—288.
11. Elliott P.M., Gimeno J.R., Tome M.T. et al. Left ventricular outflow tract obstruction and sudden death risk in patients with hypertrophic cardiomyopathy. Eur Heart J 2006; 27: 1933-1941.
12. MoyaA., Sutton R, Ammirati F. et al. Guidelines for the diagnosis and management of syncope (version 2009): the Task Force for the Diagnosis and Management of Syncope of the European Society of Cardiology (ESC). Eur Heart J 2009; 30: 2631-2671.
Eur Heart J 2009; 30: 2631-2671.
13. Olivotto I., Cecchi F., Casey S.A. et al. Impact of atrial fibrillationon the clinical course of hypertrophic cardiomyopathy. Circulation 2001; 104: 2517—2524.
14. Bookstall K., Link M. A primer on arrhythmias in patients with hypertrophic Cardiomyopathy. Curr Cardiol Rep 2012; 14: 552-562.
15. Barriales-VillaR., Centurion-IndaR., Fernandez-FernandezX. et al. Severe cardiac conduction disturbances and pacemaker implantation in patients with hypertrophic cardiomyopathy. Rev Esp Cardiol 2010; 63: 985-988.
16. Bahl A., Saikia U., Talwar K. Familial conduction system disease associated with hypertrophic cardiomyopathy. Int J Cardiol 2008; 125: 44-47.
17. Prasad K., Williams L., Campbell R. et al. Episodic syncope in hypertrophic cardiomyopathy: evidence for inappropriate vasodilation. Heart 2008; 94: 1312—1317.
18. Dimitrow P.P., Chojnowska L., Rudzinski T.S. et al. Sudden death in hypertrophic cardiomyopathy: old risk factors reassessed in a new model of maximalized follow-up. Eur Heart J 2010; 31: 3084-3093.
19. Efthimiadis G.K., Parcharidou D.G., Giannakoulas G. et al. Left ventricular out flow tract obstruction as a risk factor for sudden cardiac death in hypertrophic cardiomyopathy. Am J Cardiol 2009; 104: 695-699.
20. Gimeno J.R., Tome-Esteban M., Lofiego C. et al. Exercise-induced ventricular arrhythmias and risk of sudden cardiac death in patients with hypertrophic cardiomyopathy. Eur Heart J 2009; 30: 2599-2605.
Eur Heart J 2009; 30: 2599-2605.
21. Pettersen M.D., Wei D., Skeens M.E., Humes R.A. Regression equations for calculation of Z scores of cardiac structures in a large cohort of healthy infants, children, and adolescents: An echocardiographic study. J Am Soc Echocardiogr 2008; 21: 8: 922-934.
22. BaurA., MalikM., Schmidt G. Heart rate turbulence: standards of measurement, physiological interpretation and clinical use. Amer Coll Cardiol 2008; 52: 17: 1353-1365.
23. Макарова В.А., Леонтьева И.В. Турбулентность ритма сердца как маркер электрической нестабильности миокарда. Рос вестн перинатол и педиат 2014; 4: 64—68. (Makarova V.A., Leontyeva I.V. Heart rate turbulence as a marker of myocardial electrical instability in children with hypertrophic cardiomyopathy. Ros vest perinatol i pediat 2014; 4: 65—68.)
Ros vest perinatol i pediat 2014; 4: 65—68.)
24. Shah J.S., Esteban M.T., Thaman R. et al. Prevalence of exercise-induced left ventricular outflow tract obstruction in symptomatic patients with non-obstructive hypertrophic cardiomyopathy. Heart 2008; 94: 1288—1294.
25. Monserrat L., Elliott P., Gimeno J. Non-Sustained Ventricular Tachycardia in Hypertrophic Cardiomyopathy: An Independent Marker of Sudden Death Risk in Young Patients J Am Coll Cardiol 2003; 42: 5: 873-878.
26. Gilligan DM., Nihoyannopoulos P., Chan W.L., Oakley CM. Investigation of a hemodynamic basis for syncope in hypertrophic cardiomyopathy. Use of a head-up tilt test. Circulation 1992; 85: 2140-2148.
27. Kawasaki Т., Sakai C, Harimoto K. Holter monitoring and long-term prognosis in hypertrophic Cardiomyopathy. Cardiology 2012; 122:44-54.
Kawasaki Т., Sakai C, Harimoto K. Holter monitoring and long-term prognosis in hypertrophic Cardiomyopathy. Cardiology 2012; 122:44-54.
28. American Heart Association/American College of Cardiology Foundation/. Heart rhythm society scientific statement on noninvasive risk stratification techniques for identifying patients at risk for sudden cardiac death. Circulation 2008; 118: 1497-1518.
29. Shiozak A, Senra Т., Arteaga E. Myocardial fibrosis detected by cardiac CT predicts ventricular fibrillation/ventricular tachycardia events in patients withhypertrophic cardiomyopathy JCardiovasc ComputTomogr2013; 7: 3: 173—181.
30. Schmidt G., Malik M., Barthel P. et al. Heart rate turbulence after ventricular premature beats as predictor of mortality after acute myocardial infarction. Lancet 1999; 353: 130—196.
Lancet 1999; 353: 130—196.
31. Kowalewski M. Heart rate turbulence in children — age and heart rate relationships. Pediat Res 2007; 62: 6: 710—714.
32. Комолятова B.H. Характеристика проаритмогенных маркеров электрической нестабильности миокарда у детей и подростков: Автореф. дисс. … канд. мед. наук. М2009; 22. (KomolyatovaV.N. Featureproarrhythmogenic markers myocardial electrical instability in children and adolescents: Avtoref. dis. … kand. med. nauk. Moscow 2009; 22.)
33. Brignole M., Auricchio A., Baron-Esquivias G. et al. ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA).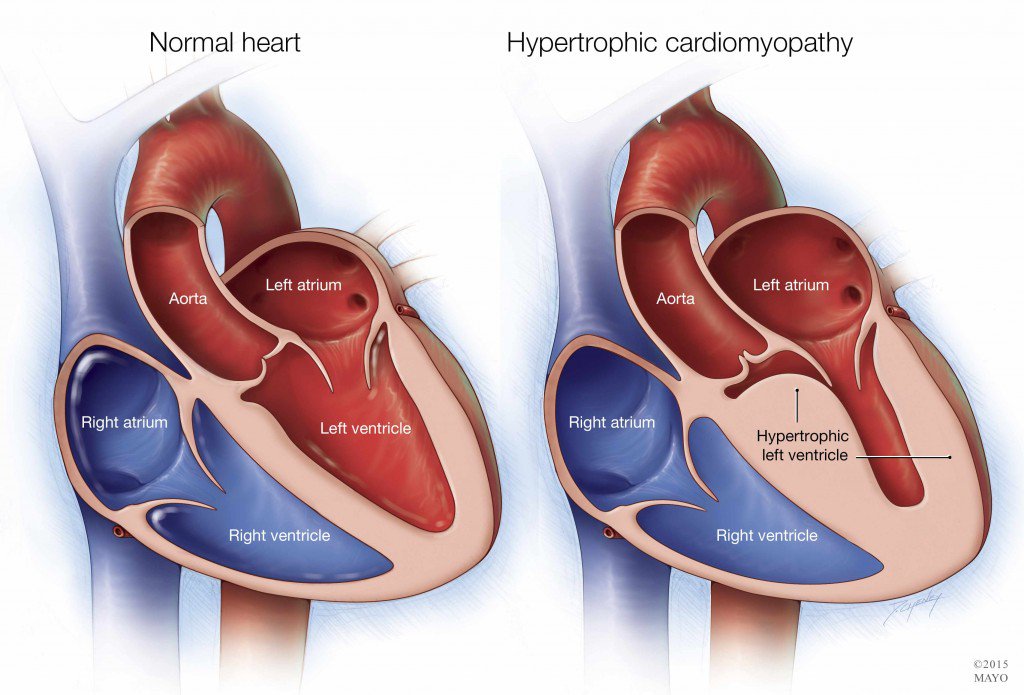 Eur Heart J 2013; 34: 2281-2329.
Eur Heart J 2013; 34: 2281-2329.
Критерии прогнозирования течения и исхода гипертрофической кардиомиопатии у детей
На правах рукописи
Тихомирова Евгения Анатольевна
КРИТЕРИИ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ И ИСХОДА ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ У ДЕТЕЙ
14 00 09 — Педиатрия
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
0031ТВ1Ь>1 Г)7
Москва — 2007
003176161
Работа выполнена в НИИ Педиатрии Государственного учреждения Научный центр здоровья детей Российской академии медицинских наук
Научные руководители-
Доктор медицинских наук, профессор Куприянова Ольга Олеговна Доктор медицинских наук Басаргина Елена Николаевна
Официальные оппоненты:
Доктор медицинских наук, профессор Рябыкина Галина Владимировна Доктор медицинских наук, профессор Макаров Леонид Михайлович
Ведущая организация. ГОУ ВПО РГМУ Росздрава
ГОУ ВПО РГМУ Росздрава
Защита состоится «4» декабря 2007 г. в часов на заседании Диссертационного совета OJb.frf
при ГУ Научный Центр здоровья детей РАМН по адресу: 119991, ГСП-1, Москва, Ломоносовский проспект, 2/62.
С диссертацией можно ознакомиться в библиотеке ГУ Научный Центр здоровья детей РАМН
Ученый секретарь Диссертационного совета, кандидат медицинских наук
Тимофеева А. Г.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Кардиомиопатии по-прежнему остаются одними из наименее изученных
кардиологических заболеваний, являясь объектом изучения активно развивающейся области современной кардиологии Повышенный интерес к проблеме изучения заболеваний миокарда объясняется необходимостью дальнейшего изучения этиологии и патогенеза, многообразием и неспецифичностью их клинических проявлений, значительными диагностическими и терапевтическими трудностями
В настоящее время неопровержимо установлена роль генетических факторов в возникновении ГКМП Это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата, причем в каждом гене может быть несколько вариантов мутаций (Keller D 1, 2002) Вьивление той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания и наиболее точно предопределяет его прогноз (Report of the American College of Cardiology, 2003) При этом описанные генетические дефекты характеризуются разной степенью пенетрантаости Все это крайне затрудняет генетическую диагностику, так как разнообразие мутаций очень велико и скрининг на наиболее частые из них становится не эффективным
Отличительной особенностью течения ГКМП является подверженность внезапной остановке кровообращения, которая может стать первым и единственным проявлением заболевания В структуре причин летальных исходов около 67 % приходится на долю внезапной смерти (Y Koga, с соавт, 1994) Ежегодная смертность больных ГКМП колеблется в пределах от 1 до 3 % у взрослых, а в детском и подростковом возрасте может достигать 4- 6% (Р Nicod с соавт, 1998 г, W МсКеппа с соавт, 1990)
Не существует единого мнения о прогностическом значении такого фактора, как выраженность гипертрофии миокарда Так, одни авторы приводят данные, в соответствии с которыми внезапная смерть в большинстве случаев (54 %) наступает у асимптоматичных больных или у больных со слабыми проявлениями гипертрофической кардиомиопатии (В Marón с соавт, 1994) В других исследованиях было показано, что значительное увеличение толщины стенки левого желудочка и диффузный характер его гипертрофии повышают риск внезапной смерти в 8 раз (Р Spirito с соавт, 1990)
В работах, опубликованных в печати, преимущественно находят отражение результаты однократного обследования детей с ГКМП и недостаточно внимания отводится проблеме динамического наблюдения за такими больными Вместе с тем именно оценка особенностей течения заболевания может способствовать разработке
прогностических критериев, что позволит предупредить возникновение тяжелых осложнений и улучшить прогноз у больных с ГКМГГ
В последние годы в связи с внедрением в практику методов компьютерной обработки ритмограмм для оценки изменчивости синусового ритма, существенно вырос научный интерес к проблемам организации ритма сердца при различных заболеваниях В настоящее время считается вполне установленной прогностическая значимость снижения вариабельности ритма сердца у постинфарктных больных и больных с сахарным диабетом ( Kleiger RE et ai, 1987, Airaksmen К et al, 1988, Casolo G Et al, 1989, Созыкина M A 2006) Подробно изучен данный вопрос у больных с ДКМП и сердечной недостаточностью (Куприяноа О О ,1995, Белова Н Р , 2005) В каждом из этих состояний снижение ВРС является прогностически неблагоприятным фактором, увеличивающим риск внезапной смерти Поэтому необходимость выявления диагностической и прогностической роли метода оценки ВРС у детей с ГКМП стала одной из задач нашего исследования
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, следствием чего является разнообразие ее клинических проявлений, вариантов течения и прогноза Все это определяет необходимость детальной стратификации риска фатальных осложнений заболевания, поиск доступных прогностических предикторов и клинико-функциональных маркеров течения процесса, а также критериев оценки проводимого лечения
Цель работы:
Определить особенности течения гипертрофической кардиомиопатии у детей, обосновать прогностические критерии заболевания и оптимизировать тактику лечения
Задачи исследования:
1 Оценить особенности клинических и структурно-функциональных проявлений у детей с гипертрофической кардиомиопатией в процессе динамического наблюдения
2 Изучить вегетативную регуляцию сердца на основе оценки суточной вариабельности сердечного ритма у детей с гипертрофической кардиомиопатией
3 Провести скрининговое обследование родственников пробандов с гипертрофической кардиомиопатией и оценить влияние наследственного характера заболевания на течение и исходы гипертрофической кардиомиопатии у детей
4 Исследовать динамику показателей сердечно-сосудистой системы на фоне применения Р-адреноблокатора пропранолола у детей с обструктивной формой гипертрофической кардиомиопатии
5 Обосновать прогностические критерии течения и исхода гипертрофической кардиомиопатии у детей Научная новизна
Впервые проведена комплексная оценка и обобщены результаты клинико-инструментальных исследований, полученных в ходе длительного наблюдения, у детей с различными формами гипертрофической кардиомитопатии
Впервые на большой группе детей, больных ГКМП, при длительном катамнестическом наблюдении исследованы нарушения суточной структуры и вариабельности сердечного ритма
Установлено различие частоты выявления, клинической и прогностической значимости нарушений ритма сердца и проводимости в зависимости от формы и характера течения заболевания Показано, что нарушение проводимости у детей с ГКМП представлено преимущественно внутрижелудочковыми блокадами, из которых нарастающее нарушение проводимости по левой ножке п Гиса характеризует прогрессирующее течение заболевания Отмечено, что сердечный ритм при ГКМП характеризуется наличием синусовой брадикардии, редкой предсердной и политопной желудочковой экстрасистолией Установлена частота встречаемости клинически значимых желудочковых аритмий у детей с ГКМП при длительном катамнестическом наблюдении Отмечено редкое выявление мерцательной аритмии и дистальных атриовентрикулярных блокад 1-2 степени
Установлено, что прогноз ГКМП у детей определяется не только выраженностью нарушений ритма сердца и проводимости, но и динамикой параметров вариабельности сердечного ритма, характеризующих состояние адаптационных возможностей больного Доказано, что у детей с прогрессирующим течением заболевания основные показатели вариабельности ритма сердца существенно снижаются, что наиболее выражено у больных с трансформацией ГКМП в ДКМП
Показано, что применение (3-адреноблокаторов позитивно влияет как на клиническое состояние, так и на показатели вариабельности ритма сердца детей, больных гипертрофической кардиомиопатией Впервые у детей с ГКМП предложен новый критерий стратификации риска внезапной сердечной смерти — снижение показателей вариабельности ритма сердца на фоне постоянного приема Р-адреноблокаторов
Путем проведения скринингового обследования родственников пробандов с ГКМП выявлены семейные формы заболевания и определено влияние наследственного характера заболевания на течение и исходы ГКМП у детей
Впервые на основе комплексной оценки функционального состояния сердца и его регуляторных систем, включающей клинико-генеалогическое исследование, анализ нарушений ритма сердца и проводимости, оценку результатов математического анализа ритмограмм и их сопряженности с эхокардиографическими параметрами, нами определены прогностические факторы неблагоприятного течения и исхода ГКМП у детей Практическая значимость
Комплексная оценка клинических и структурно-функциональных проявлений у детей с ГКМП в катамнезе позволяв! выявить доступные прогностические критерии неблагоприятного течения и прогноза этого заболевания
Полученные результаты служат основанием для своевременного и адекватного включения р-адреноблокаторов в терапию гипертрофической кардиомиопатии у детей, а также позволяют контролировать их эффективность Предложен новый критерий оценки проводимой терапии, основанный на изучении параметров временного и частотного анализа вариабельности сердечного ритма
Использованный клинико-генеапогический метод в сочетании с эхокардиографическим обследованием способствует выявлению семейных форм ГКМП, раннему выявлению гипертрофической кардиомиопати у детей и их ближайших родственников, а также выявлению группы риска по развитию внезапной смерти среди больных детей
Внедрение в практику результатов исследования*
Результаты настоящего исследования внедрены в работу кардиологического отделения и отделения функциональной диагностики, включены в материалы практических занятий с ординаторами и врачами вышеназванных отделений ГУ НЦЗД РАМН
Апробация работы.
Результаты исследования представлены, доложены и обсуждены на Всероссийском Конгрессе «Детская кардиология» (Москва, 2002г, 2004г), Всероссийском Конгрессе « Вторые Тульские чтения» (Тула, 2003г), V Съезде Российского общества медицинских генетиков (Уфа, 2005г), 12 Конгресс международного общества по Холтеровскому мониторированию и неинвазивной электрокардиологии (Афины, 2007)
Апробация работы проходила на совместном заседании проблемной комиссии «Сердечно-сосудистые заболевания у детей» отделений (функциональной диагностики, кардиологического, ультразвуковой диагностики) и лабораторий (патофизиологии с блоком радионуклидных исследований, мембранологии с генетической группой) 20 июня 2007 г
Публикации:
По теме диссертации опубликовано 9 печатных работ 3 статьи и 6 тезисов докладов
Объем и структура диссертации
Диссертация изложена на страницах машинописного текста, состоит из введения, обзора литературы, результатов собственного исследования и их обсуждения, выводов и практических рекомендаций Диссертация иллюстрирована таблицей и рисунками
ЯГ-7-
Сшсок литературы включает работ отечественных и зарубежных авторов
СОДЕРЖАНИЕ РАБОТЫ Методы и объем исследований:
Работа выполнена в отделении функциональной диагностики (руководитель — д м н, профессор О Ф Лукина) и кардиологии (руководитель — д м н Е Н Басаргина) НИИ Педиатрии Государственного учреждения Научного центра здоровья детей Российской академии медицинских наук (директор — академик РАМН, профессор А А Баранов)
В соответствии с поставленными задачами нами проанализированы результаты обследования, лечения и длительного катамнестического наблюдения 70 больных в возрасте от 1 года до 17 лет (средний возраст 11 ± 3,8 лет) с диагнозом гипертрофическая кардиомиопатия Возраст более чем 62 % детей на момент постановки диагноза составлял 7 лет и старше Мальчиков было 50, девочек — 20
У 20 больных (28,5 %) диагносцирована необсгруктивная форма заболевания, у 35 больных (50 %) — обструктивная, у 11 больных (15,7 %) за период наблюдения нами была отмечена трансформация необструктивной формы в обструктивную, у 4 детей (5,7 %) гипертрофической кардиомиопатии в дилатационную Референтную группу составили 20 практически здоровых детей
Больные наблюдались в катамнезе до 17 лет Динамическое обследование проводилось всем детям с периодичностью от б до 12 месяцев, в зависимости от тяжести состояния Продолжительность наблюдения составила от 6 месяцев до 13 лет, в среднем 3,3 года
Все больные с обструктивной формой ГКМП получали базисную терапию, направленную на улучшение диастолической функции миокарда и коррекцию основных клинических проявлений заболевания, из них 32 длительно (от 6 месяцев до 11 лет) принимали Р-адреноблокаторы в индивидуально подобранных дозах
С целью выявления семейных форм заболевания нами было проведено обследование ближайших родственников детей с ГКМП В исследование были включены 125 человек из 42-х неродственных семей У 27 взрослых (14 мужчин и 13 женщин) были выявлены
признаки ГКМП, в 11 случаях обструктивной, в 15 необструктивной У 1 взрослого больного была отмечена трансформация ГКМП в ДКМП Большинство больных, как детей, так и взрослых, были русской национальности, проживали в Москве и центральной части Российской федерации
На основании полученных данных клинического, инструментального обследования, а также с учетом результатов длительного наблюдения больные были распределены на группы следующим образом в первую группу вошли 20 больных с необструктивной формой ГКМП, во вторую — 46 с обструктивной, в третью — 4 больных с трансформацией ГКМП в ДКМП Выделение всего лишь четырех больных в отдельную группу было обусловлено особенностями течения заболевания
Диагностика ГКМП основывалась на анализе анамнестических данных и совокупности данных тщательно проведенного клинического обследования, что позволило исключить другие заболевания, которые могли бы привести к гипертрофии миокарда Для диагностики ГКМП и оценки результатов терапии применялись неинвазивные методы обследования ЭХО-ЮГ, ЭКГ, CM-ЭКГ, СМАД, ЭХО-КГ
Морфофункциональное состояние сердца оценивалось по данным метода эхокардиографии в В- и М- режимах Одновременно проводили допплерэхокардиографическое исследование для определения внутрисердечного кровотока на аппарате SIM-5000 (Биомедика, Италия) и «Алока-680» (Япония) При оценке данных ЭХО-КГ у детей с ГКМП высчитывали должные показатели с помощью уравнения регрессии для данной массы тела обследуемого и сравнивали с фактическими величинами, степень изменения которых определяли в процентах от должных значений (Иванов А П, 1985)
Состояние диастолической функции сердца определяли по следующим параметрам максимальной скорости раннего диастолического наполнения левого желудочка (Ml), максимальной скорости кровотока во время систолы левого предсердия (М2), отношению скоростей М1/М2, времени изоволюмического расслабления левого желудочка (Т ивр), скорости ауксволюмического расслабления левого желудочка (V авр)
Регистрацию ЭКГ проводили в 12 общепринятых отведениях Запись осуществлялась на 6-канальном электрокардиографе «Megacart» фирмы Siemens, Швеция
Длительная регистрация ЭКГ по методу Holter (CM-ЭКГ) осуществлялась с помощью двухканального портативного кассетного регистратора в модифицированных грудных отведениях VI и V5 с последующей обработкой записи на системе Medilog Optima фирмы Oxford Medical (Великобритания) Определяли ЧСС среднесуточную, максимальную, минимальную, среднюю в период бодрствования и в период ночного сна
Определялся также циркадный индекс (ЦИ) — отношение средней дневной к средней ночной ЧСС
Подсчитывали общее количество суправентрикулярных и желудочковых экстрасистол за сутки, наличие сложных нарушений ритма сердца, их циркадность Для оценки прогностической значимости желудочковой аритмии использовали классификацию, разработанную В Lown и M Wolf (1971) в модификации W J McKenna с соавторами (1981) Кроме желудочковой аритмии II- V градации к значимым нарушениям ритма сердца и проводимости нами были отнесены мерцательная аритмия, пароксизмальная суправентрикулярная тахикардия, синдром слабости синусового узла, полная блокада левой ножки пучка и неполная трифасцикулярная блокада Для оценки вариабельности сердечного ритма (ВСР) использовались стандартные показатели временного и спектрального анализа Показатели ВСР изучались только у больных с преобладанием синусового ритма как в течение суток, так и отдельно в периоды бодрствования и сна При анализе исключались артефакты, эпизоды желудочковой тахикардии, аллоритмии, проводилась адекватная интерполяция (методом линейной регрессии или другими сходными алгоритмами) по значению предшествующего и последующего комплекса QRS, что помогало уменьшить ошибку
Суточное мониторирование АД было проведено 30 больным, преимущественно с обструктивной формой заболевания, с помощью приборов BPLab и Schiller Исследование проводилось до и после назначения p-адреноблокатора с целью индивидуального подбора его дозы Измерение АД в дневные часы проводилось с 15-ти минутным интервалом, в ночные- с 30-ти минутным Оценивались средние значения, суточный ритм и вариабельность АД в дневные и ночные часы, перечисленные параметры рассчитывались отдельно для систолического и диастолического АД
Статистическая обработка данных проводилась с использованием пакета Statistica for Windows, Version б на персональном компьютере методами вариационной статистики, корреляционного анализа Для описания данных в случае нормального распределения изучаемых признаков применялись их среднее значение и стандартное отклонение (Mis), оценка различий в этих группах проводилась на основании параметрических критериев t-Student, метод X2, различия считались достоверными при р<0,05 В связи с тем, что большинство данных не имело приближенно нормального распределения, центральные тенденции и дисперсии количественных признаков описывали медианой и интерквартильным размахом (25-й и 75-й процентили) Оценка различий в изучавшихся группах проводилась методами непараметрической статистики Анализ зависимости
между признаками осуществлялся при помощи коэффициента ранговой корреляции Спирмена
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ.
Результаты обследования показали, что клинические проявления ГКМП у детей можно выявить в любом возрасте, однако в большинстве случаев заболевание распознавалось в возрасте 7-11 лет Наименьшая частота встречаемости ГКМП отмечена нами у детей дошкольного возраста, особенно первых 3 лет жизни, что не противоречит данным литературы (Новикова Т Н ,1995,Амосова Е Н ,1999) На наш взгляд, это связано с тем, что заболевание длительное время может протекать бессимптомно в связи с неполным проявлением генетического дефекта до завершения роста организма Прогрессированию заболевания могут способствовать гормональные перестройки, а гакже повышенные физические нагрузки, о чем свидетельствует факт постановки диагноза у большинства детей в пре- и пубертатном периоде, те в период ускоренного роста и созревания организма
Заболевание во многих случаях характеризовалось скудной субъективной симптоматикой Многие больные в течение ряда лет чувствовали себя удовлетворительно, не предъявляли каких-либо жалоб, однако при целенаправленном сборе анамнеза обнаруживались утомляемость и слабость после интенсивных физических нагрузок, сердцебиение, приступы головокружения, а иногда и синкопальные состояния Субъективные симптомы встречались главным образом у детей с обструктивной формой ГКМП и трансформацией ГКМП в ДКМП Синкопальные состояния встречались в 26% случаев, в 1,2 раза чаще при обструктивной форме заболевания, чем при необструктивной Среди жалоб редко встречались сердцебиение и боли в области сердца, которые достаточно часто присутствуют у взрослых лиц с ГКМП (\Vigle ЕБ е1 а1,1995) Кардиалши были отмечены нами у 21% больных, в подавляющем большинстве случаев с прогрессирующим течением заболевания
Суточное мониторирование артериального давления, проведенное нами у 30 больных (6-ти с необструктивной, 24-х с обструктивной формой), средний возраст которых составил 14,4+1,1 лет, выявило склонность к гипотонии у детей с ГКМП Так средние цифры артериального давления у больных составляли 112/65 мм рт ст в дневные часы и 99/54 мм рт ст в ночные, что значимо отличалось от одноименных показателей у здоровых детей (данные М Э 8оегяе1 е1 а1,1997) только в период бодрствования
Ведущее место при обследовании больных придавали методу ультразвуковой диагностики, являющемуся приоритетным при постановке окончательного диагноза
По данным ЭХО-КГ у подавляющего большинства больных (66 детей, 94,28%) имела место ассиметричная гипертрофия миокарда левого желудочка, т е соотношение Тмжп/Тзслж составляло 1,3 и более Только у 4-х детей из 70 (2-х с обструктивной, 2-х с необструктивной формой) гипертрофия миокарда левого желудочка носила симметричный характер Гипертрофия МЖП имела различную локализацию и распространенность, наиболее редко диагносцировался верхушечный вариант гипертрофии, что согласуется с мнением ряда исследователей (Klues Н et al ,1995, Ryan М et al, 1995, Леонтьева ИВ, Белозеров Ю М, 2000) Наиболее выраженная гипертрофия миокарда левого желудочка, а также уменьшение его полости отмечалось у больных с обструктивной формой заболевания, о чем свидетельствует значимая разница средних величин, указанных параметров ЭхоКГ по сравнению с таковыми у детей с необструктивной формой ГКМП (Тмжп 2,03+0,7см и 1,4+0,Зсм, КДР 3,4±0,5 и 4,0+0,4 см соответственно) Диаметр левого предсердия был увеличен у 40 (57,14%) больных, в подавляющем большинстве случаев у детей с признаками обструкции Его средняя величина у детей с обструктивной формой ГКМП составила 3,0±0,86 см, у больных с необструктивной формой заболевания 2,4+0,32 см (t=2,55, р=0,01)
Нами было выявлено достоверное изменение таких показателей, как УО и МО, при этом у больных с необструктивной формой ГКМП средние величины УО и МО были больше, чем у детей с обструктивной формой заболевания Полученные данные указывают на относительно низкий сердечный выброс у детей с обструктивной формой ГКМП Было существенно увеличено (достоверно по сравнению с контрольной группой) среднее значение ФИ, характеризующей сократимость миокарда Преобладали изменения показателя сократимости сердечной мышцы у детей с обструктивной формой ГКМП (ФВ=0,8±0,05 у е), что по литературным данным свидетельствует не о повышении инотропного состояния миокарда, а о гипердинамическом характере его сокращения в условиях сниженной постнагрузки (Амосова Е Н , 1999)
У детей с ГКМП были выявлены существенные нарушения диастолической функции миокарда, наиболее выраженные у детей с обструктивной формой заболевания (табл 1) Об этом свидетельствует достоверное замедление максимальной скорости раннего диастолического наполнения левого желудочка (М1) при менее выраженном снижении скорости кровотока в систолу предсердий (М2) и уменьшение отношения скоростей (М1/М2) по сравнению с контролем На нарушение расслабления левого желудочка в диастоле указывают также удлинение времени изоволюмического расслабления (Тивр) и замедление скорости ауксоволюмического расслабления (Уавр) левого желудочка
У больных с трансформацией ГКМП в ДКМП эхокардиографические показатели в процессе наблюдения существенно изменялись Отмечалось прогрессирующее снижение показателей сократимости миокарда, которая в дебюте заболевания была повышенной, среднее значение ФИ уменьшалось с 80 до 47% (минимальное значение ФИ составляло 38%) При этом отмечалось нарастание дилатации полостей сердца, атриовеитрикулярной регургитации и легочной гипертензии Заслуживает внимания тот факт, что, несмотря на дилатацию левого желудочка у 2-х больных из 4-х сохранялись признаки обструкции его выводного тракта, а Тмжп достигала 26 мм
Таблица 1
Средние величины показателей диасголической функции миокарда левого желудочка у детей с ГКМП
Показатели Необструктивная форма (п=20) Обструктивная форма (п=46) Здоровые дети Р1 р2
М1 (мм/сек) 0,75+0,05* 0,61+0,03 0,84±0,04 >0,5 <0,001
М2(мм/сек) 0,46+0,03 0,58±0,036 0,51 ±0,04 >0,5 >0,23
М1/М2 1,61+0,14* 1,06+0,08 1,65±0,14 >0,5 <0,05
Тивр(мсек) 0,039+0,003* 0,069+0,002 0,02±0,001 <0,001 <0,001
Уавр(мм/сек) 79,4+5,4* 46,71±2,8 99,3±7,8 >0,5 <0,001
р1 — достоверность различий у больных с необструктивной, р2 — с обструктивной формой ГКМП по сравнению с контролем, *- достоверность различий между формами ГКМП
Корреляционный анализ, проведенный по методу Спирмена, выявил зависимость между наличием у больных синкопальных состояний и показателями ЭХО-КГ При уменьшении показателей КСР и КСО вероятность синкопальных состояний повышалась (р=0,03 и 0,04 соответственно) Замедление скорости ауксволюмического расслабления, увеличение времени изоволюмического расслабления и уменьшение отношения скоростей М1/М2, также было сопряжено с возникновением обмороков у больных с обструктивной формой ГКМП (р=0,05, 0,05 и 0,09 соответственно)
Длительное катамнестическое наблюдение позволило выделить 2 варианта течения заболевания стабильное (доброкачественное) и прогрессирующее, характеризующееся нарастанием толщины миокарда МЖП и ЗСЛЖ, усилением одышки, слабости, утомляемости, появлением отсутствовавших ранее синкопальных состояний, нарушений ритма сердца, признаков обструкции выходного тракта ЛЖ и легочной гипертензии, усилением диастолической дисфункции ЛЖ (65 и 35% больных соответственно) Нами выделено также 3 основных исхода ГКМП — больные выжившие, умершие и с трансформацией ГКМП в ДКМП За период наблюдения у 11(16%) больных
необструктивная форма заболевания сменилась обструктивной, у 4(5,7%) гипертрофическая кардиомиопатия — дилатационной Умерло 13(18,5%) больных, из них 4(5,7%) — с необструктивной формой, 5(7,1%) — с обструктивной, 4(5,7%) — с трансформацией ГКМП в ДКМП, причем на долю внезапной смерти приходилось около трети всех летальных исходов Ежегодная летальность по нашим данным составила 1,4%
Подробный анализ ЭКГ позволил выделить ряд изменений, наиболее характерных для этого заболевания У 33% больных отмечалась синусовая брадикардия, синусовая тахикардия — в 2 раза реже Еще в 17% случаев брадикардия была обусловлена наличием на ЭКГ правопредсердного замещающего ритма
Мутафьян О А (2003) описывает нарушения внутрижелудочковой проводимости у 30% детей с ГКМП В нашем исследовании данное нарушение проводимости встречалось в два раза чаще чаще — у 42 (60 %) детей Первой по частоте встречаемости являлась неполная блокада правой ножки п Гиса (15,7% больных), второй- блокада передней ветви левой ножки п Гиса (12,8% больных) Специфической для больных с ГКМП являлась блокада перегородочной ветви, имитирующая гипертрофию миокарда правого желудочка (8,5% больных) Только у 10% больных отмечалась полная блокада левой ножки п Гиса Комбинированное нарушение внутрижелудочковой проводимости встречалось в 14% случаев Нарушение проведения импульса по передней ветви ЛНПГ практически одинаково часто встречалось как при необструктивной, так и при обструктивной форме ГКМП, а блокада левой задней ветви и полная блокада левой ножки пуча Гиса чаще регистрировались при обструктивной форме и у больных с трансформацией гипертрофической кардиомиопатии в дилатационную Нарастающее нарушение проводимости по левой ножке пучка Гиса указывало на тяжелое, прогрессирующее течение данного заболевания
Нарушение синоатриальной и атриовентрикулярной проводимости на обьиной ЭКГ отмечались довольно редко, в 1,5 и 12% случаев соответственно Клинически значимые нарушения ритма сердца в виде пароксизмов суправентрикулярной и желудочковой тахикардии, желудочковой экстрасистолии и мерцательной аритмии были характерны только для больных с трансформацией ГКМП в ДКМП Синдром преждевременного возбуждения желудочков был зарегистрирован нами у 10 (14,3 %) больных, типичных приступов пароксизмальной тахикардии, а также синкопальных состояний не наблюдалось ни у одного из них
Патологический зубец 0 являлся довольно часто встречающейся особенностью ЭКГ у больных с ГКМП, регистрировался он более чем в 40% случаев, преимущественно при обструктивной форме заболевания на фоне сочетания гипертрофии межжелудочковой
перегородки и задней стенки левого желудочка Глубина зубца О составляла от 4-х до 25 мм На наличие патологического зубца С2 на ЭКГ у больных с ГКМП влияла комбинированная гипертрофия МЖП и задней стенки левого желудочка (табл 2)
Таблица 2
Толщина МЖП и миокарда задней стенки левого желудочка в зависимости от наличия на ЭКГ патологического зубца С> у детей с ГКМП
Среднее значение показателя /см/ Отсутствие патологического зубца Q Наличие патологического зубца Q t Р
Тмжп 1,77 1,95 -0,91 0,36
Тзслж 0,8 1,03 -2,09 0,04
Глубина зубца <3 также зависела преимущественно от толщины миокарда задней стенки левого желудочка. У больных с глубиной зубца О до 10 мм толщина миокарда задней стенки левого желудочка была значимо меньше, чем у больных с зубцом <3 более 10 мм Значения толщины миокарда межжелудочковой перегородки вновь значимо не различались, хотя и были выше у больных с глубоким зубцом О (табл 3)
У больных с глубиной зубца О до 10 мм толщина миокарда задней стенки левого желудочка была значимо меньше, чем у больных с зубцом <3 более 10 мм Значения толщины миокарда межжелудочковой перегородки вновь значимо не различались, хотя и были выше у больных с глубоким зубцом О (табл 3)
Таблица 3
Толщина МЖП и миокарда задней стенки левого желудочка у больных с ГКМП в
зависимости от глубины патологического зубца Q на ЭКГ
Среднее значение показателя /см/ Глубина зубца Q менее 10 мм Глубина зубца Q более 10 мм t Р
Тмжп 1,77 2,2 — 1,34 0,19
Тзслж 0,9 1,27 -2,15 0,04
Корреляционный анализ по методу Спирмена также выявил зависимость глубины зубца Q от толщины миокарда задней стенки левого желудочка (R = 0,48, р = 0,04)
Нами отмечено, что зубец Q в отведениях II, HI, aVF регистрировался преимущественно у больных с умеренной изолированной гипертрофией миокарда левого желудочка, при более тяжелом, прогрессирующем течении ГКМП помимо отведений II, III, aVF он диагностировался в отведениях V4-V6, при комбинированной гипертрофии миокарда левого и правого желудочков — в отведениях I, II, aVL, V4-V6 Исходя из полученных нами данных, можно предположить, что патологический зубец Q является не столько изолированным признаком гипертрофии межжелудочковой перегородки (В Maren с соавт ,1983), сколько косвенным критерием особенностей асимметрии гипертрофии левого желудочка
Прогностически неблагоприятным признаком, указывающим на прогрессирующее течение заболевания, являлось возникновение симптома «провала» зубца R в различных
отведениях, в результате чего комплекс <3113 трансформировался в (ЗЭ Инфарктоподобные изменения на ЭКГ, встречающиеся у взрослых больных достаточно часто (Рябыкина Г В и соавт,1989, Б^гаап V, 1993) в нашем исследовании при проспективном наблюдении были отмечены только у 4-х больных (из 29, имеющих на ЭКГ зубец 0) с прогрессирующим течением ГКМП Двое из этих больных умерли в возрасте 14 и 15 лет, один внезапно, другой на фоне трансформации ГКМП в ДКМП при нарастании симптомов застойной сердечной недостаточности Мы предполагаем, что в данном случае причиной возникновения «провала» комплекса <3118 мог явиться кардиосклероз, возникший за счет существования длительной ишемии миокарда Возможность наличия ишемии миокарда у больных с ГКМП подтверждается литературными данными (V 01ктап а! а1, 1993)
При изучении частоты регистрации признаков гипертрофии миокарда предсердий и желудочков на основании результатов анализа обычной ЭКГ в дебюте заболевания установлено, что наиболее характерной для больных, независимо от формы заболевания, была изолированная гипертрофия миокарда левого желудочка(45,3 %) Сочетанная гипертрофия различных отделов сердца встречалась редко, преимущественно у больных с обструктивной формой заболевания и 1 больного с трансформацией ГКМП в ДКМП Динамическое наблюдение показало, что в группе больных с необструктивной формой заболевания в 4,5 раза увеличилось количество пациентов с гипертрофией миокарда левых отделов сердца, что расценено нами как признак прогрессирующего течения заболевания Процент комбинированной гипертрофии обоих желудочков в этой группе оставался невысоким (5,5 %) Напротив, в группе больных с обструктивной формой заболевания увеличилась частота встречаемости комбинированной гипертрофии желудочков и предсердий в 1,6 раза, гипертрофии миокарда всех отделов сердца в 1,8 раза В группе больных с трансформацией ГКПМ в ДКМП процент встречаемости сочетанной гипертрофии предсердий и желудочков был самым высоким (66,6 %)
На ЭКГ у 82% обследованных детей имелись изменения процесса реполяризации различной степени выраженности от снижения амплитуды зубца Т (в 21% случаев) до выраженной его инверсии (в 61% случаев), вплоть до регистрации гигантских отрицательных зубцов Т (до 30 мм и более) в отведениях от VI до У6 Выраженное нарушение процесса реполяризации регистрировалось преимущественно у больных с обструктивной формой заболевания, исключением стал больной с верхушечной ГКМП
Изменение зубца Т у большинства больных сопровождалось смещением сегмента вТ по отношению к изолинии У больных с глубоким отрицательным зубцом Т сегмент вТ в тех же отведениях был ниже изолинии В то же время у детей с высокоамплитудным
зубцом Т отмечался подъем сегмента £Т С нашей точки зрения подобные изменения у детей со стенокардическим синдромом могут отражать относительный дефицит коронарного кровотока и гипоксию гипертрофированного миокарда У больных с необструктивной формой заболевания эти изменения могут быть связаны с изменением направления вектора реполяризации при выраженной асимметричной гипертрофии верхушки, дистальной части межжелудочковой перегородки и задней сосочковой мышцы (Hasegava К е1 а1, 1992)
Суточное мониторирование ЭКГ позволило получить информацию о характере, частоте встречаемости, суточном распределении и клинической значимости нарушений ритма сердца и проводимости у больных с ГКМП (табл 4)
Таблица 4
Нарушение ритма сердца и проводимости в зависимости от формы ГКМП
Нарушения ритма сердца и проводимости Н/ф (п = 20) О/ф (п = 46) ГКМП/ДКМП(п = 4) Всего (а = 70)
абс % абс % абс % абс %
Миграция водителя ритма 9 45 25 54,3 1 25 35 50
Суправентрикулярная экстрасистолия 17 85 29 63 2 50 48 69
Пароксизмальная суправентрикуляр-ная тахикардия — — 1 2,17 1 25 2 3
Желудочковая экстрасистолия 6 30 21 45,6 2 50 29 41
Пароксизмальная желудочковая тахикардия — — — — 1 25 1 1,4
Синоатриальная блокада 8 40 16 34,7 1 25 25 36
Атриовентрикулярная блокада I ст 2 10 7 15,2 1 25 10 14,3
Атриовентрикулярная блокада П ст 1 5 1 2,2 — — 2 3
Неполная трифасцикулярная блокада 2 10 — — — — 2 3
Мерцательная аритмия 2 50 2 3
Синдром слабости синусового узла 2 10 3 6,5 2 50 7 10
Атриовентрикулярная диссоциация 1 5 1 2,17 2 50 4 6
С-м преждеврем возб желудочков 4 20 6 13 — — 10 14
В дебюте заболевания суправентрикулярная экстрасистолия отмечалась у 48 (69 %)
пациентов, эпизоды пароксизмальной суправеитрикулярной тахикардии были зарегистрированы нами только у 2-х (2,8 %) больных у 1-го с обструктивной формой ГКМП, другого с трансформацией ГКМП в ДКМП Количество эпизодов составляло от 1-
го до 10-ти в сутки, продолжительность от 3-х комплексов QRS до 30 секунд и у ребенка с ДКМП до 10 минут Все пароксизмы отмечались только во время бодрствования Частота ритма в пароксизме составляла от 128 до 150 ударов в минуту Хотя суправентрикулярные аритмии не относятся к факторам риска внезапной смерти, их следует рассматривать как потенциально опасные, так как они могут привести к гемодинамическим нарушениям и ухудшению состояния больного (Nakatani М , 1996)
Мерцательная аритмия по данным литературы встречается у 10-30% взрослых больных с ГКМП (Robinson К et al, 1990, Olivotto I et al, 2001) В нашем наблюдении постоянная форма мерцательной аритмии была выявлена только у двух больных (2,8%) с тяжелым, прогрессирующим течением заболевания, трансформацией ГКМП в ДКМП и проявлением застойной сердечной недостаточности 2Бст Корреляционный анализ по методу Спирмена выявивл прямую зависимость между исходом заболевания и наличием у больных с ГКМП мерцательной аритмии (R=0,56, И0,34, р=0,001) Таким образом, роль мерцательной аритмии в танатогенезе больных ГКМП довольно высока
Желудочковая аритмия высоких (II — V) градаций в начале исследования отмечалась лишь у 37 % больных, что соответствовало мнению ряда авторов о том, что желудочковые нарушения ритма гораздо реже встречаются у детей, чем у взрослых больных с ГКМП (Muller G с соавт ,1995, Зардалишвшш В Ш , 1997) Однако, проспективное наблюдение показало, что частота встречаемости желудочковых аритмий возросла почти в 2 раза (до 68 %) Отличительной чертой больных с ГКМП являлось то, что частые единичные экстрасистолы в структуре желудочковых нарушений ритма сердца занимали довольно небольшую долю, тогда как желудочковые экстрасистолы III и IV градаций составляли наибольший процент при их довольно небольшом среднем количестве за сутки(220±144,9)
Данные литературы убедительно доказывают, насколько обосновано желудочковые нарушения ритма сердца ассоциируются с вероятностью возникновения фатальных аритмий, то есть с внезапной аритмогенной смертью (В Marón с соавт ,1990) Среди обследованных нами больных с желудочковой экстрасистолией 1-2 градации летальный исход был отмечен у 15%, 3-4 градации — у 21%, тогда, как у пациентов с пароксизмами желудочковой тахикардии (5-ая градация) в 67% случаев Таким образом, желудочковая тахикардия у больных с ГКМП является предиктором плохого пргноза, поскольку повышает вероятность летального исхода почти в 2 раза Динамическое наблюдение показало, что общее количество детей с желудочковой аритмией увеличилось преимущественно во 2-ой и 3-ей группах, однако процент больных с желудочковыми нарушениями ритма высоких градаций в 1-ой и 2-ой группах стал практически одинаков
(40 и 43% соответственно) Самой неблагоприятной по частоте встречаемости желудочковых нарушений ритма и степени их градации по-прежнему оставалась группа больных с трансформацией ГКМП в ДКМП Изучив суточное распределение клинически значимых нарушений ритма сердца у больных с необструктивной формой, а также со стабильным (доброкачественным) течением обструктифной формы мы получили следующие данные в 75% случаев НРС регистрировались в часы бодрствования, в 20% было характерно их равномерное распределение, в 5% ночное Среди больных с прогрессирующим течением обструктивной формы и трансформацией ГКМП в ДКМП преобладающим было дневное и равномерное распределение (48, 42 и 10 % случаев соответственно)
Суточное мониторирование ЭКГ выявило нарушение синоатриальной проводимости у 25-ти (35 %) больных У 8 (11 %) больных, 4-х с необстуктивной и 4-х с обструктивной формой заболевания, количество пауз колебалось от 20 до 58 за сутки, продолжительность их составляла от 1,5 до 1,8 сек и в одном случае до 2,7 сек, распределение их в течение суток было относительно равномерным При этом в 5 случаях из 8 имели место синкопальные состояния Проведенный нами корреляционный анализ выявил прямую зависимость между количеством синоатриальных блокад за сутки, продолжительностью пауз и синкопальными состояниями у обследованных больных (11=0,74, 1=2,7, р=0,006) Выявленная зависимость свидетельствует, что нарушение синоатриальной проводимости является еще одним механизмом возникновения синкопе у больных с ГКМП, причем независимо от формы заболевания У 7 детей, 3-х с необструктивной и 4-х с обструктивной ГКМП, нарушение синоатриальной проводимости сочеталось с постоянной миграцией водителя ритма из синусового узла в миокард правого предсердия, доминированием в течение суток эктопического правопредсердного ритма и выраженной брадикардией Выявленное у этих больных нарушение ритма сердца и проводимости было расценено нами в качестве признаков синдрома ССУ У двух больных с исходом ГКМП в ДКМП синдром ССУ сопровождался явлениями атриовентрикулярной диссоциации, наличием медленного замещающего атриовентрикулярного ритма и синкопальными состояниями
Нарушение атриовентрикулярной проводимости имело место у 17% больных, в подавляющем большинстве случаев в виде атриовентрикулярной блокады I степени Этот вид нарушения проводимости чаще отмечался у больных с обструктивной формой ГКМП
У 2-х детей с необструктивной формой заболевания атриовентрикулярная блокада III степени сопровождала нарушение внутрижелудочковой проводимости У обоих детей с необструктивной формой ГКМП и комбинированным нарушением внутрижелудочковой и
атриовентрикулярной проводимости исход заболевания был летальным, следовательно, выявленные изменения могут рассматриваться как фактор стратификации риска летальности у детей с ГКМП.
Состояние адаптационных возможностей организма больного характеризуют не только темпы прогрессирования сердечной недостаточности, выраженность нарушений ритма сердца и проводимости, но и динамика изменений параметров вариабельности сердечного ритма (Баевский P.M., Кириллов О.И., 1984., Куприянова O.Ü., 1995., Рябыкина Г.В., Соболев A.B., 2005).
Проведенный индивидуальный анализ временных и спектральных показателей вариабельности ритма сердца (ВРС) выявил явную неоднородность обследуемой популяции. Исходно в 48% случаев указанные выше параметры не отличались от таковых у здоровых детей, в 27% случаев превышали норму, и еще в 27% были существенно снижены. Как известно из литературных источников, у здоровых детей с возрастом от 3-х до 15-ти лет ВРС увеличивается, что отражает процесс усиления парасимпатических влияний на сердечный ритм (Макаров JI.M.,2000.). В нашей работе мы не получили соответствующих результатов. При проспективном наблюдении мы отмечали динамику показателей ВРС, которая зависела не столько от возраста, сколько от характера течения и исхода заболевания. Ухудшение функционального состояния миокарда сопровождалось нарушением симпато-вагального баланса, что находило отражение в достоверном отличии параметров ВРС по сравнению с группой здоровых детей. В динамике мы отмечали достоверное увеличение больных в группе с низкими показателями ВРС (р<0,05; х2=4,16) за счет уменьшения групп с нормальными и высокими параметрами ВРС ( рис.1).
Ухудшение функционального состояния миокарда сопровождалось нарушением симпато-вагального баланса, что находило отражение в достоверном отличии параметров ВРС по сравнению с группой здоровых детей. В динамике мы отмечали достоверное увеличение больных в группе с низкими показателями ВРС (р<0,05; х2=4,16) за счет уменьшения групп с нормальными и высокими параметрами ВРС ( рис.1).
В группе больных с исходно низкими или снижающимися в динамике показателями ВРС практически все временные и спектральные характеристики имели прямую связь с такими морфометрическими параметрами, как КДР, КДО и УО. При этом наиболее высокий коэффициент корреляции (г от 0,83 до 0,91) был получен для SDNN, rMSSD, pNN50 и общей мощности спектра (р<0,05 во всех случаях).
Рис.1. Группы больных в зависимости от показателей ВРС при проспективном наблюдении.
Исходно В динамике
□ Низкие показатели ВРС ЭНормальные показатели ВРС В Высокие показатели ВРС
Размер левого предсердия, напротив, имел обратную связь с показателем SDNN и общей мощностью спектра (г =-0,88 и -0,94, но находился в прямой зависимости от уровня симпатовагального баланса (г =0,95) Выявленная зависимость позволяет предположить, что у больных с ГКМП прогрессивное снижение показателей ВРС и нарушение симпатовагальных взаимоотношений отражает ухудшение функционального состояния миокарда, что характеризуется уменьшением размера полости левого желудочка, нарастанием митральной регургитации и появление дилатации левого предсердия
В группе больных с показателями ВРС не отличающимися от нормы, КДО и УО были связаны с показателем pNN50 среднесуточным и дневным, а также с мощностью волн HF диапазона в часы бодрствования (г > 0,6 во всех случаях) Заслуживает внимания тот факт, что у больных с показателями ВРС превышающими норму, отмечалась тесная связь УО с волнами LF диапазона (г = 0,9), а параметры SDNN и rMSSD (как среднесуточные, так и ночные) имели прямую связь с размерами правого предсердия (г составляет от 0,92 до 0,95) Для определения влияния вегетативной нервной системы на формирование патологической желудочковой активности у больных с ГКМП нами был проведен анализ связи показателей ВРС с желудочковой аритмией, классифицированной по Lown в модификации W МсКеппа У пациентов с желудочковой аритмией отмечалась склонность к тахикардии, показатель SDNN в дневные часы был ниже в 1,8 раза, имелась тенденция к понижению rMSSD, pNN50 был значимо более низким, а мощность волн диапазона ULF и показатель вагосимпатического баланса (LF/HF) были повышены (табл 5) Выявленные изменения указывали на повышение активности симпатического звена регуляции и недостаточность вагусной модуляции, что свидетельствовало о важной роли вагосимпатического дисбаланса в формировании аритмий у больных с ГКМП
Таблица 5
Показатели ВРС у больных с ГКМП в зависимости от наличия или отсутствия
желудочковой аритмии
Показатели Больные с ЖА Больные без ЖА
(среднее значение) (п=26) (п=38)
Mean день 578,68 679,72 0,02
SDNN день 56,23 101,08 0,01
rMSSD день 28,4 42,06 0,07
pNN50 день 5,84 13,82 0,02
ULF день 3035,38 1006,9 0,03
LF/HF день 3,86 1,94 0,0007
LF/HF сутки 3,4 1,54 0,01
Проведенный в зависимости от исхода заболевания сравнительный анализ суточных показателей ВРС выявил достоверные различия характеристик вагусного вегетативного обеспечения в период бодрствования, однако в группе больных с летальным исходом отмечалась тенденция к уменьшению общей мощности спектра, причем как за счет его высокочастотой (ЭТ), так и низкочастотной (и) составляющих (табл 6)
Таблица 6
Временные и спектральные характеристики в зависимости от исхода заболевания
Показатели Летальный исход (п=11) Me (25-75перц) Выжившие (п=33) Me (25-75перц) Р
Mean сут 746,5(674,1-786,7) 829,82(728,6-903,9) 0,04
Mean день 686,3(647,3-730,3) 756,97(658,4-831,3) 0,08
pNN50 сут 14,69(6,8-22,5) * 24,86(13,3-37,24) 0,04
pNN50 день 8,83(6,06-13,09) * 17,8(5,88-27,52) 0,04
Общая мощность день 4204,1(2240-5896,7) 7054,1(3283-8338) 0,08
HF сут 612,8(262-1111)* 1063,3(490,9-1286) 0,07
HF день 357,4(189,5-505,8) * 740,4(259,1-947,9) 0,07
LF сут 1221,5(433,7-2027) 1719(1010-1866) 0,1
LF день 873,04(402,7-1097,4) * 1537(685,3-1679,8) 0,07
*- достоверность отличий по сравнению со здоровыми детьми,
Р- между группами выживших и умерших больных
Только у больных с летальным исходом, не смотя на терапию р-адреноблокаторами, отмечалось в динамике двукратное снижение таких показателей временного анализа, как rMSSD и pNN50 (как среднесуточных, так и дневных), снижение общей мощности спектра- в 2- 12 раз, снижение мощности волн низкой частоты в 2-Зраза, а волн высокой частоты в 4-6 раз Коэффициент вегетативного баланса у этих больных возрастал в 2 раза Наибольшей была дельта общей мощности спектра, волн LF и HF у больных с трансформацией ГКМП в ДКМП Среди больных, имевших показатель rMSSD менее 48 мс и pNN50 менее 18% смертность составляла 41%, тогда как среди больных с более высокими показателями — 10,5% Таким образом, снижение указанных параметров временного анализа повышало риск летальности в 4 раза
Как известно, наличие синкопальных состояний в анамнезе является одним из наиболее информативных клинических факторов риска внезапной сердечной смерти у больных с ГКМП, особенно у детей и подростков (McKenna W at all ,1984, Azzano О at ail „1995) Проведенный нами тест Колмогорова-Смирнова выявил достоверные различия между показателями ВРС у больных с синкопальными состояниями и не имеющих таковых Так у больных, имеющих в анамнезе синкопе, среднесуточная и среднедневная ЧСС была достоверно выше ( р<0,02), отмечалось снижение rMSSD и pNN50 только в
дневное время (р<0,025 в обоих случаях), а также снижение мощности волн LF и HF диапазона на фоне бодрствования (р<0,025 и 0,05) По всей видимости, синкопальные состояния у больных с ГКМП могут быть обусловлены выраженным снижением сердечного выброса на фоне физической нагрузки и сопровождающей ее тахикардии в условиях недостаточности вагусных механизмов регуляции К тем же последствиям, вероятно, может приводить и эмоциональный стресс С другой стороны, вегетативный дисбаланс может способствовать развитию аритмогенной ситуации и возникновению жизнеугрожающих желудочковых аригмий У больных с синкопальными состояниями клинически значимые ЖА были зарегистрированы нами в 62% случаев, а без синкопе- в 32% Смертность в группе детей с синкопе составляла 33%, тогда, как в группе без синкопальных состояний 15%, т е риск летального исхода уменьшался в 2,2 раза
Схожие нарушения вегетативной регуляции сердечного ритма были выявлены нами у больных, имеющих в анамнезе случаи внезапной смерти в семье Эта группа больных также характеризовалась недостаточностью преимущественного вагусного обеспечения в дневные часы При этом смертность у больных без отягощенного анамнеза составляла 5%, тогда, как среди больных, имеющих случаи внезапной смерти в семье количество умерших возрастало до 14%, т е риск летального исхода повышался в 2,8 раза
Лечение ГКМП, генетически обусловленного заболевания, до настоящего времени остается в основном симптоматическим Различные проведенные ранее клинические исследования указывают на то, что терапия p-адреноблокаторами (БАБ) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики (Marón М, Ohvotto 1, 2003), а также способствует снижению летальности и устранению жизнеугрожающих желудочковых аритмий (Spinto Р at al, 2000)
Нами была проведена комплексная оценка влияния БАБ на клиническую картину, выраженность нарушений ритма сердца и вегетативную регуляцию сердечного ритма, а также на прогноз у детей с обструктивной формой ГКМП БАБ получали 32 пациента с обструктивной формой ГКМП, средний возраст которых составил 14+1 лет Всем больным пропранолол назначался в начальной дозе 0,5 мг/кг в сутки с постепенным увеличением дозы Подбор дозы проводился индивидуально под контролем артериального давления и ЧСС Максимальная доза составляла 1 мг/кг в сутки Применение пропранолола сопровождалось значимым улучшением самочувствия у больных в подавляющем большинстве случаев На фоне лечения отмечалось урежение средней ЧСС (суточной, ночной и дневной), которая составила ~ 76% от должной, отмечалось достоверне увеличения ударного и конечного диастолического объема, что говорило об улучшении наполнения левого желудочка В то же время нами не
зарегистрировано регрессии гипертрофии миокарда левого желудочка, а также непосредственного изменения показателей диастолической функции
Также нами отмечена положительная динамика параметров вариабельности ритма сердца Увеличились значения временных показателей р№^50,гМЯ8П , характеризующих парасимпатическое звено регуляции, данные спектрального анализа свидетельствовали о достоверном увеличении высокочастотных модуляций и о нормализации симпато-вагального баланса
Применение БАБ сопровождалось достоверным снижением выраженности клинически значимых нарушений ритма сердца в 73% случаев и характеризовалось преимущественно снижением градации желудочковых нарушений ритма Так число больных, имеющих ЖА 3-5 градации, уменьшилась на фоне лечения в 2,3 раза Несмотря на проводимую терапию 2-е пациентов умерли внезапно один в возрасте 16-ти лет на фоне выраженного психо-эмоционального стресса, второй — в возрасте 14 лет на фоне прогрессирующего течения заболевания и отсутствия положительной динамики на фоне лечения
С целью выявления семейных форм заболевания и клинико-функциональных особенностей его течения нами было проведено обследование 42-х неродственных семей, в число которых входило 40 детей с установленным диагнозом ГКМП и 125 их ближайших родственников Группу контроля, в которой дети были здоровы, составили 30 семей Все родственники обследовались независимо от наличия клинических проявлений
По результатам обследования все семьи были разделены нами на три подгруппы В 10 (25%) семьях, составивших 1-ую подгруппу, семейный характер ГКМП установить не удалось В 9 (22,5%) семьях 2-ой подгруппы по объективным причинам были обследованы только матери пробандов, у которых не было обнаружено признаков заболевания В 23 (57,5%) семьях 3-ей подгруппы нами был установлен наследственный характер заболевания Среди родителей с диагнозом ГКМП соотношение полов было 1 1, что характерно для классического аутосомно-доминантного типа наследования Средний возраст взрослых больных составлял 40,2±7,6 лет Средний возраст детей 1-ой и 3-ей подгрупп на момент постановки диагноза достоверно различался и составлял 10,6± 1,1 и 7,4+1,3 лет соответственно, что свидетельствует о более позднем появлении клинической симптоматики в случае спорадической формы заболевания
У детей третьей подгруппы в отличие от взрослых жалобы возникали достоверно чаще (р< 0,001), у 5 (21%) детей с прогрессирующим течением ГКМП отмечались боли в области сердца, на которые не жаловался ни один из взрослых пациентов
Частота встречаемости внезапной смерти в семьях с наследственным характером заболевания была значимо выше, чем в подгруппах 1 и 2, а также в группе контроля (р<0,05, точный критерий Фишера Р=0,041 и 0,023 соответственно) Подгруппы с неустановленным наследственным характером ГКМП и группа контроля по числу случаев внезапной смерти достоверно не различались (р>0,1, точный критерий Фишера Р=0,б9) Только в 4-х семьях третьей подгруппы нами было отмечено по 2 случая внезапной смерти в одном поколении
Формы заболевания у пробандов и их ближайших родственников совпадали в 61% случаев, что вероятно свидетельствует о важной роли факторов внешней среды, а также наличии дополнительных генетических факторов, как модуляторов фенотипической экспрессии заболевания В 39% семей заболевание носило более выраженный характер у пробандов, нежели у их родителей Средние значения толщины межжелудочковой перегородки и задней стенки левого желудочка у пробандов и их родителей с ГКМП существенно не различались, несмотря на значительную разницу в возрасте (Тмжп 1,75+0,65 см и 1,9+0,39 см, Тзслж 0,92+0,39 см и 0,96+0,14 см соответственно, р>0,05) Возможно, это является косвенным признаком более тяжелого течения заболевания у пробандов, чем у родственников предыдущего поколения Нами также установлено, что в дебюте заболевания морфометрические показатели детей 1-ой и 3-ей подгрупп существенно не различались, однако проспективное наблюдение выявило достоверно более выраженные гипертрофию межжелудочковой перегородки, задней стенки левого желудочка, дилатацию левого предсердия и диастолическую дисфункцию у больных с семейной формой ГКМП (р<0,05 во всех случаях)
Различные ЭКГ- изменения отмечались у 95% детей и 74% взрослых ( ?-2=4,55, р<0,05) У детей изменения электрокардиограммы выявлялись независимо от формы ГКМП, различаясь лишь степенью выраженности У взрослых больных отмечалась взаимосвязь наличия изменений на ЭКГ с формой заболевания и у большинства взрослых с необструктивной формой ЭКГ была в пределах возрастной нормы
При изучении временных и спектральных показателей вариабельности сердечного ритма нами были выявлены нарушения автономной регуляции деятельности сердца как у пробандов, так и у их родителей Внимания заслуживает тот факт, что особенности вариабельности ритма сердца (те индивидуальные вегетативные профили) у членов одной семьи в 80% случаев были схожи
Совместно с институтом клинической кардиологии им А Л Мясникова 9 пациентам из 8 неродственных семей была проведена ДНК-диагностика, направленная на поиск генетических дефектов (Селезнев Д М , Габрусенко С А, Ткачук Е В , 2005) В
общей сложности в 3-23 экзонах гена р-МНС у обследованных пациентов было обнаружено 12 различных типов аберрантных хроматографических картин, причем в 11 случаях из 12 замены нуклеотидов не меняли аминокислотную последовательность белка Лишь у одного пациента замена аденина на цитозин в 22-м экзоне гена Р-МНС привела к замене лизина на треонин в 835-й позиции белка Данная миссенс-мутация не была описана ранее в мировой литературе и, возможно, является уникальной для российской популяции Тот факт, что лишь у 1 из 8 пациентов мутация была найдена в гене Р-МНС, может свидетельствовать о невысокой распространенности мутаций в данном гене у российских пациентов с ГКМП, что также наблюдается в Финляндйи(7аа. чке1атеп Р, Soranta M , at al, 1998) и Швеции (Morner S , Richard PI ,2003)
чке1атеп Р, Soranta M , at al, 1998) и Швеции (Morner S , Richard PI ,2003)
ВЫВОДЫ
1 Гипертрофическая кардиомиопатия y 65% детей характеризуется стабильным, доброкачественным течением Течение гипертрофической кардиомиопатии у 35% детей носит прогрессирующий характер, что проявляется нарастанием толщины миокарда межжелудочковой перегородки и задней стенки левого желудочка, уменьшением полости левого желудочка, появлением или увеличением признаков обструкции выходного тракта левого желудочка, митральной регургитации, дилатации левого предсердия, а также возникновением жалоб и синкопальных состояний
2. Показатели вариабельности ритма сердца у детей с гипертрофической кардиомиопатией характеризуются значительной вариабельностью и зависят от характера течения заболевания и семейного вегетативного профиля Прогрессирующее течение заболевания сопровождается снижением временных и спектральных показателей вариабельности ритма сердца, характеризующих парасимпатическое звено регуляции и нарастанием вагосимпатического баланса
3. Семейные формы гипертрофической кардиомиопатии с наследованием по аутосомно-доминантному типу выявлены в 57,5 % случаев Формы заболевания у пробандов и их ближайших родственников совпадают в 61% случаев, в 39% случаев у пробандов определяется обструктивная форма гипертрофической кардиомиопатии при отсутствии признаков обструкции у родителей, что свидетельствует о более тяжелом течении заболевания у пробандов и сопряжено с более высоким риском летального исхода
Семейные формы гипертрофической кардиомиопатии с наследованием по аутосомно-доминантному типу выявлены в 57,5 % случаев Формы заболевания у пробандов и их ближайших родственников совпадают в 61% случаев, в 39% случаев у пробандов определяется обструктивная форма гипертрофической кардиомиопатии при отсутствии признаков обструкции у родителей, что свидетельствует о более тяжелом течении заболевания у пробандов и сопряжено с более высоким риском летального исхода
4. Применение p-адреноблокатора пропранолола у больных с обструктивной формой гипертрофической кардиомиопатии приводит «к улучшению самочувствия, оказывает позитивное влияние на параметры вариабельности ритма сердца, улучшает
диастолическое наполнение левого желудочка, а также способствует профилактике жизнеугрожакяцих аритмий
5. Критериями неблагоприятного прогноза и прогрессирующего течения гипертрофической кардиомиопатии у детей являются случаи внезапной смерти в семье, наличие в анамнезе синкопе, формирование комплекса типа (^Б и нарастающее нарушение проводимости по левой ножке п Гиса, желудочковая аритмия высоких градаций, мерцательная аритмия, синдром слабости синусового узла и дистальная атриовентрикулярная блокада 1-2 степени, выявление исходно низких показателей вариабельности ритма сердца в дебюте заболевания, а также их снижение на 50% от исходного в динамике, снижение показателей вариабельности сердечного ритма на фоне постоянного приема (5-адреноблокатора
Практические рекомендации
1 Для определения характера течения и прогноза гипертрофической кардиомиопатии у детей необходимо проведение клинико-генеалогического обследования
2 В комплекс инструментальных методов исследования детей с гипертрофической кардиомиопатией, независимо от наличия клинических проявлений и формы заболевания, необходимо обязательное включение суточного мониторирования ЭКГ с оценкой дизритмий и анализом вариабельности ритма сердца, что позволяет у детей с гипертрофической кардиомиопатией с большей долей вероятности прогнозировать неблагоприятный исход заболевания и своевременно принять меры по его предупреждению
3 Профилактика синкопе и внезапной сердечной смерти у детей с гипертрофической кардиомиопатией включает обязательное ограничение физических и эмоциональных нагрузок
4 Детям с обструктивной формой заболевания для профилактики жизнеугрожакяцих аритмий и улучшения вегетативной регуляции показано применение бета-блокаторов под контролем частоты сердечных сокращений и артериального давления
5 Критериями оценки эффективности терапии являются исчезновение клинически значимых желудочковых нарушений ритма сердца, положительная динамика морфометрических и функциональных параметров сердца, а также повышение показателей, характеризующих парасимпатическое звено регуляции и нормализация симпато-вагального баланса
Список работ, опубликованных по теме диссертации
1 Куприянова О О , Сербии В И , Белова Н Р , Тихомирова Е А Особенности ЭКГ у детей с гипертрофической кардиомиопатией // Нижегородский медицинский журнал -2001 -№2- С 56-59
2 Иванов А П, Куприянова О О, Басаргина Е Н, Тихомирова Е А Морфо-функциональное состояние миокарда при семейных формах гипертрофической кардиомиопатии // Материалы Всероссийского Конгресса «Детская кардиология» -М, 2002 — С 93
3 Тихомиров Е Е , Березнева Н А , Куприянова О О , Тихомирова Е А Полиморфизм гена ангиотензинпревращающего фермента у детей с гипертрофической кардиомиопатией // Материалы Всероссийского Конгресса «Детская кардиология» -М, 2002 — С 74
4 Иванов А П, Куприянова О О, Басаргина Е Н, Тихомирова Е А Оценка морфофункциональных особенностей миокарда у детей с гипертрофической кардиомиопатией и их ближайших родственников // Материалы Всероссийского Конгресса «Вторые Тульские чтения» — Т, 2003 — С 41
5 Тихомиров Е Е, Березнева Н А , Тихомирова Е А , Куприянова О О , Басаргина Е Н Генный полиморфизм кардиомиопатий у детей // Материалы Всероссийского Конгресса «Детская кардиология» — М, 2004 — С 303
6 Селезнев Д М , Тихомирова Е А, Иванов А П , Наумов В Г , Басаргина Е Н Случай внезапной смерти в молодом возрасте вследствие гипертрофической кардиомиопатии, вызванный мутацией в гене тяжелых цепей бета-миозина //Российский педиатрический журнал — 2005 — №1- С 59-61
7 Тихомирова Е А , Куприянова О О, Басаргина Е Н , Журкова Н В Диагностика различных форм гипертрофической кардиомиопатии // Материалы V Съезда Российского общества мед генетиков — У -2005 — С 367
8 Куприянова О О , Тихомирова Е А , Басаргина Е Н, Иванов А П Особенности течения гипертрофической кардиомиопатии при семейных формах заболевания //Материалы Конгресса международного общества по Холтеровскому мониторированию и неинвазивной электрокардиологии — Афины- 2007 — С 136
9 Тихомирова Е А, Куприянова О О , Басаргина Е Н, Иванов А П Динамика показателей сердечно-сосудистой системы на фоне применения (3-адреноблокаторов у детей с обструктивной формой гипертрофической кардиомиопатии //Педиатрическая фармакология — 2007 — Том 4, №5- С 60-63
Отпечатано в копицентре «СТ ПРИНТ» Москва, Ленинские горы, МГУ, 1 Гуманитарный корпус www stpnnt ru e-mail zakaz@stprint ru тел 939-33-38 Тираж 50 экз Подписано в печать 31 10 2007 г
Клинические исследование Гипертрофическая кардиомиопатия (ГКМП) — Реестр клинических исследований
Пациенты с HCM имеют повышенную частоту внезапной смерти, особенно в молодом возрасте. физические лица. Тем не менее, ГКМП имеет сильно различающиеся клинические проявления, и риск внезапная смерть и события аритмии (НЯ) значительно различаются от одного пациента к другому. Было предложено несколько факторов риска НЯ. Эти факторы риска определены в преимущественно взрослые популяции с HCM. Имеется мало данных, определяющих факторы риска внезапная смерть в тщательно определенной популяции HCM, состоящей только из детей и подростков. Те, кто находится в группе повышенного риска, могут получить пользу от имплантируемого дефибриллятора (ИКД). Однако повсеместное применение ИКД-терапии не обходится без значительной заболеваемости и смертности.
физические лица. Тем не менее, ГКМП имеет сильно различающиеся клинические проявления, и риск внезапная смерть и события аритмии (НЯ) значительно различаются от одного пациента к другому. Было предложено несколько факторов риска НЯ. Эти факторы риска определены в преимущественно взрослые популяции с HCM. Имеется мало данных, определяющих факторы риска внезапная смерть в тщательно определенной популяции HCM, состоящей только из детей и подростков. Те, кто находится в группе повышенного риска, могут получить пользу от имплантируемого дефибриллятора (ИКД). Однако повсеместное применение ИКД-терапии не обходится без значительной заболеваемости и смертности.
Традиционные факторы риска внезапной смерти (SD) у взрослых пациентов с HCM включают семейный анамнез. SD, молодой возраст, неустойчивая желудочковая тахикардия (ЖТ) при холтеровском мониторинге, повышенная толщина межжелудочковой перегородки (ST), реакция аномального артериального давления (АД) на упражнения и обмороки.
Целью данного исследования будет: 1) определить, существуют ли факторы риска и механизмы НЯ у взрослых имеют прогностическое значение у детей, и 2) в частности, желудочковые толщина перегородки и индуцируемая желудочковая тахикардия при электрофизиологическом исследовании (EPS) определит подгруппу детей, которым имплантация ИКД может принести наибольшую пользу.
Клинические признаки, которые будут изучены как потенциальные предикторы НЯ, включали: возраст в представление в NIH; семейный анамнез SD; предобморочное состояние или обморок; вызванное осуществление гипотония; толщина межжелудочковой перегородки; Обструкция оттока ЛЖ; повышение конечного диастолического давления ЛЖ давление; Продолжительность QRS; Интервал QT; ВТ на амбулаторном электрокардиографическом мониторинге; ишемия миокарда при стрессовой ядерной перфузии; индуцибельная ЖТ; внутри сердца интервалы проводимости; и желудочковые рефрактерные периоды. Статистическая значимость для анализ времени до события будет оцениваться с использованием статистики логарифмического ранга для дихотомических переменных и статистика Кокса для непрерывных переменных.
Мы ожидаем, что это исследование улучшит стратификацию риска у детей и подростков. с HCM, расширяют нашу способность прогнозировать НЯ и уточняют рекомендации по терапии ИКД в дети.
ОСОБЕННОСТИ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ У ПОЖИЛЫХ ПАЦИЕНТОВ | Полякова
1. 2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy // J. Am. Coll. Cardiol. — 2011. — Vol. 58, № 25. — P. 212–260.
2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy // J. Am. Coll. Cardiol. — 2011. — Vol. 58, № 25. — P. 212–260.
2. Wilkinson J.D., Sleeper L.A., Alvarez J.A. et al. The pediatric cardiomyopathy registry: 1995–2007 // Prog. Pediatr. Cardiol. — 2008. — Vol. 25, № 1. — P. 31–36.
3. Maron B.J., Rowin E.J., Casey S.A. et al. Risk stratification and outcome of patients with hypertrophic cardiomyopathy ≥ 60 years of age // Circulation. — 2013. — Vol. 127, № 5. — P. 585–593.
4. Maron B.J., Maron M.S. Hypertrophic cardiomyopathy // Lancet. — 2013. — Vol. 381, № 9862. — P. 242–255.
5. Niimura H., Patton K.K., McKenna W.J. et al. Sarcomere protein gene mytations in hypertrophic cardiomyopathy of the elderly // Circulation.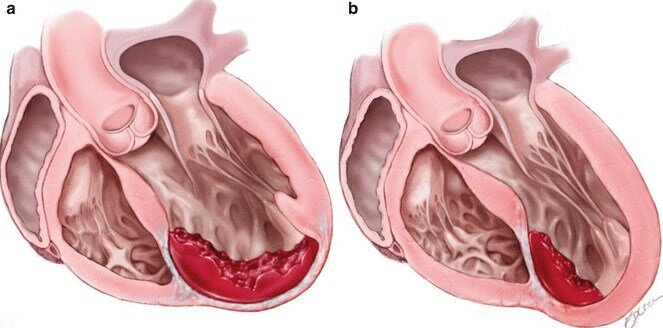 — 2002. — Vol. 105, № 4. — P. 446–451.
— 2002. — Vol. 105, № 4. — P. 446–451.
6. Konno T., Shimizu M., Ino H. et al. A novel missense mutation in the myosin-binding protein C gene is responsible for hypertrophic cardiomyopathy with left ventricular dysfunction and dilation in elderly patients // J. Am. Coll. Cardiol. — 2003. — Vol. 41, № 5. — P. 781–786.
7. Lai Z.Y., Shih C.M., Chang N.C., Wang T.C. Clinical and morphologic features of hypertrophic cardiomyopathy in elderlypatients 85 years or older. // Jpn Heart J. — 1999. — Vol. 40,
8. № 2. — P. 155–164.
9. Maron B.J., Casey S.A., Haas T.S., Kitner C.L., Garberich R.F., Lesser J.R. Hypertrophic cardiomyopathy with longevity to 90 years or older // Am. J. Cardiol. — 2012. — Vol. 109, № 9. — P. 1341–1347.
— 2012. — Vol. 109, № 9. — P. 1341–1347.
10. Erdmann J., Raible J., Maki-Abadi J. et al. Spectrum of clinical phenotypes and gene variants in cardiac myosin-binding protein C mutation carriers with hypertrophic cardiomyopathy // J. Am. Coll. Cardiol. — 2001. — Vol. 38, № 2. — P. 322–330.
11. Olivotto I., Ommen S.R., Maron M.S., Cecchi F., Maron B.J. Surgical myectomy versus alcohol septal ablation for obstructive hypertrophic cardiomyopathy // J. Am. Coll. Cardiol. — 2007. — Vol. 50, № 9. — P. 831–834.
12. Гудкова А.Я., Шляхто Е.В. Клеточные механизмы ги- Гудкова А.Я., Шляхто Е.В. Клеточные механизмы гипертрофии миокарда при гипертрофической кардиомиопатии и эссенциальной артериальной гипертензии (обзор литературы и результаты собственных исследований) // Артериальная гипертензия. — 2008. — Т. 14, № 4. — С. 373–380. / Goodkova A.Ya., Shlyakhto E.V. Cellular mechanisms of myocardial hypertrophy in hypertrophic cardiomyopathy and essential hypertension // Arterial Hypertension [Arterialnaya Gipertenziya]. — 2008. — Vol. 14, № 4. — Р. 373–380 [Russian].
— 2008. — Т. 14, № 4. — С. 373–380. / Goodkova A.Ya., Shlyakhto E.V. Cellular mechanisms of myocardial hypertrophy in hypertrophic cardiomyopathy and essential hypertension // Arterial Hypertension [Arterialnaya Gipertenziya]. — 2008. — Vol. 14, № 4. — Р. 373–380 [Russian].
13. Гудкова А.Я. Характеристика сердечной недостаточности у пациентов с обструктивной гипертрофической кардиомиопатией (обзор литературы и результаты собственных исследований) // Артериальная гипертензия. — 2008. — Т. 14, № 2. — С. 39–49. / Goodkova A.Ya. Characteristics of heart failure in patients with obstructive hypertrophic cardiomyopathy (review and own results) // Arterial Hypertension [Arterialnaya Gipertenziya]. — 2008. — Vol. 14, № 2. — Р. 39–49 [Russian].
14. Akshay Desai, Fang J.C. Heart failure with preserved ejection fraction: hypertension, diabetes, obesity/sleep apnea and hypertrophic and infiltrative cardiomyopathy // Heart Fail. Clin. — 2008. — Vol. 4, № 1. — P. 87–97.
Clin. — 2008. — Vol. 4, № 1. — P. 87–97.
15. Romano R., Losi M.A., Migliore T. et al. Evaluation of the left ventricular anatomy in hypertrophic cardiomyopathy: comparison between echocardiography and cardiac magnetic resonance imaging // Minerva Cardioangiol. — 2008. — Vol. 56, № 2. — P. 181–187.
16. Mahrholdt H., Wagner A., Judd R.M., Sechtem U., Kim R.J. Delayed enhancement cardiovascular magnetic resonance assessment of non-ischaemic cardiomyopathies // Eur. Heart J. — 2005. — Vol. 26, № 15. — P. 1461–1474.
Кардиомиопатия у детей и подростков
Редкая и часто недооцененная кардиомиопатия является основной причиной внезапной сердечной смерти у детей в возрасте до 18 лет. Поскольку заболевание протекает бессимптомно, семьи должны знать всех членов семьи, которые страдаете сердечным заболеванием или неожиданно умерли в возрасте до 50 лет.
Читайте ответы на часто задаваемые вопросы Американской академии педиатрии о кардиомиопатии у детей.
Что такое кардиомиопатия?
Кардиомиопатия — это хроническое заболевание сердца, при котором происходит разрушение сердечной мышцы (миокарда).Сердечная мышца становится ненормально увеличенной, утолщенной или жесткой. В конце концов сердце не может эффективно перекачивать кровь и не может снабжать организм достаточным количеством крови для функционирования. В тяжелых случаях кардиомиопатия может привести к сердечной недостаточности или внезапной смерти.
Существует 5 форм кардиомиопатии:
Дилатационная кардиомиопатия (DCM)
Гипертрофическая кардиомиопатия (HCM)
Рестриктивная кардиомиопатия (RCM) 9205
Правосторонняя кардиомиопатия (RCM)
)Кардиомиопатия без уплотнения левого желудочка (LVNC)
Кто заболевает кардиомиопатией?
Кардиомиопатия поражает преимущественно взрослых, но в редких случаях поражает младенцев и детей.
Согласно
В Североамериканском реестре детской кардиомиопатии каждый год у одного из 100000 детей в США диагностируется кардиомиопатия. Однако это консервативное число, поскольку оно не включает все типы кардиомиопатий. Кардиомиопатия может возникнуть у любого ребенка независимо от возраста, пола, расы или экономического положения.
Причины кардиомиопатии у детей
Есть много причин кардиомиопатии у детей, в том числе некоторые, которые до конца не изучены.Общие причины включают:
Наследование состояния от одного или обоих родителей
Вирусная инфекция
Токсины, поражающие другие органы
Использование химиотерапевтических препаратов
Метаболические, митохондриальные или системные заболевания в частях тела кроме сердца
Несмотря на достижения в
генетическое тестирование, точная причина остается неизвестной у 2/3 диагностированных детей.
Симптомы детской кардиомиопатии
Иногда симптомы детской кардиомиопатии можно принять за простуду, грипп, астму или боль в животе. У некоторых пораженных детей симптомы отсутствуют, в то время как у других может наблюдаться любой из следующих симптомов:
Одышка или учащенное дыхание
Головокружение и обмороки
Нерегулярное или учащенное сердцебиение
Вздутие или вздутие живота
Боль в груди
Чрезвычайная усталость
Младенцы могут испытывать плохую прибавку в весе, сильную сонливость, затруднения при кормлении или чрезмерное потоотделение.
Как диагностируется детская кардиомиопатия?
А
детский кардиолог подтверждает диагноз с помощью
эхокардиограмма (эхо) и
электрокардиограмма (ЭКГ, или ЭКГ). В некоторых случаях необходимы другие медицинские тесты. Для выяснения причины заболевания может быть рекомендовано генетическое тестирование.
Для выяснения причины заболевания может быть рекомендовано генетическое тестирование.
Поскольку детская кардиомиопатия встречается редко, рекомендуется открыть детский медицинский центр с большим опытом лечения детей с кардиомиопатией.Ранняя диагностика и лечение заболевания необходимы для предотвращения осложнений и прогрессирования сердечной недостаточности.
Варианты лечения кардиомиопатии
Кардиомиопатия неизлечима, но болезнь поддается лечению. Симптомы и осложнения можно контролировать с помощью лекарств, хирургического вмешательства и имплантируемых устройств. Тип кардиомиопатии и ее тяжесть определяют план лечения.
Лекарство обычно является первым вариантом лечения, улучшающим работу сердца.
Имплантируемый кардиовертер-дефибриллятор (ICD) может потребоваться для регулирования сердцебиения у детей с нерегулярным сердечным ритмом (аритмией).
Хирургическая процедура, называемая миэктомией , может облегчить некоторые симптомы у детей с ГКМП.

Пересадка сердца может потребоваться, если медицинское лечение неэффективно для контроля симптомов и предотвращения сердечной недостаточности.
Генетические аспекты
Кардиомиопатия часто бывает генетической, поэтому важно оценить риск наследственности в семье и обсудить семейный скрининг. Детский кардиолог и педиатр-генетик должен вместе составить план скрининга и обсудить варианты генетического тестирования.
Как диагноз влияет на образ жизни ребенка?
Хотя кардиомиопатия является хроническим заболеванием, многие дети с кардиомиопатией ведут относительно нормальную жизнь с небольшими ограничениями.Скорее всего, для постановки диагноза потребуется больше посещений кардиолога и ежедневный прием лекарств. Другие корректировки могут включать ограничение от
соревновательные и контактные виды спорта, изменение диеты и школьные условия.
Дополнительная информация
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра. Ваш педиатр может порекомендовать различные варианты лечения в зависимости от индивидуальных фактов и обстоятельств.
Ваш педиатр может порекомендовать различные варианты лечения в зависимости от индивидуальных фактов и обстоятельств.
Кардиомиопатия | Детская больница Филадельфии
Кардиомиопатия — заболевание сердечной мышцы (миокарда). Мышца становится ненормально толстой, жесткой или увеличенной, что влияет на способность сердца наполнять или перекачивать кровь и поддерживать ее ритм.
Существуют разные виды кардиомиопатий, в том числе:
- Дилатационная кардиомиопатия : наиболее распространенный тип как у взрослых, так и у детей. Это происходит, когда насосные камеры (желудочки) сердца ненормально увеличиваются и ослабляются.У некоторых детей с расширенным сердцем симптомы отсутствуют, в то время как у других развивается сердечная недостаточность (затрудненное дыхание, затрудненное питание, чрезмерное потоотделение и плохой рост). Существует много различных причин дилатационной кардиомиопатии. В некоторых семьях много членов из многих поколений, страдающих этим типом кардиомиопатии, который известен как семейная дилатационная кардиомиопатия.

- Гипертрофическая кардиомиопатия : Возникает, когда одна или несколько насосных камер (желудочков) в сердце вашего ребенка становятся необычно утолщенными или «скованными мышцами».»Это может повлиять на левый желудочек, который перекачивает кровь к телу, или на левый и правый желудочки (правый желудочек перекачивает кровь в легкие). Этот тип кардиомиопатии часто связан с нарушением сердечного ритма, что может привести к внезапному смерть. Гипертрофическая кардиомиопатия может передаваться по наследству; членам пострадавших семей рекомендуется пройти обследование.
- Рестриктивная кардиомиопатия : Самый редкий вид кардиомиопатии у детей. Камеры сердца становятся жесткими, что приводит к неправильному расслаблению сердечной мышцы, так что сердце вашего ребенка не может в достаточной степени наполняться кровью.При этом заболевании также могут возникать нарушения сердечного ритма. Не существует лекарств, которые, как известно, улучшают состояние пациентов с рестриктивной кардиомиопатией, и детям с этим заболеванием часто рекомендуется пересадка сердца.

- Некомпактная кардиомиопатия : Характеризуется губчатым внешним видом сердечной мышцы при эхокардиографии. Считается, что причиной некомпактной кардиомиопатии является неполное созревание сердечных клеток. Он может существовать отдельно или вместе со структурным заболеванием сердца; это может быть частью основного синдрома или возникать идиопатическим путем (без установления причины).Сердце без компрессии может быть расширено со сниженной насосной функцией, как при дилатационной кардиомиопатии (см. Выше), или может иметь нормальную насосную функцию. Насосные камеры также могут утолщаться, как при гипертрофической кардиомиопатии (см. Выше). Это наиболее вариабельная форма кардиомиопатии, поскольку при диагностировании в раннем возрасте дети могут болеть из-за плохо функционирующего сердца, в то время как некомпактная кардиомиопатия также может быть обнаружена у детей старшего возраста и взрослых, у которых не развились какие-либо симптомы нарушения функции сердца.
 .
.
В некоторых случаях сердце ребенка, страдающего кардиомиопатией, становится все более слабым, и у ребенка наступает стадия сердечной недостаточности (затрудненное дыхание, затрудненное питание, чрезмерное потоотделение и плохой рост), достаточно развитая, чтобы потребовать трансплантации. Однако в некоторых случаях кардиомиопатии можно лечить с помощью лекарств, и здоровье ребенка может улучшиться.
Когда у детей развивается кардиомиопатия, часто не обнаруживается какого-либо фактора, такого как другое заболевание.Иногда кардиомиопатия передается по наследству (передается от семьи из-за генетических различий).
Реже у детей причина кардиомиопатии поддается идентификации. Инфекция сердца, называемая миокардитом, нарушение белка в сердечной мышце, химиотерапевтические препараты, нарушения обмена веществ или мышечные расстройства — это одни из факторов, которые могут вызвать кардиомиопатию у ребенка или подростка.
Иногда, особенно когда у взрослых развиваются кардиомиопатии, заболевание вызывается такими факторами, как диабет, перенесенный ранее сердечный приступ или определенные химиотерапевтические препараты.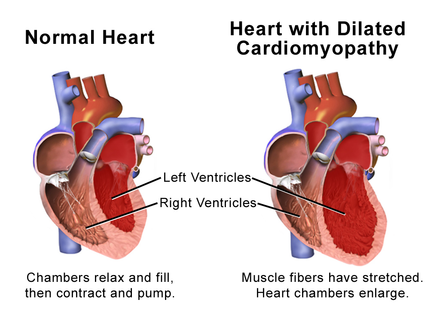 Однако во многих случаях, как у взрослых, так и у детей, врачи не знают, что вызывает кардиомиопатии.
Однако во многих случаях, как у взрослых, так и у детей, врачи не знают, что вызывает кардиомиопатии.
Симптомы кардиомиопатии широко различаются по типу и степени тяжести.
Иногда у младенцев появляются симптомы кардиомиопатии вскоре после рождения. Они могут включать:
- Затрудненное дыхание
- Потливость во время кормления грудью или принятия бутылочки
- Плохая прибавка в весе
- Раздражительность, вялость или невосприимчивость (ребенок кажется «не в себе»)
Иногда симптомы не проявляются, пока ребенок не подрастет.Они могут включать:
- Шумы в сердце или другие аномальные сердечные тоны при прослушивании врачом с помощью стетоскопа
- Затруднения при выполнении упражнений, затрудненное дыхание и / или боли в груди при выполнении упражнений
- Головокружение или обморок
- Необычная усталость
- Учащенное сердцебиение
- Рвота и боли в животе
Диагностика кардиомиопатии может включать:
Во время катетеризации сердца врач может взять биопсию (крошечные кусочки ткани сердца), которые будут изучены в лаборатории.
Если одному человеку в семье поставлен диагноз кардиомиопатии, может оказаться важным, чтобы кардиолог обследовал других членов семьи, чтобы оценить их риск. Детская больница Филадельфии и Система здравоохранения Пенсильванского университета создали Программу семейной кардиомиопатии для оценки и лечения детей и взрослых с кардиомиопатиями.
Варианты лечения кардиомиопатии широко варьируются в зависимости от типа и степени тяжести кардиомиопатии.
Лекарства
В зависимости от типа кардиомиопатии врачи могут прописать лекарства, которые помогают уменьшить размер расширенного сердца, расслабить сердце, увеличить силу откачки крови, регулировать ритм сердца или помочь другим способом. Часто несколько лекарств используются в комбинации.
Кардиостимуляторы и имплантируемые дефибрилляторы
Эти устройства помогают контролировать сердечный ритм, чтобы сердце не билось слишком медленно или нерегулярно. Устройства имплантируются под кожу и подключаются к сердцу с помощью крошечных проводов, называемых выводами.
Миэктомия перегородки
У пациентов с гипертрофической кардиомиопатией (ГКМП) иногда перегородка (стенка ткани, разделяющая две стороны сердца) выпячивается в левый желудочек (нижняя насосная камера). Если у человека с ГКМП наблюдаются симптомы, которым не помогают лекарства, хирург может удалить выпуклую часть перегородки с помощью операции, называемой миэктомией перегородки. Эта операция применяется редко.
Пересадка сердца
Когда симптомы, мешающие повседневной деятельности или росту младенцев, или физические изменения являются результатом кардиомиопатии, можно рассмотреть возможность пересадки сердца.
Дети и подростки с кардиомиопатиями продолжат регулярно посещать детского кардиолога. Уровень лечения будет варьироваться в зависимости от тяжести кардиомиопатии. Многим полезно проконсультироваться со специалистом по кардиомиопатии, и их могут направить к другим специалистам по метаболизму, генетике или неврологии, если подозревается наследственное или системное заболевание, связанное с кардиомиопатией.
Если есть подозрение на генетическую причину кардиомиопатии, важно, чтобы другие близкие члены семьи (родители, братья и сестры, дети) прошли проверку сердца у кардиолога, чтобы убедиться, что у них нет такого же или родственного сердечного заболевания (даже если у них нет симптомов проблем с сердцем).Детская больница Филадельфии и Penn Medicine осуществляют совместную программу, Семейную кардиомиопатическую программу, чтобы гарантировать, что члены семей пациентов с кардиомиопатиями проходят надлежащий кардиологический скрининг и генетическое тестирование.
Гипертрофическая кардиомиопатия у детей | Детская больница CS Mott
Что такое гипертрофическая кардиомиопатия?
Гипертрофическая кардиомиопатия (ГКМП) — это наследственное заболевание, поражающее определенные белки в клетках сердечной мышцы. Он передается от родителя к ребенку через хромосомы.К настоящему времени обнаружено около 100 различных ошибок (мутаций) в 10 генах, вызывающих HCM. Это довольно часто встречающееся генетическое заболевание, которым страдает примерно 1 человек из 500. Другие термины, используемые для описания проблемы, — это гипертрофическая обструктивная кардиомиопатия (HOCM) и идиопатический гипертрофический субаортальный стеноз (IHSS).
Другие термины, используемые для описания проблемы, — это гипертрофическая обструктивная кардиомиопатия (HOCM) и идиопатический гипертрофический субаортальный стеноз (IHSS).
Нормальное сердце — это четырехкамерный насос. Стенки сердца состоят из слоев мышечных клеток. Сердечный ритм находится под контролем электрической системы сердца.. Клетки сердечной мышцы реагируют на электрический импульс резким сокращением (сокращением). Когда клетки сокращаются вместе, это «сжимает» камеру, и кровь перекачивается вперед. Между сокращениями клетки расслабляются (удлиняются), позволяя крови заполнять камеры сердца до следующего сердцебиения. При HCM белки в мышечных клетках, которые позволяют клетке сокращаться и расслабляться, являются ненормальными. Это приводит к жесткости стенок сердца, которые не расслабляются обычным образом между ударами сердца. Медицинский термин для этого — диастолическая дисфункция.
При HCM мышечные клетки также толстые (медицинский термин для этого — гипертрофия), из-за чего стенки сердца также становятся толстыми. Этот эффект наиболее заметен в межжелудочковой перегородке — стенке между двумя нижними камерами сердца — желудочками. В некоторых случаях стенка становится настолько толстой, что препятствует оттоку крови к телу. Это может вызвать симптомы боли в груди во время упражнений и сделать человека более предрасположенным к опасным для жизни нарушениям сердечного ритма, таким как желудочковая тахикардия или фибрилляция желудочков.Даже при отсутствии блокировки кровотока толстые стенки сердца могут вызвать у человека легкую усталость.
Этот эффект наиболее заметен в межжелудочковой перегородке — стенке между двумя нижними камерами сердца — желудочками. В некоторых случаях стенка становится настолько толстой, что препятствует оттоку крови к телу. Это может вызвать симптомы боли в груди во время упражнений и сделать человека более предрасположенным к опасным для жизни нарушениям сердечного ритма, таким как желудочковая тахикардия или фибрилляция желудочков.Даже при отсутствии блокировки кровотока толстые стенки сердца могут вызвать у человека легкую усталость.
Как эта проблема влияет на здоровье моего ребенка?
Хотя ГКМП представляет собой серьезную проблему, его последствия для здоровья широко варьируются как по возрасту начала, так и по степени тяжести. Часто симптомы слабо выражены или отсутствуют до позднего детства или подросткового возраста. Самый частый симптом — низкая выносливость с одышкой и болью в груди во время упражнений. У некоторых в более зрелом возрасте хроническое переутомление сердца вызывает увеличение сердца и симптомы застойной сердечной недостаточности.
У людей с ГКМП существует повышенный риск нарушений сердечного ритма, таких как синдром Вольфа-Паркинсона-Уайта, наджелудочковая тахикардия, трепетание предсердий и фибрилляция предсердий. Также существует повышенный риск внезапной сердечной смерти (вызванной желудочковой тахикардией или фибрилляцией желудочков), который может быть выше у пациентов с очень толстыми стенками сердца или серьезной блокировкой кровотока из левой части сердца. Внезапная сердечная смерть (опасный для жизни ненормальный ритм, который преобразуется в себя) может показаться «приступом обморока».«В будущем достижения в области генетического тестирования могут позволить врачам прогнозировать, кто подвергается более высокому риску внезапной смерти, и принимать профилактические меры (например, имплантировать кардиовертер-дефибриллятор или ИКД).
Как диагностируется эта проблема?
Симптомы: Возможные симптомы включают учащенное сердцебиение («учащенное сердцебиение» или «прерывистое сердцебиение»), боль в груди и одышку при физической нагрузке, а также обмороки.
Физикальные признаки: Обследование обычно нормальное, за исключением шума в сердце.
Медицинские тесты: Эхокардиограмма — это основной тест, который используется для диагностики гипертрофической кардиомиопатии. Также выполняется электрокардиограмма (ЭКГ), которая почти всегда отклоняется от нормы. Другие сердечные тесты включают холтеровский монитор и рентген грудной клетки. Иногда делают катетеризацию сердца. Если есть проблемы с сердечным ритмом, может потребоваться электрофизиологическое исследование.
Как лечится проблема?
Сердечные лекарства, такие как блокаторы кальциевых каналов (верапамил) и бета-блокаторы (пропанолол, атенолол), используются для стимуляции расслабления сердечной мышцы.Бета-адреноблокаторы также помогают предотвратить опасные для жизни нарушения сердечного ритма (желудочковая тахикардия). Если возникают опасные для жизни аритмии или считается, что человек подвергается высокому риску таких аритмий, может потребоваться ИКД. Операция на сердце, называемая миомэктомией, иногда выполняется, если имеется значительная блокировка кровотока. Во время этой операции удаляется часть лишней сердечной мышцы. Пересадка сердца может потребоваться, если есть серьезные симптомы, несмотря на лечение сердечными препаратами / миомэктомию.Пересадка сердца также может потребоваться, если есть аномальные сердечные ритмы, которые нельзя безопасно лечить с помощью кардиовертера-дефибриллятора.
Операция на сердце, называемая миомэктомией, иногда выполняется, если имеется значительная блокировка кровотока. Во время этой операции удаляется часть лишней сердечной мышцы. Пересадка сердца может потребоваться, если есть серьезные симптомы, несмотря на лечение сердечными препаратами / миомэктомию.Пересадка сердца также может потребоваться, если есть аномальные сердечные ритмы, которые нельзя безопасно лечить с помощью кардиовертера-дефибриллятора.
Каковы проблемы со здоровьем этих детей в долгосрочной перспективе?
Хотя ГКМП может быть серьезной проблемой, у многих людей заболевание только легкое, которое вызывает легкие симптомы или вообще не проявляется. Течение, тяжесть и последствия для здоровья широко варьируются даже среди членов семьи. В целом, риск серьезных проблем довольно низок, пока гипертрофия (утолщение стенки сердечной мышцы) остается легкой.В более тяжелых случаях лечение бета-блокаторами в высоких дозах и имплантация ИКД (при угрожающих жизни аритмиях) значительно улучшили результаты лечения.
Профилактика SBE: Дети с HCM подвержены повышенному риску подострого бактериального эндокардита (SBE). Это инфекция сердца, вызванная бактериями в кровотоке. Дети с пороками сердца более подвержены этой проблеме из-за измененного кровотока через сердце и / или аномальных сердечных клапанов.SBE может возникнуть после стоматологической работы или медицинских процедур на желудочно-кишечном тракте или дыхательных путях, потому что эти процедуры почти всегда приводят к попаданию некоторых бактерий в кровь. СБЭ обычно можно предотвратить, если перед этими процедурами принять антибиотик.
Рекомендации по упражнениям: Индивидуальную программу упражнений лучше всего спланировать с врачом, чтобы можно было учесть все факторы. Большинству детей с HCM не разрешается заниматься соревновательными видами спорта, но разрешается заниматься малотравматичным спортивным спортом.Для детей важно всегда иметь возможность самостоятельно ограничивать свою деятельность, то есть отдыхать всякий раз, когда они чувствуют в этом необходимость. Дети с HCM обычно не участвуют в интенсивных занятиях физкультурой, но если врач разрешает легкие упражнения, им следует разрешить самостоятельно ограничивать уровень нагрузки, и их не следует оценивать (что может вынудить их превысить свой естественный уровень). пределы).
Дети с HCM обычно не участвуют в интенсивных занятиях физкультурой, но если врач разрешает легкие упражнения, им следует разрешить самостоятельно ограничивать уровень нагрузки, и их не следует оценивать (что может вынудить их превысить свой естественный уровень). пределы).
Список литературы
Gajarski RJ & Towbin J. Последние достижения в этиологии, диагностике и лечении миокардита и кардиомиопатий у детей.Curr Opinion Pediatrics 1995; 7: 587-594.
Spirito et al. Степень гипертрофии левого желудочка и риск внезапной смерти при гипертрофической кадиомиопатии. New England J Med 2000; 342: 1778-1785.
Автор: С. Лерой RN, MSN, CPNP
Отзыв написан сентябрь 2012 г.
Кардиомиопатия у детей | Бостонская детская больница
Что такое кардиомиопатия?
Кардиомиопатия — это заболевание сердечной мышцы, характеризующееся аномально большой, толстой или жесткой сердечной мышцей.Это может повлиять только на нижние камеры сердца (желудочки) или на нижнюю и верхнюю камеры (предсердия)
Кардиомиопатия вызывает повреждение тканей вокруг сердца, а также клеток сердечной мышцы.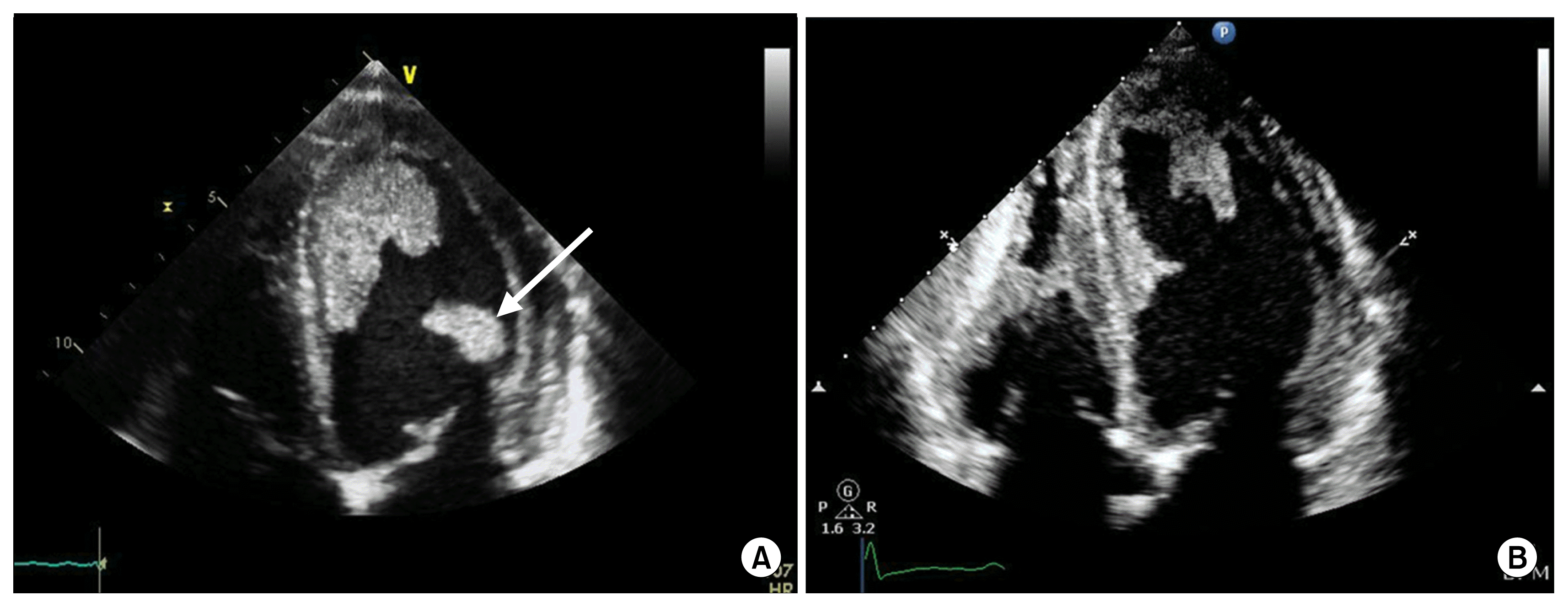 В тяжелых случаях сердце становится настолько слабым, что не может нормально перекачивать кровь. Это может привести к сердечной недостаточности или нерегулярному сердцебиению (аритмии). В некоторых случаях кардиомиопатия также включает накопление рубцовой ткани или жира в сердечной мышце. В редких случаях сердечная мышца не может расслабиться и кровь не может должным образом наполнять сердце.
В тяжелых случаях сердце становится настолько слабым, что не может нормально перекачивать кровь. Это может привести к сердечной недостаточности или нерегулярному сердцебиению (аритмии). В некоторых случаях кардиомиопатия также включает накопление рубцовой ткани или жира в сердечной мышце. В редких случаях сердечная мышца не может расслабиться и кровь не может должным образом наполнять сердце.
Кардиомиопатия — очень часто болезнь, которую время покажет. Симптомы могут быть разными, а прогрессирование болезни может быть непредсказуемым.
Какие виды кардиомиопатии?
Есть много форм кардиомиопатии. К основным типам относятся:
Дилатационная кардиомиопатия (ДКМ)
DCM является наиболее распространенным типом и возникает, когда основная насосная камера сердечной мышцы слишком растянута (расширена). Дилатационная кардиомиопатия делает сердце неспособным эффективно перекачивать кровь.
Гипертрофическая кардиомиопатия (ГКМП)
HCM делает сердечную мышцу слишком толстой. Обычно утолщение происходит в мышце левого желудочка сердца, часто затрагивая стенку между двумя желудочками сердца.
Обычно утолщение происходит в мышце левого желудочка сердца, часто затрагивая стенку между двумя желудочками сердца.
Рестриктивная кардиомиопатия
Рестриктивная кардиомиопатия — это редкий тип кардиомиопатии, при котором сердечная мышца становится очень жесткой или жесткой. Из-за этого желудочки сердца не могут правильно наполняться кровью.
Аритмогенная кардиомиопатия правого желудочка (АРВК)
ARVC — это редкая форма кардиомиопатии, которой страдает только один из 5000 человек. Это происходит, когда мышца правого желудочка сердца заменяется толстой или жировой рубцовой тканью. Рубцы «мешают» электрические сигналы в сердце и могут затруднить перекачивание крови сердцем.
Как мы лечим кардиомиопатию у детей
В программе кардиомиопатии Бостонской детской больницы наши кардиологи, кардиохирурги и медсестры, специалисты по визуализации сердца и другие клиницисты имеют многолетний опыт лечения не только множественных форм кардиомиопатии у детей, но и различных стадий заболевания.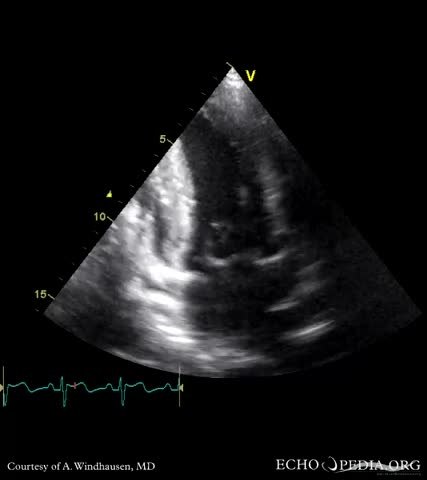
Гипертрофическая кардиомиопатия: причины. Симптомы и лечение
Обзор
Гипертрофическая кардиомиопатия (ГКМ) — это заболевание, которое поражает сердечную мышцу, вызывая ее увеличение или «гипертрофию».«
В Семейном институте сердца, сосудов и грудной клетки Миллера клиники Кливленда мы проявляем особый интерес к лечению гипертрофической кардиомиопатии (ГКМП). С 1978 года мы вылечили сотни пациентов, и их число с каждым годом увеличивается.
Что такое гипертрофическая кардиомиопатия (ГКМП)?
Гипертрофическая кардиомиопатия (ГКМП) — это сложный тип сердечного заболевания, поражающего сердечную мышцу. Это вызывает утолщение сердечной мышцы (особенно желудочков или нижних камер сердца), жесткость левого желудочка, изменения митрального клапана и клеточные изменения.
Утолщение сердечной мышцы (миокарда) чаще всего происходит в области перегородки. Перегородка — это мышечная стенка, разделяющая левую и правую стороны сердца. Проблемы возникают, когда перегородка между нижними камерами сердца или желудочками утолщается. Утолщенная перегородка может вызвать сужение, которое может блокировать или уменьшать кровоток из левого желудочка в аорту — состояние, называемое «обструкцией оттока». Желудочки должны работать сильнее, чтобы преодолеть сужение или закупорку.Этот тип гипертрофической кардиомиопатии можно назвать гипертрофической обструктивной кардиомиопатией (ГОКМ).
HCM также может вызывать утолщение в других частях сердечной мышцы, например, в нижней части сердца, называемой верхушкой, правым желудочком или во всем левом желудочке.
Нормальное сердце
Жесткость в левом желудочке возникает в результате клеточных изменений, которые происходят в сердечной мышце при ее утолщении. Левый желудочек не может нормально расслабиться и наполняться кровью.Поскольку в конце наполнения остается меньше крови, к органам и мышцам перекачивается меньше крови, богатой кислородом. Жесткость левого желудочка вызывает повышение давления внутри сердца и может привести к симптомам, описанным ниже.
Левый желудочек не может нормально расслабиться и наполняться кровью.Поскольку в конце наполнения остается меньше крови, к органам и мышцам перекачивается меньше крови, богатой кислородом. Жесткость левого желудочка вызывает повышение давления внутри сердца и может привести к симптомам, описанным ниже.
Изменения митрального клапана: Сужение выходного тракта левого желудочка нарушает правильную функцию митрального клапана, что приводит к обструкции оттока и повышению давления в левом желудочке.
Обструкция является результатом удара митрального клапана о перегородку.Когда это происходит, митральный клапан часто протекает, в результате чего кровь возвращается в левое предсердие.
Клеточные изменения, или изменения в клетках сердечной мышцы, происходят при ГКМП. Под микроскопом клетки кажутся неорганизованными и нерегулярными (так называемый «беспорядок»), а не организованными и параллельными. Этот беспорядок может вызвать изменения в электрических сигналах, проходящих через нижние камеры сердца, и привести к желудочковой аритмии (разновидность нарушения сердечного ритма).
Неорганизованная структура
Нормальный образец ячеек
Кто страдает гипертрофической кардиомиопатией (ГКМП)?
Гипертрофическая кардиомиопатия поражает примерно 600 000–1,5 миллиона американцев, или одного человека из 500. Это более распространено, чем рассеянный склероз, которым страдает каждый 700 человек.
Симптомы и причины
Что вызывает гипертрофическую кардиомиопатию (ГКМП)?
- ГКМ может передаваться по наследству в результате отклонения от нормы в гене, который кодирует характеристики сердечной мышцы.Есть много генов, которые могут вызвать HCM. При наличии генного дефекта тип развивающейся HCM сильно варьируется в семье. Кроме того, у некоторых людей, у которых есть ген HCM, болезнь может никогда не развиться.

- Гипертрофия может быть приобретена в результате высокого кровяного давления или старения.
- В других случаях причина гипертрофии и ГКМП неизвестна.
Поскольку причины HCM различны, часто бывает трудно определить группу высокого риска.
Какие состояния связаны с гипертрофической кардиомиопатией (ГКМП)?
Многие люди с HCM живут нормальной жизнью и не имеют проблем со здоровьем.
У других людей с HCM могут развиться сердечные заболевания, которые сокращают продолжительность жизни или снижают качество жизни человека, в том числе:
- Внезапная остановка сердца и внезапная сердечная смерть: Внезапная остановка сердца — это внезапная потеря функции сердца, вызванная опасно учащенным сердечным ритмом, называемым желудочковой тахикардией. Если неотложное лечение, включая СЛР и дефибрилляцию, не будет начато сразу после появления симптомов, может произойти внезапная сердечная смерть.
Большинство людей с ГКМП имеют низкий риск внезапной сердечной смерти. Однако HCM является наиболее частой причиной внезапной сердечной смерти у людей в возрасте до 30 лет. HCM может быть наиболее известен своей ролью в остановке сердца и последующей смерти у некоторых молодых профессиональных спортсменов.
Однако HCM является наиболее частой причиной внезапной сердечной смерти у людей в возрасте до 30 лет. HCM может быть наиболее известен своей ролью в остановке сердца и последующей смерти у некоторых молодых профессиональных спортсменов.
- Сердечная недостаточность: Состояние, при котором насосная мощность сердца ниже нормальной.
Сопутствующие симптомы
Симптомы, связанные с наличием желудочковой тахикардии или сердечной недостаточности, включают:
- Боль в груди или давление, которое обычно возникает при физических упражнениях или физической активности, но также может возникать во время отдыха или после еды.
- Одышка и утомляемость, особенно при физической нагрузке. Эти симптомы чаще встречаются у взрослых с гипертрофической кардиомиопатией и, скорее всего, вызваны резервным давлением в левом предсердии и легких.
- Обморок (обморок или потеря сознания) может повлиять на пациентов с HCM.
 Обморок при ГКМП может быть вызван нерегулярным сердечным ритмом, аномальной реакцией кровеносных сосудов во время упражнений или может быть не обнаружен.
Обморок при ГКМП может быть вызван нерегулярным сердечным ритмом, аномальной реакцией кровеносных сосудов во время упражнений или может быть не обнаружен. - Сердцебиение (трепетание в груди) из-за нарушения сердечного ритма (аритмии), например мерцательной аритмии или желудочковой тахикардии.Фибрилляция предсердий встречается примерно у 25% больных ГКМП и увеличивает риск образования тромбов и сердечной недостаточности.
Диагностика и тесты
Как диагностируется гипертрофическая кардиомиопатия (ГКМП)?
Диагноз HCM основан на:
- История болезни: Ваш врач задаст вам вопросы о ваших симптомах и семейном анамнезе.
- Осмотр: Врач выслушает ваше сердце и легкие. У пациентов с гипертрофической обструктивной кардиомиопатией (HOCM) может быть шум в сердце.

- Тесты: Эхокардиограмма — наиболее распространенный тест, используемый для диагностики ГКМП, поскольку характерное утолщение стенок сердца обычно видно на эхо-сигнале. Другие тесты могут включать анализы крови, электрокардиограмму, рентген грудной клетки, эхо-тест с физической нагрузкой, катетеризацию сердца и магнитно-резонансную томографию (МРТ).
Ведение и лечение
Тип назначаемого лечения HCM зависит от:
- Имеется ли сужение оттока (путь, по которому кровь выходит из сердца)
- Как работает сердце
- Симптомы пациента
- Возраст и уровень активности пациента
- Наличие аритмий
Лечение направлено на минимизацию или предотвращение симптомов и снижение риска осложнений, таких как сердечная недостаточность и внезапная сердечная смерть.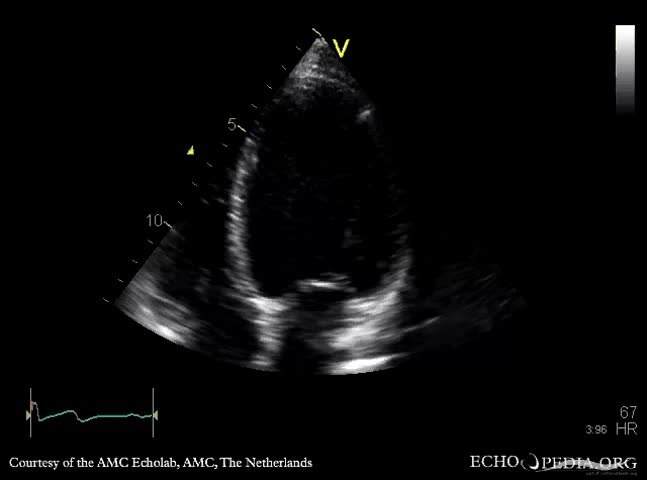
Лечение включает выявление рисков и регулярное наблюдение, изменение образа жизни, прием лекарств и процедур по мере необходимости.
Скрининг и идентификация рисков
Просеивание
Гипертрофическая кардиомиопатия (ГКМП) — это заболевание, которое может передаваться из поколения в поколение. Для вас или членов вашей семьи важно пройти обследование, если у вас есть родственник первой степени родства с этим заболеванием. Ближайшие родственники — это ваши родители, братья, сестры и дети.
Первый шаг — сделать электрокардиограмму (ЭКГ) и эхокардиограмму (эхо), чтобы проверить свое сердце.
Если результаты теста показывают признаки гипертрофической кардиомиопатии, вам необходимо обратиться к кардиологу, специализирующемуся на ГКМП. Чтобы получить список врачей клиники Кливленда, которые лечат пациентов с этим заболеванием, посетите наш Центр гипертрофической кардиомиопатии.
Если результаты ваших анализов в норме, мы рекомендуем повторное эхо-исследование и ЭКГ каждые три года, пока вам не исполнится 30 лет, а затем каждые 5 лет.
Риск внезапной сердечной смерти
Большинство людей с ГКМП имеют низкий риск внезапной сердечной смерти. Однако важно определить небольшое количество пациентов с ГКМП, у которых действительно повышен риск внезапной сердечной смерти, чтобы можно было принять профилактические меры.
К людям с HCM, у которых есть более высокий риск внезапной сердечной смерти, относятся:
- Пациенты, у которых в семейном анамнезе была внезапная сердечная смерть
- Молодые пациенты, перенесшие несколько эпизодов обморока (обморока)
- Пациенты, у которых наблюдается ненормальная реакция артериального давления при физической нагрузке
- Пациенты с аритмией в анамнезе с учащенным пульсом
- Пациенты с тяжелыми симптомами и нарушением функции сердца
Ваш врач может обсудить ваш личный риск.Если у вас есть два или более фактора риска внезапной смерти, ваш врач может назначить профилактическое лечение, такое как антиаритмические препараты или имплантируемый кардиовертер-дефибриллятор (ICD), чтобы снизить ваш риск.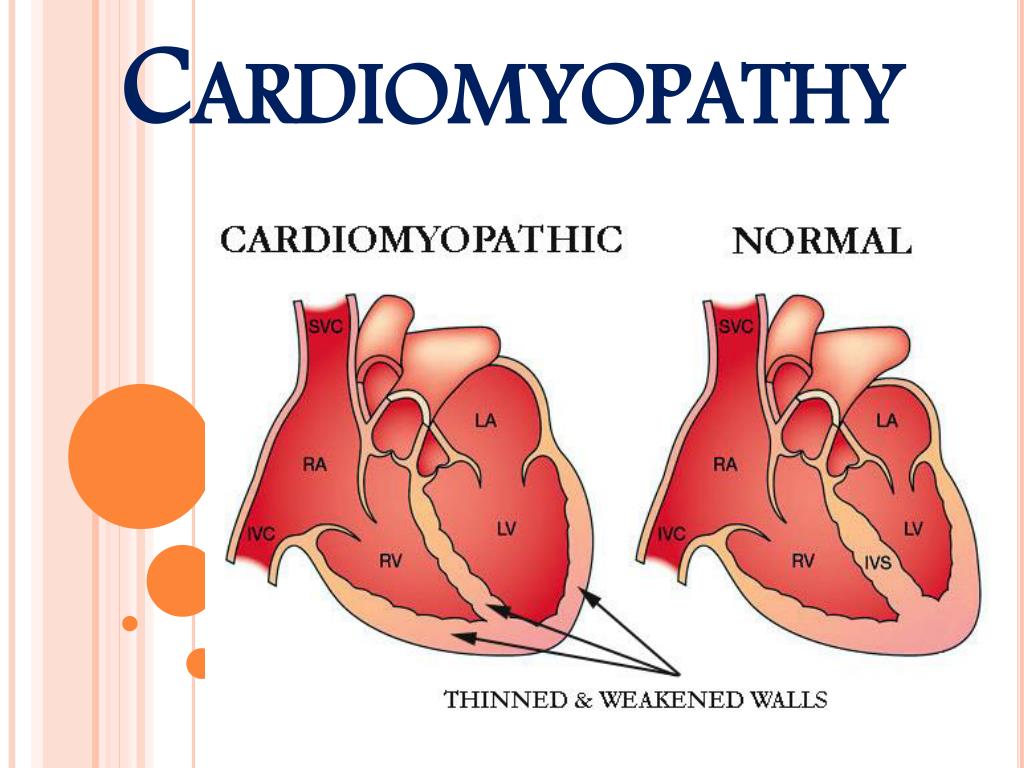
Лекарства
Лекарства часто назначают для лечения симптомов и предотвращения дальнейших осложнений. Лекарства, такие как бета-блокаторы и блокаторы кальциевых каналов, расслабляют сердечную мышцу, позволяя ей лучше наполняться и перекачивать кровь более эффективно. При необходимости могут быть прописаны другие лекарства, чтобы контролировать частоту сердечных сокращений или уменьшить частоту аритмий.
Вам могут посоветовать избегать некоторых лекарств, таких как нитраты, потому что они снижают кровяное давление, или дигоксина, потому что он увеличивает силу сокращения сердца.
Антибиотики могут быть прописаны для снижения риска бактериального эндокардита, потенциально опасного для жизни состояния (см. Другие меры предосторожности, перечисленные на следующей странице).
Процедуры
Процедуры лечения гипертрофической обструктивной кардиомиопатии включают миэктомию перегородки, абляцию этанолом, имплантируемый кардиовертер-дефибриллятор (ICD) и, при необходимости, лечение сердечной недостаточности.
Миэктомия перегородки
Во время миэктомии перегородки, хирургической процедуры, хирург удаляет небольшое количество утолщенной стенки перегородки, чтобы расширить отток крови (путь, по которому проходит кровь) от левого желудочка к аорте. Миэктомия рассматривается, когда лекарства не эффективны при лечении ГКМП. Это часто устраняет регургитацию митрального клапана.
Абляция этанолом
Эта процедура, также называемая аблацией перегородки, предназначена для пациентов, которые не соответствуют критериям для проведения миэктомии перегородки.Процедура абляции проводится в лаборатории катетеризации сердца.
Во-первых, во время процедуры катетеризации сердца располагается малая коронарная артерия, которая снабжает кровоток верхней частью перегородки. В артерию вводится баллонный катетер и надувается. Контрастное вещество вводится, чтобы определить местонахождение утолщенной стенки перегородки, которая сужает проход от левого желудочка к аорте.
При обнаружении выпуклости через катетер вводится небольшое количество чистого спирта.Спирт убивает клетки при контакте, в результате чего перегородка сокращается до более нормальных размеров в течение следующих месяцев, расширяя проход для кровотока.
Имплантируемые кардиовертер-дефибрилляторы (ICD)
ИКД рекомендованы людям с риском угрожающих жизни аритмий или внезапной сердечной смерти. ИКД — это небольшое устройство, которое помещается прямо под кожу и подключается к проволочным выводам, которые проходят через вену к сердцу. ИКД постоянно контролирует сердечный ритм.Когда он обнаруживает очень быстрый, ненормальный сердечный ритм, он доставляет энергию (небольшой, но мощный разряд) в сердечную мышцу, чтобы сердце снова билось в нормальном ритме. Ваш врач скажет вам, рекомендуется ли использовать ИКД.
Изменения образа жизни
Определенные изменения образа жизни, перечисленные ниже, необходимы для правильного лечения HCM.
- Ограничение количества жидкости и натрия может потребоваться некоторым пациентам при наличии симптомов сердечной недостаточности.
 Спросите своего врача о конкретных рекомендациях по употреблению жидкости и диете, включая информацию об алкогольных напитках и продуктах с кофеином.
Спросите своего врача о конкретных рекомендациях по употреблению жидкости и диете, включая информацию об алкогольных напитках и продуктах с кофеином. - Упражнение. Ваш врач обсудит с вами рекомендации по упражнениям. Большинство людей с гипертрофической кардиомиопатией могут заниматься неконкурентной аэробной нагрузкой. Не рекомендуется поднимать тяжести и заниматься многими видами спорта высокой интенсивности.
- Регулярные контрольные посещения. Пациенты с HCM должны регулярно посещать своего кардиолога, как рекомендовано, для наблюдения за своим состоянием.
- Снижение риска заражения. См. Ниже информацию о мерах предосторожности, которые следует предпринять, если вы подвержены риску развития инфекционного эндокардита.
Меры предосторожности при инфекционном эндокардите
Если у вас ГКМП, у вас повышенный риск развития бактериального или инфекционного эндокардита.
Бактериальный или инфекционный эндокардит — это инфекция сердечных клапанов или внутренней оболочки сердца (эндокарда). Это происходит, когда микробы (особенно бактерии, но иногда и грибки и другие микробы) попадают в кровоток и атакуют слизистую оболочку сердца или сердечные клапаны. Бактериальный эндокардит вызывает разрастания или отверстия на клапанах или рубцевание клапанной ткани, что чаще всего приводит к утечке сердечного клапана.Без лечения бактериальный эндокардит может быть смертельным заболеванием.
Это происходит, когда микробы (особенно бактерии, но иногда и грибки и другие микробы) попадают в кровоток и атакуют слизистую оболочку сердца или сердечные клапаны. Бактериальный эндокардит вызывает разрастания или отверстия на клапанах или рубцевание клапанной ткани, что чаще всего приводит к утечке сердечного клапана.Без лечения бактериальный эндокардит может быть смертельным заболеванием.
Чтобы снизить риск
- Соблюдайте правила гигиены полости рта каждый день. Позаботьтесь о своих зубах и деснах: каждые шесть месяцев обращайтесь за профессиональной стоматологической помощью, регулярно чистите зубы щеткой и зубной нитью и следите за тем, чтобы протезы подходили правильно.
- Позвоните своему врачу, если у вас есть симптомы инфекции, в том числе температура выше 100 градусов по Фаренгейту; пот или озноб; кожная сыпь; боль, нежность, покраснение или припухлость; рана или порез, которые не заживают; красная, теплая или дренирующая рана; боль в горле, першение в горле или боль при глотании; дренаж носовых пазух, заложенность носа, головные боли или болезненность вдоль верхних скул; стойкий сухой или влажный кашель, который длится более двух дней; белые пятна во рту или на языке; тошнота, рвота или диарея.

- Не медлите, чтобы обратиться за лечением. Простуда и грипп не вызывают эндокардит, но инфекции, которые могут иметь одинаковые симптомы, вызывают эндокардит. На всякий случай позвоните своему врачу. Кардиологи
- Cleveland Clinic считают, что для пациентов с HCM важно принимать профилактические антибиотики перед определенными медицинскими и стоматологическими процедурами, а также выполнять указанные выше действия для снижения риска. Пожалуйста, поговорите со своим врачом о типе и количестве антибиотиков, которые вам следует принимать, а также о процедурах, которые вам следует принимать.
- Идентификационная карточка с бактериальным эндокардитом доступна в Американской кардиологической ассоциации, и ее следует носить с собой. Попросите у врача карточку или зайдите на сайт www.americanheart.org и найдите «бумажник с карточкой от бактериального эндокардита».
Ресурсы
Как мне найти врача, если у меня гипертрофическая кардиомиопатия?
Чтобы найти врача, записаться на прием или узнать больше о лечении гипертрофической кардиомиопатии в клинике Кливленда, посетите Центр гипертрофической кардиомиопатии.
По вопросам педиатрии посетите веб-сайт Центра детских и врожденных пороков сердца.
Ассоциация гипертрофической кардиомиопатии (HCMA)
Ассоциация гипертрофической кардиомиопатии (HCMA) занимается поддержкой и обучением людей с HCM, их семей и других медицинских работников. С ними можно связаться по телефону:
P.O. Box 306,
Hibernia, NJ 07842
Телефон: 973.983.7429
Электронная почта: поддержка @ 4hcm.org
www.4hcm.org *
Дополнительные ресурсы
Гипертрофическая кардиомиопатия: для пациентов, их семей и заинтересованных врачей
Очень полезное руководство для людей с гипертрофической кардиомиопатией. Книги можно заказать на www.4hcm.org
* Откроется новое окно браузера с этой ссылкой. Включение ссылок на другие веб-сайты не означает одобрения материалов на веб-сайтах или какой-либо связи с их операторами
- Предикторы отдаленных исходов у пациентов с симптоматической гипертрофической обструктивной кардиомиопатией, перенесших хирургическое лечение обструкции выходного тракта левого желудочка.

- Desai MY, Bhonsale A, Smedira NG, Naji P, Thamilarasan M, Lytle BW, Lever HM. Тираж. 2013, 14 июня [Epub перед печатью]
- Взаимосвязь между исходной диастолической функцией в состоянии покоя и переносимостью физических нагрузок у пациентов с гипертрофической кардиомиопатией, перенесших стресс-эхокардиографию на беговой дорожке: когортное исследование.
- Альджаруди, Вашингтон, Десаи, М.К. Алрайес, Тамиларасан, М., Менон, В., Родригес, Л.Л., Смедира, Н., Гримм, Р.А., Левер, М.М., Джабер, ВА. BMJ Open. 2012 декабря 12; 2 (6).doi: pii: e002104. 10.1136 / bmjopen-2012-002104. Печать 2012.
- Разнообразие аномалий митрального клапана при обструктивной гипертрофической кардиомиопатии.
- Cavalcante JL, Barboza JS, Рычаг HM. Prog Cardiovasc Dis. 2012 май-июнь; 54 (6): 517-22. DOI: 10.1016 / j.pcad.2012.03.002. Рассмотрение.
- Корреляция между функциональным статусом, воспринимаемым врачом, состоянием здоровья, воспринимаемым пациентом, и сердечно-легочной нагрузкой приводит к гипертрофической кардиомиопатии.

- Huff CM, Turer AT, Wang A. Qual Life Res. 2013 Апрель; 22 (3): 647-52. DOI: 10.1007 / s11136-012-0182-у. Epub 2012 29 апреля
Могут ли дети и подростки заболеть сердечными заболеваниями или сердечными приступами? — Центр детской кардиологии штата Орегон
Многие люди, вероятно, склонны думать о сердечных заболеваниях и сердечных приступах как о недугах пожилых людей. Мы думаем, что они накапливаются с течением времени — часто после многих лет малоподвижного образа жизни, курения, высокого кровяного давления, высокого уровня холестерина или диабета.
Но печальная реальность заключается в том, что сердечные заболевания и сердечные приступы могут поразить кого угодно в любое время, включая детей и подростков, которые, похоже, имеют крепкое здоровье.
Возможно, даже большее беспокойство: эти проблемы у молодых людей часто являются примерами врожденных пороков сердца — то есть они присутствуют с рождения, — а не тем, что считается типичными факторами риска. В некоторых случаях это включает генетическую предрасположенность к высокому холестерину.
В некоторых случаях это включает генетическую предрасположенность к высокому холестерину.
Иногда проблемы с сердцем остаются незамеченными, пока не возникают проблемы.Конечно, все мы знакомы с печальными историями юных спортсменов в расцвете сил, которые заболели недиагностированным сердечным недугом. Иногда это может быть смертельно опасным. Например, гипертрофическая кардиомиопатия является «основной причиной смерти молодых спортсменов».
Однако хорошие новости заключаются в том, что эти проблемы возникают очень редко.«Внезапная смерть среди людей моложе 35 лет, часто из-за необнаруженных пороков сердца или недооцененных сердечных аномалий, является редкостью», — сообщает клиника Мэйо.«Эти внезапные смерти чаще происходят во время физической активности, например, занятий спортом, и чаще случаются у мужчин, чем у женщин».
Сердечная недостаточность у молодых людей
Американская кардиологическая ассоциация (AHA) утверждает, что «иногда сердце ребенка может работать неправильно. Термин «сердечная недостаточность» описывает сердце, которое не работает должным образом. Это не означает, что сердце перестало работать, это означает, что оно не работает так, как должно ».
Термин «сердечная недостаточность» описывает сердце, которое не работает должным образом. Это не означает, что сердце перестало работать, это означает, что оно не работает так, как должно ».
Далее они перечисляют некоторые возможные симптомы сердечных заболеваний, с которыми сталкиваются дети:
- Проблемы с дыханием
- Плохое питание или рост
- Чрезмерное потоотделение
- Низкое давление
Если смотреть на эту тему в более широком смысле, есть некоторые тревожные признаки того, что частота сердечных приступов растет среди людей, особенно женщин в возрасте до 54 лет.Это, в то время как исследования показывают, что, по данным AHA, «частота сердечных приступов в США снизилась в последние десятилетия среди людей в возрасте от 35 до 74 лет».
Исследование не было сосредоточено на детях или подростках, но оно подчеркивает тот факт, что сердечные заболевания больше не являются чем-то, о чем следует беспокоиться «пожилым» людям.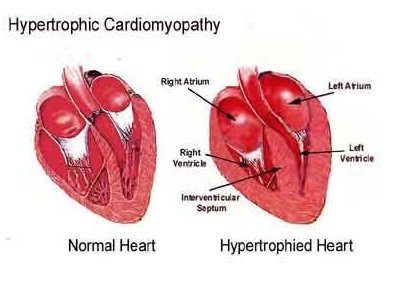
Болезни сердца в США
Болезни сердца остаются основной причиной смерти в США. И врачи начинают замечать рост числа подростков, у которых диагностировано высокое кровяное давление и высокий уровень холестерина — определенные факторы риска сердечных заболеваний.Вот почему каждому жизненно важно понимать факторы риска или факторы, которые увеличивают риск сердечного приступа и риск сердечных заболеваний.
Сохранять здоровье сердца означает принимать активное участие в обеспечении собственного благополучия, а также благополучия тех, о ком нам доверили заботиться. Хорошее здоровье и полезные для сердца привычки можно прививать маленьким детям и подросткам с раннего возраста; важна физическая активность, равно как и правильное питание.
Согласно документам U.S. News и World Report, проблемы с сердцем — или те вещи, которые в конечном итоге приводят к проблемам с сердцем — «могут начаться в очень раннем возрасте», по словам доктораГрегори Перенс, детский кардиолог в детской больнице UCLA Mattel. В той же истории отмечается, что помимо генетики, «к самым ранним факторам риска (сердечных заболеваний) относятся курение матери, пока ребенок еще находится в утробе матери».
В той же истории отмечается, что помимо генетики, «к самым ранним факторам риска (сердечных заболеваний) относятся курение матери, пока ребенок еще находится в утробе матери».
Врачи по возможности рекомендуют грудное вскармливание; было обнаружено, что это снижает риск развития сердечных заболеваний у ребенка в более позднем возрасте.
Еще один фактор риска сердечных заболеваний: недосыпание. По словам доктора Клэр Маккарти из Гарвардской медицинской школы: «За последние 20 лет количество сна, которое получают подростки, значительно сократилось.Лишь около половины из них регулярно спят более семи часов, при этом подростки старшего возраста спят меньше, чем молодые, что, учитывая, что рекомендуемое количество составляет от восьми до 10 часов, является плохой новостью ».
Маккарти цитирует исследование в журнале «Pediatrics», в котором исследователи обнаружили, что «у тех, кто мало спал, был более высокий« показатель метаболического риска ». У них с большей вероятностью был жир на животе, высокое кровяное давление и отклонения от нормы.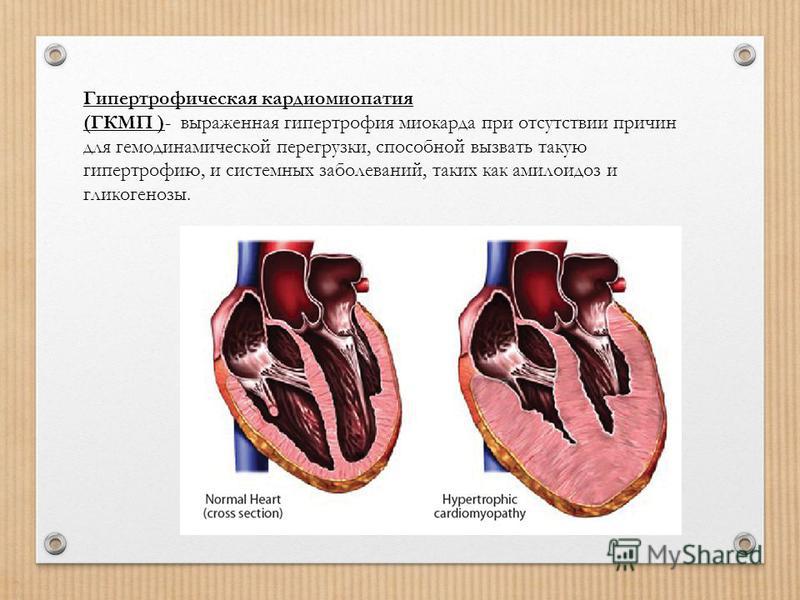 липиды крови, а также инсулинорезистентность, что увеличивает риск диабета.”
липиды крови, а также инсулинорезистентность, что увеличивает риск диабета.”
Другими словами, недостаток сна у молодых людей может запустить цепную реакцию проблем со здоровьем, вплоть до болезни сердца.
Центр детской кардиологии штата Орегон
Итак, да, дети и подростки могут заболеть сердечными заболеваниями и сердечными приступами, хотя это очень редко и часто является результатом врожденных пороков сердца. Тем не менее молодые люди с хорошим здоровьем могут начать путь к ухудшению здоровья сердца без надлежащего руководства.
Как взрослые, мы обязаны заботиться о здоровье и благополучии молодых людей.В конце концов, за ними будущее. Мы должны прививать ценности физической активности и качественному питанию с самых ранних стадий их развития.
Дети учатся у родителей, поэтому неплохо позаботиться о себе — о своем здоровье и здоровье ребенка.
В Центре детской кардиологии штата Орегон (PCCO) мы предоставляем полный спектр услуг по педиатрической кардиологии. Наше партнерство с Медицинским центром Legacy Emanuel и детской больницей Randall ставит нас в центр ряда кардиологических практик: визуализации сердца, катетерных вмешательств, электрофизиологии и т. Д.
Наше партнерство с Медицинским центром Legacy Emanuel и детской больницей Randall ставит нас в центр ряда кардиологических практик: визуализации сердца, катетерных вмешательств, электрофизиологии и т. Д.
PCCO специализируется на сердечно-сосудистых заболеваниях и здоровье сердца, как и с 1986 года. Наши педиатрические кардиологи первыми сделали важные достижения в лечении врожденных пороков сердца. Два примера: мы выполнили первую хирургическую процедуру Норвуда при синдроме гипоплазии левых отделов сердца (HLHS) в Орегоне и первую операцию артериального переключения для транспозиции магистральных артерий (TGA).
Свяжитесь с Детским кардиологическим центром штата Орегон сегодня с любыми вопросами.
Факторы риска сердечных заболеваний у детей и подростков
Дорога к здоровью сердца начинается в детстве?
Да. Большинство факторов риска, влияющих на детей, можно контролировать в раннем возрасте, что снижает риск сердечных заболеваний в более позднем возрасте.
Большинство факторов риска, влияющих на детей, можно контролировать в раннем возрасте, что снижает риск сердечных заболеваний в более позднем возрасте.
Болезнь сердца не является основной причиной смерти среди детей и подростков, но это самая большая причина смерти среди взрослых в Соединенных Штатах. Фактически, кто-то в Америке умирает каждые 37 секунд от какой-либо формы сердечно-сосудистого заболевания.
Определенные факторы играют важную роль в шансах человека на развитие сердечных заболеваний. Это так называемые факторы риска. Некоторые факторы риска можно изменить, лечить или модифицировать, а некоторые нет.
Многие факторы риска можно контролировать в раннем возрасте, что снижает риск сердечных заболеваний в более зрелом возрасте.Другие факторы риска передаются через членов семьи (они передаются по наследству) или являются результатом другой болезни или заболевания.
Профилактика — лучший способ избежать проблем с сердцем в дальнейшей жизни. Контроль как можно большего количества следующих факторов риска, начиная с детства, поможет снизить риск развития сердечных заболеваний у вашего ребенка во взрослом возрасте.
Контроль как можно большего количества следующих факторов риска, начиная с детства, поможет снизить риск развития сердечных заболеваний у вашего ребенка во взрослом возрасте.
- Высокое артериальное давление
- Холестерин высокий
- Курение
- Ожирение
- Отсутствие физической активности
Менее 3% детей в США имеют высокое кровяное давление.Но высокое кровяное давление — серьезное заболевание в детстве, которое часто остается незамеченным, поскольку не вызывает никаких симптомов. Убедитесь, что кровяное давление вашего ребенка проверяется при его или ее ежегодном осмотре.
Что вызывает высокое кровяное давление у детей?
Повышенное артериальное давление (гипертония) у детей не является врожденным пороком сердца, но может иметь наследственную связь. По этой причине детям, родившимся в семьях с историей высокого кровяного давления, необходимо с особой тщательностью следить за своим кровяным давлением.
В большинстве случаев высокое кровяное давление у детей является результатом другого заболевания, например, болезни сердца или почек. Это называется вторичной гипертонией .
Как измеряется артериальное давление?
Врач измерит кровяное давление вашего ребенка с помощью устройства, называемого сфигмоманометром.
Показания артериального давления измеряют две части артериального давления: систолическое и диастолическое. Систолическое давление — это сила кровотока через артерию при сокращении сердца.Диастолическое давление — это сила кровотока в кровеносных сосудах, когда сердце отдыхает между ударами.
Врач изучит возраст, пол и рост вашего ребенка, чтобы определить систолическое и диастолическое артериальное давление. Врачи используют этот метод, потому что он позволяет им определять кровяное давление на разных уровнях роста. Это также позволяет им получить наиболее точную классификацию артериального давления в соответствии с размером тела вашего ребенка.
Как лечится высокое кровяное давление у детей?
В большинстве случаев изменение образа жизни поможет детям контролировать высокое кровяное давление.
- Помогите своему ребенку поддерживать здоровый вес. У детей с избыточным весом артериальное давление обычно выше, чем у детей с избыточным весом.
- Увеличивают физическую активность.
- Ограничьте количество потребляемой соли.
- Предупредить их об опасности курения сигарет. Никотин в сигаретах вызывает сужение кровеносных сосудов, что еще больше затрудняет прохождение крови по сосудам.
Если диета и упражнения не снижают артериальное давление вашего ребенка, ему могут назначить лекарства.
Холестерин
Менее 15% детей имеют высокий уровень холестерина, но исследования показали, что накопление жировых бляшек начинается в детстве и прогрессирует во взрослом возрасте. Этот болезненный процесс называется атеросклерозом. Со временем атеросклероз приводит к болезни сердца, которая является самой большой причиной смерти в Соединенных Штатах.
Этот болезненный процесс называется атеросклерозом. Со временем атеросклероз приводит к болезни сердца, которая является самой большой причиной смерти в Соединенных Штатах.
Что такое холестерин?
Холестерин — это жироподобное вещество, называемое липидом, которое содержится во всех клетках организма.Печень вырабатывает весь холестерин, необходимый вашему организму для образования клеточных мембран и выработки определенных гормонов. Дополнительный холестерин попадает в организм при употреблении в пищу продуктов животного происхождения, таких как мясо, яйца и молочные продукты, а также продуктов с высоким содержанием насыщенных жиров.
Холестерин попадает в клетки через кровоток в специальных носителях, называемых липопротеинами. Двумя наиболее важными липопротеинами являются липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). Врачи изучают, как ЛПНП, ЛПВП и жиры, называемые триглицеридами, связаны друг с другом и с вашим общим уровнем холестерина.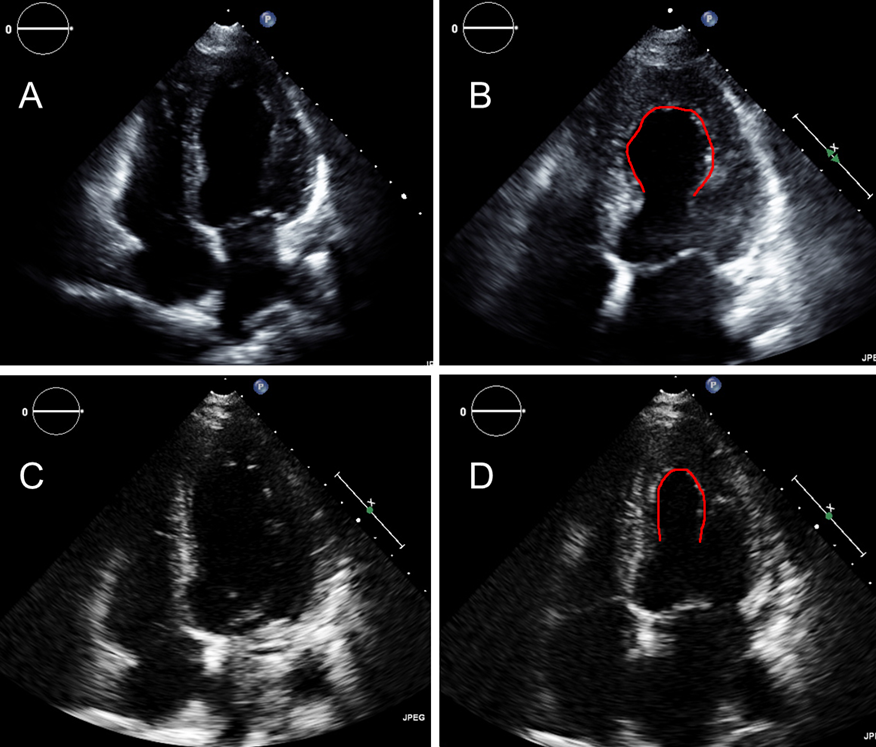
Что вызывает повышенный уровень холестерина у детей и подростков?
В некоторых случаях высокий уровень холестерина передается по наследству. Это называется семейной гиперхолестеринемией . Этим заболеванием страдают от 1% до 2% детей, и им следует проверять уровень холестерина до достижения 5-летнего возраста.
К другим факторам риска высокого уровня холестерина относятся ожирение, высокое кровяное давление и курение.
Как предотвратить или лечить высокий уровень холестерина?
Чтобы снизить риск накопления жировых отложений в артериях, вашему ребенку следует
- Делайте много упражнений.Поощряйте их заниматься физическими упражнениями от 30 до 60 минут большую часть дней недели.
- Ешьте продукты с низким содержанием холестерина и жиров. Предложите ребенку есть больше цельнозерновых и свежих фруктов и овощей. (Примечание: вы не должны ограничивать, сколько полных детей едят, если они моложе двух лет.
 Младенцам нужен жир для роста и развития. После двухлетнего возраста дети должны начать есть меньше калорий из жира.)
Младенцам нужен жир для роста и развития. После двухлетнего возраста дети должны начать есть меньше калорий из жира.) - Знайте о вреде курения сигарет.
- Научитесь контролировать вес, чтобы избежать рисков, связанных с ожирением.
- Контролировать свой диабет, высокое кровяное давление или другие состояния, способствующие сердечным заболеваниям.
Детям, у которых был диагностирован высокий уровень холестерина, необходимо, по крайней мере, соблюдать специальную программу питания и физических упражнений. Если в течение 1 года диеты и лечебной физкультуры не снижает уровень холестерина, могут быть назначены статины или другие лекарства, снижающие уровень холестерина.
Курение По данным Центров по контролю за заболеваниями (CDC), почти 25% старшеклассников употребляют какие-либо табачные изделия, и почти 4000 детей в возрасте до 18 лет пробуют свою первую сигарету каждый день. Фактически, 9 из 10 курильщиков начали курить еще до окончания средней школы. Это означает, что если дети могут не курить в школе, они, вероятно, никогда не будут курить.
Фактически, 9 из 10 курильщиков начали курить еще до окончания средней школы. Это означает, что если дети могут не курить в школе, они, вероятно, никогда не будут курить.
Более 90 000 человек ежегодно умирают от сердечных заболеваний, вызванных курением. Среди молодых людей, у которых в противном случае был бы очень низкий риск сердечных заболеваний, курение сигарет может вызывать до 75 процентов случаев сердечных заболеваний. И чем дольше человек курит, тем выше риск сердечных заболеваний.
Как курение влияет на сердце?
Более известен тем, что увеличивает риск рака легких. Курение сигарет и табака также увеличивает риск сердечных заболеваний и заболеваний периферических сосудов (заболевания сосудов, которые снабжают кровью руки и ноги).
По данным главного хирурга, большинство курящих подростков зависимы от никотина, содержащегося в сигаретах. Никотин сужает кровеносные сосуды и создает дополнительную нагрузку на сердце.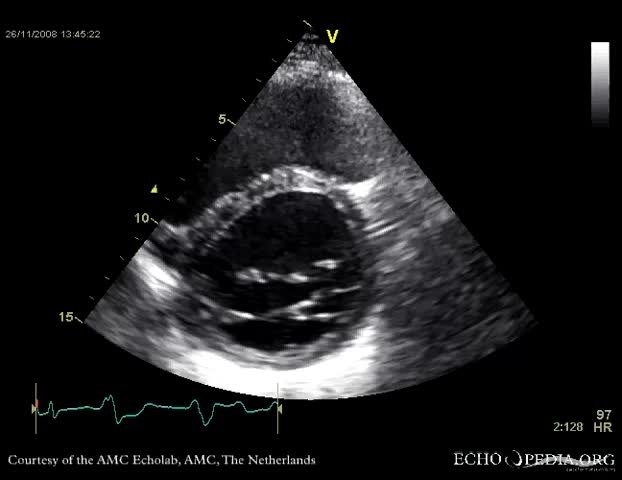 Даже когда подростки хотят бросить курить, никотиновая зависимость делает это очень трудным, и они испытывают те же симптомы отмены, что и взрослые.
Даже когда подростки хотят бросить курить, никотиновая зависимость делает это очень трудным, и они испытывают те же симптомы отмены, что и взрослые.
Хотя никотин является основным активным агентом сигаретного дыма, другие химические вещества и соединения, такие как смола и окись углерода, также вредны для сердца. Исследования показали, что курение увеличивает частоту сердечных сокращений, сужает основные артерии и может вызвать нарушения в ритме сердечных сокращений, что приводит к усилению работы сердца.Химические вещества, содержащиеся в сигаретном и табачном дыме, приводят к накоплению жирового налета в артериях, возможно, из-за повреждения стенок сосудов. Эти химические вещества также влияют на холестерин и уровень фибриногена, который является материалом для свертывания крови. Это увеличивает риск образования тромба, который может привести к сердечному приступу.
Как мне отговорить моего ребенка от курения?
- Поговорите с ними о вредных последствиях курения, таких как желтые зубы, неприятный запах изо рта, вонючая одежда и одышка.
 Если ваш ребенок любит заниматься спортом, расскажите ему или ей, как курение может повредить легкие и уменьшить приток кислорода, который необходим мышцам для правильной работы.
Если ваш ребенок любит заниматься спортом, расскажите ему или ей, как курение может повредить легкие и уменьшить приток кислорода, который необходим мышцам для правильной работы. - Открыто поговорите с ребенком об опасности курения.
- Комплимент подросткам, которые не курят. Результаты опроса CDC показали, что больше молодых людей не курят, чем курят. Большинство опрошенных подростков заявили, что считают курение непривлекательным и что они не будут встречаться с курящим.
- Будьте примером для подражания для вашего ребенка.Если вы курите, бросьте. И не позволяйте другим курить в вашем доме.
Как я могу помочь своему ребенку бросить курить?
- Посоветуйте им, как бросить курить, но будьте готовы помочь и поддержать.
- Помогите им выяснить причины, по которым им следует бросить курить, например, чтобы жить дольше; снижение их шансов на сердечный приступ, инсульт или рак; и иметь больше денег, чтобы тратить их на другие вещи, кроме сигарет.

- Если вы курите, соглашайтесь бросить курить вместе с ними. Около половины всех курильщиков-подростков имеют курящих родителей.
- Посоветуйтесь с врачом, как бросить курить.
Курение — самая предотвратимая причина смерти. Если уровень курения среди подростков не снизится, 5,6 миллиона американцев умрут в более позднем возрасте от болезней, вызванных курением.
Ожирение
Ожирение — главный фактор риска сердечных заболеваний. Это тревожно, если учесть, что каждый третий взрослый американец страдает ожирением. Недавние исследования показали, что ожирение связано с более чем 110 000 смертей в Соединенных Штатах каждый год.
Детское ожирение в Соединенных Штатах стало проблемой в последние годы. По данным Американской академии детской и подростковой психиатрии, от 16% до 33% детей и подростков страдают ожирением. В результате резко возросло количество проблем, связанных с ожирением, таких как диабет 2 типа, который обычно наблюдается только у взрослых. Поскольку дети с ожирением более склонны к ожирению взрослыми, профилактика или лечение ожирения в детстве может снизить риск ожирения у взрослых. В свою очередь, это может помочь снизить риск сердечных заболеваний, диабета и других заболеваний, связанных с ожирением.
Поскольку дети с ожирением более склонны к ожирению взрослыми, профилактика или лечение ожирения в детстве может снизить риск ожирения у взрослых. В свою очередь, это может помочь снизить риск сердечных заболеваний, диабета и других заболеваний, связанных с ожирением.
Что такое ожирение и что его вызывает?
Наше тело состоит из воды, жиров, белков, углеводов, витаминов и минералов. Ожирение означает, что у вас слишком много жира.
Для некоторых людей причина ожирения довольно проста: они едят больше калорий, чем сжигают во время упражнений и повседневной жизни. Другие причины ожирения могут включать генетику, старение, пол, образ жизни и болезнь.
Ожирение у детей опасно, потому что исследователи считают, что жировые клетки, которые мы накапливаем в детстве, остаются с нами, когда мы взрослые.У детей с ожирением может быть в 5 раз больше жировых клеток, чем у детей с нормальным весом. Диета во взрослом возрасте уменьшит размер жировых клеток, но не фактическое количество жировых клеток.
Как узнать, страдает ли мой ребенок ожирением?
При определении жировой прослойки у детей и подростков индекс массы тела (ИМТ) является ориентиром на основе веса и роста для определения недостаточного и избыточного веса. Оценка ИМТ зависит от возраста ребенка, поскольку по мере роста детей количество жира в организме меняется.Кроме того, у девочек и мальчиков будет разное количество жира в организме по мере роста, поэтому для построения ИМТ детей используются диаграммы для конкретных возрастов и полов.
ИМТ — это формула веса в килограммах, деленная на рост в метрах в квадрате (ИМТ = кг / м 2 ). Чтобы узнать ИМТ вашего ребенка, воспользуйтесь калькулятором ниже.
Врачи наносят индекс массы тела на диаграмму относительно результатов измерений других детей того же возраста и пола. Это покажет врачу процентиль вашего ребенка.Процентиль ИМТ ребенка показывает, как его или ее измерения сравниваются с другими мальчиками или девочками в той же возрастной группе. Таким образом, ребенок выше 95-го процентиля считается избыточным весом, потому что 95% населения имеет ИМТ меньше, чем он или она. Ребенок с ИМТ 50-го процентиля близок к среднему значению для населения. Ребенок ниже 5-го процентиля считается с недостаточным весом, потому что 95% населения имеет более высокий ИМТ.
Как я могу управлять или лечить ожирение моего ребенка?
Если вы считаете, что ваш ребенок страдает ожирением, покажите его или ее врачу, чтобы убедиться, что ожирение не вызвано медицинской проблемой.Если нет болезни или состояния, вызывающего ожирение, врач, вероятно, порекомендует некоторые изменения образа жизни, чтобы помочь вашему ребенку похудеть.
- Контролируйте порции (количество съедаемой пищи) и заставляйте их есть меньше калорий.
- Не используйте еду в качестве награды за хорошее поведение или хорошие оценки.
- Ограничьте количество перекусов и помните, какие закуски они едят.
- Знайте, что ест ваш ребенок в школе.
- Ешьте всей семьей, чтобы было легче узнать, что и сколько ест ваш ребенок.
- Увеличьте их физическую активность и найдите увлекательные занятия, которыми вы можете заниматься всей семьей.
- Ограничьте количество времени, которое ваш ребенок тратит на просмотр телевизора и игры на компьютере.
Детское ожирение трудно контролировать, потому что часто после достижения здоровой массы тела ребенок возвращается к своим старым привычкам. Врач вашего ребенка обычно может помочь вам составить диету и план упражнений, который включает разумные цели по снижению веса, изменение образа жизни, а также поддержку и участие семьи.
Отсутствие физической активностиОтсутствие физической активности — главный фактор риска сердечных заболеваний. Люди, которые не занимаются спортом, имеют повышенный риск сердечных заболеваний. Отсутствие физической активности также увеличивает риск развития других факторов риска сердечных заболеваний, таких как высокий уровень холестерина, высокое кровяное давление, ожирение и диабет.
Активные дети обычно вырастают активными взрослыми. Помимо предотвращения факторов риска сердечно-сосудистых заболеваний в более старшем возрасте, регулярные физические упражнения помогут
.- Помогите контролировать вес.Поскольку дети с ожирением более склонны к ожирению взрослыми, профилактика или лечение ожирения в детстве может снизить риск ожирения у взрослых. В свою очередь, это может помочь снизить риск сердечных заболеваний, диабета и других заболеваний, связанных с ожирением.
- Укрепляйте кости. Регулярные упражнения улучшают развитие костей и снижают риск образования тонких или ломких костей (остеопороза) в зрелом возрасте.
- Повышение самооценки и уверенности в себе. Физические упражнения помогут вашему ребенку почувствовать себя лучше физически и морально.
- Улучшение здоровья сердечно-сосудистой системы. Физические упражнения снижают кровяное давление, увеличивают количество ЛПВП или «хорошего холестерина» в крови и снижают уровень стресса.
Как узнать, достаточно ли у моего ребенка упражнений?
Американская кардиологическая ассоциация рекомендует всем детям от 5 лет и старше заниматься физическими упражнениями не менее 60 минут в день. Это должно включать в себя сочетание занятий средней и высокой интенсивности.
Если вы считаете, что ваш ребенок недостаточно двигается, задайте себе следующие вопросы:
- Сколько времени в неделю ваш ребенок проводит , занимаясь сидячими видами деятельности , например, смотрит телевизор или играет в видеоигры? Это называется малоподвижной деятельностью, потому что при ней мало или совсем нет физической активности.
- Сколько времени в неделю ваш ребенок проводит развлекательных мероприятий , таких как катание на велосипеде, роликовых коньках, сноуборде или водных лыжах? Ваш ребенок любит кататься на велосипеде или ходить пешком туда, куда он собирается?
- Сколько времени в неделю ваш ребенок проводит аэробных упражнений , таких как беговая дорожка, уроки танцев или игра в футбол или баскетбол? Аэробная активность задействует большие группы мышц тела и помогает укрепить сердце и легкие.
Дети, которым нравится сочетать развлекательные и аэробные упражнения, вероятно, получают достаточно физических упражнений.Если вас беспокоит отсутствие физической активности, составьте «список активности» врачу вашего ребенка, и он или она предложит занятия, соответствующие возрасту, размеру и способностям вашего ребенка. Если у вашего ребенка заболевание, ограничивающее физическую активность, обязательно поговорите с врачом о безопасных занятиях для вашего ребенка.
Как я могу помочь своему ребенку повысить уровень активности?
Если ваш ребенок физически неактивен, первое, что вы можете сделать, — это ограничить количество времени, которое вы проводите перед телевизором, играми в видеоигры или серфингом в Интернете.Поищите организованные виды спорта, уроки или клубы, которые соответствуют интересам вашего ребенка. Самое главное, проводите время с ребенком и устраивайте семейные прогулки, которые предполагают какой-либо вид физической активности (например, катание на велосипеде, ходьба, походы).
Физические упражнения важны для всех детей, даже для тех, кто не любит спорт, плохо координирует свои действия или имеет инвалидность. Сосредоточившись на активной «игре» вместо упражнений, дети, скорее всего, сами изменят свое поведение при выполнении упражнений и увеличат физическую активность.
.
 Eur. Heart J., 28: 88-136.
Eur. Heart J., 28: 88-136. Bone Marrow Transplant., 34: 149-154.
Bone Marrow Transplant., 34: 149-154. J. Clin. Endocrinol. Metab., 91: 3171-3180.
J. Clin. Endocrinol. Metab., 91: 3171-3180.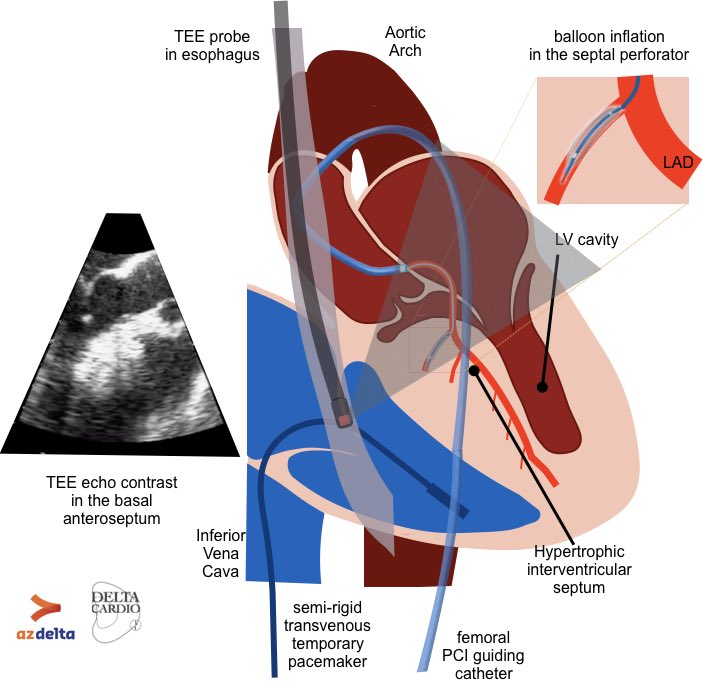 Circulation, 107: 448-454.
Circulation, 107: 448-454.

 .
.
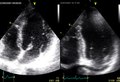 Обморок при ГКМП может быть вызван нерегулярным сердечным ритмом, аномальной реакцией кровеносных сосудов во время упражнений или может быть не обнаружен.
Обморок при ГКМП может быть вызван нерегулярным сердечным ритмом, аномальной реакцией кровеносных сосудов во время упражнений или может быть не обнаружен.
 Спросите своего врача о конкретных рекомендациях по употреблению жидкости и диете, включая информацию об алкогольных напитках и продуктах с кофеином.
Спросите своего врача о конкретных рекомендациях по употреблению жидкости и диете, включая информацию об алкогольных напитках и продуктах с кофеином.

 Младенцам нужен жир для роста и развития. После двухлетнего возраста дети должны начать есть меньше калорий из жира.)
Младенцам нужен жир для роста и развития. После двухлетнего возраста дети должны начать есть меньше калорий из жира.) Если ваш ребенок любит заниматься спортом, расскажите ему или ей, как курение может повредить легкие и уменьшить приток кислорода, который необходим мышцам для правильной работы.
Если ваш ребенок любит заниматься спортом, расскажите ему или ей, как курение может повредить легкие и уменьшить приток кислорода, который необходим мышцам для правильной работы.