Вагинальное кровотечение — Гинекология и акушерство
Все женщины репродуктивного возраста должны
-
Сдать анализ мочи на беременность
Анализ должен включать клинический анализ крови, если кровотечение сильнее обычного (например, > 1 прокладки или тампона в час) или длится в течение нескольких дней, или есть подозрение на анемию или гиповолемию. В случае выявления анемии, которая не явно связана с дефицитом железа (на что указывают микроцитарные и индексы эритроцитов), необходимо сделать анализ на уровень железа в крови.
Обычно измеряют уровень тиреостимулирующего гормона и пролактина, даже если отсутствует галакторея.
В случае подозрения на нарушение гемостаза необходимо определить фактор Виллебранда, количество тромбоцитов, время свертывания крови и активированное частичное тромбопластиновое время.
При подозрении на симптом поликистозных яичников необходимо установить уровень тестесторона и дегидроэпиандростерон-сульфата (ДГЭА).
Визуализация включает трансвагинальное ультразвуковое исследование, в случае если:
-
Возраст >35 лет
-
Есть факторы риска рака эндометрия
-
Кровотечение продолжается, несмотря на терапию гормонами
Локальное утолщение эндометрия, обнаруженное на УЗИ, может потребовать гистероскопии или соногистерографии для выявления небольших внутриматочных образований (например, полип эндометрия, миома).
Если результаты обследования и УЗД у женщин оказались неубедительными, проводят другие исследования, включая отбор проб эндометрия, при наличии хотя бы одного из следующих факторов:
-
Возраст >35 лет
-
Факторы риска развития рака
-
Утолщение эндометрия > 4 мм
Отбор биопсии эндометрия может быть сделан путем аспирации или, если канал шейки матки требует расширения, методом расширения и выскабливания.
Интенсивная терапия массивной кровопотери в акушерстве Часть I. Геморрагический шок
Р.А. Ткаченко, д.м.н., доцент кафедры анестезиологии и интенсивной терапии Национального медицинского университета им. А.А. Богомольца, главный консультант ГУЗО и МЗ г. Киева по вопросам акушерской реанимации
Геморрагический шок и его осложнения в акушерской практике устойчиво занимают ведущее место среди причин материнской смертности. Как правило, причиной его развития являются массивные маточные кровотечения, которые встречаются в 8-11% случаев от всех родов [1]. Повсеместно акушерские кровотечения – одна из основных причин материнской смертности, составляющая в чистом виде 20-25%; как конкурирующая причина – 42% и как фоновая – до 78% [8]. К сожалению, подобная статистика характерна и для Украины (рис. 1).
 Первичная гиповолемия у беременных наблюдается при гестозах, многоводии, многоплодии, сосудистых аллергических поражениях, заболеваниях, сопровождающихся лихорадочными состояниями, диабете, заболеваниях почек, недостаточности кровообращения и др. Кроме того, возможно развитие вторичной (ятрогенной) гиповолемии под влиянием неадекватного использования диуретиков, ганглиоблокаторов и т.д. [18].
Первичная гиповолемия у беременных наблюдается при гестозах, многоводии, многоплодии, сосудистых аллергических поражениях, заболеваниях, сопровождающихся лихорадочными состояниями, диабете, заболеваниях почек, недостаточности кровообращения и др. Кроме того, возможно развитие вторичной (ятрогенной) гиповолемии под влиянием неадекватного использования диуретиков, ганглиоблокаторов и т.д. [18].1. Кровотечения на ранних сроках беременности:
● аборт;
● внематочная беременность;
● пузырный занос.
2. Кровотечения на поздних сроках беременности или в родах:
● преждевременная отслойка плаценты;
● предлежание плаценты;
● разрывы матки;
● эмболия околоплодными водами.
3. Кровотечения после родов:
● гипотония или атония матки;
● разрывы родовых путей.
4. Печеночная недостаточность.
5. Патология системы гемостаза.
Наиболее частые причины акушерских кровотечений отражены в таблице 1.
Особенностью акушерских кровотечений являются их внезапность и массивность. Для акушерских кровотечений характерны острый дефицит объема циркулирующей крови (ОЦК), нарушения сердечной деятельности, анемическая и циркуляторные формы гипоксии. Основные причины нарушений гемодинамики – дефицит ОЦК и несоответствие между ним и емкостью сосудистого русла. Возникающая на этом фоне тканевая гипоксия сопровождается нарушением окислительно-восстановительных процессов спреимущественным поражением ЦНС, почек, печени. Кроме того, происходит нарушение водно-электролитного баланса, кислотно-щелочного состояния, гормональных соотношений и ферментативных процессов. При массивных кровотечениях быстро развивается порочный круг, который может привести к терминальному состоянию и летальному исходу.
Наилучшими способами предупреждения развития кровотечений являются тщательное наблюдение за беременными, современные методы диагностики и обследования, а также наличие квалифицированного персонала, владеющего методами интенсивной терапии и знающего специфику акушерской клиники.
Опасность развития геморрагического шока у беременных возникает при кровопотере 15-20% от ОЦК или 750-1000 мл. Кровопотеря, превышающая 1500 мл (25-30% от ОЦК или 1,5% от массы тела), считается массивной [7, 13, 14]. Связано это в первую очередь с теми адаптационно-приспособительными изменениями, которые возникают у женщин в процессе прогрессирования беременности. Прежде всего, это развитие физиологической гиперволемической аутогемодилюции, снижение коллоидно-осмотического давления до 22 мм рт. ст. и осмолярности до 275-280 мосмоль/л [2, 9, 18]. Данные изменения способствуют развитию отека легких, особенно на фоне непродуманной инфузионно-трансфузионной терапии. Кроме того, на фоне гиперпрогестеронемии увеличивается эластичность вен и уменьшается реакция сосудов на катехоламины, что создает определенную проблематичность компенсации кровопотери более 20% от ОЦК. Снижение общего периферического сосудистого сопротивления до 750-1500 дин × см/с
 Все это делает приспособительные реакции у беременных малоэффективными при кровопотере более 30% ОЦК [2] и приводит к развитию тяжелого гиповолемического шока, сопровождающегося множеством патологических нарушений (рис. 2).
Все это делает приспособительные реакции у беременных малоэффективными при кровопотере более 30% ОЦК [2] и приводит к развитию тяжелого гиповолемического шока, сопровождающегося множеством патологических нарушений (рис. 2). Также следует учитывать и большую скорость маточного кровотока в конце III триместра беременности, достигающего 400-700 мл/мин, что обусловливает достаточно высокий темп потери ОЦК. Особенно быстро развивается геморрагический шок у беременных на фоне исходной гиповолемии [3].
Этиопатогенез
Основной причиной патогенетических изменений, развивающихся при геморрагическом шоке, является острая кровопотеря, приводящая к снижению ОЦК. В результате этого происходит уменьшение венозного возврата и сердечного выброса (в соответствии с законом Старлинга) и как следствие – снижение уровня артериального давления (АД). Это в свою очередь приводит к стимуляции барорецепторов в дуге аорты, что сопровождается активацией симпато-адреналовой системы и выбросом катехоламинов (концентрация адреналина может повыситься в два раза, а норадреналина – в шесть раз).
Обусловленная кровопотерей внезапная гиповолемия приводит к миграции интерстициальной жидкости в сосудистое русло за счет первоначального снижения гидростатического давления в капиллярах.В первые 5 мин после кровопотери в сосудистое русло может перейти количество жидкости, соответствующее 10-15% ОЦК, что и обусловливает достаточно хорошую компенсацию кровопотери в этом объеме (рис. 2). В дальнейшем при продолжающемся кровотечении развивается компенсаторная централизация кровообращения, направленная на улучшение перфузии жизненно важных органов, в первую очередь головного мозга и сердца [3, 9, 15, 26]. Без симпатической компенсации быстрая потеря 25% ОЦК (20 мл/кг)привела бы к остановке кровообращения вследствие прекращения венозного возврата к сердцу [23].
 Очень существенным фактором перераспределения крови при кровопотере является реакция спланхнического кровотока, которая выражается в спазме артериол, снижении венулярного сопротивления портальной системы и печени, в результате чего улучшается отток крови из этого бассейна в системный кровоток [22].
Очень существенным фактором перераспределения крови при кровопотере является реакция спланхнического кровотока, которая выражается в спазме артериол, снижении венулярного сопротивления портальной системы и печени, в результате чего улучшается отток крови из этого бассейна в системный кровоток [22]. Активация β1-адренорецепторов повышает сократительную активность миокарда, что сопровождается повышением частоты сердечных сокращений и до определенного периода позволяет удерживать АД на прежнем уровне. Кроме того, это сопровождается расширением бронхиол и снижением сопротивления дыхательных путей. По мере прогрессирования кровопотери, возникающие в организме компенсаторные изменения не в состоянии противостоять все более усиливающемуся падению сердечного выброса, что приводит к снижению перфузии и ишемизации различных органов и тканей, в том числе почек, печени, кишечника, кожи и др. Ишемия почек приводит к активации ренин-ангиотензиновой системы, сопровождающейся повышением продукции антидиуретического гормона и дальнейшим усугублением спазма артериол, а также повышением периферического сосудистого сопротивления, что еще больше увеличивает нагрузку на миокард.

Ишемизация тканей приводит к тканевой гипоксии и перестройке клеточного метаболизма, что сопровождается накоплением недоокисленных продуктов, в частности молочной, пировиноградной и других органических кислот, и развитием метаболического ацидоза. Возникающие нарушения кислотно-основного состояния еще больше редуцируют функционирование микроциркуляторного русла и нарушают работоспособность пре- и посткапиллярных сфинктеров. Это обусловливает повышение внутрикапиллярного гидродинамического давления и последующий выход жидкости из капиллярного русла. Потеря жидкости сопровождается нарастанием вязкости крови и замедлением капиллярного кровотока, что в конечном итоге приводит к склеиванию эритроцитов, тромбоцитов и развитию сладж-феномена. Таким образом, в сосудистом русле создаются все предпосылки для дальнейшей каскадной реакции внутрисосудистой коагуляции и прогрессирования ДВС-синдрома.
Нарушение клеточного метаболизма сопровождается активацией цитокинов и комплемента, часть фракций которого образует мембраноповреждающий комплекс, что приводит к повреждению мембран форменных элементов и эндотелия сосудов, выбросу тромбопластина и усугубляет нарушенную сосудистую проницаемость.
 Все эти изменения происходят на фоне активизации метаболизма арахидоновой кислоты и образования эйкозаноидов (простагландинов, лейкотриенов и тромбоксанов). Под действием фосфолипазы А2 запускается каскад последующих превращений арахидоновой кислоты, которые проходят двумя путями: циклооксигеназным и липооксигеназным. В результате прохождения циклооксигеназным путем образуются короткоживущие эндоперекиси РGG2 и РGН2, которые затем метаболизируются в тромбоксан (ТХА2), простациклин (РGІ2) и простагландины (PGD2, PGE2 и PGF2α).Липоксигеназные энзимы обеспечивают конкурирующий путь окисления свободной арахидоновой кислоты, первичными продуктами которой являются эндоперекиси. Они в дальнейшем могут превращаться в лейкотриены. Метаболиты арахидоновой кислоты активно влияют на микроциркуляцию. Тромбоксан А2 вызывает спазм артериол и стимулирует агрегацию тромбоцитов. Простациклин обладает способностью расширять сосуды и является сильным ингибитором агрегации тромбоцитов.
Все эти изменения происходят на фоне активизации метаболизма арахидоновой кислоты и образования эйкозаноидов (простагландинов, лейкотриенов и тромбоксанов). Под действием фосфолипазы А2 запускается каскад последующих превращений арахидоновой кислоты, которые проходят двумя путями: циклооксигеназным и липооксигеназным. В результате прохождения циклооксигеназным путем образуются короткоживущие эндоперекиси РGG2 и РGН2, которые затем метаболизируются в тромбоксан (ТХА2), простациклин (РGІ2) и простагландины (PGD2, PGE2 и PGF2α).Липоксигеназные энзимы обеспечивают конкурирующий путь окисления свободной арахидоновой кислоты, первичными продуктами которой являются эндоперекиси. Они в дальнейшем могут превращаться в лейкотриены. Метаболиты арахидоновой кислоты активно влияют на микроциркуляцию. Тромбоксан А2 вызывает спазм артериол и стимулирует агрегацию тромбоцитов. Простациклин обладает способностью расширять сосуды и является сильным ингибитором агрегации тромбоцитов. Простагландин Е2 является вазодилататором, тогда как простагландин F2α индуцирует вазоконстрикцию. Лейкотриены С4, D4 и Е4 в 1000-5000 раз превосходят гистамин по действию на сосудистую проницаемость и обусловливают спазм сосудов. Конечным результатом изменений в сосудах микроциркуляторного русла является нарушение нормального капиллярного барьера, что приводит к пропотеванию в интерстиций жидкости и к снижению объема плазмы [27].
Простагландин Е2 является вазодилататором, тогда как простагландин F2α индуцирует вазоконстрикцию. Лейкотриены С4, D4 и Е4 в 1000-5000 раз превосходят гистамин по действию на сосудистую проницаемость и обусловливают спазм сосудов. Конечным результатом изменений в сосудах микроциркуляторного русла является нарушение нормального капиллярного барьера, что приводит к пропотеванию в интерстиций жидкости и к снижению объема плазмы [27]. Тканевая ишемия, перестройка клеточного метаболизма, активизация метаболизма арахидоновой кислоты и другие патологические факторы способствуют дальнейшему повреждению клеточных мемебран и поступлению в организм обломков белковых молекул, обладающих миокардиодепрессивным эффектом, замыкая образовавшийся порочный круг [17]. Mebazaa A.и соавт. (2004) полагают, что миокардиальная ишемия является одним из основных осложнений после массивной послеродовой кровопотери. Считается, что низкий уровень диастолического АД в сочетании с выраженной тахикардией – серьезный прогностический фактор в генезе развития ишемии миокарда у этой категории пациенток [24].

Образование вазоактивных метаболитов при длительной тканевой гипоксии приводит к расширению сосудов и резкому, нередко трудно поддающемуся коррекции, снижению АД. При снижении систолического АД ниже 50 мм рт. ст. нарушается синтез сурфактанта, вследствие чего альвеолы начинают спадаться, нарушая альвеолярную вентиляцию и диффузию газов через альвеоло-капиллярную мембрану и усугубляя имеющуюся гипоксию тканей и гипоксемию.
При снижении кровотока в периферических сосудах и артериальной гипотензии ткани активно начинают потреблять кислород из венозного отдела капилляров. В результате этого увеличивается артерио-венозная разница по кислороду и в течение некоторого времени поддерживается нормальное потребление тканями кислорода. В дальнейшем возникают снижение потребления кислорода тканями и нарастающая тканевая гипоксия вследствие открытия артерио-венозных шунтов. Основная часть кровотока устремляется через открывшиеся шунты, делая абсолютно неэффективной тканевую перфузию [26].
Таким образом, после острой кровопотери при отсутствии своевременной коррекции происходит полное поражение макро- и микроциркуляции, нарушение всех видов метаболизма, растройство деятельности всех органов и ферментативных систем.
 Возникает синдром полиорганной и полисистемной недостаточности, который в конечном итоге приводит к гибели клеток и всего макроорганизма [11].
Возникает синдром полиорганной и полисистемной недостаточности, который в конечном итоге приводит к гибели клеток и всего макроорганизма [11]. Комбинация гипотензии, гипотермии, коагулопатии и ацидоза является постоянным синдромом при шоке, который поддерживает порочный круг, и если его не разорвать – исход может быть летальным [21].
Клиническая картина
Клиника геморрагического шока в значительной мере зависит не только от объема кровопотери, но и от ее скорости и возможности организма включать компенсаторные системы. Следует также учитывать, что артериальная гипотензия считается поздним симптомом акушерского геморрагического шока. Благодаря физиологической гиперволемической аутогемодилюции у беременных АД может оставаться неизменным даже при кровопотере 25-30% от ОЦК [10]. Компенсация гиповолемии у таких пациенток происходит в первую очередь за счет активации симпато-адреналовой системы, что проявляется вазоспазмом и тахикардией. Однако, как уже указывалось выше, эти механизмы неустойчивы и быстро истощаются. Рано присоединяется олигоурия [5, 6, 12]. Поэтому при постановке диагноза геморрагического шока необходимо ориентироваться не только на объем кровопотери, но и на его клинические проявления. Адекватно определитьобъем кровопотери у беременных при развитии массивного маточного кровотечения зачастую бывает крайне сложно, так как вытекающая из влагалища кровь часто разбавлена околоплодными водами. Кроме того, не исключается задержка крови во влагалище или матке или же развитие внутреннего кровотечения при разрыве матки, что также затрудняет адекватное определение реального объема кровопотери. Уточнение диагноза необходимо проводить параллельно с интенсивной терапией. Борьба с шоком – экстренное задание, поскольку процесс стремительно прогрессирует, а терапевтические возможности организма беременной быстро исчерпываются. Поэтому для качественного проведения инфузионно-трансфузионной терапии необходимо отталкиваться не только от объема кровопотери, но и от клинических проявлений степени тяжести шока, используя шоковый индекс Алговера, симптом «бледного пятна», уровень лактата венозной крови и др.
Рано присоединяется олигоурия [5, 6, 12]. Поэтому при постановке диагноза геморрагического шока необходимо ориентироваться не только на объем кровопотери, но и на его клинические проявления. Адекватно определитьобъем кровопотери у беременных при развитии массивного маточного кровотечения зачастую бывает крайне сложно, так как вытекающая из влагалища кровь часто разбавлена околоплодными водами. Кроме того, не исключается задержка крови во влагалище или матке или же развитие внутреннего кровотечения при разрыве матки, что также затрудняет адекватное определение реального объема кровопотери. Уточнение диагноза необходимо проводить параллельно с интенсивной терапией. Борьба с шоком – экстренное задание, поскольку процесс стремительно прогрессирует, а терапевтические возможности организма беременной быстро исчерпываются. Поэтому для качественного проведения инфузионно-трансфузионной терапии необходимо отталкиваться не только от объема кровопотери, но и от клинических проявлений степени тяжести шока, используя шоковый индекс Алговера, симптом «бледного пятна», уровень лактата венозной крови и др. (табл. 2).
(табл. 2).
Таким образом, самая простая и главная причина ухудшения доставки кислорода к тканям – это невозможность организма обеспечить адекватный кровоток вследствие уменьшения объема внутрисосудистой жидкости. Следовательно, для поддержания и улучшения доставки кислорода к тканям необходимо восстановление внутрисосудистого объема как единственно главного критического параметра для адекватного кровотока и, следовательно, транспорта кислорода, что позволяет предупредить серьезные клинические последствия гипоксии. Гиповолемия должна корригироваться на наиболее ранних стадиях, потому что как только гипоксия вызовет значительные изменения тканей, процесс становится необратимым, и развивается полиорганная недостаточность [1, 3, 16].
Организация экстренной помощипри геморрагическом шоке
Анализ историй родов, сопровождавшихся массивной кровопотерей, показывает, что эффективность проводимого лечения в значительной степени зависит от времени начала интенсивной противошоковой терапии и организации мероприятий, направленных на окончательную остановку кровотечения.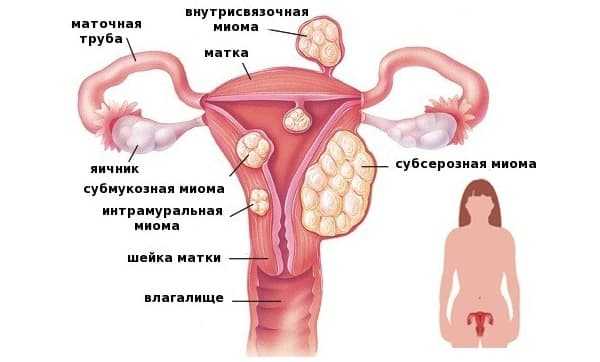 Именно упущенное время, как известно, является одним из пусковых факторов, приводящих в действие весь комплекс патофизиологических сдвигов, которые происходят в организме при продолжающейся кровопотере. По-этому во главу угла проблемы снижения материнской смертности от массивной кровопотери должны быть поставлены вопросы организации экстренной помощи этой категории женщин.
Именно упущенное время, как известно, является одним из пусковых факторов, приводящих в действие весь комплекс патофизиологических сдвигов, которые происходят в организме при продолжающейся кровопотере. По-этому во главу угла проблемы снижения материнской смертности от массивной кровопотери должны быть поставлены вопросы организации экстренной помощи этой категории женщин.
Экстренная помощь должна базироваться на следующих принципах:
1. Каждому члену дежурной бригады родильного блока и операционной, начиная от акушерки приемного покоя и заканчивая врачебной бригадой, следует четко знать порядок своих действий при оказании помощи женщине с кровотечением в зависимости от его причины, объема, скорости и исходной тяжести состояния больной.
2. Медперсонал лечебного учреждения должен находиться в постоянной готовности к оказанию помощи пациенткам с любым объемом кровопотери.
3. В лечебном учреждении надлежит организовать запас препаратов крови всех групп, средств для инфузионной терапии, в том числе коллоидных и белковых препаратов. Должны быть в наличии и постоянной готовности наборы для катетеризации центральных вен и венесекции, системы для переливания крови и ее забора.
Должны быть в наличии и постоянной готовности наборы для катетеризации центральных вен и венесекции, системы для переливания крови и ее забора.
4. В постоянной готовности необходимо содержать операционный инструментарий и анестезиологическое оборудование, включая наборы для проведения сердечно-легочной реанимации женщине и новорожденному.
5. Круглосуточно должна функционировать экспресс-лаборатория для диагностики состояния жизненно важных органов и систем [6, 14].
Интенсивная терапия геморрагического шока включает следующие мероприятия:
● немедленную остановку кровотечения консервативными или хирургическими методами, в зависимости от причины кровопотери;
● восполнение ОЦК;
● обеспечение адекватного газообмена;
● лечение органной дисфункции и профилактики полиорганной недостаточности;
● коррекцию метаболических нарушений.
Остановка кровотечения является основным компонентом интенсивной терапии. Методы для этого выбирают в зависимости от причины, объема, скорости кровопотери и тяжести состояния больной, соблюдая главное условие – остановка кровотечения должна быть надежной и своевременной (тяжесть состояния не является противопоказанием к операционному гемостазу).
Восполнение ОЦК и проведение инфузионной терапии базируется на старом и хорошо зарекомендовавшем себя принципе: чем раньше – тем лучше. От скорости восстановления ОЦК и эффективной перфузии органов и тканей в основном зависит исход и вероятность выживания пациентки. Как правило, лечение геморрагического шока более эффективно, если инфузионная терапия начинается как можно раньше, не позднее чем за 30 минот начала развития первых проявлений шока [20].
Скорость инфузионной терапии определяется степенью тяжести состояния больной (в терминальных случаях до 500 мл/мин, но не менее 100 мл/мин) [15].
В зависимости от объема кровопотери и тяжести шокового состояния проводят катетеризацию одной-двух периферических вен катетерами большого диаметра (№ 14-16 G). При существующей возможности доступа к нескольким периферическим венам не следует спешить с катетеризацией центральных вен, так как существует вероятность возникновения тяжелых посткатетеризационных осложнений. При развитии шока 3-4-й степени тяжести необходима катетеризация трех или даже четырех вен, при этом одна из них должна быть центральной. Преимущество при катетеризации вен следует отдавать венесекции v. braсhialis или пункции v. jugularis interna с последующим постоянным контролем центрального венозного давления (как одного из показателей эффективности проводимой терапии). При шоке 2-3-й степени темп инфузии должен составлять 200-300 мл/мин [13]. При прогрессировании сердечной недостаточности, о чем свидетельствует повышение центрального венозного давления на фоне проведения инфузионной терапии, при остающемся низком уровне АД необходимо проведение симпатомиметической поддержки (дофамином 5-20 мкг/кг/минили добутамином 5-40 мкг/кг/мин) [11].
Преимущество при катетеризации вен следует отдавать венесекции v. braсhialis или пункции v. jugularis interna с последующим постоянным контролем центрального венозного давления (как одного из показателей эффективности проводимой терапии). При шоке 2-3-й степени темп инфузии должен составлять 200-300 мл/мин [13]. При прогрессировании сердечной недостаточности, о чем свидетельствует повышение центрального венозного давления на фоне проведения инфузионной терапии, при остающемся низком уровне АД необходимо проведение симпатомиметической поддержки (дофамином 5-20 мкг/кг/минили добутамином 5-40 мкг/кг/мин) [11].
Показателем эффективности проводимой терапии геморрагического шока является нормализация центрального венозного давления и АД, уменьшениетахикардии, сердечный индекс > 3 л/мин, потребление кислорода (VO2) > 100 мл/мин × м2, повышение темпа мочеотделения > 30 мл/ч, снижение уровня венозного лактата < 3,5 ммоль/л. При своевременном начале и адекватном проведении интенсивной терапии исход геморрагического шока, как правило, благоприятный [15].
Список литературы находится в редакции
Отделение фетальной хирургии | ЦПСиР
ЦПСиР, являясь ведущим акушерским стационаром города, в течение 20 лет оказывает специализированную помощь пациенткам с иммуноконфликтной беременностью.
В составе ЦПСиР имеется консультативно – диагностическое отделение, где ведут прием высококвалифицированные врачи акушеры — гинекологи, к которым из женских консультаций города Москвы, Московской области, а также различных регионов страны направляются беременные с резус-сенсибилизацией. У большинства из этих пациенток развивается гемолитическая болезнь плода (ГБП). Диагностика гемолитической болезни плода основывается на результатах комплексного обследования состояния матери и плода, которое включает изучение анамнеза, определение титра резус-антител, эхографию с фето-и и плацентометрию, исследование сердечной деятельности и биофизического профиля плода (БФПП), околоплодных вод, крови плода, полученной с помощью кордоцентеза. Тактика ведения беременности при иммунологической несовместимости крови матери и плода направлена на раннюю диагностику ГБП, выявление степени сенсибилизации, проведение лечебных мероприятий и определение оптимальных сроков родоразрешения.
Тактика ведения беременности при иммунологической несовместимости крови матери и плода направлена на раннюю диагностику ГБП, выявление степени сенсибилизации, проведение лечебных мероприятий и определение оптимальных сроков родоразрешения.
Коноплянников Александр Георгиевич
Главный акушер — гинеколог города Москвы. Доктор медицинских наук, профессор кафедры акушерства и гинекологии РНИМУ им. Н.И. Пирогова, врач высшей категории
Кордоцентез
Обследование беременных с указанной акушерской патологией в ЦПСиР целесообразно начинать с 20 недель гестации. Однако, пациенткам с отягощенным акушерским анамнезом (антенатальной гибелью детей от гемолитической болезни, рождением детей с тяжелыми формами этого заболевания) необходимо обращаться в центр уже в 18 недель. Именно в этом сроке специалисты центра при ультразвуковом сканировании могут выявить первые признаки гемолитической болезни плода, своевременно поставить диагноз. Однако более точным методом выявления ГБП и определения ее тяжести является исследование крови плода, полученной путем кордоцентеза – пункции пуповины. Эта диагностическая манипуляция производится врачами ЦПСиР в дневном стационаре с 24 недель беременности. Показаниями к кордоцентезу являются наличие ультразвуковых маркеров ГБП, титр антител 1:16 и выше, отягощенный анамнез. Полученную кровь плода исследуют для определения группы крови и резус принадлежности, уровня гемоглобина и гематокрита, эритроцитов и билирубина, кислотно-щелочного равновесия. На основании полученных данных определяется дальнейшая тактика ведения беременности. При резус-отрицательной крови у плода дальнейшее наблюдение за беременной продолжается в амбулаторных условиях как за несенсибилизированной пациенткой и для ее родоразрешения не требуется госпитализация в специализированный стационар. При резус положительной крови плода и наличии данных, свидетельствующих и наличии ГБП, необходимо начинать патогенетическое лечение этого заболевания.
Эта диагностическая манипуляция производится врачами ЦПСиР в дневном стационаре с 24 недель беременности. Показаниями к кордоцентезу являются наличие ультразвуковых маркеров ГБП, титр антител 1:16 и выше, отягощенный анамнез. Полученную кровь плода исследуют для определения группы крови и резус принадлежности, уровня гемоглобина и гематокрита, эритроцитов и билирубина, кислотно-щелочного равновесия. На основании полученных данных определяется дальнейшая тактика ведения беременности. При резус-отрицательной крови у плода дальнейшее наблюдение за беременной продолжается в амбулаторных условиях как за несенсибилизированной пациенткой и для ее родоразрешения не требуется госпитализация в специализированный стационар. При резус положительной крови плода и наличии данных, свидетельствующих и наличии ГБП, необходимо начинать патогенетическое лечение этого заболевания.
К сожалению, традиционные методы терапии этой патологии (десенсибилизирующая терапия, гемосорбция и плазмоферез, внутривенное введение растворов иммуноглобулинов) являются неэффективными, и их применение часто приводят к потери времени для проведения патогенетического лечения, развитию тяжелых некурабельных форм заболевания. В настоящее время единственным эффективным методом лечения тяжелых форм гемолитической болезни плода является операция внутриутробного переливания крови, которое с успехом в течение многих лет производят специалисты ЦПСиР. Для проведения этой операции беременную госпитализируют в отделение патологии центра. Целью данной манипуляции является повышение уровня гематокрита, снижение риска развития отечной формы ГБП, дальнейшее пролонгирование беременности на 2 -3 недели (время функционирования введенных эритроцитов). Показаниями к внутриутробному переливанию крови плоду является снижение в пуповинной крови показателей гемоглобина и гематокрита на 15% и более по сравнению с гестационной нормой. Нередко указанную манипуляцию проводят несколько раз на протяжении беременности. Необходимость повторных переливаний крови плоду определяется сроком беременности и уровнем посттрансфузионного гематокрита, поскольку при ГБП скорость снижения гематокрита составляет в среднем 1% в сутки. Внутриутробные переливания крови допустимо проводить до 32 недель беременности.
В настоящее время единственным эффективным методом лечения тяжелых форм гемолитической болезни плода является операция внутриутробного переливания крови, которое с успехом в течение многих лет производят специалисты ЦПСиР. Для проведения этой операции беременную госпитализируют в отделение патологии центра. Целью данной манипуляции является повышение уровня гематокрита, снижение риска развития отечной формы ГБП, дальнейшее пролонгирование беременности на 2 -3 недели (время функционирования введенных эритроцитов). Показаниями к внутриутробному переливанию крови плоду является снижение в пуповинной крови показателей гемоглобина и гематокрита на 15% и более по сравнению с гестационной нормой. Нередко указанную манипуляцию проводят несколько раз на протяжении беременности. Необходимость повторных переливаний крови плоду определяется сроком беременности и уровнем посттрансфузионного гематокрита, поскольку при ГБП скорость снижения гематокрита составляет в среднем 1% в сутки. Внутриутробные переливания крови допустимо проводить до 32 недель беременности. После этого срока решается вопрос о досрочном родоразрешении.
После этого срока решается вопрос о досрочном родоразрешении.
В ЦПСиР накоплен большой опыт проведения данной операций: ежегодно в центре проводится от 70 до 80 внутриутробных переливаний крови. Этот метод лечения гемолитической болезни является уникальным и в городе Москве производится только специалистами ЦПСиР.
Преждевременные роды – это проблема, которая часто сопровождает иммуноконфликтную беременность. В структуре ЦПСиР важное место занимает детская реанимация, располагающая возможностью выхаживать не только детей с эсктримально низкой массой тела, но и недоношенных детей с тяжелыми формами гемолитической болезни новорожденных. Эти дети получают комплексное лечение ГБ, включающее гематрансфузию в условиях операционной сразу после проведенной их матерям операции кесарева сечения, далее заменное переливания крови в условиях детской реанимации, а также инфузионную и фототерапию.
Алгоритм обследования и лечения пациенток и резус сенсибилизацией, разработанный и внедренный в ЦПСиР, позволил снизить перинатальные потери в 1,5 раза, сократить число преждевременно родившихся детей, количество детей с тяжелыми формами гемолитической болезни, уменьшить частоту и кратность применения заменного переливания крови у новорожденных с ГБ, а также позволил добиться рождения здоровых детей с пациенток с большим количеством перинатальных потерей, обусловленных резус сенсибилизацией и ГБ.
Однако проблема резус сенсибилизации до настоящего времени не является решенной. Врачи консультативно – диагностического отделения ЦПСиР ежедневно принимают новых пациенток, страдающих этой акушерской патологией. Это связано с отсутствием проведения профилактических мероприятий в других лечебных учреждениях, несмотря на то, что меры профилактики всем известны и давно внедрены в практику лечебной работы ЦПСиР.
В ЦПСиР всем пациенткам с резус отрицательной кровью и отсутствием резус-антител в сыворотке крови при сроке гестации 28 недель, при угрозе прерывания беременности, сопровождающейся кровяными выделениями из половых путей, независимо от срока гестации, после инвазивных процедур (биопсия хориона, амниоцентеза, кордоцентеза), самопроизвольного или искусственного прерывания беременности, внематочной беременности, а также после родов резус положительным плодом, вводят антирезус иммуноглобулин.
Бугеренко Андрей Евгеньевич
Кандидат медицинских наук. Доцент кафедры акушерства и гинекологии факультета фундаментальной медицины МГУ
Доцент кафедры акушерства и гинекологии факультета фундаментальной медицины МГУ
Cиндром фето-фетальной трансфузии
Желанная беременность – радость для будущих родителей. Беременность двойней – двойная радость. Но для акушера это даже не двойные проблемы, а проблемы в квадрате. Особенно это касается монохориальной двойни. Хотя частота таких беременностей невелика, зато помимо проблем, присущих многоплодной беременности как таковой, имеются серьезные осложнения, присущие исключительно монохориальному типу плацентации.
Одним из таких тяжелых осложнений монохориальной двойни является синдром фето-фетальной трансфузии (СФФТ). Возникновение этого осложнения, как правило, заканчивается гибелью обоих плодов до сроков, в которых возможно выхаживание преждевременно родившихся детей.
Cиндром фето-фетальной трансфузии, известный также как фето-фетальный трансфузионный синдром ( twin-to-twin transfusion syndrome, TTTS) возникает в связи с наличием сосудистых плацентарных анастомозов, соединяющих кровеносные системы плодов между собой. Частота возникновения СФФТ по данным разных авторов колеблется от 5 до 25% от числа беременностей с монохориальным типом плацентации. Дисбаланс обмена крови по анастомозам приводит к оттоку крови от одного близнеца (донора) к другому (реципиенту). Это тяжелая патология, при которой вероятность интранатальной гибели плодов достигает 80-100%.
Частота возникновения СФФТ по данным разных авторов колеблется от 5 до 25% от числа беременностей с монохориальным типом плацентации. Дисбаланс обмена крови по анастомозам приводит к оттоку крови от одного близнеца (донора) к другому (реципиенту). Это тяжелая патология, при которой вероятность интранатальной гибели плодов достигает 80-100%.
СФФТ впервые в 1882 году описал немецкий акушер Friedrich Schatz. Но несмотря на такую длительную историю, для подавляющего большинства врачей поликлинического звена здравоохранения как диагностика, так и тактика ведения пациенток с проявлениями СФФТ является «terra incognita», что приводит в результате к неблагоприятному завершению беременности.
Кратко о патогенезе развития СФФТ:
Дисбаланс обмена крови по анастомозам приводит к оттоку крови от одного близнеца (донора) к другому (реципиенту). У близнеца-донора развивается гипоксия (вследствие недостаточности плацентарного кровообращения), гиповолемия со снижением артериального давления. Вследствие этих факторов задерживается внутриутробное развитие, снижается объем околоплодных вод, и часто развивается выраженная анемия с уровнем гемоглобина менее 80 г/л. Наиболее частым следствием тяжелой антенатальной гипоксии является формирование, так называемой, скрытой сердечной недостаточности, когда показатели ударного и минутного объемов кровообращения существенно не меняются, но ряд индексов диастолической функции свидетельствуют о поражении миокарда плода. Плод-реципиент, напротив, получает слишком много крови, у него развивается гиперволемия, что увеличивает пред- и постнагрузку на сердце, это может привести в дальнейшем к сердечной недостаточности. В условиях гиперволемии у плода-реципиента появляются отёки, повышается артериальное давление, развивается гипертрофия миокарда. Организм плода в ответ на увеличение объема циркулирующей крови (ОЦК) выделяет избыточное количество воды через органы мочевыводящей системы, что приводит к выраженному многоводию. Из-за высокого содержания в крови эритроцитов появляется высокий риск развития тромбозов.
Вследствие этих факторов задерживается внутриутробное развитие, снижается объем околоплодных вод, и часто развивается выраженная анемия с уровнем гемоглобина менее 80 г/л. Наиболее частым следствием тяжелой антенатальной гипоксии является формирование, так называемой, скрытой сердечной недостаточности, когда показатели ударного и минутного объемов кровообращения существенно не меняются, но ряд индексов диастолической функции свидетельствуют о поражении миокарда плода. Плод-реципиент, напротив, получает слишком много крови, у него развивается гиперволемия, что увеличивает пред- и постнагрузку на сердце, это может привести в дальнейшем к сердечной недостаточности. В условиях гиперволемии у плода-реципиента появляются отёки, повышается артериальное давление, развивается гипертрофия миокарда. Организм плода в ответ на увеличение объема циркулирующей крови (ОЦК) выделяет избыточное количество воды через органы мочевыводящей системы, что приводит к выраженному многоводию. Из-за высокого содержания в крови эритроцитов появляется высокий риск развития тромбозов. Полицитемия у близнеца-реципиента обуславливает повышенный гематокрит, составляющий 60% и более или уровень гемоглобина выше 220 г/л в любой момент на первой неделе жизни новорожденного. Близнецу с полицитемией угрожают расстройства дыхания, сердечной деятельности, поражение центральной нервной системы.
Полицитемия у близнеца-реципиента обуславливает повышенный гематокрит, составляющий 60% и более или уровень гемоглобина выше 220 г/л в любой момент на первой неделе жизни новорожденного. Близнецу с полицитемией угрожают расстройства дыхания, сердечной деятельности, поражение центральной нервной системы.
При внутриутробной гибели одного плода при СФФТ с вероятностью 25% существует риск развития осложнений другого плода. Подобные осложнения в виде некрозов головного мозга и паренхиматозных органов считаются следствием острой ишемии и гипотензии, возникающими из-за шунтирования крови от живого плода умирающему. Перинатальная смертность плода-реципиента после смерти плода-донора составляет около 50% при сроке беременности до 34.
Для своевременной диагностики СФФТ необходимо прежде всего правильно определить тип плацентации на ранних сроках беременности, когда это не представляет трудности. Наличие Т-признака (в отличие от λ-признака при бихориальной беременности) является поводом для пристального УЗ-мониторирования данной беременности в сроки манифестации СФФТ (с 14 недель). Характерными ультразвуковыми признаками развития СФФТ являются: нарастающее многоводие в амниотической полости реципиента, определяющееся как вертикальный размер наибольшего водного кармана от 8 см и более до 20 недель гестации, и превышающий 10 см с 20 по 26 неделю; для донора характерно олигоурическое маловодие или агидрамнион и отсутствие эхо-тени мочевого пузыря. Могут возникнуть трудности в дифференциальной диагностике СФФТ с другим серьезным осложнением монохориальной двойни — синдромом изолированной задержки роста плода (иЗРП), но это уже является прерогативой специализированного акушерско-гинекологического стационара.
Характерными ультразвуковыми признаками развития СФФТ являются: нарастающее многоводие в амниотической полости реципиента, определяющееся как вертикальный размер наибольшего водного кармана от 8 см и более до 20 недель гестации, и превышающий 10 см с 20 по 26 неделю; для донора характерно олигоурическое маловодие или агидрамнион и отсутствие эхо-тени мочевого пузыря. Могут возникнуть трудности в дифференциальной диагностике СФФТ с другим серьезным осложнением монохориальной двойни — синдромом изолированной задержки роста плода (иЗРП), но это уже является прерогативой специализированного акушерско-гинекологического стационара.
Единственным патогенетически оправданным методом лечения СФФТ является фетоскопическая лазерная коагуляция анастомозов (ФЛКА). Методика заключается в фетоскопическом (через оптическую систему малого диаметра) трансабдоминальном введении лазерного световода в амниотическую полость плода-реципиента под контролем УЗИ. Эндоскопическая лазерная коагуляция позволяет осуществлять обследование плаценты вдоль всей межплодовой перегородки, выявить и произвести коагуляцию анастомозирующих сосудов. Таким образом, поступление крови от одного близнеца другому прекращается, баланс поступления крови к обоим плодам восстанавливается, и близнецы в дальнейшем развиваются нормально. Операция заканчивается дренированием околоплодных вод до нормализации их количества. Эффективность эндоскопической лазеркоагуляционной терапии СФФТ (рождение хотя бы одного живого ребёнка) составляет от 80 до 90 %, возможно пролонгирование беременности в среднем на 10-12 недель, что приводит к снижению внутриутробной гибели плодов.
Таким образом, поступление крови от одного близнеца другому прекращается, баланс поступления крови к обоим плодам восстанавливается, и близнецы в дальнейшем развиваются нормально. Операция заканчивается дренированием околоплодных вод до нормализации их количества. Эффективность эндоскопической лазеркоагуляционной терапии СФФТ (рождение хотя бы одного живого ребёнка) составляет от 80 до 90 %, возможно пролонгирование беременности в среднем на 10-12 недель, что приводит к снижению внутриутробной гибели плодов.
В Центре планирования семьи и репродукции ДЗ Москвы фетоскопические операции проводятся с 2005 года, на данный момент выполнено более 100 вмешательств. Наличие специального оборудования позволяет проводить ФЛКА в сроки беременности от 15 до 25 недель при стадии ФФТС вплоть до 4.
Вмешательство мы проводим под регионарной анестезией. Тщательно осматриваются плоды, амниотическая перегородка и особенно пересекающие её сосуды на плодовой поверхности плаценты. Такие сосуды прослеживаются до их концевых ветвей, которые, собственно, и могут соединятся с аналогичными ветвями со стороны второго плода.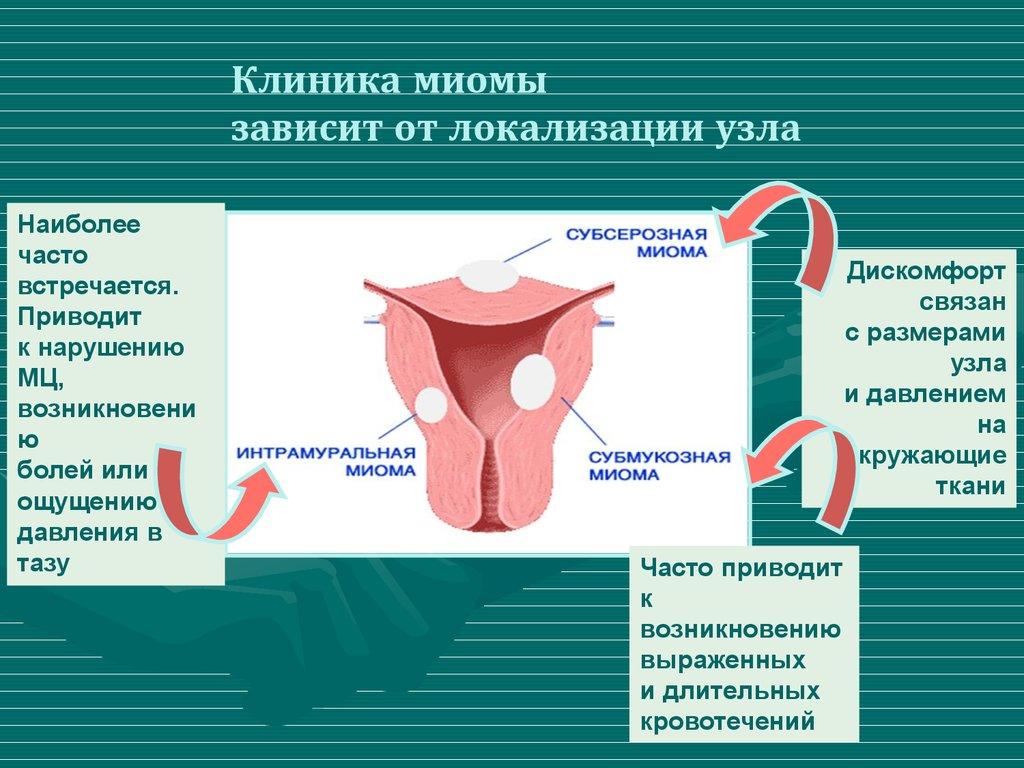 Оценивается не только количество, но и характер, а самое главное – диаметр анастомозов. Это очень важно для правильного порядка коагуляции. Сначала «перекрывается» кровоток в крупных артерио-венозных и артерио-артериальных анастомозах. Затем – коагулируются более мелкие и мельчайшие анастомозы. За время операции по ним часть крови возвращается к донору, улучшая его прогноз.
Оценивается не только количество, но и характер, а самое главное – диаметр анастомозов. Это очень важно для правильного порядка коагуляции. Сначала «перекрывается» кровоток в крупных артерио-венозных и артерио-артериальных анастомозах. Затем – коагулируются более мелкие и мельчайшие анастомозы. За время операции по ним часть крови возвращается к донору, улучшая его прогноз.
Важно выявить и коагулировать абсолютно все анастомозы, даже самые маленькие, иначе при прогрессировании беременности их диаметр увеличится и к 28-30 неделям беременности может произойти рецидив фетофетального синдрома.
При правильно и без осложнений выполненной лазерной коагуляции анастомозов прогноз благоприятный у подавляющего количества пациенток. В настоящее время эффективность наших фетоскопических операций аналогична данным мировой литературы (благоприятный исход беременности в 80-85% наблюдений).
Отслойка плаценты преждевременная
Отслойка плаценты преждевременная
Преждевременная отслойка плаценты — отделение нормально расположенной плаценты от стенки матки до рождения ребёнка.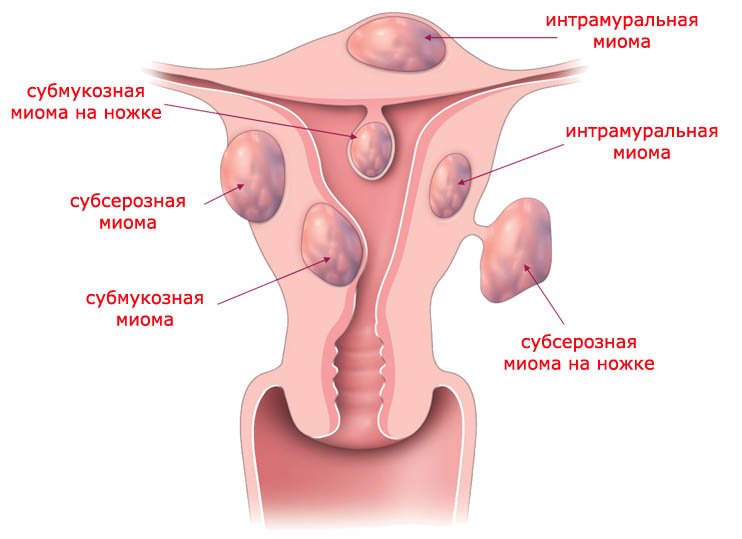 Основной признак — кровотечение (внутриматочное, наружное или комбинированное) • Наружное кровотечение бывает при отделении периферической части плаценты. Кровь изливается через шейку матки; матка напряжена и болезненна. Плод вначале жизнеспособен, затем происходит гибель плода, возникает коагулопатия (в 30% случаев тяжёлая) • Внутриматочное кровотечение. Матка напряжена и болезненна; части плода не пальпируются. Диагностируют при выявлении ретроплацентарной гематомы по УЗИ или после рождения жизнеспособного или мёртвого плода. Кровь накапливается между плацентой и маткой; периферия плаценты остаётся прикреплённой к матке. ДВС-синдром присутствует всегда.
Основной признак — кровотечение (внутриматочное, наружное или комбинированное) • Наружное кровотечение бывает при отделении периферической части плаценты. Кровь изливается через шейку матки; матка напряжена и болезненна. Плод вначале жизнеспособен, затем происходит гибель плода, возникает коагулопатия (в 30% случаев тяжёлая) • Внутриматочное кровотечение. Матка напряжена и болезненна; части плода не пальпируются. Диагностируют при выявлении ретроплацентарной гематомы по УЗИ или после рождения жизнеспособного или мёртвого плода. Кровь накапливается между плацентой и маткой; периферия плаценты остаётся прикреплённой к матке. ДВС-синдром присутствует всегда.
Статистические данные • Частота возникновения — 0,5% всех беременностей •• 56,6% случаев происходит во время беременности •• 43,4% — в периодах раскрытия и изгнания • 15% — при наличии однократной отслойки плаценты в анамнезе, 20% — при отслойке плаценты в анамнезе более 1 раза.
Этиология и патогенез • Наиболее частые этиологические факторы •• Токсикоз второй половины беременности (45% случаев происходит на фоне длительного вялотекущего гестоза) •• Эссенциальная артериальная гипертензия •• Заболевания почек, сопровождающиеся артериальной гипертензией •• Острые инфекционные заболевания • Менее частые этиологические факторы •• Травма в результате удара в живот, падения, наружного акушерского поворота плода, амниоцентеза •• Быстрое изменение объёма матки после излития околоплодных вод при многоводии или двойне •• Хронические урогенитальные инфекции •• АФС • Факторы риска •• Курение (особенно более 1 пачки сигарет в день) •• Большое количество родов в анамнезе •• Злоупотребление алкоголем, наркотики •• Короткая пуповина •• Артериальная гипертензия, обусловленная беременностью •• Отслойка плаценты в анамнезе •• Сочетание артериальной гипертензии и 3 (и более) родов в анамнезе •• Преждевременное отхождение околоплодных вод •• Возраст беременной старше 35 лет.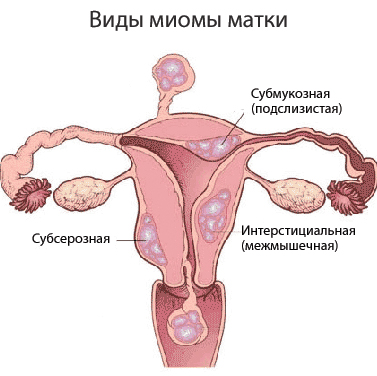
Важную роль в патогенезе отводят патологии сосудов плаценты (снижению эластичности и повышению хрупкости терминальных отделов сосудов и септ межворсинчатых пространств в области прикрепления плаценты). Основные звенья патогенеза отслойки плаценты — спонтанный разрыв сосудов, неспособность матки к эффективному сокращению, отсутствие пережатия сосудов с возникновением кровотечения или образованием ретроплацентарной гематомы. Изменения давления в сосудах матки, колебания давления амниотической жидкости и другие незначительные механические нагрузки могут провоцировать разрыв патологически изменённых сосудов.
Классификация по степени тяжести
Степень отслойки плаценты (лёгкая, средняя, тяжёлая) определяют, ориентируясь на состояние беременной и плода • Лёгкая степень: плацентарное кровотечение <100 мл; отслаивается <25% плаценты; дискомфорт в нижних отделах живота; неполное расслабление матки; удлинение времени свёртывания крови; гипофибриногенемия, дистресс плода • Средняя степень: плацентарное кровотечение 100–500 мл; отслаивается 25–50% плаценты; продолжительные боли в животе; непрекращающиеся сильные схватки; возможна ранняя коагулопатия потребления; дистресс плода • Тяжёлая степень: плацентарное кровотечение >500 мл или скрытое; отслаивается >50% плаценты; боль в животе кинжальная, разрывающая; матка между схватками не расслабляется; шок, олигурия, коагулопатия потребления; выраженный дистресс или гибель плода.
Клиническая картина Клиническая картина варьирует в зависимости от типа и степени отслойки плаценты. Отслойка периферической части плаценты с наружным кровотечением представляет меньшую опасность, чем центральная отслойка со скрытым кровотечением • Влагалищное кровотечение различной интенсивности (при средней интенсивности необходима смена одной гигиенической прокладки или тампона в час) во II половине беременности •• Кровопотеря может быть скрытой (за счёт формирования ретроплацентарной гематомы), клинические симптомы могут не соответствовать объёму внешнего кровотечения (вплоть до шока при умеренном кровотечении) •• Застой крови в малом тазу при беременности может увеличивать кровопотерю •• Поскольку ОЦК при беременности увеличен, кровопотеря может превысить 30% до появления признаков шока и гиповолемии • Боль в спине и животе (даже при отсутствии сокращений миометрия) • Сокращения миометрия, матка напряжена и болезненна, полностью не расслабляется • Уменьшение пульсового давления, увеличение диастолического АД, ортостатическая гипотензия, тахикардия — первые признаки уменьшения ОЦК • Глухость сердечных тонов плода, невозможность или трудность пальпаторного определения частей плода вследствие напряжённости матки.
Лабораторные исследования • Определение группы крови, Rh-принадлежности • Проба Кумбса • Полный клинический анализ крови с подсчётом количества тромбоцитов и определением свёртываемости • Проба на совместимость крови женщины с кровью донора (проводят трижды) • Если появляется подозрение на развитие ДВС, необходимо помнить, что содержание продуктов расщепления фибрина при беременности возрастает и поэтому не столь информативно • Нормоцитарная нормохромная анемия на фоне острого кровотечения • Увеличение ПВ и ЧТВ, содержание фибриногена менее 1,0–1,5 г/л; при развитии ДВС количество тромбоцитов резко снижается • Положительная проба на АТ, если произошла изосенсибилизация Аг Rh0-D.
Специальные исследования • Проба Клейхауэра–Бетке для выявления кровотечения у плода • Коагуляционная проба у постели больной с отсутствием или слабым свёртыванием крови через 7–10 мин указывает на коагулопатию • Проба для определения плодного происхождения крови: смешивают кровь, взятую из влагалища женщины, с небольшим количеством водопроводной воды (чтобы произошёл гемолиз), несколько минут центрифугируют; затем жидкость, расположенную над осадком и имеющую розовый цвет за счёт содержащегося в ней Hb, смешивают с гидроксидом натрия (1 мл NaOH на каждые 5 мл жидкости) и через 2 мин оценивают цвет — если жидкость содержит Hb плода, её цвет останется розовым, а Hb взрослого даст жёлто-коричневое окрашивание • Гематологическая окраска влагалищной крови и выявление эритроцитов, содержащих ядра (обычно они плодного происхождения) • Выяснение соотношения лецитин/сфингомиелин в околоплодных водах, если решают вопрос о преждевременном родоразрешении • УЗИ — выявление ретроплацентарной гематомы, закругления края плаценты или её утолщения.
Дифференциальная диагностика • Разрыв матки • Предлежание плаценты • Предлежание сосудов • Патология влагалища и шейки матки, приводящая к кровотечению из них • Новообразования • Другие состояния, сопровождающиеся болью в животе (например, аппендицит) • Роды.
ЛЕЧЕНИЕ
Диета. Приём пищи запрещён до стабилизации состояния и исключения необходимости кесарева сечения.
Тактика ведения зависит от состояния женщины и плода и степени отслойки плаценты. Необходима госпитализация до стабилизации состояния • Лёгкая степень — нет необходимости в немедленном родоразрешении. При выявлении дистресса плода или усилении кровотечения показано кесарево сечение • Если плод незрелый, назначают токолитическую терапию • Если плод испытывает дистресс, необходимо срочное родоразрешение (через естественные родовые пути или путём кесарева сечения) • Если плод мёртв и нет выраженного кровотечения, не поддающегося терапии кровезаменителями, отдают предпочтение родоразрешению через естественные родовые пути. Для стимуляции родов используют амниотомию. Введение окситоцина запрещено. Если отслойка плаценты прогрессирует, показано срочное оперативное родоразрешение даже в случае гибели плода • Ингаляция кислорода (проводят всем) • Постоянное наблюдение по крайней мере в течение 4 ч для выявления признаков травмы/гибели плода, отслойки плаценты, кровотечения от плода к беременной (особенно если госпитализации предшествовала травма) • Контроль за жизненно важными показателями, поддержание Ht выше 30%, диуреза более 30 мл/ч • Внутривенное введение кристаллоидных р-ров, установка центральных катетеров только после исключения нарушений коагуляции • Периодическое определение времени свёртывания крови и парциального давления газов артериальной крови, если есть подозрение на развитие ацидоза • Положение беременной на левом боку может увеличить венозный возврат и сердечный выброс до 30% исходного объёма • Возможна установка внутриматочного катетера для определения давления в полости матки (опасность для плода возрастает при увеличении давления) • При тяжёлой отслойке плаценты, если плод жив и жизнеспособен, показано срочное родоразрешение при условии удовлетворительного состояния женщины.
Для стимуляции родов используют амниотомию. Введение окситоцина запрещено. Если отслойка плаценты прогрессирует, показано срочное оперативное родоразрешение даже в случае гибели плода • Ингаляция кислорода (проводят всем) • Постоянное наблюдение по крайней мере в течение 4 ч для выявления признаков травмы/гибели плода, отслойки плаценты, кровотечения от плода к беременной (особенно если госпитализации предшествовала травма) • Контроль за жизненно важными показателями, поддержание Ht выше 30%, диуреза более 30 мл/ч • Внутривенное введение кристаллоидных р-ров, установка центральных катетеров только после исключения нарушений коагуляции • Периодическое определение времени свёртывания крови и парциального давления газов артериальной крови, если есть подозрение на развитие ацидоза • Положение беременной на левом боку может увеличить венозный возврат и сердечный выброс до 30% исходного объёма • Возможна установка внутриматочного катетера для определения давления в полости матки (опасность для плода возрастает при увеличении давления) • При тяжёлой отслойке плаценты, если плод жив и жизнеспособен, показано срочное родоразрешение при условии удовлетворительного состояния женщины. Амниотомия ускоряет роды.
Амниотомия ускоряет роды.
Лекарственная терапия
• Интенсивное внутривенное введение жидкостей (0,9% р-ра натрия хлорида или р-ра Рингера) • Токолитики (магния сульфат) можно применять при небольшой неосложнённой отслойке • Rh0-(анти-D)-Ig, если кровь женщины Rh-отрицательна при положительной пробе Клейхауэра–Бетке (300 мкг Rh0-[анти-D]-Ig на каждые 15 мл эритроцитов плода, попавших в кровоток женщины). Если проба Клейхауэра–Бетке вновь становится положительной, повторное введение Rh0-(анти-D)-Ig (расчёт тот же) • Переливание свежезамороженной плазмы и тромбоцитов при коагулопатии, по показаниям — криопреципитат и фибриноген • Переливание цельной донорской крови и замороженной эритроцитарной массы по показаниям.
Осложнения • Геморрагический шок может развиться в результате как скрытой, так и наружной кровопотери • Коагулопатия потребления (ДВС) — 30% случаев тяжёлой формы отслойки плаценты, сопровождающейся гибелью плода • ОПН возникает из-за спазма сосудов почек в результате массивного кровотечения и гиповолемии.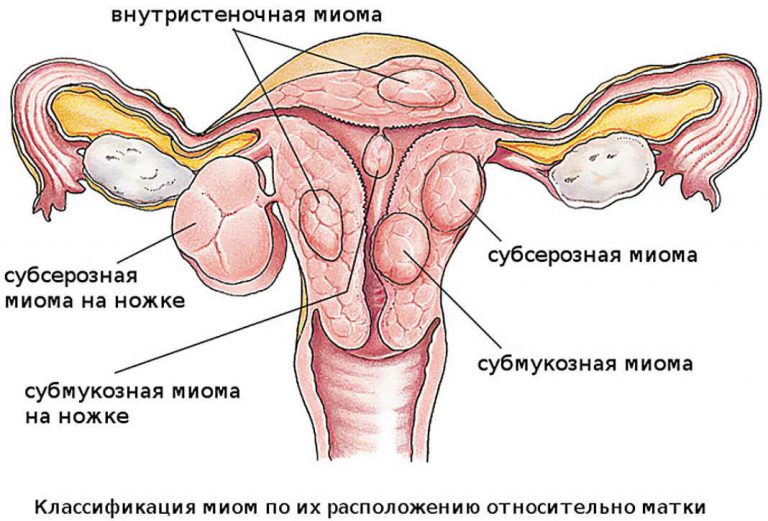 В тяжёлых случаях возможно развитие острого канальцевого некроза • Симптомокомплекс Кювелера (матка Кювелера) связан с обширным пропитыванием миометрия кровью и попаданием её под серозную оболочку матки. Хотя в некоторых клиниках симптомокомплекс Кювелера не считают показанием для гистерэктомии, российская школа акушеров-гинекологов рекомендует в таких случаях производить экстирпацию, а при наличии небольших участков имбибиции ограничиться надвлагалищной ампутацией матки • Эмболия околоплодными водами (возникает редко) может дебютировать ДВС и тяжёлыми нарушениями функции органов дыхания.
В тяжёлых случаях возможно развитие острого канальцевого некроза • Симптомокомплекс Кювелера (матка Кювелера) связан с обширным пропитыванием миометрия кровью и попаданием её под серозную оболочку матки. Хотя в некоторых клиниках симптомокомплекс Кювелера не считают показанием для гистерэктомии, российская школа акушеров-гинекологов рекомендует в таких случаях производить экстирпацию, а при наличии небольших участков имбибиции ограничиться надвлагалищной ампутацией матки • Эмболия околоплодными водами (возникает редко) может дебютировать ДВС и тяжёлыми нарушениями функции органов дыхания.
Течение и прогноз • Смертность плода 0,5–1%, перинатальная смертность 30–50% • При травме и отслойке плаценты материнская смертность 1%, смертность плода 30–70% • Роды обычно быстрые, но часто со слабостью родовой деятельности.
МКБ-10 • O45 Преждевременная отслойка плаценты [abruptio placentae]
Обновлены рекомендации по контролю послеродового кровотечения » Медвестник
Американский колледж акушеров и гинекологов (ACOG) обновил рекомендации по контролю послеродового кровотечения (ПРК). Представляя собой расширенную версию предыдущего руководства, проект включает в себя стандартные протоколы профилактики и лечения ПРК и потенциальные методы терапии, сообщает Medscape.
Представляя собой расширенную версию предыдущего руководства, проект включает в себя стандартные протоколы профилактики и лечения ПРК и потенциальные методы терапии, сообщает Medscape.
В соответствии с обновленным руководством ACOG, опубликованным в журнале Obstetrics & Gynecology, три составляющие активного управления третьим периодом родов могут способствовать снижению частоты послеродового кровотечения: введение окситоцина, массаж матки и контролируемые тракции за пуповину. В случае если послеродовое кровотечение вызвано атонией матки, в качестве первой линии терапии должны рассматриваться утеротонические средства, вызывающие сокращение матки. При неэффективности утеротонических препаратов рекомендуется баллонная тампонада матки и применение транексамовой кислоты.
ACOG определяет ПРК как кумулятивную кровопотерю, равную 1000 мл и более, наряду с признаками или симптомами гиповолемии в течение 24 часов после родов (включая интранатальную потерю), независимо от вида родоразрешения. Однако «потерю крови более 500 мл при вагинальном родоразрешении следует считать аномальной и рассматривать как показатель для исследования повышенного дефицита крови», пишут авторы работы.
Однако «потерю крови более 500 мл при вагинальном родоразрешении следует считать аномальной и рассматривать как показатель для исследования повышенного дефицита крови», пишут авторы работы.
При кровотечении, превышающем 500 мл при вагинальных родах и 1000 мл при кесаревом сечении в ближайшем послеродовом периоде, врачам рекомендуется провести тщательное обследование: быстрое физикальное обследование матки, шейки матки, влагалища, вульвы и промежности часто может помочь идентифицировать этиологию послеродового кровоизлияния.
При продолжающемся кровотечении с потерей крови более 1500 мл или при нарушениях жизненно важных функций (тахикардии и гипотонии) следует начинать немедленную подготовку к переливанию крови.
«Акушеры-гинекологи и медицинский персонал, оказывающий акушерскую помощь, должны быть знакомы с алгоритмами диагностики и контроля послеродового кровотечения», – заключили авторы работы.
РЕДАКЦИЯ ЖУРНАЛА ПРОДОЛЖАЕТ ПОЛУЧАТЬ ПОЗДРАВЛЕНИЯ ПО СЛУЧАЮ 50-ЛЕТИЯ |
4 |
ИЗ ИСТОРИИ РУССКОГО НАРКОЗА |
|
Маслов О. К. Забытые имена в анестезиологии К. Забытые имена в анестезиологии |
5 |
НОВЫЕ ТЕНДЕНЦИИ ПОСЛЕВУЗОВСКОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ |
|
| Выжигина М. А., Бунятян А. А., Сизова Ж. М., Протопопова Т. А., Заугольникова Т. В., Жукова С. Г. Роль системы зачетных единиц в развитии непрерывного профессионального образования врачей в рамках реализации «Программы формирования инновационного образовательного пространства Московской медицинской академии им. И. М. Сеченова» | 8 |
МЕТОДЫ АНЕСТЕЗИИ И ИНТРАОПЕРАЦИОННОЙ ИНТЕНСИВНОЙ ТЕРАПИИ В СПЕЦИАЛИЗИРОВАННЫХ РАЗДЕЛАХ ХИРУРГИИ |
|
Рябова О. С., Выжигина М. А., Жукова С. Г., Титов В. А., Кулагина Т.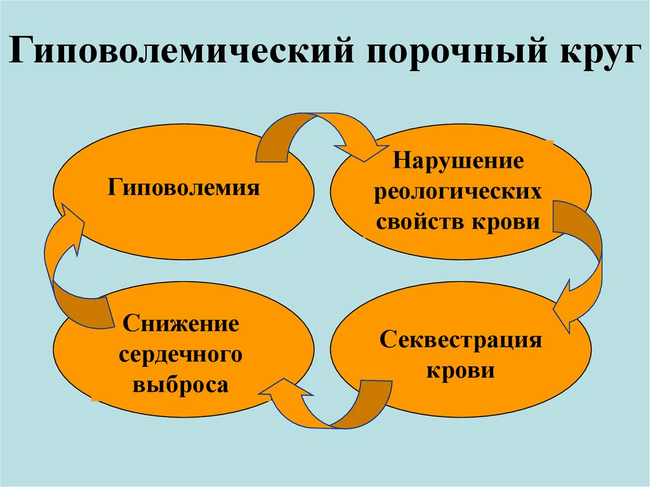 Ю., Паршин В. Д., Сандриков В. А., Бунятян А. А. Севофлуран и изофлуран при торакальных операциях с искусственной однолегочной вентиляцией у пациентов высокого операционно-анестезиологического риска Ю., Паршин В. Д., Сандриков В. А., Бунятян А. А. Севофлуран и изофлуран при торакальных операциях с искусственной однолегочной вентиляцией у пациентов высокого операционно-анестезиологического риска |
15 |
| Платонов Д. П., Тимербаев В. X., Валетова В. В., Давыдова Н. А. Состояние церебрального метаболизма и обмен биогенных аминов в головном мозге пациентов при различных видах анестезии в хирургии интракраниальных аневризм | 22 |
| Михайловичев Ю. И., Чурляев Ю. А., Соколовский В. С., Мартыненков В. Я. Проводниковые методы обезболивания и проблема безопасной анестезии | 25 |
| Козлов И. А., Романов А. А. Маневр открытия («мобилизация») альвеол при интраоперационном нарушении оксигенирующей функции легких у кардиохирургических больных | 27 |
Валетова В.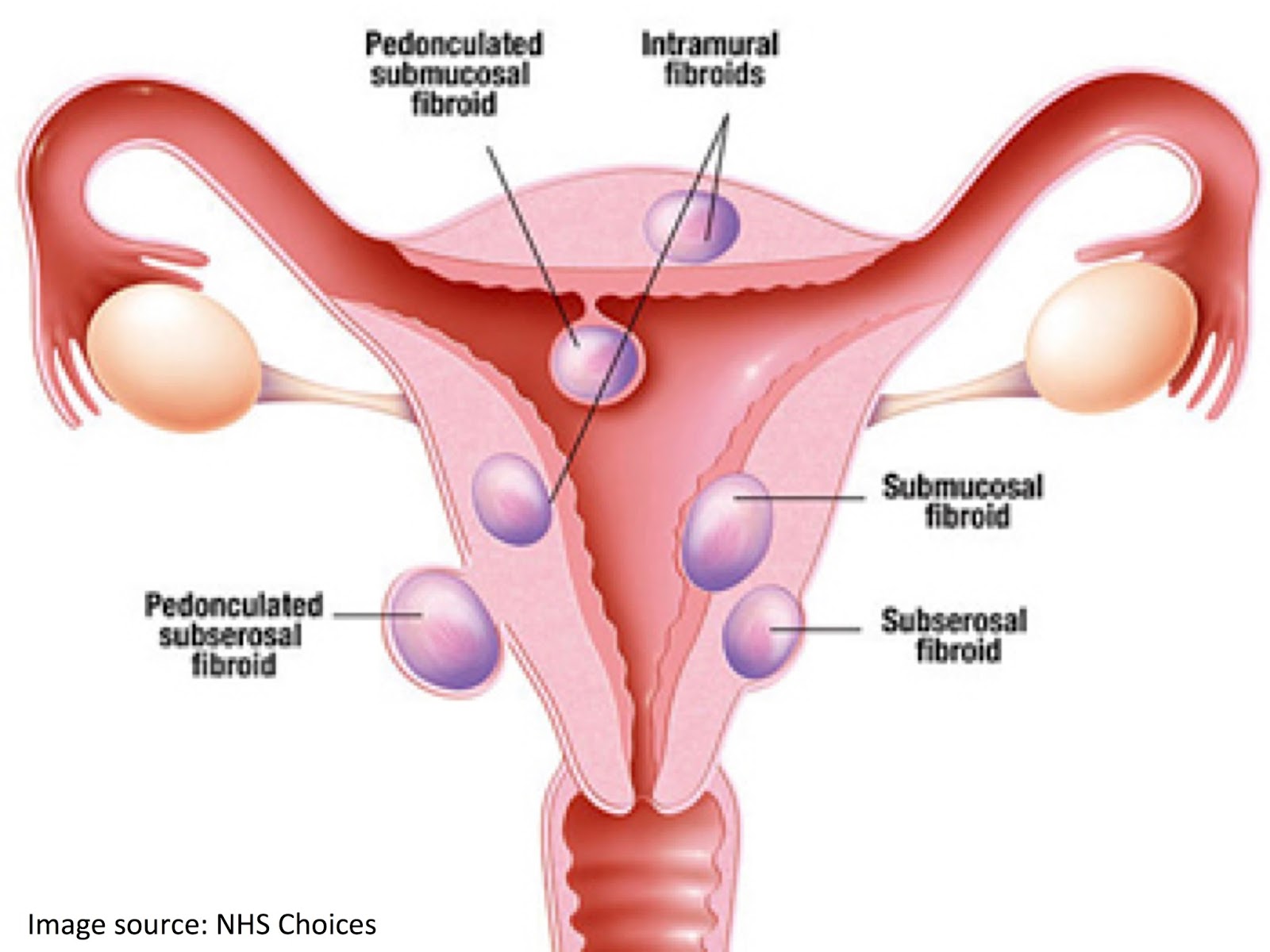 В., Худенко Н. В., Сахарова Е. А., Тимербаев В. X. Роль препаратов крахмала в интраоперационной коррекции гиповолемии у больных с миомой матки больших размеров В., Худенко Н. В., Сахарова Е. А., Тимербаев В. X. Роль препаратов крахмала в интраоперационной коррекции гиповолемии у больных с миомой матки больших размеров |
31 |
| Дементьева И. И., Мильчаков В. И., Палюлина М. В., Жидков И. Л., Трекова Н. А. Оценка протективных антирадикальных свойств кардиоплегических растворов консол и кустодиол | 34 |
| Жидков И. Л., Иванов В. А., Кожевников В. А., Чарная М. А., Мухамедзянова А. Р., Трекова Н. А. Интраоперационная защита миокарда внеклеточными кардиоплегическими растворами у пациентов с патологией клапанов сердца | 38 |
КОРРЕКЦИЯ ОРГАННЫХ ДИСФУНКЦИЙ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ |
|
Воробьева Н. А., Непорада Е. Л., Турундаевская О. В., Мельникова Г. Н. Место концентрата антитромбина III в интенсивной терапии ДВС-синдрома А., Непорада Е. Л., Турундаевская О. В., Мельникова Г. Н. Место концентрата антитромбина III в интенсивной терапии ДВС-синдрома |
42 |
| Лутфарахманов И. И., Миронов П. И., Тимербулатов В. М. Прогностическая значимость структуры синдрома мультиорганной дисфункции при тяжелом остром панкреатите | 44 |
| Плоткин Л. Л. Применение вазопрессина для коррекции гемодинамических нарушений у больных с абдоминальным сепсисом | 47 |
| Ионеску Д., Митре К., Леукэ Л., Бертяну К., Паскаренко Г., Пуя К., Бертяну М. Способы предотвращения случаев тошноты и послеоперационной рвоты после лапароскопической холецистэктомии. Дексаметазон и ондансетрон | 50 |
Воробьева Н. А., Капустин С. И. Роль генетических полиморфизмов системы гемостаза в формировании полиорганной недостаточности при остром ДВС-синдроме А., Капустин С. И. Роль генетических полиморфизмов системы гемостаза в формировании полиорганной недостаточности при остром ДВС-синдроме |
52 |
СЛУЧАЙ ИЗ ПРАКТИКИ |
|
| Савин И. А., Попугаев К. А., Ошоров А. В., Горячев А. С., Молдоташева А. К., Курдюмова Н. В., Абрамов Т. А., Куликовский В. П., Хейреддин А. С., Цейтлин А. М. Несахарный диабет в остром периоде субарахноидального кровоизлияния | 56 |
| Битюков Ю. В., Гилин А. В. Применение ларингеальной маски при синдроме сонного апноэ | 59 |
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ |
|
Пырегов А. В., Аляутдин Р. Н., Петров В. Е., Пивоварова Г. М., Силуянова Е. В., Гурьянов В. А. Экспериментальные исследования анальгетической активности фентанила и неопиоидных средств: клонидина, исрадипина и ингибиторов протеаз В., Аляутдин Р. Н., Петров В. Е., Пивоварова Г. М., Силуянова Е. В., Гурьянов В. А. Экспериментальные исследования анальгетической активности фентанила и неопиоидных средств: клонидина, исрадипина и ингибиторов протеаз |
60 |
| Лазебник Л. Б., Лычкова А. Э., Нилова Т. В., Петраков А. В. Роль серотонина в регуляции гемостаза в эксперименте | 63 |
ОБЗОРЫ |
|
| Шифман Е. М., Бутров А. В., Федулова И. В. Эпидуральная блокада в анестезиологическом обеспечении лапароскопических операций в гинекологии | 65 |
| Дементьева И. И., Чарная М. А., Морозов Ю. А. Апротинин: безопасность применения в хирургической практике | 69 |
Заболотских И. Б., Синьков С. В., Аверьянова Л. Е. Синдром диссеминированного внутрисосудистого свертывания крови: диагностика и интенсивная терапия Б., Синьков С. В., Аверьянова Л. Е. Синдром диссеминированного внутрисосудистого свертывания крови: диагностика и интенсивная терапия |
72 |
ХРОНИКА |
Lechenie zhelezodefitsitnoy anemii u bol’nykh s miomoy matki | Burlev
Миома матки — одно из наиболее распространенных доброкачественных опухолевых заболеваний половой системы женщин репродуктивного возраста. Заболевание диагностируется у 20-30% женщин в возрасте 15-45 лет. В настоящее время доказана роль эндокринной, ауто — и паракринной систем в регуляции роста и развития опухоли, цитогенетических нарушений, пролиферативного потенциала опухоли, нейрогуморальных факторов, гормональных и ростовых факторов. Представленные в настоящем обзоре данные свидетельствуют о том, что применение РЭПО в сочетании с насыщением организма железом — это новое, эффективное и патогенетически обоснованное направление в лечении анемии у пациентов с анемией при ХПН, подверженных гемодиализу; в акушерской практике при лечении железодефицитных анемий у беременных и родильниц; в педиатрии у недоношенных новорожденных; в хирургической и гинекологической практике при подготовке пациентов с ЖДА к операциям, а также в онкогематологии. Считаем, что применение препарата рекомбинантного человеческого эритропоэтина — перспективное направление, требующее развития, качественно новый уровень в лечении железодефицитных анемий у больных с миомой матки в предоперационном и послеоперационном периодах.
Считаем, что применение препарата рекомбинантного человеческого эритропоэтина — перспективное направление, требующее развития, качественно новый уровень в лечении железодефицитных анемий у больных с миомой матки в предоперационном и послеоперационном периодах.
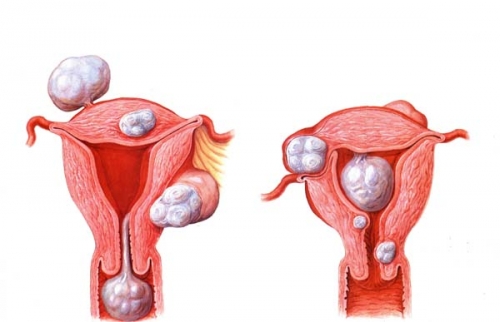
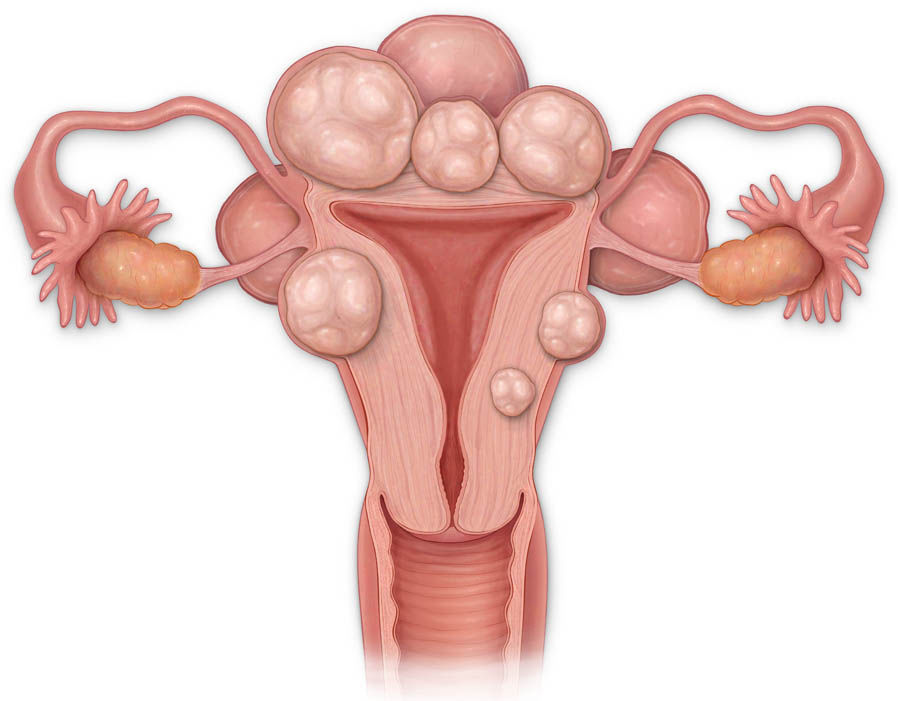
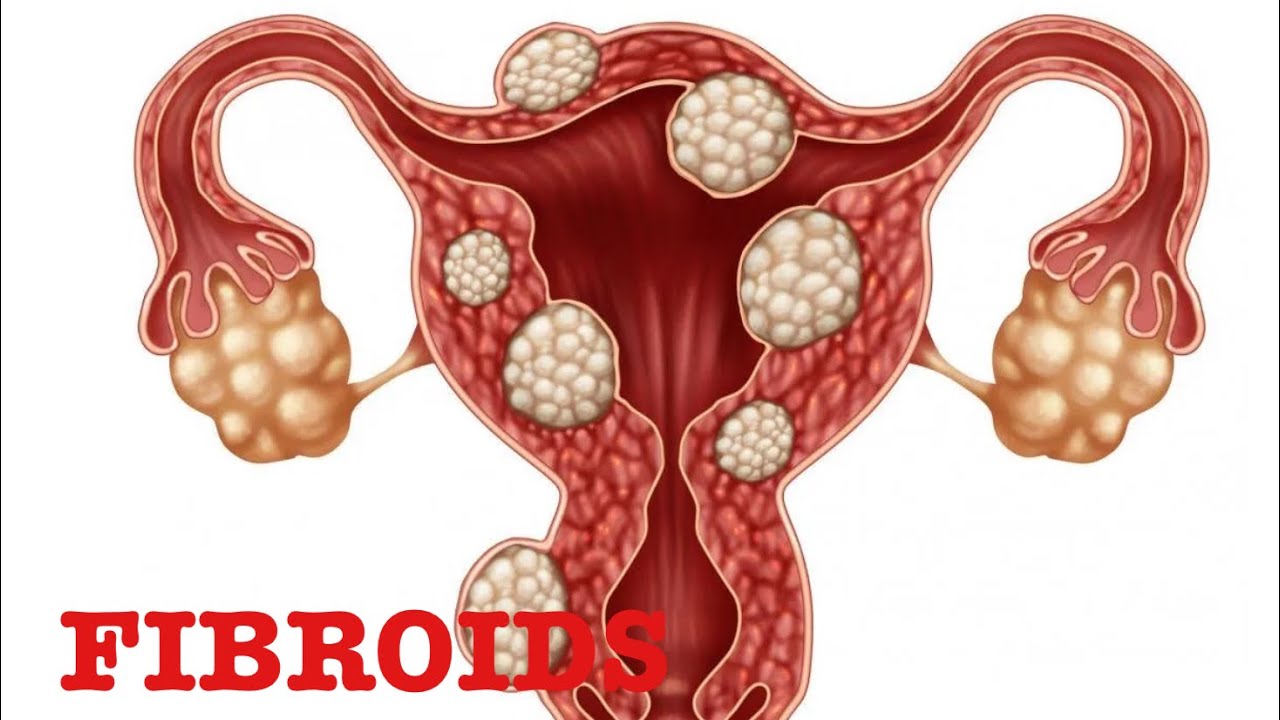
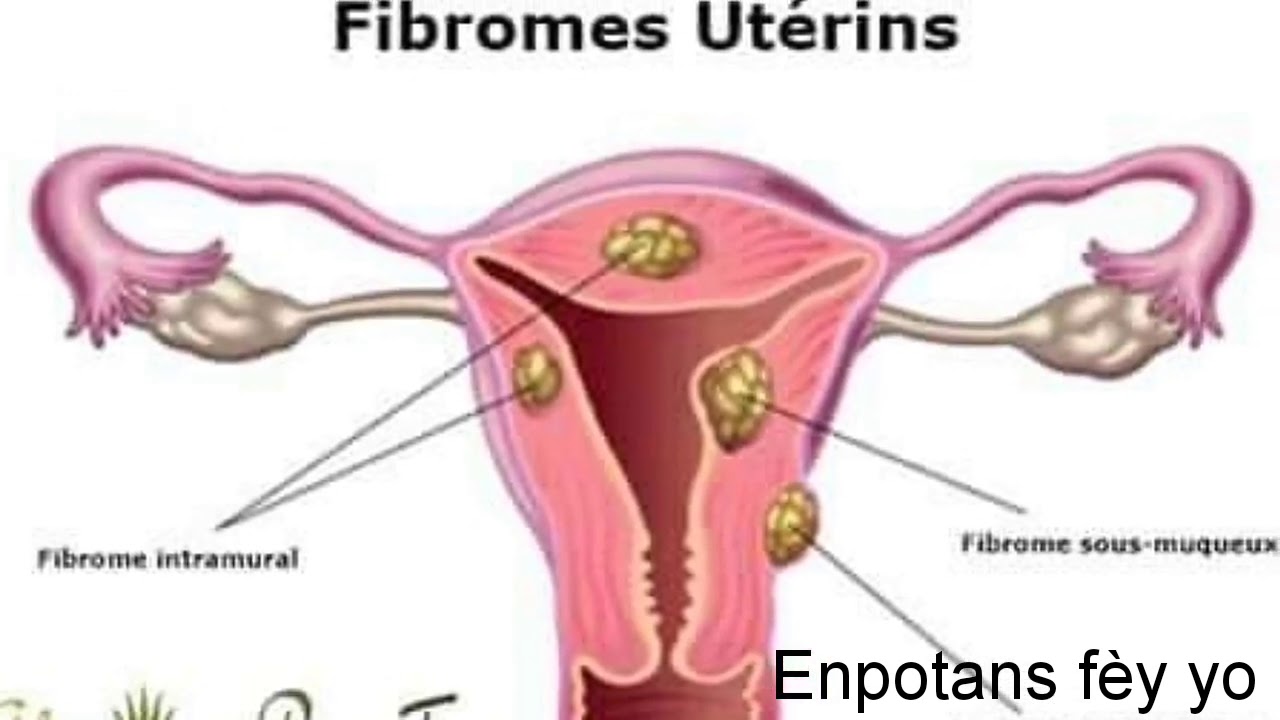
Миома матки — одно из наиболее распространенных доброкачественных опухолевых заболеваний половой системы женщин репродуктивного возраста. Заболевание диагностируется у 20-30% женщин в возрасте 15-45 лет. Современные воззрения на природу этой распространенной доброкачественной опухоли матки претерпели изменения благодаря новым данным о молекулярно-генетических детерминантах процесса гормонального канцерогенеза. Использование этих данных в изучении пато- и морфогенеза лейомиомы матки способствовало расширению представлений о механизмах ее роста и развития и пересмотру стратегии и тактики при этом заболевании [1]. В настоящее время доказана роль эндокринной, ауто- и паракринной систем в регуляции роста и развития опухоли, цитогенетических нарушений, пролиферативного потенциала опухоли, нейрогуморальных факторов, гормональных и ростовых факторов [2-4]. По нозологическим формам согласно МКБ-10 лейомиомы делятся на подслизистые, интрамуральные и субсерозные; по величине опухоли на менее и более 12 нед беременности. По осложнениям и приравненным к ним факторам различают лейомиомы с быстрым ростом и ростом в постменопаузе; с некрозом или инфицированием узла; лейомиомы с рождением подслизистого узла; миомы с железодефицитной анемией (ЖДА) и с атипическими процессами эндометрия [5]. Характерные клинические проявления роста и развития миомы матки нередко сопровождаются повышением менструальной кровопотери, иногда и маточными кровотечениями, которые ряд исследователей считают «дисфункциональными», в основном зависящими от «нейроэндокринных расстройств» [2]. Другие связывают генез патологической кровопотери прежде всего с ростом и локализацией узлов опухоли, а также с нейроэндокринными и гуморальными сдвигами, вызывающими глубокие метаболические нарушения [6].
В настоящее время доказана роль эндокринной, ауто- и паракринной систем в регуляции роста и развития опухоли, цитогенетических нарушений, пролиферативного потенциала опухоли, нейрогуморальных факторов, гормональных и ростовых факторов [2-4]. По нозологическим формам согласно МКБ-10 лейомиомы делятся на подслизистые, интрамуральные и субсерозные; по величине опухоли на менее и более 12 нед беременности. По осложнениям и приравненным к ним факторам различают лейомиомы с быстрым ростом и ростом в постменопаузе; с некрозом или инфицированием узла; лейомиомы с рождением подслизистого узла; миомы с железодефицитной анемией (ЖДА) и с атипическими процессами эндометрия [5]. Характерные клинические проявления роста и развития миомы матки нередко сопровождаются повышением менструальной кровопотери, иногда и маточными кровотечениями, которые ряд исследователей считают «дисфункциональными», в основном зависящими от «нейроэндокринных расстройств» [2]. Другие связывают генез патологической кровопотери прежде всего с ростом и локализацией узлов опухоли, а также с нейроэндокринными и гуморальными сдвигами, вызывающими глубокие метаболические нарушения [6]. Изучение особенностей функциональной морфологии матки при миоме свидетельствует о том, что при развитии опухоли в матке первично создаются условия для повышенной менструальной кровопотери. Многие исследователи отмечают, что по мере роста узла опухоли и сопутствующей этому росту гипертрофии миометрия развитие его сосудистой сети происходит по генетически детерминированной программе, свойственной беременности. Особенностью этого развития является чрезмерная гипертрофия венозной системы матки, формирующей ее дренажную систему, мощность которой во много раз превышает реальные потребности оттока [7]. Вместе с интенсивным развитием венозной сети между наружным и внутренними слоями миометрия не меньшее развитие получает венозная сеть внутреннего мышечного слоя и венозные сплетения в базальном слое эндометрия. Некоторые исследователи, изучая реограммы малого таза у пациенток с миомой, обнаружили увеличение кровенаполнения матки, понижение тонуса и эластичности сосудов. Кроме того, при развитии миомы отток крови от матки затруднен, что также создает условия для повышенной кровопотери при повреждении вен эндометриального сплетения [7].
Изучение особенностей функциональной морфологии матки при миоме свидетельствует о том, что при развитии опухоли в матке первично создаются условия для повышенной менструальной кровопотери. Многие исследователи отмечают, что по мере роста узла опухоли и сопутствующей этому росту гипертрофии миометрия развитие его сосудистой сети происходит по генетически детерминированной программе, свойственной беременности. Особенностью этого развития является чрезмерная гипертрофия венозной системы матки, формирующей ее дренажную систему, мощность которой во много раз превышает реальные потребности оттока [7]. Вместе с интенсивным развитием венозной сети между наружным и внутренними слоями миометрия не меньшее развитие получает венозная сеть внутреннего мышечного слоя и венозные сплетения в базальном слое эндометрия. Некоторые исследователи, изучая реограммы малого таза у пациенток с миомой, обнаружили увеличение кровенаполнения матки, понижение тонуса и эластичности сосудов. Кроме того, при развитии миомы отток крови от матки затруднен, что также создает условия для повышенной кровопотери при повреждении вен эндометриального сплетения [7]. Особенности органного и внутриопухолевого кровотока при миоме матки, хорошо изученные при помощи допплерометрии, свидетельствуют о снижении сопротивления кровотоку в бассейне маточных артерий, способствующему большей интенсивности кровообращения в матке [8]. Многие исследователи считают, что увеличение площади эндометрия при развитии миомы матки является причиной повышенной кровопотери [7, 9, 10]. В литературе делается акцент и на локализацию миоматозного узла как фактора, определяющего величину кровопотери [1, 7]. Подслизистое и интерстицильно-подслизистое расположение узлов способствует гипертрофии миометрия, увеличению площади эндометрия, оказывает влияние на моторику матки. У женщин, страдающих кровотечениями, изменение гормональной функции яичников влечет нарушения гормонального фона [11]. Некоторые авторы указывают, что локальная гиперэстрадиолемия снижает сосудистую резистентность, что увеличивет кровоток в миометральном контуре матки [7, 12]. Также установлено, что на фоне гиперэстрогении в стенке матки увеличивается удельный вес соединительной ткани и уменьшается — мышечной, вследствие чего снижается емкость микроциркуляторного русла и развивается гипертензия в интрамуральных сосудах стенки матки.
Особенности органного и внутриопухолевого кровотока при миоме матки, хорошо изученные при помощи допплерометрии, свидетельствуют о снижении сопротивления кровотоку в бассейне маточных артерий, способствующему большей интенсивности кровообращения в матке [8]. Многие исследователи считают, что увеличение площади эндометрия при развитии миомы матки является причиной повышенной кровопотери [7, 9, 10]. В литературе делается акцент и на локализацию миоматозного узла как фактора, определяющего величину кровопотери [1, 7]. Подслизистое и интерстицильно-подслизистое расположение узлов способствует гипертрофии миометрия, увеличению площади эндометрия, оказывает влияние на моторику матки. У женщин, страдающих кровотечениями, изменение гормональной функции яичников влечет нарушения гормонального фона [11]. Некоторые авторы указывают, что локальная гиперэстрадиолемия снижает сосудистую резистентность, что увеличивет кровоток в миометральном контуре матки [7, 12]. Также установлено, что на фоне гиперэстрогении в стенке матки увеличивается удельный вес соединительной ткани и уменьшается — мышечной, вследствие чего снижается емкость микроциркуляторного русла и развивается гипертензия в интрамуральных сосудах стенки матки. Кроме того, имеет место уменьшение содержания меди и дисбаланс кальций/медь в миометрии и миоматозном узле. Морфологические изменения и дисбаланс кальций/медь в миометрии и миоматозном узле на фоне дисбаланса эстрадиол/прогестерон являются патогенетическими факторами развития маточного кровотечения [13]. В перименопаузе клинико-патогенетические особенности возникновения аномальных маточных кровотечений у больных миомой матки небольших размеров определяются характером гормональных соотношений и сочетанными изменениями эндо- и миометрия. Так, при кровотечениях циклического характера наблюдается преимущественное сочетание миомы и внутреннего эндометриоза матки, при ациклических кровотечениях — гиперпластических процессов эндо- и миометрия [14]. Маточные кровотечения у больных с миомой матки приводят к развитию ЖДА. ЖДА — как крайняя степень железодефицитного состояния — клинико-гематологический симптомокомплекс, характеризующийся нарушением образования гемоглобина вследствие дефицита желез в сыворотке и костном мозге и развитием трофических нарушений в органах и тканях.
Кроме того, имеет место уменьшение содержания меди и дисбаланс кальций/медь в миометрии и миоматозном узле. Морфологические изменения и дисбаланс кальций/медь в миометрии и миоматозном узле на фоне дисбаланса эстрадиол/прогестерон являются патогенетическими факторами развития маточного кровотечения [13]. В перименопаузе клинико-патогенетические особенности возникновения аномальных маточных кровотечений у больных миомой матки небольших размеров определяются характером гормональных соотношений и сочетанными изменениями эндо- и миометрия. Так, при кровотечениях циклического характера наблюдается преимущественное сочетание миомы и внутреннего эндометриоза матки, при ациклических кровотечениях — гиперпластических процессов эндо- и миометрия [14]. Маточные кровотечения у больных с миомой матки приводят к развитию ЖДА. ЖДА — как крайняя степень железодефицитного состояния — клинико-гематологический симптомокомплекс, характеризующийся нарушением образования гемоглобина вследствие дефицита желез в сыворотке и костном мозге и развитием трофических нарушений в органах и тканях.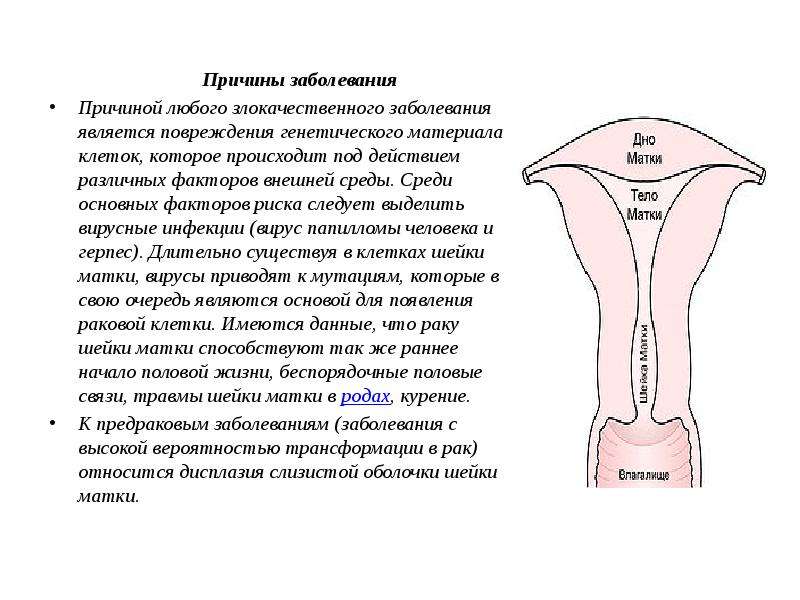 ЖДА является самым распространенным анемическим синдромом и составляет приблизительно до 80% всех анемий [15]. В репродуктивном возрасте дефицит железа выявляется у 40-60% женщин. Клинические проявления ЖДА у больных с миомой общеизвестны и обусловлены, с одной стороны, наличием анемического синдрома, а с другой — дефицитом железа (гипосидерозом) [16]. Повышенная кровопотеря у больных с миомой матки, приобретая характер хронической, довольно быстро приводит к нарушениям функции различных систем: сердечно-сосудистой и иммунной, системы гемостаза и кроветворения, способствует развитию органической тканевой гипоксии [2, 7, 17]. Развитие гипоксии у больных с хронической постгеморрагической анемией приводит к серьезным нарушениям в системе ПОЛ и ОС, которые усугубляются в послеоперационном периоде, вследствие операционного стресса, наркоза и дополнительной кровопотери во время операции [18]. Исследования показали, что интенсивное развитие миомы сопровождается снижением объема циркулирующей крови (ОЦК) при неизменном гематокрите.
ЖДА является самым распространенным анемическим синдромом и составляет приблизительно до 80% всех анемий [15]. В репродуктивном возрасте дефицит железа выявляется у 40-60% женщин. Клинические проявления ЖДА у больных с миомой общеизвестны и обусловлены, с одной стороны, наличием анемического синдрома, а с другой — дефицитом железа (гипосидерозом) [16]. Повышенная кровопотеря у больных с миомой матки, приобретая характер хронической, довольно быстро приводит к нарушениям функции различных систем: сердечно-сосудистой и иммунной, системы гемостаза и кроветворения, способствует развитию органической тканевой гипоксии [2, 7, 17]. Развитие гипоксии у больных с хронической постгеморрагической анемией приводит к серьезным нарушениям в системе ПОЛ и ОС, которые усугубляются в послеоперационном периоде, вследствие операционного стресса, наркоза и дополнительной кровопотери во время операции [18]. Исследования показали, что интенсивное развитие миомы сопровождается снижением объема циркулирующей крови (ОЦК) при неизменном гематокрите.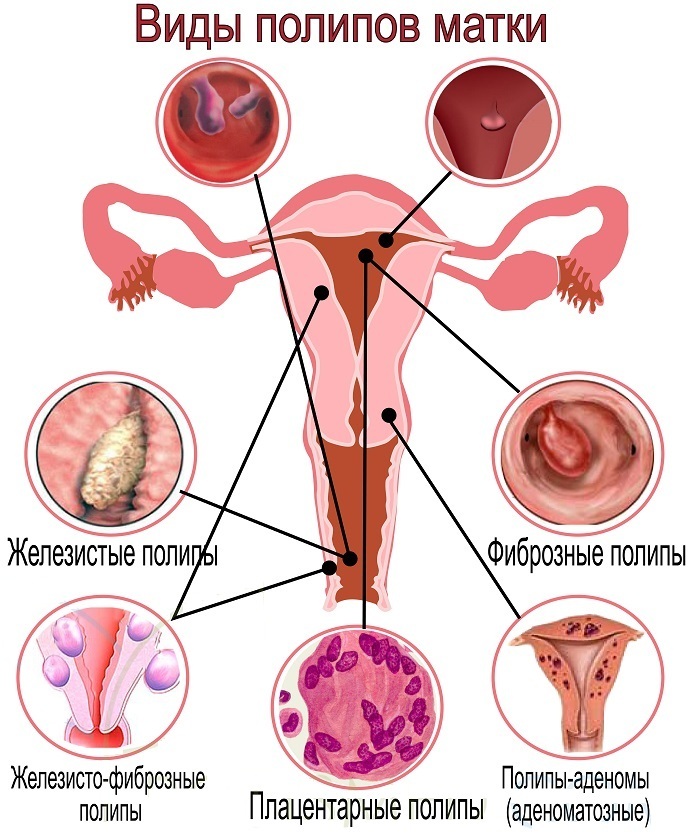 Но на ранних этапах существования миомы гемодинамика характеризуется увеличением ОЦК за счет глобулярного объема. В дальнейшем тяжесть гиповолемии зависит не только от давности заболевания, темпов роста и размеров опухоли, но и от особенностей менструальной функции. В настоящее время доказанным фактом является то, что обильная кровопотеря приводит к изменению содержания эритроцитов, падению гемоглобина, уменьшению ОЦК, что сочетается с развитием олигоцитемической гиповолемии [5]. Нарушения гемостаза у больных с миомой матки нередко являются причиной развития тромботических осложнений в послеоперационном периоде. Известно, что анемия, развивающаяся в результате кровотечений, и тромбические осложнения не ограничиваются расстройствами в системе гемостаза, а сопровождаются серьезными изменениями текучести крови, т.е. нарушениями ее реологических свойств [19]. Нарушениям гемодинамики сопутствуют изменения регионарного кровообращения, белкового обмена и водно-электролитного баланса. Хроническая постгеморрагическая анемия при миоме матки приводит к снижению железосодержащих ферментов [10, 20].
Но на ранних этапах существования миомы гемодинамика характеризуется увеличением ОЦК за счет глобулярного объема. В дальнейшем тяжесть гиповолемии зависит не только от давности заболевания, темпов роста и размеров опухоли, но и от особенностей менструальной функции. В настоящее время доказанным фактом является то, что обильная кровопотеря приводит к изменению содержания эритроцитов, падению гемоглобина, уменьшению ОЦК, что сочетается с развитием олигоцитемической гиповолемии [5]. Нарушения гемостаза у больных с миомой матки нередко являются причиной развития тромботических осложнений в послеоперационном периоде. Известно, что анемия, развивающаяся в результате кровотечений, и тромбические осложнения не ограничиваются расстройствами в системе гемостаза, а сопровождаются серьезными изменениями текучести крови, т.е. нарушениями ее реологических свойств [19]. Нарушениям гемодинамики сопутствуют изменения регионарного кровообращения, белкового обмена и водно-электролитного баланса. Хроническая постгеморрагическая анемия при миоме матки приводит к снижению железосодержащих ферментов [10, 20]. Эритропоэз у пациенток с миомой матки носит нормобластический характер, преобладают ядросодержащие клетки. По мнению большинства авторов, происходит задержка созревания клеток эритроидного ряда вследствие угнетения эритронормобластической реакции костного мозга [20]. Картина красной крови характеризуется анизоцитозом, иногда полихроматофилией. Выявлено, что ЖДА у женщин с миомой матки приводит к функциональной неполноценности клеток, ответственных за эритропоэз. Такое состояние проявляется выраженной гипорегенераторной реакцией костномозгового кроветворения [21, 22]. В последние годы появились доказательства того, что эстрогены оказывают угнетающее действие на эритропоэз [23]. Эстрогены, ускоряя созревание эритроцитов, уменьшают клеточный состав костного мозга. В настоящее время высказывается мнение о том, что развитие ЖДА и ЖДС у женщин, страдающих миомой матки, может быть связано не только с патологической кровопотерей или с нарушением нейроэндокринной функции [24], но и с нарушением продукции эритропоэтина (ЭПО) [21].
Эритропоэз у пациенток с миомой матки носит нормобластический характер, преобладают ядросодержащие клетки. По мнению большинства авторов, происходит задержка созревания клеток эритроидного ряда вследствие угнетения эритронормобластической реакции костного мозга [20]. Картина красной крови характеризуется анизоцитозом, иногда полихроматофилией. Выявлено, что ЖДА у женщин с миомой матки приводит к функциональной неполноценности клеток, ответственных за эритропоэз. Такое состояние проявляется выраженной гипорегенераторной реакцией костномозгового кроветворения [21, 22]. В последние годы появились доказательства того, что эстрогены оказывают угнетающее действие на эритропоэз [23]. Эстрогены, ускоряя созревание эритроцитов, уменьшают клеточный состав костного мозга. В настоящее время высказывается мнение о том, что развитие ЖДА и ЖДС у женщин, страдающих миомой матки, может быть связано не только с патологической кровопотерей или с нарушением нейроэндокринной функции [24], но и с нарушением продукции эритропоэтина (ЭПО) [21]. Таким образом, в литературе достаточно подробно освещено значение морфофункциональных особенностей матки при миоме в патогенезе маточных кровотечений, а также проблема гиповолемии у пациенток с миомой матки. Так как нарушения гемодинамики сочетаются с изменениями регионального кровообращения, белкового обмена и водно-электролитного баланса, имеющими довольно стойкий характер и не устраняющимися в ближайшее время после оперативного лечения, то коррекция хронической ЖДА должна быть одной из задач комплексной терапии при ведении больных с миомой матки. Лечение миомы матки имеет много вариантов в зависимости от клиники, длительности заболевания, возраста, репродуктивной функции и т.д. Основу консервативной терапии миомы составляет гормональное лечение. В качестве лечебных мероприятий при миоме матки также применяются иммуностимуляторы, витамины, физио- и курортолечение, лекарственные травы [5, 7]. Однако консервативную, в частности гормональную, терапию миомы матки нельзя рассматривать как альтернативу хирургическому лечению.
Таким образом, в литературе достаточно подробно освещено значение морфофункциональных особенностей матки при миоме в патогенезе маточных кровотечений, а также проблема гиповолемии у пациенток с миомой матки. Так как нарушения гемодинамики сочетаются с изменениями регионального кровообращения, белкового обмена и водно-электролитного баланса, имеющими довольно стойкий характер и не устраняющимися в ближайшее время после оперативного лечения, то коррекция хронической ЖДА должна быть одной из задач комплексной терапии при ведении больных с миомой матки. Лечение миомы матки имеет много вариантов в зависимости от клиники, длительности заболевания, возраста, репродуктивной функции и т.д. Основу консервативной терапии миомы составляет гормональное лечение. В качестве лечебных мероприятий при миоме матки также применяются иммуностимуляторы, витамины, физио- и курортолечение, лекарственные травы [5, 7]. Однако консервативную, в частности гормональную, терапию миомы матки нельзя рассматривать как альтернативу хирургическому лечению. Если есть показания для операции, то необходимо производить вмешательство, не тратя время и средства на лечение, которое либо вообще не поможет больной, либо даст временное улучшение. Для консервативного лечения основной целью является ослабление или снятие болезненных симптомов миомы матки или попытки воздействия на ее рост. Большинство авторов отдают предпочтение препаратам гестагенного действия: норколут, дюфастон, 17-ОПК. Оправдано применение контрацептивных препаратов, уменьшающих размер опухоли и кровотечения. Применение комбинированных эстроген-гестагенных препаратов чаще приводит к стабилизации роста опухоли, реже — к незначительному уменьшению ее размеров. В последние годы предложено лечение миомы матки аналогами гонадотропин-рилизинг-гормона (а-ГнРГ). Некоторые ученые, используя а-ГнРГ, отметили уменьшение размеров матки, прекращение менометроррагий, наступление беременности у каждой 2-й бесплодной пациентки [25, 26]. В современной литературе преобладает мнение, что действие а-ГнРГ ограничено кратковременным эффектом уменьшения опухоли, что может быть использовано в качестве терапии предшествующей операции или у больных, возраст которых близок к менопаузе [7].
Если есть показания для операции, то необходимо производить вмешательство, не тратя время и средства на лечение, которое либо вообще не поможет больной, либо даст временное улучшение. Для консервативного лечения основной целью является ослабление или снятие болезненных симптомов миомы матки или попытки воздействия на ее рост. Большинство авторов отдают предпочтение препаратам гестагенного действия: норколут, дюфастон, 17-ОПК. Оправдано применение контрацептивных препаратов, уменьшающих размер опухоли и кровотечения. Применение комбинированных эстроген-гестагенных препаратов чаще приводит к стабилизации роста опухоли, реже — к незначительному уменьшению ее размеров. В последние годы предложено лечение миомы матки аналогами гонадотропин-рилизинг-гормона (а-ГнРГ). Некоторые ученые, используя а-ГнРГ, отметили уменьшение размеров матки, прекращение менометроррагий, наступление беременности у каждой 2-й бесплодной пациентки [25, 26]. В современной литературе преобладает мнение, что действие а-ГнРГ ограничено кратковременным эффектом уменьшения опухоли, что может быть использовано в качестве терапии предшествующей операции или у больных, возраст которых близок к менопаузе [7].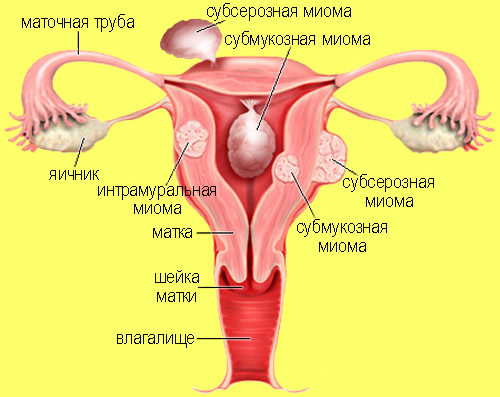 Применение антигонадотропного препарата «Данатрола» и антигестагена «Гестринона» у больных перименопаузального возраста с аномальными кровотечениями при умеренном увеличении матки и сочетанных гиперпластических изменениях эндо- и миометрия приводит к уменьшению объема маточных кровотечений [1, 14]. При неуспехе медикаментозного воздействия для лечения больных лейомиомой в последние годы стали прибегать к одно- или двусторонней эмболизации маточных артерий. При этом отмечаются уменьшение размеров опухоли и исчезновение меноррагий [1]. Несмотря на достижения лекарственной, в основном гормональной, терапии миомы матки, хирургическое лечение миомы у основной части больных остается ведущим. По мнению большинства гинекологов, одним из первых показаний к оперативному лечению больных с миомой матки является потгеморрагическая ЖДА [10, 12, 27], фигурирующая среди показаний для оперативного лечения более чем у 70% женщин [7]. Чаще всего показания к операции у больных миомой бывают сочетанными. Если за основу взять основной, ведущий признак, то все показания группируются следующим образом: подслизистая миома матки, центрипетальный рост узла, миома, сопровождающаяся кровотечением, анемией — 1-я группа; большие размеры миомы, быстрый рост опухоли, рост узла, несмотря на проводимое лечение, — 2-я группа; миома матки и бесплодие — 3-я группа; прочие показания — 4-я группа.
Применение антигонадотропного препарата «Данатрола» и антигестагена «Гестринона» у больных перименопаузального возраста с аномальными кровотечениями при умеренном увеличении матки и сочетанных гиперпластических изменениях эндо- и миометрия приводит к уменьшению объема маточных кровотечений [1, 14]. При неуспехе медикаментозного воздействия для лечения больных лейомиомой в последние годы стали прибегать к одно- или двусторонней эмболизации маточных артерий. При этом отмечаются уменьшение размеров опухоли и исчезновение меноррагий [1]. Несмотря на достижения лекарственной, в основном гормональной, терапии миомы матки, хирургическое лечение миомы у основной части больных остается ведущим. По мнению большинства гинекологов, одним из первых показаний к оперативному лечению больных с миомой матки является потгеморрагическая ЖДА [10, 12, 27], фигурирующая среди показаний для оперативного лечения более чем у 70% женщин [7]. Чаще всего показания к операции у больных миомой бывают сочетанными. Если за основу взять основной, ведущий признак, то все показания группируются следующим образом: подслизистая миома матки, центрипетальный рост узла, миома, сопровождающаяся кровотечением, анемией — 1-я группа; большие размеры миомы, быстрый рост опухоли, рост узла, несмотря на проводимое лечение, — 2-я группа; миома матки и бесплодие — 3-я группа; прочие показания — 4-я группа.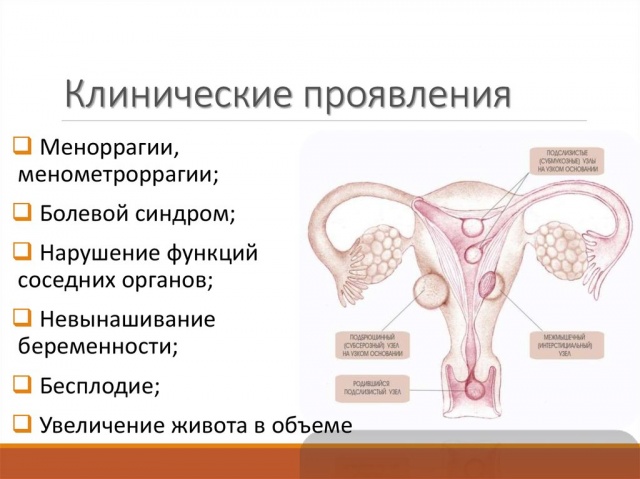 При такой группировке показаний к операции большие размеры и быстрый рост опухоли отмечены в 57%, подслизистая миома и кровотечения — в 33%, сочетание миомы с придатковыми образованиями и опухолями яичников — в 5%, миома и бесплодие — в 3%, прочие — в 3% случаев. В 12,5% случаев отмечено сочетание миомы с внутренним эндометриозом, который, как правило, тоже осложняется кровотечением и анемией [5]. Повторяющиеся обильные кровопотери чаще всего связны с субмукозной или интерстициальной миомой и требуют срочного оперативного лечения, несмотря на то, что матка может и не достигать больших размеров, а в некоторых случаях может лишь быть слегка увеличена [7, 11, 12, 24]. В настоящее время оперативному лечению миомы уделяется большое внимание. Существуют модификации оперативного доступа, позволяющие пациентке делать приемлемый выбор. При выборе объема и доступа оперативного вмешательства (лапаротомия-лапароскопия — ЛТ-ЛС) приходится учитывать степень ЖДА, размер опухоли, клинику, локализацию узлов, возраст, детородную функцию [28, 29].
При такой группировке показаний к операции большие размеры и быстрый рост опухоли отмечены в 57%, подслизистая миома и кровотечения — в 33%, сочетание миомы с придатковыми образованиями и опухолями яичников — в 5%, миома и бесплодие — в 3%, прочие — в 3% случаев. В 12,5% случаев отмечено сочетание миомы с внутренним эндометриозом, который, как правило, тоже осложняется кровотечением и анемией [5]. Повторяющиеся обильные кровопотери чаще всего связны с субмукозной или интерстициальной миомой и требуют срочного оперативного лечения, несмотря на то, что матка может и не достигать больших размеров, а в некоторых случаях может лишь быть слегка увеличена [7, 11, 12, 24]. В настоящее время оперативному лечению миомы уделяется большое внимание. Существуют модификации оперативного доступа, позволяющие пациентке делать приемлемый выбор. При выборе объема и доступа оперативного вмешательства (лапаротомия-лапароскопия — ЛТ-ЛС) приходится учитывать степень ЖДА, размер опухоли, клинику, локализацию узлов, возраст, детородную функцию [28, 29]. Больным с миомой матки производят радикальные и консервативные операции. Использование современной ЛС в хирургии позволяет произвести полноценное хирургическое вмешательство функционального характера у 80% больных. По сравнению с ЛТ при ЛС затрачивается меньше времени, меньше кровопотеря, ниже процент послеоперационных осложнений [7, 17, 30]. Однако необходимо учитывать противопоказания к проведению ЛС при миоме матки — диаметр миоматозного узла более 10 см, расположение узла в перешеечной или шеечной области. Показанием к ЛС миомэктомии является наличие небольших (не более 2,5-5,0 см), преимущественно субсерозных или интерстициальных узлов, локализованных в теле и дне матки. Часть показаний к ЛС надвлагалищной ампутации матки или экстирпации матки при наличии одиночных и сравнительно небольших субмукозных узлов может быть заменена на гистерорезектоскопический метод лечения [28, 29]. До настоящего времени для антианемической терапии применяли диетотерапию, витаминотерапию, прием препаратов железа.
Больным с миомой матки производят радикальные и консервативные операции. Использование современной ЛС в хирургии позволяет произвести полноценное хирургическое вмешательство функционального характера у 80% больных. По сравнению с ЛТ при ЛС затрачивается меньше времени, меньше кровопотеря, ниже процент послеоперационных осложнений [7, 17, 30]. Однако необходимо учитывать противопоказания к проведению ЛС при миоме матки — диаметр миоматозного узла более 10 см, расположение узла в перешеечной или шеечной области. Показанием к ЛС миомэктомии является наличие небольших (не более 2,5-5,0 см), преимущественно субсерозных или интерстициальных узлов, локализованных в теле и дне матки. Часть показаний к ЛС надвлагалищной ампутации матки или экстирпации матки при наличии одиночных и сравнительно небольших субмукозных узлов может быть заменена на гистерорезектоскопический метод лечения [28, 29]. До настоящего времени для антианемической терапии применяли диетотерапию, витаминотерапию, прием препаратов железа. Так как анемия нередко сопровождается гипопротеинемией, угнетением иммунной системы, обмена электролитов, снижением активности ряда ферментов, многие клиницисты рекомендуют наряду с терапией препаратами железа и витаминотерапией назначать диету с целью восполнения дефицита белка, железа, микроэлементов, витаминов [31-33]. Основой патогенетической терапии ЖДА является применение лекарственных препаратов железа внутрь. Необходимо, чтобы суточная доза двухвалентного железа (всасывается только двухвалентное железо) составляла 100-300 мг. В связи с этим при выборе препарата железа и определении суточной его дозировки следует ориентироваться не только на общее содержание в нем железа, но и на количество двухвалентного железа, содержащегося в данном препарате [16]. Рекомендуемыми препаратами железа для перорального применения в настоящее время являются «Ферро-Фольгамма» (Германия), «Тардиферон» (Швейцария), «Сорбифер Дурулес» (Венгрия), «Мальтофер» (Швейцария), «Феррум-лек» (Швейцария), «Фенюльс» (Индия), «Ферлатум» (Италия), «Хеферол», «Актиферрин»(Германия), «Ферроград», «Ферроградумент», «Гино-тардиферон» (Швейцария).
Так как анемия нередко сопровождается гипопротеинемией, угнетением иммунной системы, обмена электролитов, снижением активности ряда ферментов, многие клиницисты рекомендуют наряду с терапией препаратами железа и витаминотерапией назначать диету с целью восполнения дефицита белка, железа, микроэлементов, витаминов [31-33]. Основой патогенетической терапии ЖДА является применение лекарственных препаратов железа внутрь. Необходимо, чтобы суточная доза двухвалентного железа (всасывается только двухвалентное железо) составляла 100-300 мг. В связи с этим при выборе препарата железа и определении суточной его дозировки следует ориентироваться не только на общее содержание в нем железа, но и на количество двухвалентного железа, содержащегося в данном препарате [16]. Рекомендуемыми препаратами железа для перорального применения в настоящее время являются «Ферро-Фольгамма» (Германия), «Тардиферон» (Швейцария), «Сорбифер Дурулес» (Венгрия), «Мальтофер» (Швейцария), «Феррум-лек» (Швейцария), «Фенюльс» (Индия), «Ферлатум» (Италия), «Хеферол», «Актиферрин»(Германия), «Ферроград», «Ферроградумент», «Гино-тардиферон» (Швейцария).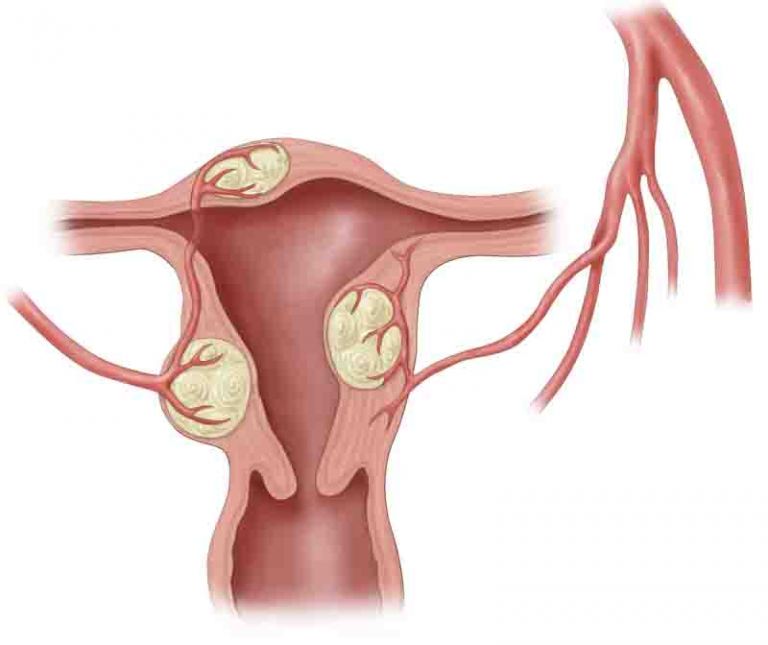 Предпочтительнее назначение препаратов с более высоким содержанием двухвалентного железа в связи с удобством приема для больных (1-2 раза в сутки вместо 3-4 раз). Входящие в состав многих лекарственных форм аскорбиновая и янтарная кислоты, фруктоза, цистеин, мальтоза и др. усиливают всасывание железа. Так, например, аминокислота серин, входящая в состав препарата Актиферрин, значительно увеличивает биодоступность железа. Это позволяет улучшить переносимость препарата и снизить риск побочных реакций. Капсулы Актиферрин обеспечивают защиту слизистой ЖКТ от раздражающего действия железа. Для лучшей переносимости препараты железа следует принимать во время еды [16]. В последнее время появились препараты, высвобождающие железо, заключенное в матрицы, так, например, «Фенюльс» — препарат, в котором железо находится в микродиализных гранулах. Скорость высвобождения железа постоянна в течение суток и обеспечивает постоянство плазменной концентрации препарата, уменьшая одновременно, число осложнений со стороны желудочно-кишечного тракта [34].
Предпочтительнее назначение препаратов с более высоким содержанием двухвалентного железа в связи с удобством приема для больных (1-2 раза в сутки вместо 3-4 раз). Входящие в состав многих лекарственных форм аскорбиновая и янтарная кислоты, фруктоза, цистеин, мальтоза и др. усиливают всасывание железа. Так, например, аминокислота серин, входящая в состав препарата Актиферрин, значительно увеличивает биодоступность железа. Это позволяет улучшить переносимость препарата и снизить риск побочных реакций. Капсулы Актиферрин обеспечивают защиту слизистой ЖКТ от раздражающего действия железа. Для лучшей переносимости препараты железа следует принимать во время еды [16]. В последнее время появились препараты, высвобождающие железо, заключенное в матрицы, так, например, «Фенюльс» — препарат, в котором железо находится в микродиализных гранулах. Скорость высвобождения железа постоянна в течение суток и обеспечивает постоянство плазменной концентрации препарата, уменьшая одновременно, число осложнений со стороны желудочно-кишечного тракта [34]. Прием препаратов железа в достаточной дозировке у больных с миомой матки и ЖДА начинается, как правило, до операции и продолжается после хирургического устранения причины кровотечения. Длительность приема препаратов железа определяется степенью тяжести ЖДА и дефицита железа в организме, объемом кровопотери при месячных, в случае сохранения менструальной функции после операции. В среднем прием железа непрерывно должен осуществляться не менее 3 мес [15, 16, 35]. В последние годы в современной отечественной и зарубежной литературе все чаще звучит мнение о том, что традиционная терапия препаратами железа имеет побочные эффекты чаще всего со стороны желудочно-кишечного тракта и зачастую не дает желаемого результата, а также прием препаратов должен проводиться длительное время [20, 36]. Наиболее рационально проведение антианемической терапии в предоперационном периоде за короткие сроки, так как очередная менометроррагия снижет ее эффективность. Гемотрасфузии в настоящее время в гинекологической практике, по понятным причинам, производятся в редких случаях и только по жизненным показаниям [37].
Прием препаратов железа в достаточной дозировке у больных с миомой матки и ЖДА начинается, как правило, до операции и продолжается после хирургического устранения причины кровотечения. Длительность приема препаратов железа определяется степенью тяжести ЖДА и дефицита железа в организме, объемом кровопотери при месячных, в случае сохранения менструальной функции после операции. В среднем прием железа непрерывно должен осуществляться не менее 3 мес [15, 16, 35]. В последние годы в современной отечественной и зарубежной литературе все чаще звучит мнение о том, что традиционная терапия препаратами железа имеет побочные эффекты чаще всего со стороны желудочно-кишечного тракта и зачастую не дает желаемого результата, а также прием препаратов должен проводиться длительное время [20, 36]. Наиболее рационально проведение антианемической терапии в предоперационном периоде за короткие сроки, так как очередная менометроррагия снижет ее эффективность. Гемотрасфузии в настоящее время в гинекологической практике, по понятным причинам, производятся в редких случаях и только по жизненным показаниям [37]. Одним из вариантов лечения миомы, позволяющим получить время для устранения дефицита железа и лечения ЖДА, является применение а-ГнРГ в течение 2-3 мес для уменьшения роста и размеров опухоли за счет ухудшения ее кровоснабжения, такая подготовка дает хороший результат: снижаются кровопотеря и длительность операции, что облегчает хирургическое вмешательство и расширяет возможности миомэктомии (удаление миоматозного узла без вскрытия полости матки). Однако некоторые исследователи имеют отрицательную точку зрения на лечение аналогами а-ГнРГ [26]. В последние годы благодаря накопленному в мире опыту по применению у больных с анемией различного генеза человеческого рекомбинантного эритропоэтина (РЭПО) начались исследования, направленные на изучение перспектив применения эритропоэтина в гинекологии. В настоящее время многие исследователи рассматривают лечение анемии РЭПО как альтернативу традиционным видам терапии [22, 36, 38]. Многими исследованиями подтверждено постоянное присутствие эритропоэтина (ЭПО) в плазме здоровых людей и экспериментальных животных.
Одним из вариантов лечения миомы, позволяющим получить время для устранения дефицита железа и лечения ЖДА, является применение а-ГнРГ в течение 2-3 мес для уменьшения роста и размеров опухоли за счет ухудшения ее кровоснабжения, такая подготовка дает хороший результат: снижаются кровопотеря и длительность операции, что облегчает хирургическое вмешательство и расширяет возможности миомэктомии (удаление миоматозного узла без вскрытия полости матки). Однако некоторые исследователи имеют отрицательную точку зрения на лечение аналогами а-ГнРГ [26]. В последние годы благодаря накопленному в мире опыту по применению у больных с анемией различного генеза человеческого рекомбинантного эритропоэтина (РЭПО) начались исследования, направленные на изучение перспектив применения эритропоэтина в гинекологии. В настоящее время многие исследователи рассматривают лечение анемии РЭПО как альтернативу традиционным видам терапии [22, 36, 38]. Многими исследованиями подтверждено постоянное присутствие эритропоэтина (ЭПО) в плазме здоровых людей и экспериментальных животных. Это является доказательством гормональной роли ЭПО в постоянном поддержании эритропоэза на должном уровне [23, 39, 40]. ЭПО — гормон белковой природы, продуцируемый в почках (90%). Основная функция его — регуляция эритропоэза путем воздействия на отдел коммитированных эритропоэтин-чувствительных клеток (ЭЧК) костного мозга [41, 42]. Гипотеза о существовании в организме фактора гормональной природы, контролирующего эритропоэз, была высказана в 1906 г. французскими исследователями [39]. В 1977 г. гормон выделен в чистом виде, а в 1985 г. ген клонирован и экспрессирован на клетках яичника китайского хомяка [43]. В работах некоторых исследователей показано, что отсутствие ЭПО в культурах вызывает остановку роста эритроидных колоний, его добавление в культуральную среду возобновляет рост и предотвращает апоптоз [40]. Некоторыми учеными выявлена линейная зависимость числа растущих эритроидных колоний от дозы ЭПО, добавленного в среду [39]. Основным местом продукции ЭПО у взрослых являются почки, у плода и новорожденных — печень.
Это является доказательством гормональной роли ЭПО в постоянном поддержании эритропоэза на должном уровне [23, 39, 40]. ЭПО — гормон белковой природы, продуцируемый в почках (90%). Основная функция его — регуляция эритропоэза путем воздействия на отдел коммитированных эритропоэтин-чувствительных клеток (ЭЧК) костного мозга [41, 42]. Гипотеза о существовании в организме фактора гормональной природы, контролирующего эритропоэз, была высказана в 1906 г. французскими исследователями [39]. В 1977 г. гормон выделен в чистом виде, а в 1985 г. ген клонирован и экспрессирован на клетках яичника китайского хомяка [43]. В работах некоторых исследователей показано, что отсутствие ЭПО в культурах вызывает остановку роста эритроидных колоний, его добавление в культуральную среду возобновляет рост и предотвращает апоптоз [40]. Некоторыми учеными выявлена линейная зависимость числа растущих эритроидных колоний от дозы ЭПО, добавленного в среду [39]. Основным местом продукции ЭПО у взрослых являются почки, у плода и новорожденных — печень. В работах многих авторов доказано, что ЭПО синтезируется в клетках коркового слоя почек, представляющих собой интерстициальные фибробласты («ЭПО-циты») [39]. Это подтверждено многочисленными экспериментальными работами [23]. Запасов эритропоэтина в организме не обнаружено. Базальная секреция гормона поддерживается уровнем оксигенации тканей. При заболеваниях сердечно-сосудистой системы, легочных заболеваниях с нарушением диффузии кислорода продукция ЭПО повышается [39, 41]. При гипоксии в почках и печени активизируется большое число ЭПО-цитов и как следствие — вырабатывается большее количество гормона. В настоящее время большое количество работ свидетельствует о повышении уровня ЭПО практически при всех видах анемий [23, 36]. ЭПО — мощный регулятор эритропоэза. Воздействие факторов, изменяющих содержание гемоглобина и уровень оксигенации тканей, приводит к изменению концентрации ЭПО в плазме крови и степени регенерации костного мозга. Это подтверждено многочисленными экспериментальными и клиническими данными.
В работах многих авторов доказано, что ЭПО синтезируется в клетках коркового слоя почек, представляющих собой интерстициальные фибробласты («ЭПО-циты») [39]. Это подтверждено многочисленными экспериментальными работами [23]. Запасов эритропоэтина в организме не обнаружено. Базальная секреция гормона поддерживается уровнем оксигенации тканей. При заболеваниях сердечно-сосудистой системы, легочных заболеваниях с нарушением диффузии кислорода продукция ЭПО повышается [39, 41]. При гипоксии в почках и печени активизируется большое число ЭПО-цитов и как следствие — вырабатывается большее количество гормона. В настоящее время большое количество работ свидетельствует о повышении уровня ЭПО практически при всех видах анемий [23, 36]. ЭПО — мощный регулятор эритропоэза. Воздействие факторов, изменяющих содержание гемоглобина и уровень оксигенации тканей, приводит к изменению концентрации ЭПО в плазме крови и степени регенерации костного мозга. Это подтверждено многочисленными экспериментальными и клиническими данными. Многие исследователи доказывают, что в условиях повышенной оксигенации тканей (гипербарическая оксигенация, искусственная полицитемия у больных лиц) продукция ЭПО уменьшается, а пролиферативная активность костного мозга снижается. При введении на этом фоне ЭПО наблюдается выраженная эритробластическая реакция костного мозга [36, 44]. В работе J.Spivak доказано, что при изменении уровня гемоглобина в крови от 150 до 120 г/л количество ЭПО в сыворотке не изменяется. Только при падении гемоглобина ниже 110 г/л уровень ЭПО повышается [40]. Помимо почек ЭПО образуется в печени, желудке, гипофизе [42]. В эксперименте доказано, что эти органы в нормальных условиях не играют существенной роли в регуляции эритропоэза. Однако при почечной патологии именно внепочечный ЭПО играет основную роль в поддержании эритропоэза на должном уровне [23]. В организме пациентов с хроническими заболеваниями почек в печени вырабатывается немалое количество ЭПО. Однако адекватный для нормального процесса эритропоэза уровень ЭПО поддерживать у таких пациентов не удается [45].
Многие исследователи доказывают, что в условиях повышенной оксигенации тканей (гипербарическая оксигенация, искусственная полицитемия у больных лиц) продукция ЭПО уменьшается, а пролиферативная активность костного мозга снижается. При введении на этом фоне ЭПО наблюдается выраженная эритробластическая реакция костного мозга [36, 44]. В работе J.Spivak доказано, что при изменении уровня гемоглобина в крови от 150 до 120 г/л количество ЭПО в сыворотке не изменяется. Только при падении гемоглобина ниже 110 г/л уровень ЭПО повышается [40]. Помимо почек ЭПО образуется в печени, желудке, гипофизе [42]. В эксперименте доказано, что эти органы в нормальных условиях не играют существенной роли в регуляции эритропоэза. Однако при почечной патологии именно внепочечный ЭПО играет основную роль в поддержании эритропоэза на должном уровне [23]. В организме пациентов с хроническими заболеваниями почек в печени вырабатывается немалое количество ЭПО. Однако адекватный для нормального процесса эритропоэза уровень ЭПО поддерживать у таких пациентов не удается [45]. У больных с тяжелыми воспалительными процессами и хроническими инфекциями отмечались подъемы сывороточного ЭПО, но они оказались недостаточными для предотвращения анемии. В эксперименте было показано, что после однократной кровопотери в размере 1-2% от массы тела животного или менее 5-7% объема крови концентрация сывороточного ЭПО несколько повышается. При массивной кровопотере увеличение уровня ЭПО в крови обнаруживается через 6-12 ч и через 20-24 ч достигает максимума. Некоторые исследователи придерживаются этой же точки зрения, опираясь на факт колебания уровня ЭПО в течение суток (например, в утренние часы его продукция снижена) [23, 45]. Суточные и иные колебания базального уровня ЭПО могут объясняться другими неспецифическими эффектами ЭПО — повышением общей резистентности организма и влиянием на иммунологические реакции [23]. Основное действие ЭПО направлено на образование эритроцитов костным мозгом. ЭПО действует непосредственно на ЭПО-чувствительные клетки (ЭЧК). В современной литературе имеются данные, что ЭПО на стволовую клетку не оказывает прямого воздействия.
У больных с тяжелыми воспалительными процессами и хроническими инфекциями отмечались подъемы сывороточного ЭПО, но они оказались недостаточными для предотвращения анемии. В эксперименте было показано, что после однократной кровопотери в размере 1-2% от массы тела животного или менее 5-7% объема крови концентрация сывороточного ЭПО несколько повышается. При массивной кровопотере увеличение уровня ЭПО в крови обнаруживается через 6-12 ч и через 20-24 ч достигает максимума. Некоторые исследователи придерживаются этой же точки зрения, опираясь на факт колебания уровня ЭПО в течение суток (например, в утренние часы его продукция снижена) [23, 45]. Суточные и иные колебания базального уровня ЭПО могут объясняться другими неспецифическими эффектами ЭПО — повышением общей резистентности организма и влиянием на иммунологические реакции [23]. Основное действие ЭПО направлено на образование эритроцитов костным мозгом. ЭПО действует непосредственно на ЭПО-чувствительные клетки (ЭЧК). В современной литературе имеются данные, что ЭПО на стволовую клетку не оказывает прямого воздействия.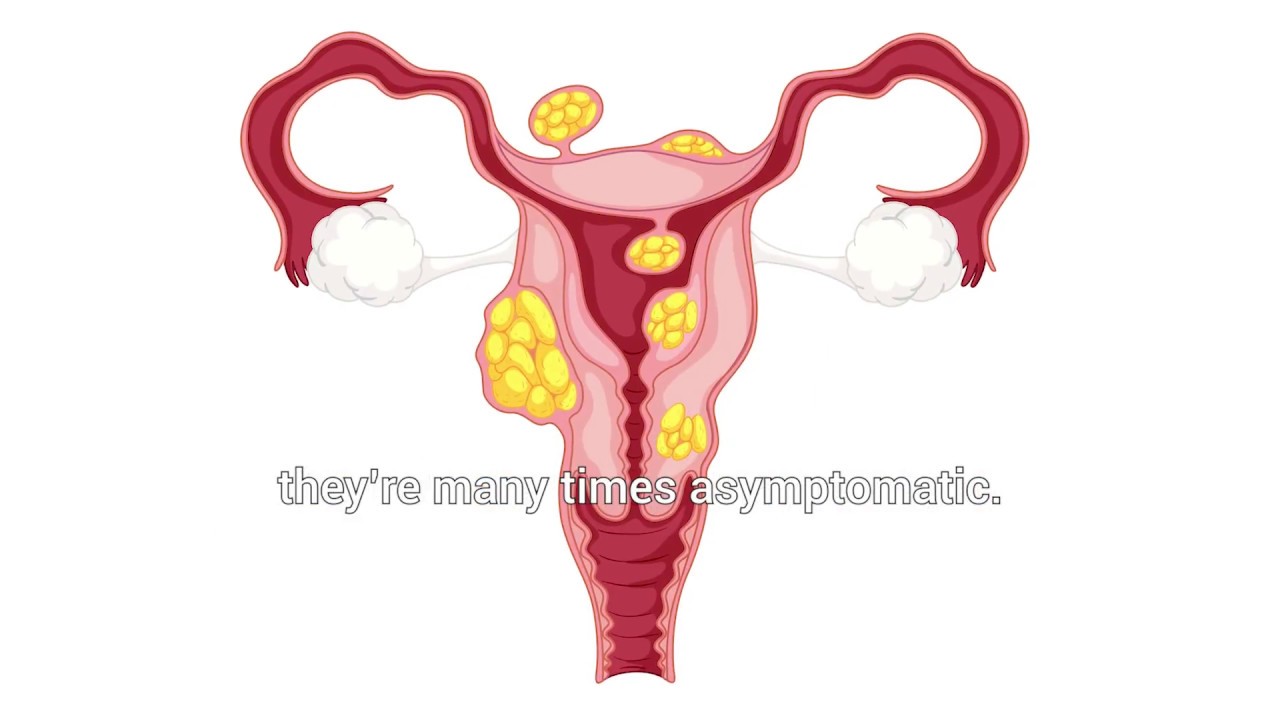 Под влиянием ЭПО усиливается пролиферация и дифференцировка ЭЧК. ЭПО ускоряет синтез гемоглобина, созревание и выход ретикулоцитов в кровь, повышает число митозов [39]. Убедительным свидетельством в пользу влияния ЭПО на терминальную фазу эритропоэза являются работы, обнаруживающие рецепторы к ЭПО на всех поздних клетках-предшественниках эритропоэза [42]. Благодаря накопленным на сегодняшний день экспериментальным и клиническим данным можно сделать вывод о доминирующей роли ЭПО в регуляции регенеративной активности эритропоэза. Продукция эритроцитов регулируется посредством колебаний насыщения тканей кислородом по принципу обратной связи. Поэтому многие исследователи называют ЭПО гормоном [39, 41, 45]. В последние годы ЭПО широко используется у больных с анемией различного генеза. Почечные анемии были главной моделью изучения механизмов регуляции эритропоэза. Отечественными и зарубежными учеными проведен ряд исследований, направленных на изучение динамики ЭПО и состояние эритропоэза при железодефицитных анемиях, развивающихся обычно вследствие незначительных, но длительных кровопотерь [37].
Под влиянием ЭПО усиливается пролиферация и дифференцировка ЭЧК. ЭПО ускоряет синтез гемоглобина, созревание и выход ретикулоцитов в кровь, повышает число митозов [39]. Убедительным свидетельством в пользу влияния ЭПО на терминальную фазу эритропоэза являются работы, обнаруживающие рецепторы к ЭПО на всех поздних клетках-предшественниках эритропоэза [42]. Благодаря накопленным на сегодняшний день экспериментальным и клиническим данным можно сделать вывод о доминирующей роли ЭПО в регуляции регенеративной активности эритропоэза. Продукция эритроцитов регулируется посредством колебаний насыщения тканей кислородом по принципу обратной связи. Поэтому многие исследователи называют ЭПО гормоном [39, 41, 45]. В последние годы ЭПО широко используется у больных с анемией различного генеза. Почечные анемии были главной моделью изучения механизмов регуляции эритропоэза. Отечественными и зарубежными учеными проведен ряд исследований, направленных на изучение динамики ЭПО и состояние эритропоэза при железодефицитных анемиях, развивающихся обычно вследствие незначительных, но длительных кровопотерь [37].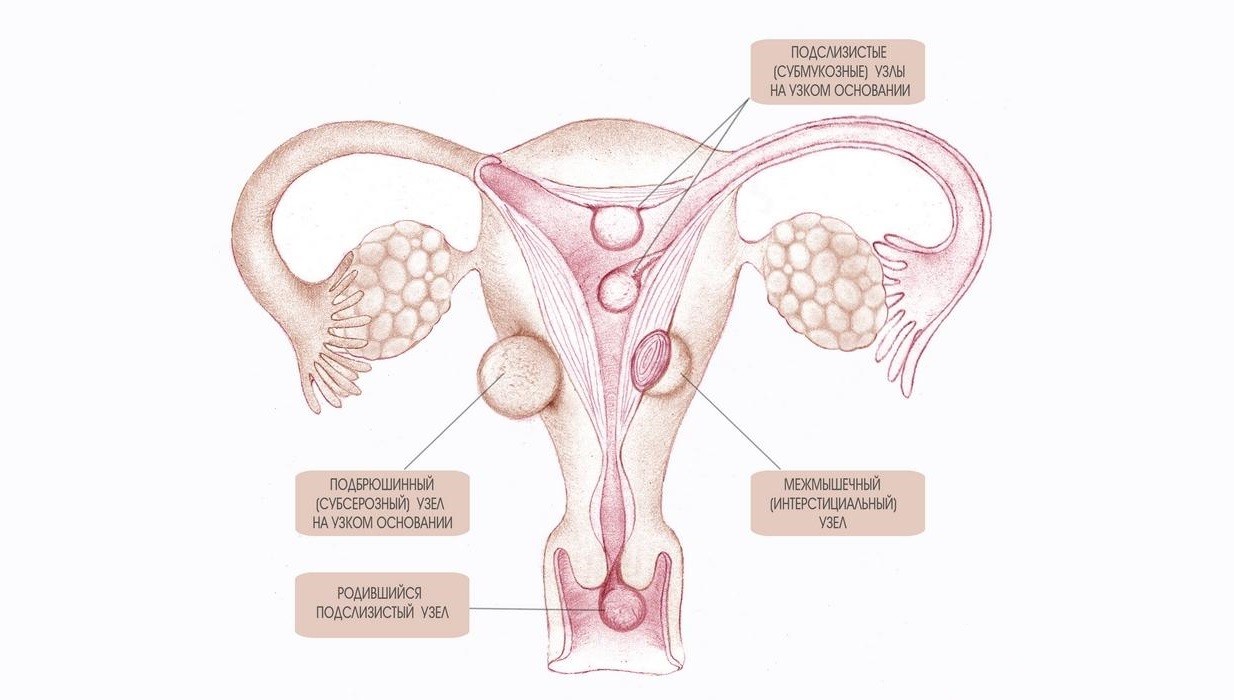 Низкая концентрация гемоглобина вследствие замедления его синтеза из-за дефицита железа приводит к замедлению вызревания эритроцитов [20, 46]. Уровень ЭПО в плазме повышается, но из-за гипорегенераторного состояния костного мозга это не приводит к должному результату [45]. В последнее десятилетие появились работы об успешном применении ЭПО для профилактики и лечения анемий у новорожденных, беременных и родильниц [47, 48]. Так, в работах M.Obladen (1995) и R.Phibbs (1995) применялся РЭПО в дозе от 300 до 1200 ЕД/кг в 1 нед у преждевременно родившихся детей возрастом менее 34 нед [43, 48]. Применение РЭПО позволило снизить число новорожденных, нуждающихся в гемотрансфузии на 18% [43]. В нашей стране и за рубежом накоплен опыт применения РЭПО при анемии у беременных женщин и родильниц. По данным М.М.Шехтман (2002), 90% анемий у беременных являются гипохромными или железодефицитными [32, 34]. Как показали многочисленные исследования, применяемые ранее препараты железа не стимулируют эритропоэз быстро и адекватно.
Низкая концентрация гемоглобина вследствие замедления его синтеза из-за дефицита железа приводит к замедлению вызревания эритроцитов [20, 46]. Уровень ЭПО в плазме повышается, но из-за гипорегенераторного состояния костного мозга это не приводит к должному результату [45]. В последнее десятилетие появились работы об успешном применении ЭПО для профилактики и лечения анемий у новорожденных, беременных и родильниц [47, 48]. Так, в работах M.Obladen (1995) и R.Phibbs (1995) применялся РЭПО в дозе от 300 до 1200 ЕД/кг в 1 нед у преждевременно родившихся детей возрастом менее 34 нед [43, 48]. Применение РЭПО позволило снизить число новорожденных, нуждающихся в гемотрансфузии на 18% [43]. В нашей стране и за рубежом накоплен опыт применения РЭПО при анемии у беременных женщин и родильниц. По данным М.М.Шехтман (2002), 90% анемий у беременных являются гипохромными или железодефицитными [32, 34]. Как показали многочисленные исследования, применяемые ранее препараты железа не стимулируют эритропоэз быстро и адекватно. В зарубежной печати появились работы об успешном лечении анемии у беременных с почечной патологией РЭПО [49, 50]. В 1995 г. были опубликованы результаты исследований C.Breymann и совт. по применению РЭПО у беременных с анемией и нормальной функцией почек. Лечение продолжалось до роста уровня гемоглобина до 110 г/л или до родов, но не более 4 нед. Беременные продемонстрировали хороший ответ на введение препарата, проявляющийся в росте числа ретикулоцитов и уровня гемоглобина. В процессе лечения побочных эффектов исследователи не отметили [51]. Есть сообщения об успешном применении РЭПО у беременных в России. Полученные данные свидетельствуют, что при введении РЭПО беременным с анемией клинический эффект реализуется через влияние ЭПО на резервное железо и объемный транспорт кислорода. Таким образом, происходит купирование синдрома неадекватной продукции ЭПО. Следовательно, применение РЭПО в сочетании с препаратами железа у беременных с ЖДА является патогенетически обоснованным [52, 53]. В литературе встречаются работы, доказывающие, что РЭПО не проникает через плаценту [54].
В зарубежной печати появились работы об успешном лечении анемии у беременных с почечной патологией РЭПО [49, 50]. В 1995 г. были опубликованы результаты исследований C.Breymann и совт. по применению РЭПО у беременных с анемией и нормальной функцией почек. Лечение продолжалось до роста уровня гемоглобина до 110 г/л или до родов, но не более 4 нед. Беременные продемонстрировали хороший ответ на введение препарата, проявляющийся в росте числа ретикулоцитов и уровня гемоглобина. В процессе лечения побочных эффектов исследователи не отметили [51]. Есть сообщения об успешном применении РЭПО у беременных в России. Полученные данные свидетельствуют, что при введении РЭПО беременным с анемией клинический эффект реализуется через влияние ЭПО на резервное железо и объемный транспорт кислорода. Таким образом, происходит купирование синдрома неадекватной продукции ЭПО. Следовательно, применение РЭПО в сочетании с препаратами железа у беременных с ЖДА является патогенетически обоснованным [52, 53]. В литературе встречаются работы, доказывающие, что РЭПО не проникает через плаценту [54].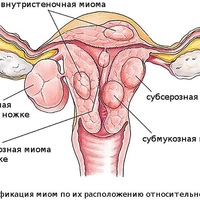 При изучении эритропоэза у плода после лечения РЭПО беременных с анемией не выявлено его стимуляции [37]. Некоторые клиницисты применяли ЭПО у женщин с анемией в послеродовом периоде [45, 55, 56]. Обоснование к использованию РЭПО у родильниц с анемией изложено в работах В.А.Бурлева и соавт. [57]. Накоплен опыт применения РЭПО с достижением хороших результатов при подготовке пациентов с анемией к обширным хирургическим вмешательствам (ортопедия, онкология), для стимуляции эритропоэза в послеоперационном периоде, при термических ожогах, в онкогематологии [58-62]. Применяют РЭПО и в гинекологии в основном для подготовки пациенток с ЖДА для операции [56, 63-65]. Технои [56, 63-65]. Технологией производства РЭПО обладает несколько фармацевтических компаний США, Германии, Швейцарии и Японии. Рекомбинантный человеческий эритропоэтин относится к числу дорогостоящих медикаментов. Производится за рубежом по лицензиям фирм «Амджен» и «Берингер» следующими компаниями: «Цилаг», Швейцария (препарат «Эпрекс»), «Орто», США, «Кирин-Амджен», Япония, «Чугаи», Япония, «Берингер-Манхейм», Германия (препарат «Рекормон»).
При изучении эритропоэза у плода после лечения РЭПО беременных с анемией не выявлено его стимуляции [37]. Некоторые клиницисты применяли ЭПО у женщин с анемией в послеродовом периоде [45, 55, 56]. Обоснование к использованию РЭПО у родильниц с анемией изложено в работах В.А.Бурлева и соавт. [57]. Накоплен опыт применения РЭПО с достижением хороших результатов при подготовке пациентов с анемией к обширным хирургическим вмешательствам (ортопедия, онкология), для стимуляции эритропоэза в послеоперационном периоде, при термических ожогах, в онкогематологии [58-62]. Применяют РЭПО и в гинекологии в основном для подготовки пациенток с ЖДА для операции [56, 63-65]. Технои [56, 63-65]. Технологией производства РЭПО обладает несколько фармацевтических компаний США, Германии, Швейцарии и Японии. Рекомбинантный человеческий эритропоэтин относится к числу дорогостоящих медикаментов. Производится за рубежом по лицензиям фирм «Амджен» и «Берингер» следующими компаниями: «Цилаг», Швейцария (препарат «Эпрекс»), «Орто», США, «Кирин-Амджен», Япония, «Чугаи», Япония, «Берингер-Манхейм», Германия (препарат «Рекормон»). В настоящее время налажено российское производство РЭПО под названием «Эпокрин» («Протеиновый контур», СПб.) для внутривенного и подкожного введения. Отечественный препарат РЭПО не уступает зарубежным аналогам, а по ряду свойств превосходит их, что подтверждено клиническими исследованиями в России и за рубежом. Для определения активности ЭПО в сыворотке крови в Санкт-Петербурге предприятием «Протеиновый контур» выпускается набор для иммуноферментного анализа. Сочетание определения активности ЭПО в сыворотке крови и применение РЭПО у больных с анемией позволяет достигать наиболее оптимальных результатов лечения. Наш опыт применения «Эпокрина» у больных с анемией и миомой матки показал его высокую эффективность. Таким образом, представленные в настоящем обзоре данные свидетельствуют о том, что применение РЭПО в сочетании с насыщением организма железом — это новое, эффективное и патогенетически обоснованное направление в лечении анемии у пациентов с анемией при ХПН, подверженных гемодиализу; в акушерской практике при лечении железодефицитных анемий у беременных и родильниц; в педиатрии у недоношенных новорожденных; в хирургической и гинекологической практике при подготовке пациентов с ЖДА к операциям, а также в онкогематологии.
В настоящее время налажено российское производство РЭПО под названием «Эпокрин» («Протеиновый контур», СПб.) для внутривенного и подкожного введения. Отечественный препарат РЭПО не уступает зарубежным аналогам, а по ряду свойств превосходит их, что подтверждено клиническими исследованиями в России и за рубежом. Для определения активности ЭПО в сыворотке крови в Санкт-Петербурге предприятием «Протеиновый контур» выпускается набор для иммуноферментного анализа. Сочетание определения активности ЭПО в сыворотке крови и применение РЭПО у больных с анемией позволяет достигать наиболее оптимальных результатов лечения. Наш опыт применения «Эпокрина» у больных с анемией и миомой матки показал его высокую эффективность. Таким образом, представленные в настоящем обзоре данные свидетельствуют о том, что применение РЭПО в сочетании с насыщением организма железом — это новое, эффективное и патогенетически обоснованное направление в лечении анемии у пациентов с анемией при ХПН, подверженных гемодиализу; в акушерской практике при лечении железодефицитных анемий у беременных и родильниц; в педиатрии у недоношенных новорожденных; в хирургической и гинекологической практике при подготовке пациентов с ЖДА к операциям, а также в онкогематологии. Считаем, что применение препарата рекомбинантного человеческого эритропоэтина — перспективное направление, требующее развития, качественно новый уровень в лечении железодефицитных анемий у больных с миомой матки в предоперационном и послеоперационном периодах.
Считаем, что применение препарата рекомбинантного человеческого эритропоэтина — перспективное направление, требующее развития, качественно новый уровень в лечении железодефицитных анемий у больных с миомой матки в предоперационном и послеоперационном периодах.
- Вихляева Е.М. Журн. акуш. и женских болезней. 2001; XLX. Вып. 1: 13-7.
- Вихляева Е.М. Вопросы онкологии. 2001; 47 (2-3).
- Сидрова И.С., Рыжова О.В. Акуш. и гин. 2002; 1: 12-3.
- Dixon D, He H, Haseman J.K. Environ Health Perspect 2000; 108 (Suppl. 5): 795-802.
- Ландеховский Ю.Д. Клинико — патогенетическое обоснование тактики ведения больных миомой матки. Дисс.. докт. мед. наук. М., 1988; 310 с.
- Серов В.В., Журавлев Т.Б., Василевская Л.Н., Мельников Ю.Г. Акуш. и гин. 1973; 1: 3-8.
- Савицкий Г.
 А., Савицкий А.Г. Миома матки: проблемы патогенеза и патогенетической терапии. Спб., 2000.
А., Савицкий А.Г. Миома матки: проблемы патогенеза и патогенетической терапии. Спб., 2000. - Арутюнян А.Ф. Автореф. дисс.. канд. мед. наук. Спб., 2002; 23 с.
- Адамян Л.В., Алексеев М.Л., Новиков Е.А., Щедрина Р.Н. Акуш. и гин. 1994; 5: 34-6.
- Красильников А.Я. Клинические аспекты анемии у больных миомой матки. Миома матки: некоторые вопросы патогенеза, клиники и лечения. Сб. науч. трудов (под ред. Л.И.Васильевской). 1979; 51-4.
- Pearce P.H. Amer J Obstet Gynec 1982; 144 (2): 133-4.
- Кулаков В.И., Голубев В.А. Реконструктивная хирургия в современной гинекологии. Сб. статей «Реконструктивная хирургия и реабилитация репродуктивной функции у гинекологических больных». 1992; 11-7.
- Хамко В.А. Роль морфологических изменений и дисбаланса кальция и меди в патогенезе кровотечений при миоме матки. Иваново, 2002; 24 с.
- Ищенко И.
 Г. Аномальные маточные кровотечения у больных миомой матки в перименопаузе. Автореф. дисс.. канд. мед. наук. М., 1994; 16 с.
Г. Аномальные маточные кровотечения у больных миомой матки в перименопаузе. Автореф. дисс.. канд. мед. наук. М., 1994; 16 с. - Аркадьева Г.В. Диагностика и лечение железодефицитных состояний. Учебно — методическое пособие. М., 1999; 22-25.
- Дворецкий Л.И. Железодефицитные анемии. М., 1998; 37 с.
- Волков В.С., Кириленко Н.П. Гематол. и трансфузиол. 1996; 41 (4): 12-5.
- Дугиева М.З., Стрижова Н.В., Багдсарова З.З. Вестник новых мед. технологий. Тула, 2001; VIII (4): 69-70.
- Кирсанова М.А. Акуш. и гин. 1988; 5: 14-7.
- Петров В.Н.Физиология и патология обмена железа. Л., 1989; 233 с.
- Синюхин В.Н., Стецюк Е., Ловчинский Е.В. и др. Тер. арх. 1994; 66 (8): 60-2.
- Шевченко Ю.Л., Данильченко В.В. и др. Военно — мед. журн. 1996; 5: 45-7.
- Румянцев А.Г., Морщакова Е.
 Ф., Павлов А.Д. Эритропоэтин: биологические свойства, возрастная регуляция эритропоэза, клиническое применение. М.: ГЭОТАР-МЕД, 2002; 400 с.
Ф., Павлов А.Д. Эритропоэтин: биологические свойства, возрастная регуляция эритропоэза, клиническое применение. М.: ГЭОТАР-МЕД, 2002; 400 с. - Stearn H.C. Postrad Med 1972; 51: 165-8.
- Golan A. Аналоги ГнРГ в терапии фибромы матки//Аналоги ГнРГ в репродуктивной медицине. М.: МедПресс, 1997; 39-49.
- Maheux R. Агонист ГнРГ: альтернатива хирургическому лечению? Аналоги ГнРГ в репродуктивной медицине. М.: МедПресс, 1997; 49-59.
- Maney C M.D, Lee C. Amer J Obstet Gynec 1984; 150 (3): 283-8.
- Guarnaccia M.M, Rein M.S. Clinical Obstet Gy 2001; 44 (2): 385-400.
- Milad M.P, Sankpal R.S. Clin Obstet Gyn 2001; 44 (2): 401-11.
- Васильченко Н.П. Клинико — физиологическое обоснование тактики хирургического лечения больных лейкомиомой матки: Дис.. док. мед. наук. М., 1989.
- Brockmsns F.J, Антагонисты а-ГнРГ и лейкомиома матки//Аналоги ГнРГ в репродуктивной медицине.
 М.: МедПресс, 1997; 7-33.
М.: МедПресс, 1997; 7-33. - Димитров Д.Я. Анемии беременных. София, 1977; 156 с.
- Идельсон Л.И. Гипохромные анемии. М., 1981; 190 с.
- Шехтман М.М. Гинекология. 2002; 2 (6): 164-72.
- Вдовиченко Ю.П. Лечение простгеморрагической анемии и послеоперационной иммуносупрессии у больных с миомой матки: Дисс.. канд. мед. наук, Одесса, 1988; 68-77.
- Гудим В.И., Еременко Л.Л., Иванова В.С. и др. Гематол. и трансфузиол. 1991; 36(М7): 3-5.
- Коноводова Е.Н., Бурлев В.А. Вестн. Рос. ассоциации акуш. — гин. 1999; 2: 34-40.
- Dicato M, Duhem C, Berchem G, Ries F. Curr Opin Oncol 2000; 12 (4): 297-302.
- Bauer C. J Perinat Med 1995; 23: 7-12.
- Spivak J.L. Seminars in Oncology 1998; 25 (3) Suppl. 7: 7-11.
- Eckardt Kai-Uwe. J Perinat Med 1995; 23: 19-29.

- Erslev A.J, Schuster G, Caro J. Eur J Haemat 1989; 43 (5): 367-73.
- Obladen M, Maier R.F. J Perinat Med 1995; 23: 119-26.
- Fletcher J.W, Gallacher N.J, Warnecke M.A. Proc Soc Exp Biol Med 1973; 4: 569-74.
- Zimmermann R, Breymann C, Richter C et al. J Perinat Med 1995; 23: 111-7.
- Hill R, Pelit J, Tuttersall M et al. Brit J Hemat 1972; 23 (4): 507-15.
- Merchant R.H, Sonigara S, Sanghvi K.P. Indian Pediatr 1996; 33 (4): 323-6.
- Phibbs R.H. J Perinat Med 1995; 23: 127-31.
- Al Shohaib S. Nephron 1999 Jan; 81 (1): 81-3.
- Amoedo M.L, Femsndez E, Borras M et al. Nephrron 1995; 70 (2): 262-3.
- Breymann C, Major A, Richter C et al. J Perinat Med 1995; 23: 89 98.
- Бурлев В.А., Коноводова Е.Н., Мурашко Л.
 Е. и др. Проблемы репродукции. 2001; 1: 41-6.
Е. и др. Проблемы репродукции. 2001; 1: 41-6. - Бурлев В.А., Коноводова Е.Н., Мурашко Л.Е. и др. Проблемы репродукции. 1999; 5 (2): 10-4.
- Reisenberger K, Egarter C, Kapiotis S, Stemberger B et al. Obstet Gynec 1997; 89 (5 Pt 1): 738-42.
- Гуревич К.Я., Жетишев Р.А., Казарин В.С. и др. Terra Medica. 2000; 3: 40-3.
- Delzanno G, Falcone M, Gaudiano L et al. Minerva Ginecol 1996; 48 (3): 115-8.
- Бурлев А.А., Коноводова Е.Н., Нерсесян Р.А. и др. Проблемы репродукции. 2002; 5: 53-6.
- Faris P.M, Ritter M.A. Clin Orthop 198 Dec.; 357: 60-7.
- Kettelhack C, Hones C, Messinger D, Schlag P.M. Br J Surg 1998 Jan; 85 (1): 63-7.
- Mercuriali F [The role of human recombinant erythropoietin in oncologic surgery]. Tumori 1997 Jul; 83 (4 Suppl. 2): S16-S19.
- Rauh M.A, Bayers-Thering M, La Butti R.
 S, Krackow K.A. Orthopedics 2002; 25 (3): 317-20.
S, Krackow K.A. Orthopedics 2002; 25 (3): 317-20. - Rohling R.G, Zimmermann A.P, Breymann C. J Hematother stem Cell Res 2000 Aug.; 9 (4): 497-500.
- Bachmann G.A. J Reprod Med 2001; 46 (5 Suppl.): 539-44.
- Larson B, Bremme K, Clyne N, Nordstrom L. Acta Obstet Gynecol Scand 2001; 80: 559-62.
- Rock W.A.Jr, Meeks G.R. J Reprod Med 2001; 46 (5 Suppl.): 507-14.
Cited-By
Article Metrics
Refbacks
- There are currently no refbacks.
Каковы признаки и симптомы послеродового кровотечения (ПРК)?
Центры по контролю и профилактике заболеваний. Репродуктивное здоровье: система наблюдения за смертностью при беременности. Доступно по адресу https://www.cdc.gov/reproductivehealth/maternalinfanthealth/pmss. html. 29 июня 2017 г .; Доступ: 21 июля 2017 г.
html. 29 июня 2017 г .; Доступ: 21 июля 2017 г.
ВОЗ. Снижение глобального бремени: послеродовое кровотечение. Обеспечение безопасной беременности . 2007. [Полный текст].
Американский колледж акушеров и гинекологов.Практический бюллетень ACOG: Руководство по клиническому ведению акушеров-гинекологов № 76, октябрь 2006 г .: послеродовое кровотечение. Акушерский гинекол . 2006 Октябрь 108 (4): 1039-47. [Медлайн].
Lutomski J, Byrne B, Devane D, Greene R. Тенденции к увеличению атонических послеродовых кровотечений в Ирландии: 11-летнее популяционное когортное исследование. BJOG . 2012 Февраль 119 (3): 306-14. [Медлайн].
Корзина TF. Осложнения третьего периода родов. Основное ведение неотложной акушерской помощи . 3-е изд. Бристоль, Англия: Clinical Press; 1999. 196-201.
3-е изд. Бристоль, Англия: Clinical Press; 1999. 196-201.
Sentilhes L, Vayssière C, Deneux-Tharaux C и др. Послеродовое кровотечение: руководство по клинической практике Французского колледжа гинекологов и акушеров (CNGOF): в сотрудничестве с Французским обществом анестезиологии и интенсивной терапии (SFAR). евро J Obstet Gynecol Reprod Biol . 2016 Март 198: 12–21. [Медлайн].
Каннингем Ф.Г., Гант Н.Ф., Левено К.Дж. и др., Ред.Ведение нормальных родов и родов. Акушерство Уильямса . 21-е изд. Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл; 2001. 320-5.
Роджерс Дж., Вуд Дж., МакКандлиш Р., Эйерс С., Трусдейл А., Элбурн Д. Активное ведение третьего периода родов по сравнению с выжидательным: рандомизированное контролируемое исследование Хинчингбрука. Ланцет . 1998 7 марта. 351 (9104): 693-9. [Медлайн].
[Медлайн].
Begley CM, Gyte GM, Devane D, McGuire W., Weeks A. Активная тактика по сравнению с выжидательной тактикой у женщин в третьем периоде родов. Кокрановская база данных Syst Rev . 2015 г. 2 марта. CD007412. [Медлайн].
Джексон К.В. Младший, Олберт Дж. Р., Шеммер Г. К., Эллиот М., Хамфри А., Тейлор Дж. Рандомизированное контролируемое исследование, сравнивающее введение окситоцина до и после родов через плаценту для предотвращения послеродового кровотечения. Am J Obstet Gynecol . 2001 Октябрь 185 (4): 873-7. [Медлайн].
Шейнер Э., Сарид Л., Леви А., Сейдман Д.С., Халлак М. Факторы акушерского риска и исход беременностей, осложненных ранним послеродовым кровотечением: популяционное исследование. J Matern Fetal Neonatal Med . 2005 Сентябрь 18 (3): 149-54. [Медлайн].
Хэнли Г.Е., Смолина К., Минцес Б., Оберландер Т.Ф., Морган С.Г. Послеродовое кровотечение и использование антидепрессантов, ингибирующих обратный захват серотонина, во время беременности. Акушерский гинекол . 2016 Март 127 (3): 553-61. [Медлайн].
Хэлле Т.Венлафаксин связан с повышенным риском послеродового кровотечения. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/858900. 15 февраля 2016 г .; Доступ: 2 марта 2016 г.
Общество акушерства и гинекологии Канады. Послеродовое кровотечение. Руководство по тревоге . 15-е изд. 2008.
Роджерс М.С., Юэн П. М., Вонг С. Как избежать ручного удаления плаценты: оценка интрапупочной инъекции утеротоников с использованием техники Pipingas для лечения приросшей плаценты. Acta Obstet Gynecol Scand . 2007. 86 (1): 48-54. [Медлайн].
М., Вонг С. Как избежать ручного удаления плаценты: оценка интрапупочной инъекции утеротоников с использованием техники Pipingas для лечения приросшей плаценты. Acta Obstet Gynecol Scand . 2007. 86 (1): 48-54. [Медлайн].
Маркетт Г.П., Сколл М.А., Донтиньи Л. Рандомизированное исследование, в котором сравнивали пероральный мизопростол с простагландином F2альфа внутри амниотических сосудов при прерывании второго триместра. Банка J Obstet Gynaecol . 2005 27 ноября (11): 1013-8. [Медлайн].
[Рекомендации] Джеймс А.Х., Куидес П.А., Абдул-Кадир Р. и др. Болезнь фон Виллебранда и другие нарушения свертываемости крови у женщин: консенсус по диагностике и лечению международной группы экспертов. Am J Obstet Gynecol . 2009 Июль 201 (1): 12.e1-8. [Медлайн].
Хан GQ, Джон И.С., Вани С., Доэрти Т. , Сибай Б.М. Контролируемое вытяжение за пуповину в сравнении с методами минимального вмешательства при доставке плаценты: рандомизированное контролируемое исследование. Am J Obstet Gynecol . 1997 Октябрь 177 (4): 770-4. [Медлайн].
, Сибай Б.М. Контролируемое вытяжение за пуповину в сравнении с методами минимального вмешательства при доставке плаценты: рандомизированное контролируемое исследование. Am J Obstet Gynecol . 1997 Октябрь 177 (4): 770-4. [Медлайн].
McDonald S, Abbott JM, Higgins SP. Профилактика эргометрин-окситоцина по сравнению с окситоцином в третьем периоде родов. Кокрановская база данных Syst Rev . 2004. (1): CD000201.
Westhoff G, Cotter AM, Tolosa JE. Профилактический прием окситоцина в третьем периоде родов для предотвращения послеродового кровотечения. Кокрановская база данных Syst Rev . 2013 30 октября. CD001808. [Медлайн].
Dansereau J, Joshi AK, Helewa ME, et al. Двойное слепое сравнение карбетоцина и окситоцина в профилактике атонии матки после кесарева сечения. Am J Obstet Gynecol . 1999, март 180 (3, часть 1): 670-6. [Медлайн].
1999, март 180 (3, часть 1): 670-6. [Медлайн].
Оладапо О.Т., Фаволе Б., Блюм Дж., Абалос Э. Расширенное распространение мизопростола для предотвращения и лечения чрезмерной кровопотери после рождения. Кокрановская база данных систематических обзоров . 15 февраля 2012г.
Американская академия педиатрии, Американский колледж акушеров и гинекологов. Руководство по перинатальной помощи . 4-е изд. Деревня Элк Гроув, штат Иллинойс: Американская академия педиатрии; 1997 г.
Американский колледж акушеров и гинекологов. Образовательный бюллетень ACOG. Геморрагический шок. Номер 235, апрель 1997 г. (заменяет № 82, декабрь 1984 г.). Американский колледж акушеров и гинекологов. Int J Gynaecol Obstet . 1997 Май. 57 (2): 219-26. [Медлайн].
Ван Вольфсвинкель М.Э., Цварт Дж., Шютте Дж. М., Дувекот Дж., Пел М., Ван Роосмален Дж. Материнская смертность и серьезные материнские заболевания у свидетелей Иеговы в Нидерландах. BJOG . 2009 июль 116 (8): 1103-8.
Singla AK, Lapinski RH, Berkowitz RL, Saphier CJ. Подвержены ли риску материнской смерти женщины, являющиеся Свидетелями Иеговы? Am J Obstet Gynecol . 2001 Октябрь 185 (4): 893-5. [Медлайн].
Xiong X, Buekens P, Alexander S, Demianczuk N, Wollast E.Анемия во время беременности и исход родов: метаанализ. Am J Perinatol . 2000. 17 (3): 137-46. [Медлайн].
Bonnar J. Массивное акушерское кровотечение. Baillieres Best Practices Clin Obstet Gynaecol . 2000 14 февраля (1): 1-18. [Медлайн].
ЖЕНЩИНА, соавторы исследования.Влияние раннего введения транексамовой кислоты на смертность, гистерэктомию и другие заболевания у женщин с послеродовым кровотечением (ЖЕНЩИНЫ): международное рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет . 2017 27 мая. 389 (10084): 2105-2116. [Медлайн].
Стоунхэм, Мэриленд. Оценка методов увеличения скорости потока i.v. жидкое введение. Br J Anaesth . 1995 Сентябрь 75 (3): 361-5. [Медлайн].
Робертс И., Олдерсон П., Банн Ф., Чиннок П., Кер К., Ширхаут Г. Коллоиды против кристаллоидов для жидкостной реанимации у тяжелобольных пациентов. Кокрановская база данных Syst Rev . 2004, 18 октября: (4): CD000567.
Hewitt PE, Machin SJ. Массовое переливание крови. ABC или Transfusion .Лондон, Англия: Издательство BMJ; 1998. 49-52.
Hughes DB, Ullery BW, Barie PS. Современный подход к заботе о свидетелях Иеговы. J Trauma . 2008 июл.65 (1): 237-47. [Медлайн].
Atoyebi W, Mundy N, Croxton T, Littlewood TJ, Murphy MF. Необходимо ли вводить анти-D для предотвращения иммунизации RhD после переливания концентратов RhD-положительных тромбоцитов? Br J Haematol . 2000 Декабрь 111 (3): 980-3.[Медлайн].
2000 Декабрь 111 (3): 980-3.[Медлайн].
Franchini M, Franchi M, Bergamini V, Salvagno GL, Montagnana M, Lippi G. Критический обзор использования рекомбинантного фактора VIIa при угрожающих жизни акушерских послеродовых кровотечениях. Семенной тромб Hemost . 2008 Февраль 34 (1): 104-12. [Медлайн].
Ахонен Дж., Джокела Р., Корттила К. Открытое нерандомизированное исследование рекомбинантного активированного фактора VII при большом послеродовом кровотечении. Acta Anaesthesiol Scand .2007 Август 51 (7): 929-36. [Медлайн].
Franchini M, Manzato F, Salvagno GL, Lippi G. Потенциальная роль рекомбинантного активированного фактора VII для лечения тяжелых кровотечений, связанных с диссеминированным внутрисосудистым свертыванием: систематический обзор. Фибринолиз свертывания крови . 2007 октября 18 (7): 589-93. [Медлайн].
[Медлайн].
Гиббинс KJ, Олбрайт CM, Роуз DJ. Послеродовое кровотечение в развитых странах: куда идти мизопростол ?. Am J Obstet Gynecol .1 августа 2012 г. [Medline].
O’Brien P, El-Refaey H, Gordon A, Geary M, Rodeck CH. Мизопростол, вводимый ректально для лечения послеродового кровотечения, не реагирует на окситоцин и эргометрин: описательное исследование. Акушерский гинекол . 1998 августа 92 (2): 212-4. [Медлайн].
Lokugamage AU, Салливан К.Р., Никулеску И. и др. Рандомизированное исследование, сравнивающее ректально вводимый мизопростол и синтометрин в сочетании с инфузией окситоцина для прекращения первичного послеродового кровотечения. Acta Obstet Gynecol Scand . 2001 Сентябрь 80 (9): 835-9. [Медлайн].
Вайд А.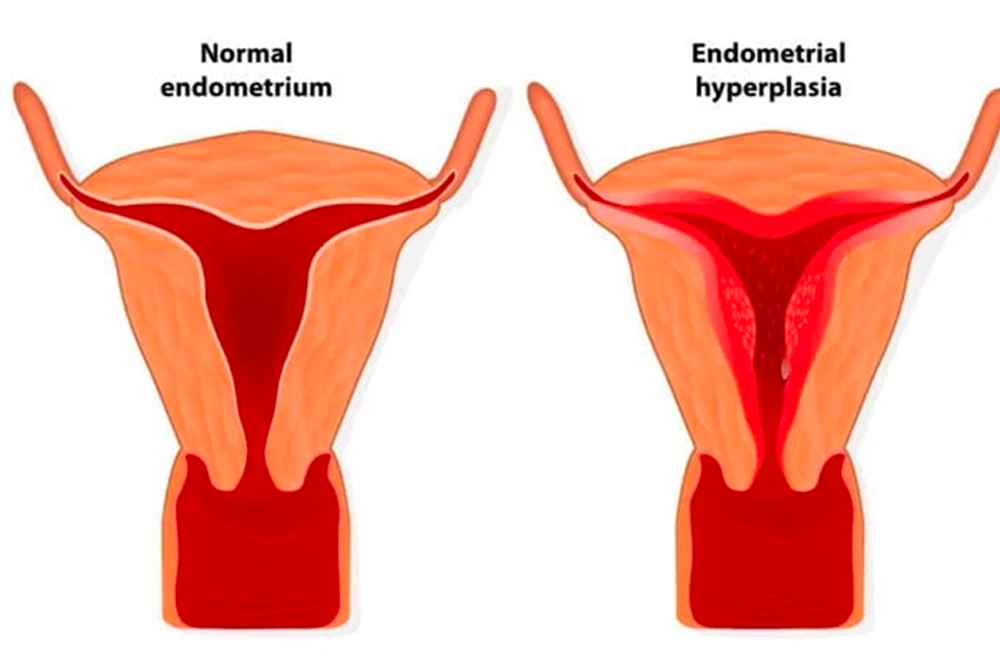 , Дадхвал В., Миттал С., Дека Д., Мисра Р., Шарма Дж. Б.. Рандомизированное контролируемое исследование профилактического сублингвального введения мизопростола в сравнении с внутримышечным введением метилэргометрина и внутримышечным введением 15-метил PGF2alpha при активном ведении третьего периода родов. Arch Gynecol Obstet . 2009 11 марта [Medline].
, Дадхвал В., Миттал С., Дека Д., Мисра Р., Шарма Дж. Б.. Рандомизированное контролируемое исследование профилактического сублингвального введения мизопростола в сравнении с внутримышечным введением метилэргометрина и внутримышечным введением 15-метил PGF2alpha при активном ведении третьего периода родов. Arch Gynecol Obstet . 2009 11 марта [Medline].
Tunçalp Ö, Hofmeyr GJ, Gülmezoglu AM. Простагландины для предотвращения послеродового кровотечения. Кокрановская база данных Syst Rev . 2012 15 августа 18; (3): CD000494. [Медлайн].
Winikoff B, Dabash R, Durocher J, Darwish E, Nguyen TN, León W. и др. Лечение послеродового кровотечения сублингвальным приемом мизопростола по сравнению с окситоцином у женщин, не подвергавшихся воздействию окситоцина во время родов: двойное слепое рандомизированное исследование не меньшей эффективности. Ланцет . 2010 16 января. 375 (9710): 210-6. [Медлайн].
2010 16 января. 375 (9710): 210-6. [Медлайн].
Quibel T, Ghout I, Goffinet F, Salomon LJ, Fort J, Javoise S и др.Активное ведение третьего периода родов с помощью комбинации окситоцина и мизопростола для предотвращения послеродового кровотечения: рандомизированное контролируемое исследование. Акушерский гинекол . 2016 Октябрь 128 (4): 805-11. [Медлайн].
Diop A, Daff B, Sow M, Blum J, Diagne M, Sloan NL и др. Окситоцин через Униджект (предварительно заполненная одноразовая инъекция) по сравнению с пероральным мизопростолом для профилактики послеродового кровотечения на уровне сообщества: кластерное рандомизированное контролируемое исследование. Ланцетный шар Здоровье . 2016, 4 (1) января: e37-44. [Медлайн].
Аттилакос Дж., Псароудакис Д., Эш Дж., Бьюкенен Р., Винтер К., Дональд Ф. и др. Карбетоцин в сравнении с окситоцином для профилактики послеродового кровотечения после кесарева сечения: результаты двойного слепого рандомизированного исследования. BJOG . 2010 июл.117 (8): 929-36. [Медлайн].
Карбетоцин в сравнении с окситоцином для профилактики послеродового кровотечения после кесарева сечения: результаты двойного слепого рандомизированного исследования. BJOG . 2010 июл.117 (8): 929-36. [Медлайн].
Criscuolo JL, Kibler MP, Micholet S, et al. [Значение антибиотикопрофилактики во время внутриматочных процедур во время родов через естественные родовые пути.Сравнительное исследование 500 пациентов. J Gynecol Obstet Biol Reprod (Париж) . 1990. 19 (7): 909-18. [Медлайн].
Hallak M, Dildy GA 3rd, Hurley TJ, Moise KJ Jr. Трансвагинальный компрессионный компресс при опасном для жизни тазовом кровоизлиянии, вызванном срастанием плаценты. Акушерский гинекол . 1991, ноябрь 78 (5, часть 2): 938-40. [Медлайн].
Майер RC. Контроль послеродового кровотечения тампонами матки. Am J Obstet Gynecol . 1993 Aug.169 (2 Pt 1): 317-21; обсуждение 321-3. [Медлайн].
1993 Aug.169 (2 Pt 1): 317-21; обсуждение 321-3. [Медлайн].
Seror J, Allouche C, Elhaik S. Использование трубки Сенгстакена-Блейкмора при массивном послеродовом кровотечении: серия из 17 случаев. Acta Obstet Gynecol Scand . 2005 июль 84 (7): 660-4. [Медлайн].
Ахтер С., Бегум М.Р., Кабир З., Рашид М., Лайла Т.Р., Забин Ф. Использование презерватива для остановки массивного послеродового кровотечения. МедГенМед . 2003 11 сентября. 5 (3): 38. [Медлайн].
Brees C, Hensleigh PA, Miller S, Pelligra R. Надувная противошоковая одежда от акушерского кровотечения. Int J Gynaecol Obstet . 2004 ноябрь 87 (2): 119-24. [Медлайн].
Johanson R, Kumar M, Obhrai M, Young P. Ведение массивного послеродового кровотечения: использование гидростатического баллонного катетера во избежание лапаротомии.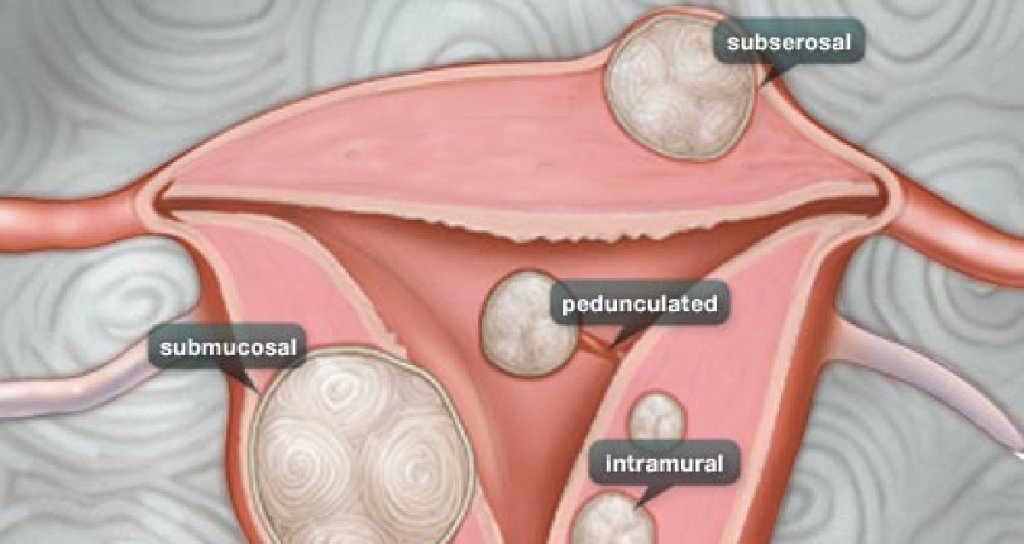 BJOG . 2001 апр. 108 (4): 420-2. [Медлайн].
BJOG . 2001 апр. 108 (4): 420-2. [Медлайн].
Propst AM, Thorp JM Jr.Травматические гематомы вульвы: консервативное против хирургического лечения. Южный Мед J . 1998 Февраль 91 (2): 144-6. [Медлайн].
Лингам К., Худ V, Карти МДж. Ангиографическая эмболизация при лечении тазовых кровотечений. BJOG . 2000 Сентябрь 107 (9): 1176-8. [Медлайн].
Stanco LM, Schrimmer DB, Paul RH, Mishell DR Jr. Экстренная околородовая гистерэктомия и связанные с ней факторы риска. Am J Obstet Gynecol . 1993 Март.168 (3, п.1): 879-83. [Медлайн].
Zelop CM, Harlow BL, Frigoletto FD Jr, Safon LE, Saltzman DH. Экстренная послеродовая гистерэктомия. Am J Obstet Gynecol . 1993 Май. 168 (5): 1443-8. [Медлайн].
Plauche WC. Перипартальная гистерэктомия. Plauche WC, Morrison JC, O’Sullivan MJ, ред. Хирургическое акушерство . Филадельфия, Пенсильвания: У. Б. Сондерс; 1992. 447-65.
О’Лири JA. Перевязка маточной артерии при посткесарева сечении. Дж Репрод Мед . 1995 г., 40 (3): 189-93. [Медлайн].
AbdRabbo SA. Поэтапная деваскуляризация матки: новый метод лечения неконтролируемого послеродового кровотечения с сохранением матки. Am J Obstet Gynecol . 1994 Сентябрь 171 (3): 694-700. [Медлайн].
Флойд Р.К., Моррисон Дж. Послеродовое кровотечение. Plauche WC, Morrison JC, O’Sullivan MJ, ред. Хирургическое акушерство . Филадельфия, Пенсильвания: У. Б. Сондерс; 1992. 373-82.
Vedantham S, Goodwin SC, McLucas B, Mohr G.Эмболизация маточной артерии: недостаточно используемый метод контроля тазовых кровотечений. Am J Obstet Gynecol . 1997 Apr.176 (4): 938-48. [Медлайн].
Пелаж Дж. П., Ле Дреф О, Матео Дж. И др. Угрожающее жизни первичное послеродовое кровотечение: лечение экстренной селективной артериальной эмболизацией. Радиология . 1998, август, 208 (2): 359-62. [Медлайн].
Пак Х.С., Шин Дж. Х., Юн Х. К. и др. Транскатетерная артериальная эмболизация при вторичном послеродовом кровотечении: результат у 52 пациентов в едином специализированном специализированном центре. J Vasc Interv Radiol . 2014, 27 июня. [Medline].
B-Lynch C, Coker A, Lawal AH, Abu J, Cowen MJ. Хирургическая техника B-Lynch для остановки массивного послеродового кровотечения: альтернатива гистерэктомии? Сообщается о пяти случаях. Br J Obstet Gynaecol . 1997 Mar.104 (3): 372-5. [Медлайн].
Price N, B-Lynch C. Техническое описание шовной нити B-Lynch для лечения массивного послеродового кровотечения и обзор опубликованных случаев.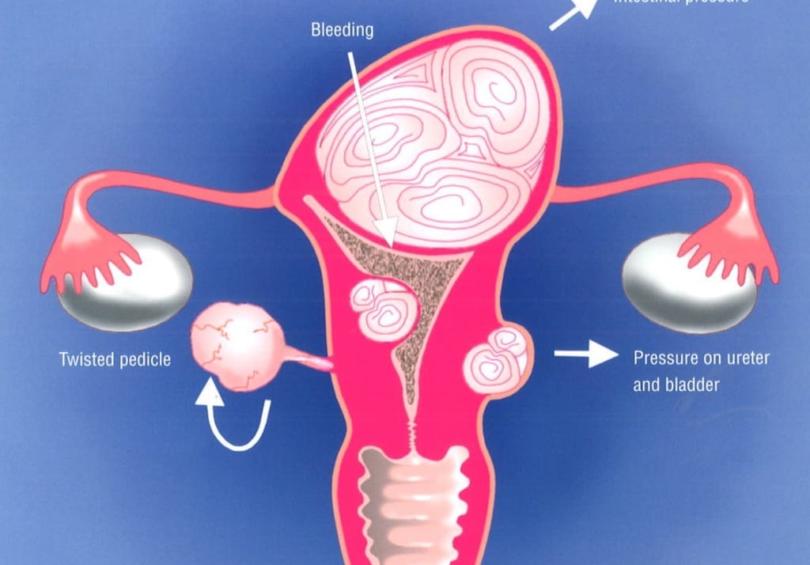 Int J Fertil Womens Med . 2005 июль-август. 50 (4): 148-63. [Медлайн].
Int J Fertil Womens Med . 2005 июль-август. 50 (4): 148-63. [Медлайн].
Hayman RG, Arulkumaran S, Steer PJ. Компрессионные швы матки: хирургическое лечение послеродового кровотечения. Акушерский гинекол .2002 Март 99 (3): 502-6. [Медлайн].
Cho JH, Jun HS, Lee CN. Гемостатическая техника наложения швов при маточном кровотечении при кесаревом сечении. Акушерский гинекол . 2000 Июль 96 (1): 129-131. [Медлайн].
Дилди GA 3-й. Послеродовое кровотечение: новые возможности лечения. Clin Obstet Gynecol . 2002 июн. 45 (2): 330-44. [Медлайн].
Anorlu RI, Maholwana B, Hofmeyr GJ. Способы доставки плаценты при кесаревом сечении. Кокрановская база данных Syst Rev . 16 июля 2008 г. (3): CD004737.
Descargues G, Douvrin F, Degre S, Lemoine JP, Marpeau L, Clavier E. Аномальная плацентация и избирательная эмболизация маточных артерий. евро J Obstet Gynecol Reprod Biol . 2001 ноябрь 99 (1): 47-52. [Медлайн].
Кук Д.И., Рив Б.К., Гайатт Г.Х. и др. Профилактика стрессовой язвы у тяжелобольных. Устранение противоречивых метаанализов. JAMA . 1996 24-31 января. 275 (4): 308-14. [Медлайн].
Smaill FM, Гривелл, РМ. Профилактика антибиотиками по сравнению с отсутствием профилактики для предотвращения инфекции после кесарева сечения.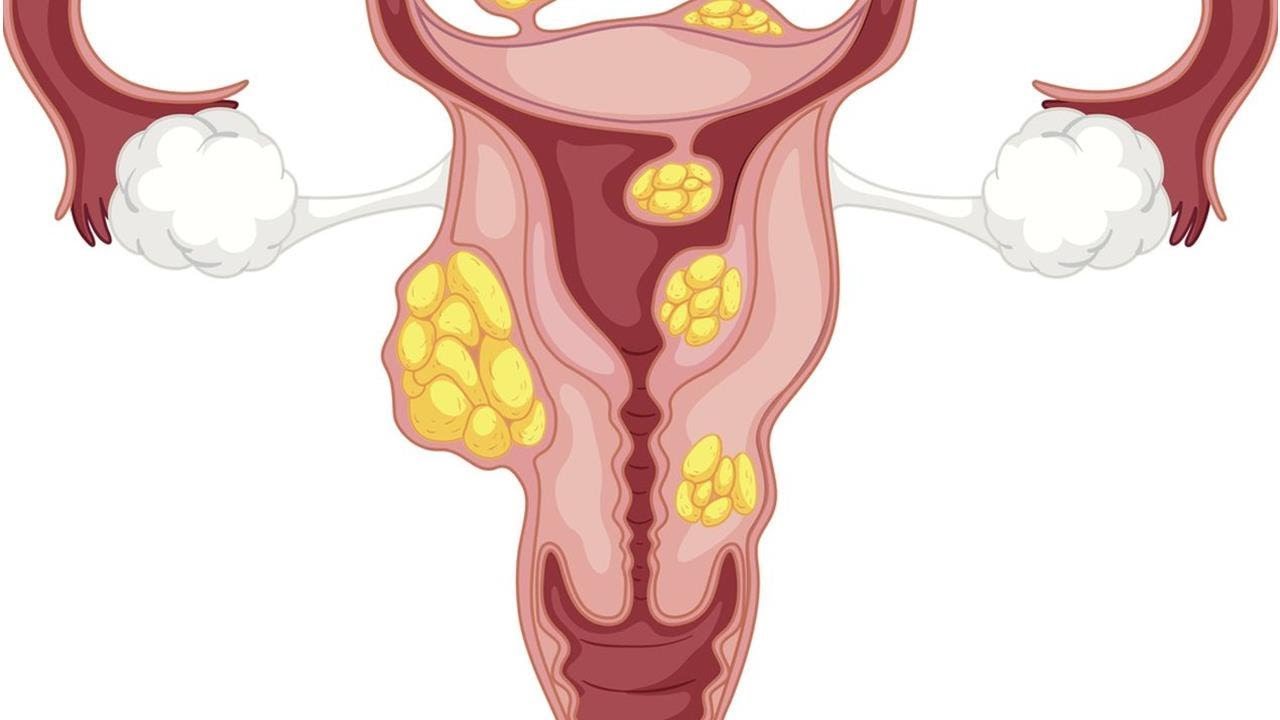 Кокрановская база данных Syst Rev .2014 28 октября. CD007482. [Медлайн].
Кокрановская база данных Syst Rev .2014 28 октября. CD007482. [Медлайн].
Комитет по практическим бюллетеням-акушерству. Практический бюллетень № 183: Послеродовое кровотечение. Акушерский гинекол . 2017 Октябрь 130 (4): e168-e186. [Медлайн].
Gallos ID, Williams HM, Price MJ, Merriel A, Gee H, Lissauer D, et al. Утеротонические агенты для предотвращения послеродового кровотечения: сетевой метаанализ. Кокрановская база данных Syst Rev . 2018 25 апреля. 4: CD011689. [Медлайн].
Видмер М., Пьяджио Г., Нгуен ТМХ и др. Термостабильный карбетоцин в сравнении с окситоцином для предотвращения кровотечения после вагинальных родов. N Engl J Med . 2018 27 июня. [Medline].
Послеродовое кровотечение — AMBOSS
Последнее обновление: 20 ноября 2020 г.
Резюме
Послеродовое кровотечение (ПРК) — это неотложная акушерская помощь, которая определяется как кровопотеря ≥ 1000 мл или кровопотеря с признаками или симптомами гиповолемии в течение 24 часов. часы доставки.Это причина номер один материнской заболеваемости и смертности во всем мире. ПРК обычно ассоциируется с симптомами гиповолемии. Начало может быть в пределах от 24 часов (первичное ПРК) до 12 недель после родов (вторичное ПРК). Наиболее серьезными причинами послеродового кровотечения являются атония матки, родовая травма матери, патологическое отделение плаценты, прикрепление бархатистой пуповины и нарушения свертывания крови. Клинические данные связаны с объемом кровопотери и могут включать анемию (например, головокружение, бледность) или гиповолемический шок (напр.г., артериальная гипотензия, тахикардия). Диагноз ставится на основе раннего распознавания клинических проявлений, систематической оценки наиболее частых причин и, в некоторых случаях, подтверждается ультразвуком.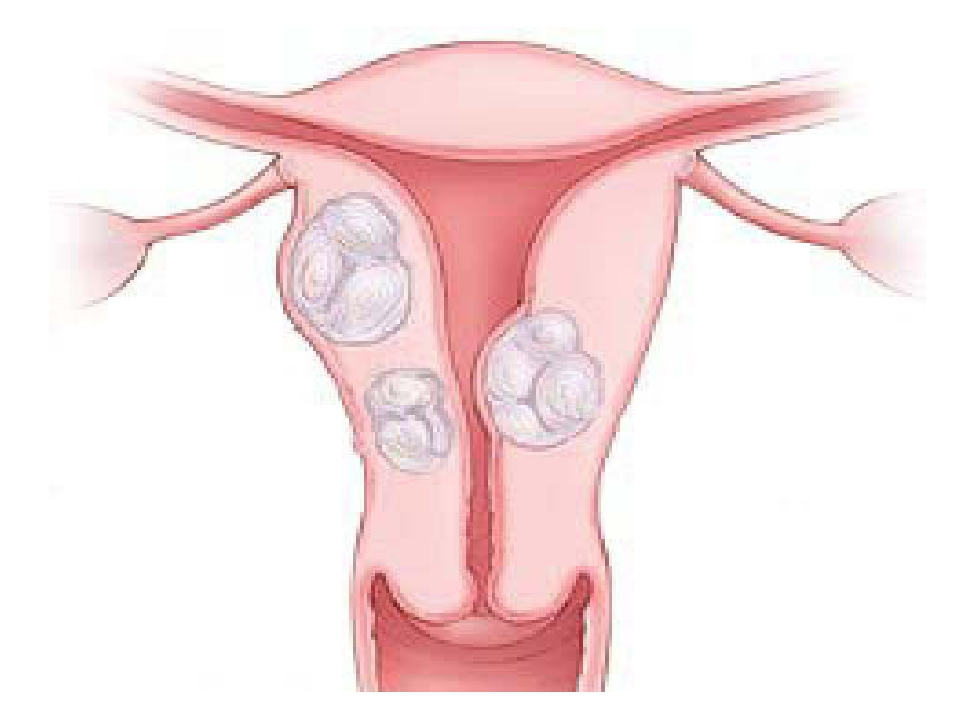 Лечение зависит от основного состояния и может включать общие меры по контролю кровопотери и поддержанию адекватной перфузии жизненно важных органов, ушивание кровоточащих ран, активное ведение третьего периода родов, например, маневры, помогающие отделить плаценту, и использование утеротонических средств. при атонии матки.Гистерэктомия часто рассматривается как последнее средство при неконтролируемом послеродовом кровотечении.
Лечение зависит от основного состояния и может включать общие меры по контролю кровопотери и поддержанию адекватной перфузии жизненно важных органов, ушивание кровоточащих ран, активное ведение третьего периода родов, например, маневры, помогающие отделить плаценту, и использование утеротонических средств. при атонии матки.Гистерэктомия часто рассматривается как последнее средство при неконтролируемом послеродовом кровотечении.
Обзор
Определения
[1]Кровопотеря ≥ 1000 мл или кровопотеря с признаками или симптомами гиповолемии в течение 24 часов после родов.
- Первичное ПРК: (наиболее часто) кровопотеря в течение 24 часов после родов.
- Вторичное послеродовое кровотечение: кровопотеря от 24 часов до 12 недель после родов
- Основная причина материнской смертности во всем мире
- Прибл.У 5% акушерских пациентов возникают ПРК.

- PPH составляет 12% материнской смертности в США.
Этиология
[1]Клинические особенности
Диагноз
Ведение
- Общие меры: для контроля кровопотери и обеспечения перфузии жизненно важных органов
- Хирургические процедуры: в случае неконтролируемого кровотечения
Профилактика
[1] [3]Осложнения
[2]Причины послеродового кровотечения включают 4 фактора: Тонус (атония матки), Травма ( е.g., разрыв, выворот матки), ткань (задержка плаценты), тромбин (кровоточащий диатез).
Атония матки
Определение
- Неспособность матки эффективно сокращаться после полного или неполного родов плаценты, что может привести к тяжелому послеродовому кровотечению из сосудов миометрия
- Наиболее частая причина случаев ПРК (примерно 80%) [1]
Патофизиология
- Обычно миометрий сокращается и сжимает спиральные артерии, что останавливает кровотечение после родов.

- Неспособность миометрия эффективно сокращаться может привести к быстрому и сильному кровотечению.
Клинические особенности
[1] [5]Диагноз
- Бимануальное исследование таза после опорожнения мочевого пузыря
- Исследование влагалища и шейки матки с помощью зеркала для оценки возможных источников внематочного кровотечения (например, травмы влагалища во время родов)
Лечение
[1] [2] [4] [5]Осложнения
Выворот матки
Определение
- Экстренная акушерская помощь, при которой дно матки коллапсирует в полость эндометрия, частично или полностью выворачивая матку наизнанку после родов через естественные родовые пути.

Патофизиология
- Частичное расслабление стенки матки → выпадение стенки матки через шейное отверстие → при одновременном вытяжении матки вниз → инверсия матки
Типы
Зависит от тяжести инверсии [7]
Клинические особенности
Диагноз
- См. «Клинические особенности» выше.
- Ультразвук
- Подтверждает диагноз в неопределенных случаях
- Гиперэхогенное образование во влагалище с центральной гипоэхогенной полостью
Лечение
Общие меры и немедленная ручная репозиция матки должны выполняться одновременно. [7]
- Общие меры: См. «Управление» в разделе «Обзор» выше.
- Перемещение матки вручную
- Техника [1] [3]
- После успешного перемещения матки: окситоцин для стимуляции извлечения плаценты и предотвращения реверсии
- Если невозможно: введите миорелаксант (например, MgSO 4 , или тербуталин)
- При неэффективности: хирургическое вмешательство
Осложнения
Аномальное отделение плаценты
Определение
Эпидемиология
- Прибл.
 3% вагинальных родов [9]
3% вагинальных родов [9]
Этиология
Классификация
- Приросшая плацента: плацента, которая не отделяется из-за недостаточных сокращений матки (например, атония матки)
- Захват плаценты: отслоение плаценты, которая не может родиться спонтанно или с помощью легкого тракции за пуповину из-за закрытия шейки матки
Факторы риска
Клинические особенности
Диагноз
Лечение
- Общие меры: См. «Управление» в разделе «Обзор» выше.
- Активное ведение третьего периода родов: см. «Профилактика» в разделе «Обзор» выше.
- Ручное удаление плаценты
- Рассмотрите возможность введения нитроглицерина.
- Выполнять под адекватной регионарной или общей анестезией.
- Принимать профилактические антибиотики.
- Техника
- Сожмите пальцы и используйте край руки, чтобы освободить пространство между плацентой и стенкой матки, чтобы полностью отделить плаценту.

- После отделения плаценты выньте руку из матки, унося с собой плаценту.
- Другой рукой выполните противодействие глазному дну, толкая его в направлении, противоположном руке, удаляющей плаценту.
- Сожмите пальцы и используйте край руки, чтобы освободить пространство между плацентой и стенкой матки, чтобы полностью отделить плаценту.
- Хирургическое лечение
- Показано в случаях, когда ручное удаление не удается
- Предпочтительный метод: отсасывающий кюретаж (связанный с риском перфорации матки)
- Тампонада или тампонада маточного баллона: если сильное кровотечение сохраняется
Определение
Эпидемиология
Классификация
В зависимости от глубины имплантации трофобласта в стенку матки [12]16 9 Патология 554 [12]16 9 ] Любое предшествующее повреждение эндометрия Типы аномального прикрепления плаценты: Аккрета плаценты «прикрепляется» к миометрию, врастающая плацента «проникает» в миометрий, а перкрета плаценты «проникает» в миометрий. Меры по сохранению матки относительно противопоказаны при приросшей плаценте из-за высокой материнской смертности! Были описаны следующие два механизма [19] 1. Knight M,
Каллаган ВМ,
Берг С,
и другие.Тенденции послеродовых кровотечений в странах с высокими ресурсами: обзор и рекомендации Международной совместной группы по послеродовым кровотечениям. 2. Скажите L,
Чжоу Д,
Геммилл А,
и другие.
Глобальные причины материнской смертности: систематический анализ ВОЗ. Ланцетный шар Здоровье .
2014; 2 (6): e323 – e333. 3. Кларк SL,
Белфорт М.А.,
Дилди GA,
Herbst MA,
Мейерс Дж. А.,
Хэнкинс Г.Д.Материнская смерть в 21 веке: причины, профилактика и связь с кесаревым сечением. Am J Obstet Gynecol .
2008; 199 (1): 36.e136.e5. 4. Менар МК,
Главный ЭК,
Currigan SM.
Краткое изложение инициативы reVITALize: стандартизация определений акушерских данных. Акушерский гинекол .
2014. 124 (1): 150–153. 5. Американский колледж акушеров и гинекологов. Определения акушерских данных (версия 1.0). Оживить. https://www.acog.org/-/media/Departments/Patient-Safety-and-Quality-Improvement/2014reVITALizeObstetricDataDefinitionsV10. 6. Эвенсен А., Андерсон Дж. Глава J. Послеродовое кровотечение: третья стадия беременности. В: Leeman L, Quinlan J, Dresang LT, ред. Продвинутое жизнеобеспечение в акушерстве: учебный план. 5-е изд. Ливуд, Кан .: Американская академия семейных врачей; 2014. 7. Руководящие принципы и комитет по аудиту Королевского колледжа акушеров и гинекологов.Профилактика и лечение послеродового кровотечения. https://www.rcog.org.uk/en/guidelines-research-services/guidelines/gtg52/. По состоянию на 23 марта 2017 г. [обновлено] 8. Mousa HA,
Блюм Дж.
Abou El Senoun G,
Шакур Х,
Альфиревич З.
Лечение первичного послеродового кровотечения. Кокрановская база данных Syst Rev .
2014; (2): CD003249. 9. Маганн Э.Ф.,
Эванс С,
Хатчинсон М,
Коллинз Р.,
Говард BC,
Моррисон JC.Послеродовое кровотечение после естественных родов: анализ факторов риска. South Med J . 10. Совет по безопасности пациентов при охране здоровья женщин. Связка безопасности пациента при акушерском кровотечении. http://safehealthcareforeverywoman.org/patient-safety-bundles/obstetric-hemorrhage/ [требуется вход в систему]. По состоянию на 16 октября 2016 г. 11. Begley CM,
Gyte GML,
Деван Д,
Макгуайр В,
Недели А.
Активная тактика по сравнению с выжидательной тактикой у женщин в третьем периоде родов. Кокрановская база данных Syst Rev .
2015; (3): CD007412. 12. Tunçalp Ö,
Хофмейр Г.Дж.,
Гюльмезоглу AM.
Простагландины для предотвращения послеродового кровотечения. Кокрановская база данных Syst Rev .
2012; (8): CD000494. 13. Комитет акушерской практики. Мнение комитета нет. 529: приросшая плацента. Акушерский гинекол .
2012; 120 (1): 207–211. 14. Главный ЭК,
Гоффман Д.,
Scavone BM,
и другие. 15. Deneux-Tharaux C,
Sentilhes L,
Майяр Ф,
и другие.
Влияние рутинного контролируемого тракции за пуповину в рамках активного ведения третьего периода родов на послеродовое кровотечение: многоцентровое рандомизированное контролируемое исследование (TRACOR) [опубликованные исправления появляются в BMJ.2013; 347: f6619 и BMJ. 2013; 346: f2542]. BMJ .
2013; 346: f1541. 16. Westhoff G,
Коттер А.М.,
Толоса JE.
Профилактический прием окситоцина в третьем периоде родов для предотвращения послеродового кровотечения. Кокрановская база данных Syst Rev . 17. Soltani H,
Хатчон Д.Р.,
Пулозе Т.А.
Сроки профилактического приема утеротоников в третьем периоде родов после вагинальных родов. Кокрановская база данных Syst Rev .2010; (8): CD006173. 18. Беллад М.Б.,
Тара Д,
Ганачари М.С.,
и другие.
Профилактика послеродового кровотечения с помощью мизопростола или окситоцина сублингвально: двойное слепое рандомизированное контролируемое исследование. БЖОГ .
2012; 119 (8): 975–982, обсуждение 982–986. 19. Хофмейр Г.Дж.,
Абдель-Алим Х,
Абдель-Алим МА.
Массаж матки для предотвращения послеродового кровотечения. Кокрановская база данных Syst Rev .2013; (7): CD006431. 20. Чен М.,
Чанг Q,
Дуан Т,
Он J,
Чжан Л.,
Лю X.
Массаж матки для уменьшения кровопотери после естественных родов: рандомизированное контролируемое исследование. 21. Хофмейр Г.Дж.,
Мшвешве NT,
Гюльмезоглу AM.
Контролируемое вытяжение за пуповину в третьем периоде родов. Кокрановская база данных Syst Rev .
2015; (1): CD008020. 22. Количественная оценка кровопотери: практическое задание AWHONN № 1. J Obstet Gynecol Neonatal Nurs .
2015; 44 (1): 158–160. 23. Американский колледж акушеров и гинекологов.
Послеродовое кровотечение при естественных родах. Контрольный список безопасности пациента № 10. Акушерский гинекол .
2013; 121: 1151–1152. 24. Соса К.Г.,
Althabe F,
Белизан Ю.М.,
Буекенс П.
Использование окситоцина на ранних стадиях родов и его влияние на активное ведение третьего периода родов. Am J Obstet Gynecol .
2011; 204 (3): 238.e1–238.e5. 25. ЖЕНЩИНЫ, соавторы исследования.
Влияние раннего введения транексамовой кислоты на смертность, гистерэктомию и другие заболевания у женщин с послеродовым кровотечением (ЖЕНЩИНЫ): международное рандомизированное двойное слепое плацебо-контролируемое исследование. 26. Carroli G,
Миннини Л.
Эпизиотомия при вагинальных родах. Кокрановская база данных Syst Rev .2009; (1): CD000081. 27. You WB,
Zahn CM.
Послеродовое кровотечение: ненормально прилегающая плацента, инверсия матки и послеродовые гематомы. Clin Obstet Gynecol .
2006. 49 (1): 184–197. 28. Корзина TF.
Острая инверсия матки: обзор 40 случаев. Банка J Obstet Gynaecol .
2002. 24 (12): 953–956. 29. Гильяно М.,
Шкаф E,
Терби Д,
LeGoueff F,
Деруэль П.,
Субтил Д.Признаки, симптомы и осложнения полного и частичного разрыва матки во время беременности и родов. Eur J Obstet Gynecol Reprod Biol .
2014. 179: 130–134. 30. Группа участников конференции по развитию консенсуса национальных институтов здравоохранения.
Заявление на конференции по развитию консенсуса Национального института здоровья: вагинальные роды после кесарева сечения: новые идеи 8–10 марта 2010 г. 31. Американский колледж акушеров и гинекологов.Практический бюллетень ACOG № 115: вагинальные роды после предыдущего кесарева сечения. Акушерский гинекол .
2010. 116 (2 ч. 1): 450–463. 32. Гиз Дж. М.,
МакДонах М.С.,
Остервейл П.,
Нигрен П.,
Чан Б.К.,
Гельфанд М.
Систематический обзор частоты и последствий разрыва матки у женщин, перенесших кесарево сечение. BMJ .
2004. 329 (7456): 19–25. 33. Маганн Э.Ф.,
Эванс С,
Чаухан СП,
Лано Г,
Фиск А.Д.,
Моррисон JC.Продолжительность третьего периода родов и риск послеродового кровотечения. Акушерский гинекол .
2005. 105 (2): 290–293. 34. Ву С,
Кочергинский М,
Hibbard JU.
Аномальная плацентация: анализ за двадцать лет. Am J Obstet Gynecol .
2005. 192 (5): 1458–1461. 35. Недели нашей эры. 36. Нардин Ю.М.,
Недели А,
Карроли Г.Инъекция в пупочную вену для лечения задержанной плаценты. Кокрановская база данных Syst Rev .
2011; (5): CD001337. 37. Güngördük K,
Асичиоглу О,
Бесимоглу Б,
и другие.
Использование инъекции окситоцина в пупковую вену в повседневной практике при активном ведении третьего периода родов: рандомизированное контролируемое исследование. Акушерский гинекол .
2010. 116 (3): 619–624. 38. Каннингем Ф.Г.,
Нельсон ДБ.Синдромы диссеминированной внутрисосудистой коагуляции в акушерстве. Акушерский гинекол .
2015; 126 (5): 999–1011. 39. Линдон А., Лагрю Д., Шилдс Л. Е., Мэйн Е, Кейп V. Улучшение медико-санитарной помощи при акушерском кровотечении. (Калифорнийский набор инструментов по качественному уходу за матерями для преобразования системы охраны материнства). 40. Neumar RW,
Шустер М,
Каллавей CW,
и другие.
Часть 1: Краткое содержание: Обновление рекомендаций Американской кардиологической ассоциации 2015 г. по сердечно-легочной реанимации и неотложной сердечно-сосудистой помощи. Тираж .
2015; 132 (18 приложение 2): S315 – S367. 41. Всемирная организация здравоохранения. Рекомендации ВОЗ по ведению послеродового кровотечения и задержки плаценты. http://apps.who.int/iris/bitstream/10665/44171/1/9789241598514_eng.pdf. По состоянию на 29 сентября 2016 г. 42. Grönvall M,
Тикканен М,
Талльберг Э,
Паавонен Дж.,
Стефанович В.
Использование баллонной тампонады Бакри при лечении послеродового кровотечения: серия из 50 случаев из специализированной больницы. 43. Американский колледж акушеров и гинекологов.
Бюллетень практики ACOG: руководство по клиническому ведению для акушеров-гинекологов № 76, октябрь 2006 г .: послеродовое кровотечение. Акушерский гинекол .
2006. 108 (4): 1039–1047. 44. Миллер С,
Мартин HB,
Моррис JL.
Противошоковая одежда при послеродовом кровотечении. Best Practices Clin Obstet Gynaecol .
2008. 22 (6): 1057–1074. 45. Робертс Н.П.,
Китчинер, штат Нью-Джерси,
Кенарди Дж.
Bisson JI.
Ранние психологические вмешательства для лечения симптомов острого травматического стресса. Кокрановская база данных Syst Rev .
2010; (3): CD007944. 46. Предупреждение материнской смертности. Jt Comm Perspect .
2010; 30 (3): 7–9. 47. Райли В,
Дэвис С.,
Миллер К,
Хансен Х,
Сайнфорт Ф,
Сладкий Р.
Дидактические и симуляционные групповые тренинги по нетехническим навыкам для улучшения перинатальных исходов для пациентов в общественной больнице. Jt Comm J Qual Безопасность пациента .
2011. 37 (8): 357–364. 48. Комитет американских акушеров и гинекологов по безопасности пациентов и повышению качества.Мнение комитета нет. 590: подготовка к неотложной медицинской помощи в акушерстве и гинекологии. Акушерский гинекол .
2014. 123 (3): 722–725. 49. Maughan K,
Хайм SW,
Галазка СС.
Профилактика послеродового кровотечения: ведение третьего периода родов. Врач Фам .
2006. 73 (6): 1025–1028. 50. Андерсон Дж. М.,
Офорт Д.
Профилактика и лечение послеродового кровотечения. Врач Фам .2007. 75 (6): 875–882. Послеродовое кровотечение (ПРК) — любое чрезмерное кровотечение после родов. Это происходит примерно в 5% всех поставок. До 25% всех смертей, связанных с беременностью, напрямую связаны с кровотечением. Это самая частая причина материнской смертности во всем мире. ПРК традиционно определяется как кровопотеря, превышающая 500 мл при естественных родах или более 1000 мл при кесаревом сечении. Однако, как практикующие, мы плохо справляемся с оценкой кровопотери, поэтому мы должны поддерживать повышенное внимание к этому серьезному осложнению при каждом родах. Кровоизлияние не обязательно должно быть внезапным массивным; даже устойчивое умеренное кровотечение может привести к серьезной гиповолемии. Быстрое распознавание ПРК, а также определение его причины и начало лечения позволяют избежать серьезных заболеваемости и смертности. Хотя многие факторы риска связаны с ПРК, это часто происходит без предупреждения. Поэтому в больницах, оказывающих акушерскую помощь, должны быть внедрены протоколы лечения послеродовых кровотечений и протокол массового переливания крови. Основные причины раннего ПРК: Атония матки (наиболее частая) Факторы риска: длительные роды, чрезмерно растянутая матка (многоплодная беременность, крупный ребенок или многоводие), использование окситоцина, послеродовые кровотечения в анамнезе, эпизиотомия, преэклампсия, оперативные роды, хориоамнионит и азиатская или латиноамериканская национальность. Разрывы Факторы риска: оперативные роды через естественные родовые пути, неправильное предлежание, макросомия плода, эпизиотомия, преждевременные роды, предварительная установка серкляжа, разрезы Дюрссена и дистоция плеча. Задержка плаценты Факторы риска: роды в середине триместра, хориоамнионит и добавочные доли плаценты. Другие причины: Выворот матки Факторы риска: чрезмерное растяжение матки, длительные роды, макросомия плода, инвазивная имплантация, короткая пуповина, применение окситоцина. Разрыв матки Факторы риска: предшествующая операция на матке (чаще всего кесарево сечение), тупая травма живота, внутренняя подалическая версия, удаление тазового предлежания, затрудненное введение щипцов, использование маточно-тонических средств у пациенток с высоким паритетом. Инвазивная имплантация (приращение плаценты, приращение, перкрета). Факторы риска: ранее перенесенное кесарево сечение или другие операции на матке, предлежание плаценты, возрастающее число детей, пожилой возраст матери. Раннее или первичное послеродовое кровотечение происходит в первые 24 часа после родов, и диагноз ставится клинически путем выявления чрезмерного кровотечения после родов. Врачи и медперсонал, занятый в родах, должны иметь навыки точной оценки кровопотери и четко осознавать, что продолжающееся кровотечение после родов требует быстрой оценки и лечения. После диагностики ПРК необходимо определить причину. Дифференциальный диагноз этиологии раннего ПРК включает: Атония матки Разрывы Задержка плаценты Выворот матки Разрыв матки Осмотр — ключ к выявлению этиологии.Бимануальное исследование органов малого таза позволит выявить атонию матки. Ручное исследование матки может выявить задержку плацентарной ткани. Необходим тщательный осмотр, чтобы найти порезы шейки матки и влагалища. Выворот матки диагностируется путем пальпации образования внутри шейки матки или через нее. Клиническое подозрение и факторы риска, такие как предшествующая хирургическая операция на матке, важны для диагностики разрыва матки. Необходимо быстро разобраться с дифференциальными причинами и быстро начать лечение. Хотя 10% снижение гемоглобина или гематокрита также использовалось для определения ПРК, это не всегда отражает текущее состояние пациента по мере продолжения кровотечения.Кроме того, у пациента может возникнуть серьезная декомпенсация за время, необходимое для получения результатов лабораторных исследований. Другие признаки и симптомы, такие как головокружение, бледность, гипотензия, тахикардия и олигурия, добавляют к диагнозу, но они могут появиться только поздно, когда истощается 15-20% или более объема крови. Позднее или вторичное послеродовое кровотечение происходит между 24 часами и 6 неделями после родов и встречается примерно у 1% женщин в послеродовом периоде. Чаще всего кровотечение возникает между 8 и 14 днями после родов. Общие причины включают: аномальную инволюцию участка плаценты, задержку плацентарной ткани, инфекцию и наследственные дефекты свертывания крови.Когда кровотечение происходит между 2-5 днями после родов, болезнь фон Виллебранда является одной из наиболее частых причин. Физикальное обследование и ультразвуковое исследование помогают определить причину. При субинволюции плаценты при осмотре матка обычно больше и мягче, чем можно было бы ожидать. Пустая полость матки на УЗИ будет указывать на субинволюцию плацентарного участка, которую следует лечить иначе, чем задержанные продукты, что можно идентифицировать путем идентификации утолщенной полосы или эхогенного материала в полости матки на УЗИ. Однако иногда бывает трудно отличить тромбы от ткани на УЗИ. Осмотр также полезен, так как расширенная шейка матки заставляет подозревать наличие задержанных продуктов зачатия. Кроме того, болезненность матки вместе с лихорадкой указывает на инфекцию как на этиологию. Заражение может быть вызвано оставшимися продуктами. Если кровотечение продолжается без выявления одной из очевидных общих причин или если стандартные методы лечения неэффективны, следует рассмотреть возможность коагулопатии.Диссеминированная внутрисосудистая коагулопатия (ДВС-синдром) может быстро развиться, если ПРК остается нераспознанным, раннее лечение неэффективно или соответствующая реанимация не начата. У некоторых женщин также может быть недиагностированное нарушение свертываемости крови, такое как болезнь фон Виллебранда. Обычно у этих пациентов в анамнезе отмечалась меноррагия. Активное ведение третьего периода родов рекомендуется для снижения риска ПРК у всех женщин.Предпочтительным лекарством является окситоцин 10 единиц внутримышечно после введения в переднюю часть плеча. В качестве альтернативы можно использовать внутривенное вливание 20-40 единиц окситоцина в 1000 мл жидкости со скоростью 150 мл / час. Цель — остановить кровотечение и достичь гемостаза. В первую очередь используются наименее инвазивные методы; однако иногда для спасения жизни пациента может потребоваться немедленная гистерэктомия. Тактика лечения варьируется в зависимости от причины кровотечения, доступных вариантов лечения, состояния пациента и ее желания иметь детей в будущем.Часто необходим междисциплинарный подход. Лечение атонии матки Учитывая, что атония является наиболее частой причиной, необходимо быстро провести оценку и лечение: Опорожните мочевой пузырь. Выполните бимануальное исследование таза и массаж матки. Выполните ручное исследование матки для выявления задержанной плаценты. Если матка твердая, ищите порезы и зашивайте их. Если матка заболела и массаж не дал результатов, начать медикаментозную терапию утеротоническими средствами. Утеротоническая терапия: Инфузия окситоцина внутривенно: Обычно инициируется в виде внутривенного переливания крови после выхода плаценты. Доза: 10-80 единиц в 1000 мл раствора кристаллоидов для внутривенной инфузии. Маршрут: 1-я линия: IV; вторая строка: 10 ЕД внутримышечно или МЕ (внутриматочно). Частота: непрерывная внутривенная инфузия. Побочные эффекты: тошнота, рвота, гипотензия при быстром в / в введении неразбавленного раствора, водная интоксикация. Противопоказания: нет. Метилэргоновин (Methergine) Доза: 0,2 миллиграмма. Маршрут: 1-я линия: IM; вторая строка: МЕ или ПО. Периодичность: 2-4 часа. Побочные эффекты: артериальная гипертензия, артериальная гипотензия, тошнота, рвота. Противопоказания: артериальная гипертензия, преэклампсия. 15-метилпростагландин Доза: 0.25 миллиграммов. Маршрут: 1-я линия: IM; вторая строка: IU. Периодичность: 15-90 минут. Побочные эффекты: диарея, лихорадка, озноб, тошнота, рвота, головная боль, приливы. Противопоказания: астма, активное заболевание сердца, печени или почек. Мизопростол (Cytotec) Дозировка: 400-1000 мкг. Путь: 1-я линия: сублингвально, буккально или ректально; вторая строка: ПО. Частота: разовая доза Побочные эффекты: лихорадка, тахикардия Противопоказания: нет Если сильное кровотечение не проходит после начала основных этапов лечения (бимануальный массаж матки и прием утеротонических препаратов): ПОЗВОНИТЕ НА ПОМОЩЬ. Мобилизовать дополнительный медперсонал. Приобретите 2 капельницы большого диаметра. Начать внутривенную жидкостную реанимацию. Часто контролируйте жизненно важные функции. Контролировать диурез. Обратитесь за помощью к другому врачу ИЛИ активируйте команду по кровотечению (* см. Ниже) Сообщите анестезиологу о возможной необходимости хирургического вмешательства. Нарисуйте базовые лаборатории. Тип и кросс для крови. Переливание на основании кровопотери или клинических признаков и симптомов. Не ждите, пока лаборатория начнет переливание. Протоколы ведения ПРК и протокол массового переливания крови должны быть установлены во всех родильных отделениях и родильных отделениях. Доказательства подтверждают использование стандартных пакетов услуг с организованной мультидисциплинарной командой. Интегрированная группа специалистов по лечению кровотечений, состоящая из акушеров и хирургов, владеющих медицинскими и хирургическими методами, а также медсестер, анестезиологов, специалистов по трансфузиологии и реанимации, может снизить материнскую заболеваемость и смертность от акушерских кровотечений.Специальная тележка для кровотечения обеспечивает легкий доступ к оборудованию и лекарствам, необходимым для остановки кровотечения. Следующие шаги в лечении, если лекарства не работают Тампонада Тампонада матки может быть эффективным методом лечения кровотечения из-за атонии матки. Оказывая давление на стенку матки, кровотечение из эндометрия останавливается. Его можно использовать для замедления кровотечения в ожидании переливания продуктов крови или перевода в место хирургического вмешательства.Следует исключить разрывы и задержку плаценты. Марля Используйте длинную непрерывную марлю (Kerlix), а не несколько маленьких губок. Если нужно более одного рулона, концы нужно связать вместе. Начните с глазного дна и двигайтесь к зеву из стороны в сторону, избегая мертвого пространства, которое может скрыть кровотечение. Оставьте конец марли за пределами шейки матки. Не оставлять на месте более 24 часов. Рекомендуется использовать антибиотики широкого спектра действия для предотвращения инфекции, когда упаковка находится на месте. Тщательно контролируйте жизненно важные показатели, диурез и гемокрит на предмет признаков продолжающегося кровотечения. Воздушные шары Специально разработан как альтернатива тампонам полости матки при ПРК. Эти баллонные катетеры изготовлены из силикона и легко соответствуют форме матки. Они поставляются предварительно стерилизованными, и их легко вставить при минимальном обучении. Доказано, что они эффективны в 92% случаев. Воздушный шар Бакри. Максимальный объем заполнения: 500 мл. Система Ebb-Jetty (имеет маточный и вагинальный баллоны). Максимальный объем заполнения маточного баллона: 750 мл (обычно требуется менее 500 мл). Максимальный объем заполнения вагинального баллона: 300 мл. В качестве альтернативы можно использовать катетер Фолея или трубку Сенгстакена-Блейкмора. Баллон помещается в полость матки и закапывается стерильным физиологическим раствором для создания тампонады в полости матки; как правило, около 300 кубических сантиметров эффективно для остановки кровотечения. Оба производителя системы Bakri и Ebb-Jetty рекомендуют ультразвуковое исследование для подтверждения размещения. Дренажная трубка позволяет контролировать постоянное кровотечение. Промывка дренажного порта стерильным физиологическим раствором позволит удалить сгустки и предотвратить закупорку пробирки со сгустками крови. Не оставлять на месте более 24 часов. Пока баллон находится на месте, рекомендуется введение антибиотиков широкого спектра действия для предотвращения инфекции. Пациенты должны тщательно контролироваться на предмет продолжения кровотечения с установленным баллоном. Давление баллона вызовет боль, поэтому рекомендуется адекватное обезболивание. Хирургический менеджмент Используется, когда атония матки не поддается консервативному лечению. Рекомендуется вертикальный разрез кожи по средней линии для оптимизации воздействия. Техники: Перевязка артерий Уменьшить перфузию матки и кровотечение. Двусторонняя перевязка может контролировать кровотечение примерно в 85–90% случаев. Используйте шовный материал из хромового кетгута №0 или полигликолевой кислоты. Используйте пошаговый подход. Матка больше, чем маточно-яичниковая. Перевязка маточной артерии (швы О’Лири). Перевязка матки и яичников. Перевязка внутренней подвздошной (гипогастральной) артерии. Технически сложно. Не техника первой линии. Компрессионные швы B-Lynch Если сделать в течение 1 часа после начала ПРК, необходимость в гистерэктомии уменьшается. Эффективен при атонии матки, но не при кровотечении из приросшей плаценты. Используйте большой рассасывающийся шовный материал (хромовый кетгут №1 или №2). Зафиксируйте шов спереди на латеральном нижнем сегменте матки. Пропустите его над дном матки. Закрепите его на задней стенке матки, идя с той же стороны, что и передний шов, на другую сторону. Снова проведите над глазным дном. Анкер на стороне, противоположной первому стежку спереди. Плотно затяните концы нити и надежно завяжите их, чтобы сжать матку. Другое Множественные квадратные швы Удаляет пространство в полости матки за счет ушивания передней и задней стенок. Описаны другие вертикальные и поперечные методы сжатия матки. Гистерэктомия Он может спасти жизнь, и его применение не следует откладывать в случае опасного для жизни кровотечения. Эмболизация артерий Th Пациент должен быть гемодинамически стабильным. Кровотечение не должно быть чрезмерным. Необходимы мобилизация бригады радиологов и ангиографического кабинета. Может использоваться для предотвращения гистерэктомии при соблюдении вышеуказанных критериев или после гистерэктомии для остановки дальнейшего кровотечения. Рекомбинантный активированный фактор VII (rFVIIa). Успешно применяется не по назначению для лечения трудноизлечимых кровотечений, связанных с ПРК. Переменная доза: от 50 до 100 мкг / кг каждые 2 часа до достижения гемостаза. Обычно останавливает кровотечение через 10-40 минут после первой дозы. Фибриноген должен быть> 50 мг / дл, чтобы он работал (перед применением rFVIIa следует начать агрессивную терапию компонентами крови). Очень дорого. Обработка разрывов Если кровотечение продолжается, несмотря на адекватный тонус матки, следует подозревать разрыв. Необходимо провести тщательный осмотр. Используйте системный подход; начинаются с шейки матки и верхней части влагалища и прогрессируют ниже по направлению к нижней части влагалища, интроиту, промежности и вульве. Необходимы адекватная выдержка, ретракция и освещение. Ремонт рваных ран. Перемещение в операционную может потребоваться для лучшего обезболивания, воздействия, визуализации и расслабления таза. При необходимости вызвать помощь для отзыва. Ведение удержания плаценты Плацентарная ткань и оболочки могут оставаться в матке и препятствовать сокращению матки. Если атония не проходит, выполните ручное исследование матки. Оберните руку влажной марлей, чтобы облегчить удаление оставшихся фрагментов плаценты и мембран. Если ручное удаление не удается, необходимо провести выскабливание матки. Следует выполнять в операционной. Следует использовать большой тупой инструмент, такой как кюретка Банджо или кольцевые щипцы. Ультразвуковой контроль может облегчить удаление всех тканей и снизить риск перфорации. Лечение инверсии матки Относится к коллапсу дна матки в полость матки. Полная инверсия происходит, когда глазное дно выходит через зев шейки матки во влагалище. Причины: Чрезмерное натяжение пуповины плаценты, имплантированной в глазное дно. Давление дна матки в расслабленном состоянии. Факторы риска: Чрезмерное растяжение матки. Длительные роды. Макросомия плода. Инвазивная имплантация. Короткая пуповина. Использование окситоцина. Может возникнуть до или после отслойки плаценты. Диагноз ставится клинически: Внезапное начало обильного кровотечения. Пальпация дна матки в нижнем сегменте матки или во влагалище через зев шейки матки при бимануальном исследовании. Дно матки при пальпации живота отсутствует. Глубокое кровотечение и нестабильность материнской гемодинамики могут произойти быстро. Требуется быстрое вмешательство, несвоевременное лечение увеличивает материнскую смертность. Управление: Немедленно обратитесь за помощью. Медперсонал, другие врачи и персонал анестезиологов. Получите внутривенный доступ большого диаметра и начните жидкостную реанимацию. При необходимости давайте продукты крови для лечения гиповолемии. Если плацента отслоилась, ее глазное дно можно подтолкнуть пальцами и ладонью руки в направлении длинной оси влагалища для замены.Если это сделать нелегко, может потребоваться маточное расслабляющее средство. Если плацента все еще прикреплена, не удаляйте ее, пока не начнется жидкостная реанимация и не будет введено маточное расслабляющее средство. Если матка выпала за пределы влагалища, замените ее во влагалище. Средства, расслабляющие матку: Галогенированный анестетик Тербуталин Сульфат магния Нитроглицерин После удаления плаценты равномерное давление кулаком или жесткими пальцами используется для проталкивания глазного дна через шейку матки.Как вариант, плаценту можно оставить на месте и удалить после того, как матка вернется в нормальное положение. После замены расслабляющее средство прекращают и назначают утеротонические препараты. Наблюдайте за пациентом на предмет последующего переворота или продолжения кровотечения. Если замена вручную не удалась, требуется хирургическое вмешательство. Плотное сужающееся кольцо в матке обычно препятствует замене вручную. Были описаны две хирургические процедуры: Модель Хантингтона: с помощью зажимов захватывают глазное дно и с помощью вытяжения снизу вверх возвращают его в нормальное положение. Для облегчения тракции на глазное дно можно наложить глубокий шов. Дно можно одновременно подталкивать влагалищной рукой. The Haultain: Сужающее кольцо рассекается сзади, обнажая глазное дно, которое затем заменяется цифровым способом. До замены глазного дна используют расслабляющее средство. Лечение разрыва матки Чаще всего возникает в результате отделения рубца после кесарева сечения. Обычно признаки и симптомы проявляются до родов. Могут возникать как травматические, так и спонтанные разрывы матки без рубцов (см. Факторы риска в Разделе 2). Диагноз подозревается клинически, но ставится хирургическим путем. Управление: Хирургия Выбор восстановления отделения матки или гистерэктомии зависит от места разрыва, степени повреждения, а также от клинического состояния пациентки и ее стремления к фертильности в будущем. Ремонт расслоения матки. Освежить края рубца с последующим послойным ушиванием рассасывающимся швом. Гистерэктомия. Сильное кровотечение обычно лечат с помощью утеротоников или выскабливания, и лечение зависит от причины. Конечно, реанимацию жидкостью и продуктами крови следует проводить в зависимости от клинической ситуации.Может потребоваться гистерэктомия. Субинволюция участка плаценты Дано маточно-тонизирующее средство. Метилэргоновин 0,2 миллиграмма перорально каждые 4 часа в течение 24-48 часов или внутримышечно, если пациент не переносит перорально. Мизопростол 200 мкг перорально каждые 6 часов в течение 24-48 часов или 600-1000 мкг вагинально или ректально, если не переносится перорально. Окситоцин 20-40 единиц в 1000 мл лактатных рингеров в виде внутривенной инфузии или 10 единиц внутримышечно. Также назначается пероральный антибиотик, поскольку субинволюция может быть вызвана инфекцией. Доксициклин по 100 миллиграммов два раза в день в течение 7-10 дней. Если на УЗИ видны большие сгустки, можно выполнить нежный кюретаж. Если ультразвуковое исследование выявляет пустую полость, следует избегать выскабливания, так как это может усилить кровотечение из-за нарушения места имплантации плаценты. Задержка плацентарной ткани Показано отсасывание и мягкое выскабливание. Следует проявлять осторожность, поскольку стенка матки мягкая и ее легче проколоть. Может оказаться полезным ультразвуковое наблюдение. Можно рассмотреть возможность введения антибиотика, если у пациента также есть признаки инфекции. Чрезмерная кровопотеря, связанная с послеродовым кровотечением, может привести к гиповолемическому шоку. Из-за нормальных физиологических изменений беременности (увеличения объема крови) большинство женщин может компенсировать кровопотерю до 10% объема кровообращения.Женщины с тяжелой преэклампсией представляют собой уникальную проблему, поскольку их физиологическая адаптация изменяется; они не обладают защитным эффектом увеличения внутрисосудистого объема. Кроме того, вазоконстрикция может поддерживать кровяное давление в пределах нормы, что затрудняет оценку кровопотери. Когда кровопотеря приближается к 20% от объема, развиваются симптомы: тахикардия, тахипноэ, сужение пульсового давления и задержка наполнения капилляров. Если кровотечение продолжается, тахикардия и гипотензия усиливаются.В качестве защитного эффекта для поддержания сердечного выброса возникает периферическая вазоконстрикция, приводящая к снижению перфузии тканей. Это может привести к похолоданию конечностей и ишемическому повреждению почек, печени, сердца и мозга. Снижается диурез, и если внутрисосудистый объем не восполняется должным образом, наступает кардиогенный шок. Лечение ПРК включает замещение объема кристаллоидными растворами и упакованными эритроцитами (prbc). В то время как перекрестно подобранная кровь является предпочтительной, использование крови для экстренного высвобождения, либо O-отрицательной, либо специфической для типа, если тип известен, может спасти жизнь.Коагулопатия разведения (неотличимая от диссеминированной внутрисосудистой коагулопатии) может возникнуть в результате истощения тромбоцитов и факторов свертывания крови. При нарушении свертываемости еще больше усугубляется кровопотеря. Иногда истинная чахоточная коагулопатия может быть связана с ПРК. Лечение обеих коагулопатий одинаково: замещение факторов свертывания крови и тромбоцитов. Факторы свертывания заменяются свежезамороженной плазмой (СЗП) и криопреципитатом. СЗП также следует использовать, если фибриноген ниже 100 мг / дл или если протромбиновое и частичное тромбопластиновое время отклоняются от нормы.Больному с кровотечением следует назначить переливание тромбоцитов, если их уровень опускается ниже 50 000 мкл. Очищенные концентраты фибриногена, такие как RiaSTAP®, можно использовать для коррекции гипофибриногенемии, связанной с ПРК. Введение протокола массового переливания в родильных домах и родильных отделениях снизит заболеваемость и смертность, связанные со значительными ПРК. После активации свежезамороженная плазма и упакованные эритроциты предоставляются в соотношении 1: 1 или 1: 2 для переливания.Тромбоциты и криопреципитат вводятся через каждые 4-8 единиц prbc или по результатам лабораторных исследований. Этот цикл продолжается до тех пор, пока кровотечение не остановится и состояние пациента не стабилизируется. Послеродовой гипопитуитаризм (синдром Шихана) PPH, особенно связанное с длительной гипотонией и / или шоком, может привести к ишемии и некрозу гипофиза. Это может привести к потере функции гипофиза. В первую очередь отмечается нарушение выработки грудного молока. Другие симптомы включают: утомляемость, аменорею, выпадение лобковых и подмышечных волос и низкое кровяное давление.Недостаток адренокортикотропного гормона (АКТГ) может привести к надпочечниковой недостаточности, опасному для жизни состоянию. Симптомы могут не развиваться в течение многих лет после родов. Прием гормонов на протяжении всей жизни: эстроген, прогестерон, щитовидная железа и кортикостероиды являются основой терапии. Осложнения переливания крови включают: инфекцию, гемолитическую трансфузионную реакцию, острое повреждение легких, связанное с переливанием (TRALI). Инфекция: Риск бактериального заражения составляет менее 1 на миллион единиц, но уровень морали составляет 60%.Риск заражения вирусом иммунодефицита человека (ВИЧ) и гепатитом С составляет менее 1 на 2 миллиона единиц. Гепатит B имеет самый высокий риск передачи — менее 1 на 100 000 единиц. Гемолитическая трансфузионная реакция: Переливание несовместимой крови, обычно в результате административной ошибки, может привести к острому гемолизу, который может привести к ДВС-синдрому, острой почечной недостаточности и смерти. Сообщается, что его риск составляет примерно 1 из 14 000 переливаемых единиц. Острое повреждение легких, связанное с переливанием крови (TRALI): это опасное для жизни осложнение, характеризующееся тяжелой одышкой, гипоксией и некардиогенным отеком легких.Начало обычно наступает через 6 часов после переливания, но может произойти и спустя 72 часа. Его риск составляет 1 на 5000 переливаний. ПРК по-прежнему является ведущей причиной материнской заболеваемости в США. Введение протоколов лечения послеродового кровотечения может снизить смертность, связанную с кровотечением. Женщины, у которых было ПРК во время родов, подвержены риску повторного ПРК при последующих родах.Подготовка к следующим родам может снизить заболеваемость и смертность. Использование профилактических мер, таких как окситоцин внутримышечно или внутривенно, может снизить риск кровотечения. За исключением гистерэктомии, другие стандартные методы лечения послеродовых кровотечений не оказывают отрицательного воздействия на фертильность в будущем. «Руководство по клиническому ведению акушеров и гинекологов № 76. Октябрь 2006 г .: послеродовое кровотечение». Obstet Gynecol.. т. 108. 2006. С. 1039–47. (В нем изложены рекомендации ACOG по клиническому ведению практикующих акушеров-гинекологов.) Allams, MS, B-Lynch, C. «B-Lynch и другие техники наложения компрессионного шва на матку». Int J Gynaecol Obstet. т. 89. 2005. С. 236–41. (В этой статье представлены пошаговые инструкции по применению компрессионного шва B-Lynch, а также обсуждаются другие методы, а также важность компрессионных швов при лечении послеродового кровотечения.) Адиэль, Флейшер, Натали, Мейровиц. «Наборы для лечения акушерского кровотечения, семинары по перинатологии». т. 40. 2016. С. 99-108. (В общих чертах описаны комплексные меры по уходу, включая использование протоколов управления кровотечением и переливания, тележки для кровотечения и специализированных мультидисциплинарных бригад.) Кларк, SL. «Акушерское кровотечение». Семинары по перинатологии. т. 40. 2016. С. 109–111. (Доктор Кларк предлагает протокол лечения послеродового кровотечения, который может улучшить лечение и, возможно, снизить заболеваемость и смертность, связанные с ПРК.) Каннингем, Ф. Г., Левено, К. Дж., Блум, С. Л.. Акушерство Уильямса. 2010. (Эта статья представляет собой систематический обзор причин и методов лечения послеродового кровотечения.) Dildy, Джорджия. «Послеродовое кровотечение: новые возможности лечения». Clin Obstet Gynecol. т. 45. 2002. С. 330–44. (В этой статье обсуждаются дополнительные меры, такие как тампонирование таза, селективная артериальная эмболизация и сохранение клеток.) Doumouchtsis, SK, Papageorghiou, AT, Arulkumaran, S.«Систематический обзор консервативного лечения послеродового кровотечения: что делать, если лечение не помогает». Obstet Gynecol Surv. т. 62. 2007. С. 540-7. (В этой статье представлен подробный обзор баллонной тампонады, компрессионных швов, артериальной эмболизации и швов для перевязки артерий как методов лечения ПРК.) Габби, С. Г., Нибил, Дж. Р., Симпсон, Дж. Л. Акушерство: нормальная и проблемная беременность. 2007. (В этой главе представлена исчерпывающая информация о причинах и лечении ПРК, включая лечение диссеминированной внутрисосудистой коагулопатии и использование компонентов крови.) Leduc, D, Denidas, V, Lalonde, AB, Ballerman, C. «Активное ведение третьего периода родов: профилактика и лечение послеродового кровотечения». Банка J Obstet Gynaecol. т. 31. 2009. С. 980–93. (В этой статье обсуждается активное ведение третьего периода родов, которое является одной из истинных мер профилактики ПРК.) Mousa, HA, Walkinshaw, S. «Большое послеродовое кровотечение». Curr Opin Obstet Gynecol. т. 13. 2001. С. 595-603. (В этой статье описывается широкий спектр медицинских и хирургических вмешательств для лечения ПРК и подробно обсуждается объемная замена.) Сибай, БМ. «10 практических, основанных на фактах рекомендаций по ведению тяжелого послеродового кровотечения». OBG Manag. т. 23. 2011. С. 44-48. (В этом комментарии описаны научно обоснованные подходы к лечению ПРК, которые могут повлиять на результаты.) Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены. Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC.Лицензионный контент является собственностью DSM и защищен авторским правом. Гиповолемия — это уменьшение объема крови в организме, которое может быть вызвано кровопотерей или потерей биологических жидкостей. Кровопотеря может быть результатом внешних травм, внутреннего кровотечения или некоторых неотложных акушерских состояний. Диарея и рвота — частые причины потери жидкости организмом. Жидкость также может быть потеряна в результате больших ожогов, чрезмерного потоотделения или мочегонных средств.Недостаточное потребление жидкости также может вызвать гиповолемию. В начале гиповолемии ротовая полость, нос и другие слизистые оболочки пересыхают, кожа теряет эластичность, а диурез уменьшается. Первоначально тело компенсирует потерю объема за счет увеличения частоты сердечных сокращений, увеличения силы сердечных сокращений и сужения кровеносных сосудов на периферии, сохраняя при этом приток крови к мозгу, сердцу и почкам. При продолжающейся потере объема организм теряет способность к компенсации, и артериальное давление падает.В этот момент сердце не может перекачивать достаточно крови к жизненно важным органам для удовлетворения их потребностей, и может произойти повреждение тканей. Гиповолемический шок возникает, когда теряется пятая часть объема крови. Симптомы могут включать холодную липкую кожу, бледность, учащенное дыхание и частоту сердечных сокращений, слабость, снижение или отсутствие диуреза, потоотделение, беспокойство, спутанность сознания и потерю сознания. Гиповолемический шок — это неотложная медицинская помощь, требующая немедленного вмешательства. Лечение гиповолемии зависит от ее степени тяжести.В тяжелых случаях может потребоваться внутривенное введение жидкости и, возможно, переливание крови для быстрого увеличения объема крови. Лекарства могут использоваться для повышения артериального давления и стабилизации частоты сердечных сокращений и силы сердечных сокращений. Любая основная причина гиповолемии, такая как травма, также должна лечиться, чтобы предотвратить постоянную потерю жидкости. В некоторых случаях потеря жидкости в организме, например, вызванная рвотой и диареей, может быть устранена повышенным потреблением жидкости и предотвращена гиповолемия.Однако в других случаях потеря крови или жидкости может быть достаточно серьезной, чтобы потребовать медицинского вмешательства. Гиповолемический шок требует неотложной медицинской помощи. Обратиться за неотложной медицинской помощью (звоните 911) в случае серьезных симптомов, таких как сухость слизистых оболочек, потеря эластичности кожи, холодная и липкая кожа, бледность или бледность кожи, учащенное дыхание и частота сердечных сокращений, слабость, снижение или отсутствие диуреза, потливость, спутанность сознания или бессознательное состояние. Спонтанный разрыв матки встречается редко, по сообщениям частота 0.5% всех беременностей и катастрофических осложнений со значительной заболеваемостью и смертностью как для матери, так и для плода [2]. Предыдущие роды пациентки с помощью кесарева сечения были единственным основным фактором риска спонтанного разрыва матки при последующих беременностях [3]. Однако есть сообщения о разрывах матки без рубцов и даже у первородящих женщин [4, 5]. Более того, наиболее частые клинические проявления спонтанного разрыва матки, как описано в литературе, возникают во время активных родов.Однако имеется ограниченное количество сообщений об этом процессе, происходящем на ранних сроках беременности [6]. Когда разрыв матки действительно присутствует в течение первых триместров, он чаще всего наблюдается у женщин с рубцами на матке, вызванными предшествующими операциями на матке, или с основными физиологическими дефектами, такими как предсердная плацента. В этих случаях у пациентов могут быть дефекты миометрия и эндометрия, нарушающие анатомическую структурную целостность матки [7]. Низкая частота разрыва матки до третьего триместра, если рассматривать ее в контексте более распространенной этиологии шока во время беременности, такой как острая тромбоэмболия легочной артерии, часто смещает этот диагноз еще дальше, даже у пациентов с более тяжелым шоковым состоянием. клинически согласуется с основной гиповолемической этиологией.Однако, несмотря на то, что разрыв матки до третьего триместра случается редко, его следует учитывать при дифференциальной диагностике беременных уже во втором триместре [8]. Неудачный диагноз может привести к катастрофической заболеваемости и даже смерти как матери, так и плода. Современная литература, относящаяся к раннему разрыву матки до третьего триместра в условиях неотложной медицины, ограничена небольшим количеством сообщений о случаях [9, 10]. Вместе эти отчеты подчеркивают, насколько легко можно не заметить геморрагический шок в этой популяции пациентов с разрушительными последствиями.В одном из таких отчетов пациент с сильной клинической картиной геморрагического шока был отправлен на визуализацию тромбоэмболии легочной артерии, поскольку последний диагноз встречается чаще. У этого пациента впоследствии развилась остановка сердца вследствие отсроченной реанимации [11]. Многие отчеты демонстрируют неблагоприятный исход для матери, часто вторичный по отношению к ошибочному диагнозу в результате преследования других, казалось бы, более распространенных основных причин. В одном отчете описан ряд случаев с пациентами на сроке от 14 до 24 недель беременности.В каждом случае были ошибочно диагностированы инфекционные или другие негинекологические патологии, а не разрыв матки. В одном случае у пациентки на 14 неделе беременности с острой болью в животе после полового акта первичная гинекологическая патология была исключена после того, как внутриутробная беременность была подтверждена при прикроватном ультразвуковом исследовании. Лишь позже на вскрытии обнаружился разрыв матки. Во втором случае подозрение на острый гастроэнтерит с нарушением гемодинамики было позже обнаружено при лапаротомии, что на самом деле было разрывом матки.Исходы этих случаев убедительно свидетельствуют о необходимости учитывать и исключать эту патологию независимо от срока беременности [12]. В дополнительном отчете Sung etal описан случай пациентки на четырнадцатой неделе беременности, у которой возникла острая боль в животе. Как и в предыдущих случаях, раннее течение и подтверждение наличия внутриутробной беременности при ультразвуковом исследовании уводили команду от диагностики разрыва матки. Пациентка была отправлена на лапароскопию для оценки «аппендицита, холецистита и перитонита», когда случайно была обнаружена патология матки [13].Дополнительные сообщения о случаях дополнительно подчеркивают риск этой патологии в контексте подлежащей предсердной плаценты и аналогичным образом отстаивают высокий уровень подозрения на разрыв матки даже на ранних сроках беременности [14]. В дополнение к его клиническим последствиям, мы также выделяем этот случай из-за его уникальной роли в развитии нашего отделения на институциональном и национальном уровне. Экстренная медицина — это молодая специальность в Израиле, да и во многих странах мира.Несмотря на и, возможно, благодаря уже существующей сильной и устоявшейся системе здравоохранения в нашей стране, мы не спешили внедрять полностью интегрированную модель экстренной медицины в нашу более широкую структуру медицины и национального здравоохранения. Хотя наша специальность полностью признана Министерством здравоохранения, и мы стремительно развиваемся в клинической практике, медицинском образовании и исследованиях, наша больница в настоящее время является единственной в стране, где круглосуточно и без выходных работают -неделя, покрытие сертифицированными врачами скорой медицинской помощи. По сути, описанный выше случай относится к пациенту с недифференцированным компенсированным циркуляторным шоком. Само по себе шоковое состояние было чрезвычайно тонким, и для его идентификации требовались специалисты по реанимации, такие как наши сертифицированные специалисты по неотложной медицине. Кроме того, скрытый шок во время беременности может представлять собой широкий дифференциальный диагноз и лежащее в основе патологическое состояние, такое как тромбоэмболия легочной артерии, которое может не требовать лечения с помощью OBGYN. Следовательно, специалисты по диагностике, такие как врачи скорой помощи, представляют собой подходящую первую линию в оценке и правильной диагностике основного процесса заболевания.Наконец, после постановки диагноза часто требуется ранняя реанимация, чтобы позволить интервенционным специалистам, таким как врачи-акушеры, перейти к окончательному лечению. В свете вышеизложенного мы считаем, что интегрированная ЭМ-модель лечения, применяемая в нашей больнице, сыграла решающую роль в быстрой диагностике и ведении этого пациента. Уникальная картина этого пациента и необходимость как в экспертной реанимации, так и в скоординированном окончательном лечении продемонстрировали потребность в специалистах по неотложной медицине, работающих в полностью интегрированном отделении неотложной помощи.Общее время нашего пациента «от двери до ножа» составило 25 минут. В то время ее осмотрел сертифицированный врач скорой помощи, правильно опознал, несмотря на ее очень тонкую картину острого шока, как с помощью клинической экспертизы, так и с помощью прикроватной визуализации, реанимировали и отправили в скоординированную многопрофильную команду для окончательного лечения. Этот случай дает важное понимание как диагностики, так и лечения уникальной патологической картины, а также подчеркивает необходимость системного подхода к оказанию неотложной помощи.Клинически это подчеркивает необходимость поддержания широкого дифференциального диагноза беременной пациентки, у которой наблюдается острое заболевание даже на ранних стадиях беременности. Хотя обструктивный шок, вторичный по отношению к тромбоэмболии легочной артерии, должен быть тщательно рассмотрен, даже во втором триместре беременности нельзя упускать из виду гиповолемический шок с внутрибрюшным кровотечением, вторичным по отношению к маточной катастрофе. Кроме того, этот и другие подобные случаи специально подчеркивают уникальную роль, которую наша специальность играет в надлежащей диагностике, лечении и комплексном лечении пациентов с острыми заболеваниями.Поскольку область экстренной медицины продолжает развиваться во всем мире, эти типы случаев обеспечивают как внешнюю валидацию, так и внутреннее подтверждение нашей практической модели, и их следует продолжать выделять. В конечном итоге нарушение кровообращения у беременной пациентки на ранних сроках беременности представляет собой уникальную диагностическую и лечебную проблему для врачей отделения неотложной помощи из-за повышенной частоты обструктивного, кардиогенного и даже геморрагического шока. Разрыв матки — это акушерская катастрофа с чрезвычайно высокой заболеваемостью и смертностью, вызванная геморрагическим шоком, которую можно легко не заметить на ранних сроках беременности.Мы считаем, что этот случай подчеркивает необходимость того, чтобы врачи неотложной помощи рассмотрели эту нетипичную диагностическую картину из-за ее потенциальной заболеваемости и смертности, а также предоставили более глубокое понимание значимого воздействия, которое наш специализированный подход оказывает на развитие систем неотложной медицины. Послеродовое кровотечение — это обильное кровотечение после рождения ребенка. Примерно от 1 до 5 процентов женщин имеют послеродовое кровотечение, и это более вероятно при кесаревом сечении.Кровоизлияние чаще всего возникает после выхода плаценты. Средний объем кровопотери после рождения единственного ребенка при естественных родах составляет около 500 мл (или около половины литра). Средний объем кровопотери при кесаревом сечении составляет примерно 1000 мл (или одну кварту). В большинстве случаев послеродовые кровотечения возникают сразу после родов, но могут возникнуть и позже. После рождения ребенка матка обычно продолжает сокращаться (напряжение мышц матки) и изгоняет плаценту.После выхода плаценты эти сокращения помогают сжать кровоточащие сосуды в области прикрепления плаценты. Если матка сокращается недостаточно сильно, что называется атонией матки, эти кровеносные сосуды кровоточат свободно, и возникает кровотечение. Это наиболее частая причина послеродового кровотечения. Если небольшие кусочки плаценты остаются прикрепленными, возможно кровотечение. Некоторые женщины подвергаются большему риску послеродового кровотечения, чем другие. Состояния, которые могут увеличить риск послеродового кровотечения, включают следующее: Отслойка плаценты.Ранняя отслойка плаценты от матки. Предлежание плаценты. Плацента закрывает шейное отверстие или находится рядом с ним. Чрезмерно расширенная матка. Чрезмерное увеличение матки из-за слишком большого количества околоплодных вод или большого ребенка, особенно с массой тела при рождении более 4000 граммов (8,8 фунтов). Многоплодная беременность. Более одной плаценты и чрезмерное расширение матки. Гестационная гипертензия или преэклампсия.Повышенное артериальное давление при беременности. Многократные роды Длительные роды Инфекция Ожирение Лекарства для стимулирования родов Прекращение родов щипцов или вакуумных родов Общая анестезия Послеродовое кровотечение также может быть вызвано другими факторами, включая следующие: Разрыв шейки матки или тканей влагалища Разрыв крови в матке сосуд Кровотечение в скрытый участок ткани или пространство в тазу, которое развивается в гематому, обычно в области вульвы или влагалища Нарушения свертывания крови, такие как диссеминированная внутрисосудистая коагуляция Приросшая плацента.Плацента ненормально прикреплена к внутренней части матки (заболевание, которое возникает у одного из 2500 родов и чаще встречается, если плацента прикрепляется к предыдущему рубцу после кесарева сечения). Прирост плаценты. Ткани плаценты вторгаются в мышцу матки. Плацента percreta. Ткани плаценты проникают в мышцу матки и могут прорваться (разрыв). Разрыв матки, хотя и встречается редко, может быть опасен для жизни матери.Состояния, которые могут увеличить риск разрыва матки, включают операцию по удалению фиброидной (доброкачественной) опухоли и предшествующего кесарева сечения рубца. Предыдущий рубец на матке в верхней части дна имеет более высокий риск разрыва матки по сравнению с горизонтальным рубцом в нижнем сегменте матки, называемым нижним поперечным разрезом. Это также может произойти до родов и подвергнуть риску плод. Чрезмерная и быстрая кровопотеря может вызвать резкое падение кровяного давления у матери и, если не лечить, может привести к шоку и смерти. Ниже приведены наиболее частые симптомы послеродового кровотечения. Однако каждая женщина может испытывать симптомы по-разному. Симптомы могут включать: Неконтролируемое кровотечение Снижение артериального давления Повышение частоты сердечных сокращений Снижение количества эритроцитов (гематокрит) в тканях влагалища и область промежности, если кровотечение вызвано гематомой Симптомы послеродового кровотечения могут напоминать другие состояния или медицинские проблемы.Всегда консультируйтесь с врачом для постановки диагноза. В дополнение к полному анамнезу и физическому обследованию диагноз обычно основывается на симптомах, а лабораторные тесты часто помогают в постановке диагноза. Тесты, используемые для диагностики послеродового кровотечения, могут включать в себя: Оценка кровопотери (это может быть сделано путем подсчета количества пропитанных там подушечек или путем взвешивания пакетов и губок, используемых для впитывания крови; 1 миллилитр крови весит приблизительно один грамм. ) Измерение частоты пульса и артериального давления Гематокрит (количество эритроцитов) Факторы свертывания крови Специфическое лечение послеродового кровотечения будет назначено вашим врачом на основе: Ваша беременность, общее состояние здоровья и история болезни Степень заболевания Ваша переносимость определенных лекарств, процедур или методов лечения Ожидания относительно течения состояния Ваша мнение или предпочтение Цель лечения послеродового кровотечения rhage — как можно быстрее найти и остановить причину кровотечения.Лечение послеродового кровотечения может включать: Медикаменты (для стимуляции сокращений матки) Ручной массаж матки (для стимуляции сокращений) Удаление кусочков плаценты, оставшихся в матке Факторы риска
[13] 
Клинические особенности
Диагноз
[15] [16] Лечение
[1] Прогноз
[10] Родовая травма
Этиология
Клинические особенности
Лечение
[2] 9502
После естественных родов
 , массаж дна дна, жидкостная терапия, утеротоники)
, массаж дна дна, жидкостная терапия, утеротоники) Введение пуповинной нити
Определение
Патогенез
Клинические особенности
Диагноз
Лечение
Осложнения
Ссылки
 Практический бюллетень № 183: Послеродовое кровотечение. Акушерство и гинекология . 2017; 130
(4): p.e168-e186.
DOI: 10.1097 / aog.0000000000002351. | Открыть в режиме чтения QxMD
Практический бюллетень № 183: Послеродовое кровотечение. Акушерство и гинекология . 2017; 130
(4): p.e168-e186.
DOI: 10.1097 / aog.0000000000002351. | Открыть в режиме чтения QxMD Спектр приросшей плаценты: номер консенсуса по акушерской помощи 7. Американский журнал акушерства и гинекологии. . 2018; 132
(Декабрь 2018 г.): с.259–75.
Спектр приросшей плаценты: номер консенсуса по акушерской помощи 7. Американский журнал акушерства и гинекологии. . 2018; 132
(Декабрь 2018 г.): с.259–75. 75-87.
DOI: 10.1016 / j.ajog.2017.05.067. | Открыть в режиме чтения QxMD
75-87.
DOI: 10.1016 / j.ajog.2017.05.067. | Открыть в режиме чтения QxMD Последнее обновление: 22 ноября 2016 г. Дата обращения: 25 апреля 2017 г.
Последнее обновление: 22 ноября 2016 г. Дата обращения: 25 апреля 2017 г. Дата обновления . Уолтем, Массачусетс: UpToDate. http://www.uptodate.com/contents/reolated-placenta-after-vaginal-birth . Последнее обновление: 5 октября 2016 г. Дата обращения: 2 мая 2017 г.
Дата обновления . Уолтем, Массачусетс: UpToDate. http://www.uptodate.com/contents/reolated-placenta-after-vaginal-birth . Последнее обновление: 5 октября 2016 г. Дата обращения: 2 мая 2017 г. 2020 г.
.
2020 г.
. Дата обращения: 2 мая 2017 г.
Дата обращения: 2 мая 2017 г. Послеродовое кровотечение: профилактика и лечение
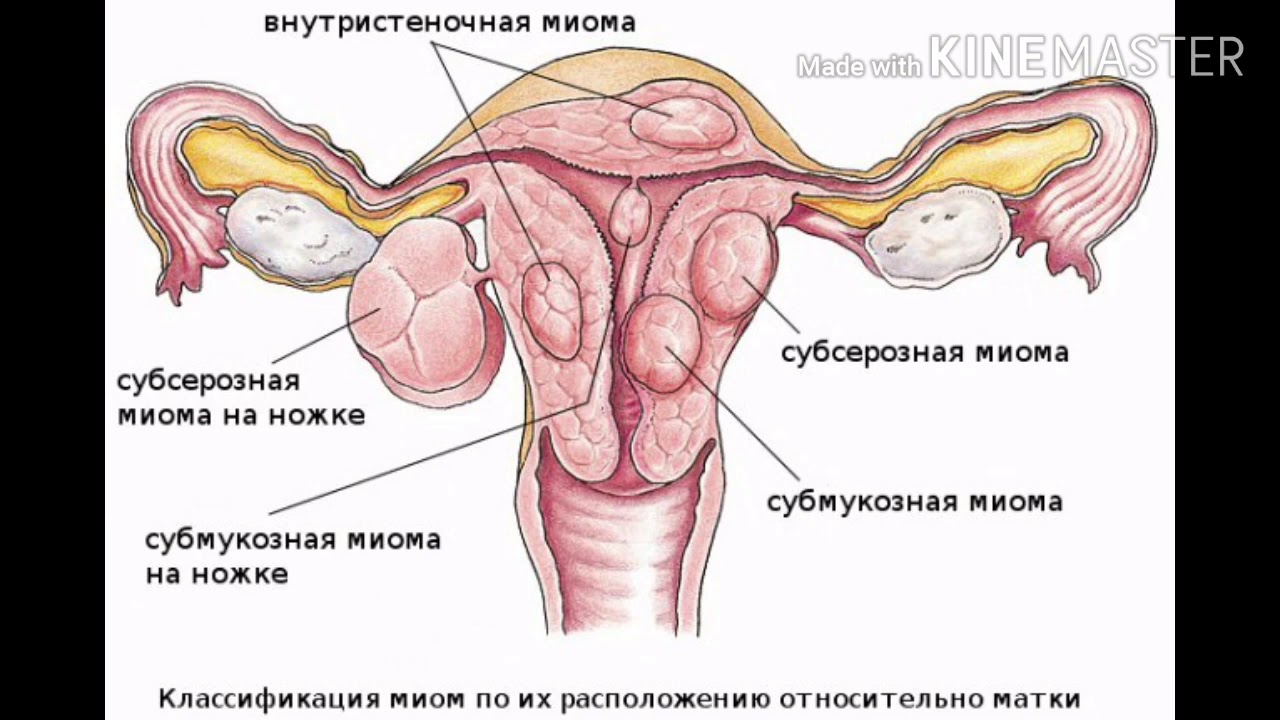 BMC Беременность и роды .
2009; 9: 55 ….
BMC Беременность и роды .
2009; 9: 55 …. pdf. На 2 октября 2016 г.
pdf. На 2 октября 2016 г. 2005. 98 (4): 419–422.
2005. 98 (4): 419–422. ;
Национальное партнерство по охране материнства; Совет по безопасности пациентов при охране здоровья женщин.
Национальное партнерство за материнскую безопасность: согласованный пакет по акушерскому кровотечению [опубликованное исправление опубликовано в Obstet Gynecol. 2015; 126 (5): 1111]. Акушерский гинекол .
2015; 126 (1): 155–162.
;
Национальное партнерство по охране материнства; Совет по безопасности пациентов при охране здоровья женщин.
Национальное партнерство за материнскую безопасность: согласованный пакет по акушерскому кровотечению [опубликованное исправление опубликовано в Obstet Gynecol. 2015; 126 (5): 1111]. Акушерский гинекол .
2015; 126 (1): 155–162.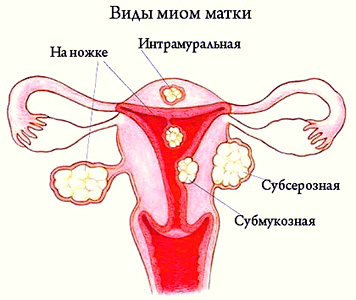 2013; (10): CD001808.
2013; (10): CD001808. Акушерский гинекол .
2013; 122 (2 п.1): 290–295.
Акушерский гинекол .
2013; 122 (2 п.1): 290–295. Ланцет .
2017; 389 (10084): 2105–2116.
Ланцет .
2017; 389 (10084): 2105–2116. Obstet Gynecol .
2010. 115 (6): 1279–1295.
Obstet Gynecol .
2010. 115 (6): 1279–1295. Задержка плаценты. Best Practices Clin Obstet Gynaecol .
2008. 22 (6): 1103–1117.
Задержка плаценты. Best Practices Clin Obstet Gynaecol .
2008. 22 (6): 1103–1117.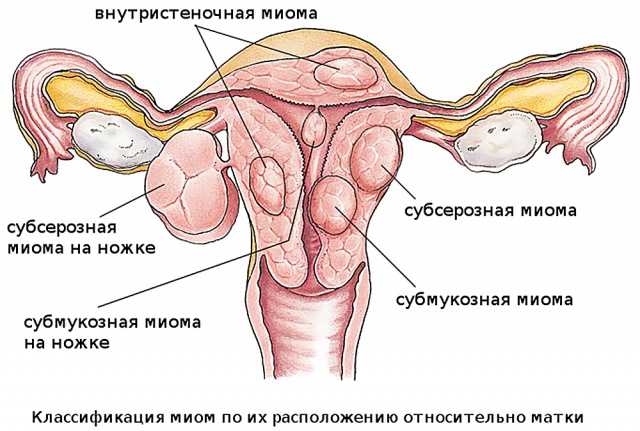 Разработан по контракту № 11–10006 с Департаментом здравоохранения Калифорнии; Отдел охраны здоровья матери, ребенка и подростков; Опубликовано Калифорнийским объединением по качественному уходу за матерями, 17 марта 2015 г.
Разработан по контракту № 11–10006 с Департаментом здравоохранения Калифорнии; Отдел охраны здоровья матери, ребенка и подростков; Опубликовано Калифорнийским объединением по качественному уходу за матерями, 17 марта 2015 г. Acta Obstet Gynecol Scand .
2013. 92 (4): 433–438.
Acta Obstet Gynecol Scand .
2013. 92 (4): 433–438. Послеродовое кровотечение — Консультант по терапии рака
Послеродовое кровотечение (ПРК) / акушерское кровотечение
1. Что должен знать каждый врач
Клинические особенности и частота встречаемости
Факторы риска
2.Диагностика и дифференциальный диагноз
3. Менеджмент
Профилактика послеродового кровотечения
Управление ранней ПП
Лечение позднего послеродового кровотечения
4. Осложнения
A. Осложнения как следствие состояния
Б. Осложнения как следствие управления
5. Прогноз и исход
A. Исходы для матери / плода
Б. Долгосрочное здоровье
6. Каковы доказательства для конкретных рекомендаций по ведению и лечению
Гиповолемия — симптомы, причины, лечение
Атипичное проявление геморрагического шока при беременности: случай, демонстрирующий развивающуюся область экстренной медицины в Израиле | BMC Emergency Medicine
Послеродовое кровотечение | Детская больница Филадельфии
Баллон Бакри или катетер Фолея для сжатия кровотечения внутри матки.

 А., Савицкий А.Г. Миома матки: проблемы патогенеза и патогенетической терапии. Спб., 2000.
А., Савицкий А.Г. Миома матки: проблемы патогенеза и патогенетической терапии. Спб., 2000. Г. Аномальные маточные кровотечения у больных миомой матки в перименопаузе. Автореф. дисс.. канд. мед. наук. М., 1994; 16 с.
Г. Аномальные маточные кровотечения у больных миомой матки в перименопаузе. Автореф. дисс.. канд. мед. наук. М., 1994; 16 с.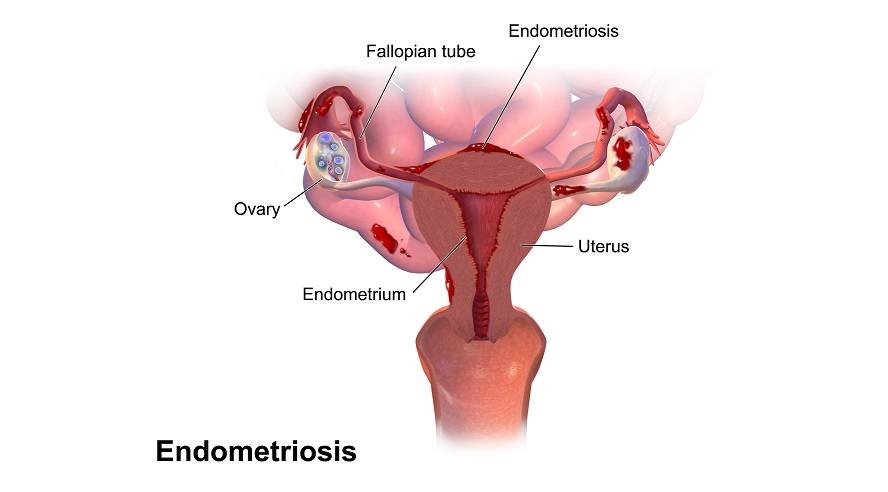 Ф., Павлов А.Д. Эритропоэтин: биологические свойства, возрастная регуляция эритропоэза, клиническое применение. М.: ГЭОТАР-МЕД, 2002; 400 с.
Ф., Павлов А.Д. Эритропоэтин: биологические свойства, возрастная регуляция эритропоэза, клиническое применение. М.: ГЭОТАР-МЕД, 2002; 400 с.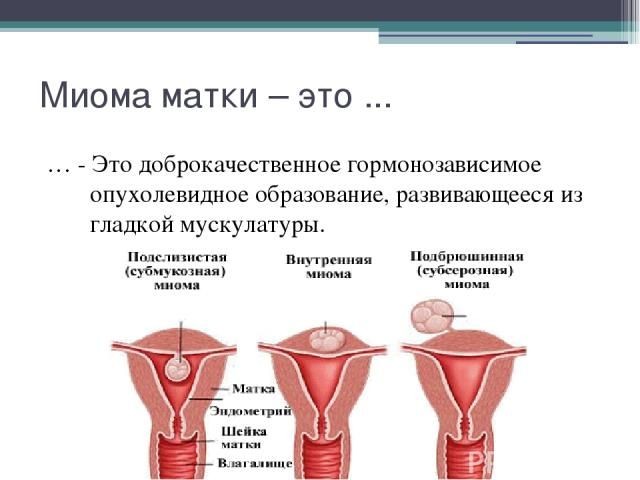 М.: МедПресс, 1997; 7-33.
М.: МедПресс, 1997; 7-33.
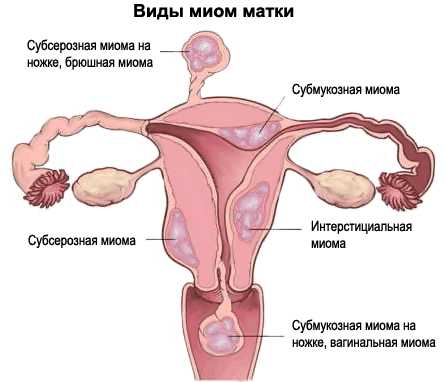 Е. и др. Проблемы репродукции. 2001; 1: 41-6.
Е. и др. Проблемы репродукции. 2001; 1: 41-6. S, Krackow K.A. Orthopedics 2002; 25 (3): 317-20.
S, Krackow K.A. Orthopedics 2002; 25 (3): 317-20.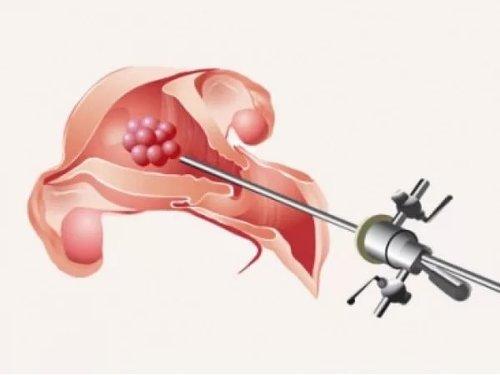
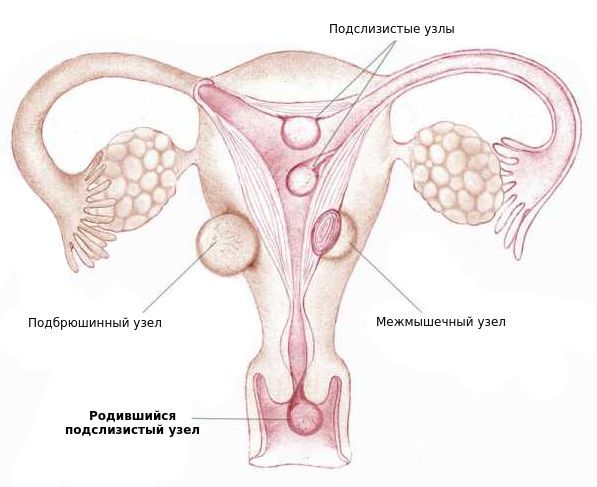
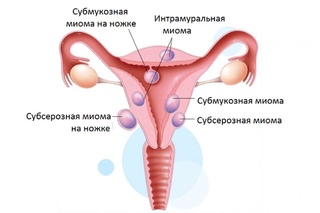
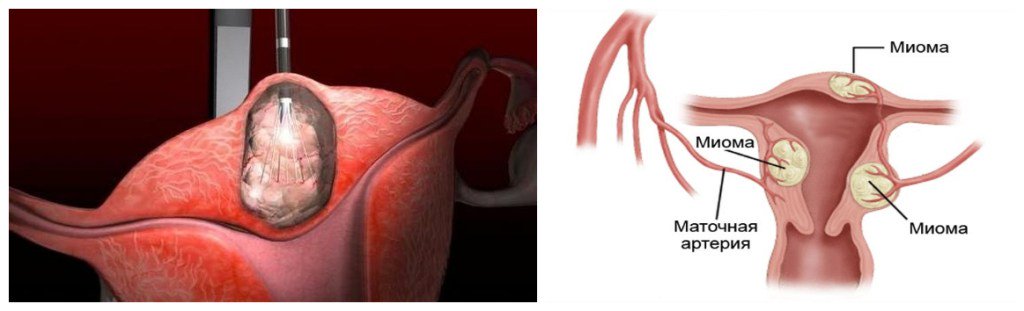 3% вагинальных родов [9]
3% вагинальных родов [9] 